南美蟛蜞菊霜霉病病原鉴定及系统发育分析
李华洪, 何成成, 习平根, 姜子德, 李敏慧
华南农业大学植物保护学院/广东省微生物信号与作物病害防控重点实验室, 广东 广州 510642
南美蟛蜞菊Sphagneticolatrilobata(L.) Pruski[异名Wedeliatrilobata(L.) Hitchc.]又名三裂叶蟛蜞菊,是菊科向日葵族蟛蜞菊属的多年生草本植物,原产于南美洲及中美洲地区,于20世纪70年代作为地被绿化植物引进我国(吴彦琼等,2005)。南美蟛蜞菊对环境的适应性超强,不仅可通过化感作用强烈抑制其周围植物的生长(柯展鸿等,2014),还可以利用其内生丛枝菌根真菌促进自身生长,增强自身对本地植物的竞争优势(祁珊珊等,2020),并能改善土壤营养环境,提高土壤肥力,形成对自身生长有利的微环境(全国明等,2016),从而快速在栖息地形成优势种群,因此也被认为是最具威胁的100个外来入侵物种之一(辜睿等,2020)。近年来,南美蟛蜞菊在我国东南沿海省(区)(福建、广东、广西和海南等)迅速定殖并不断扩散,对其周边生物多样性及生态环境造成巨大影响和潜在威胁(Qietal.,2014)。
目前,南美蟛蜞菊的治理主要采取人工清除、化学防治和生物防治等方法。人工清除效果显著,但需耗费大量人力物力。在我国广泛使用的化学除草剂莠去津虽然对南美蟛蜞菊防控效果较好,但因其高残留和高污染已经被欧盟国家禁用(田学军等,2016)。已有研究表明,施用不同浓度的百草枯、草甘膦和稳杀得化学除草剂短期内对蟛蜞菊化感作用的影响有限,反而在一定程度上促进了蟛蜞菊的入侵(李光义等,2010),因而应用化学农药控制南美蟛蜞菊还有待进一步研究。生物防治目前主要是利用本土植物的化感作用(柯展鸿等,2014; 袁伟影等,2017)和利用本土植物对其生态位的竞争(周雨露等,2016)抑制其生长。虽然利用天敌限制入侵植物的生长和蔓延是较为理想的防控方法,但南美蟛蜞菊病虫害种类较少,在我国未见其病害报道。因此,调查南美蟛蜞菊上自然发生的病害并鉴定其病原,对于挖掘其生防微生物资源、探索生物防治途径具有重要意义。
核糖体DNA(ribosomal DNA, rDNA)序列包括18S小亚基编码区(small subunit, SSU)、内转录间隔区(internal transcribed spacer, ITS)和28S大亚基编码区(large subunit, LSU)序列,这3种序列是常用的真菌鉴定分子标记(Rajaetal., 2017)。其中,ITS序列更是被称作真菌的条形码标记,广泛应用于种及种下分类水平的真菌鉴定和系统发育分析(Schochetal.,2012)。含有D1和D2高变异区的LSU序列,单独或与ITS序列结合时,也可用于真菌和卵菌的物种鉴定(Rajaetal.,2017; Riethmülleretal.,2002)。本研究对广州南美蟛蜞菊病害发生情况进行调查,并通过对病原菌ITS和LSU序列进行克隆、测序和系统发育分析,对南美蟛蜞菊霜霉病病原进行分子鉴定,明确侵染菊科植物的单轴霉属不同种之间的系统发育关系。
1 材料与方法
1.1 病害调查及标本采集
2020年8月—2021年8月,在广东省广州市天河区、白云区各森林公园以及华南农业大学校园,对南美蟛蜞菊病害的发生及危害情况进行调查,对发现的霜霉病采用5点取样法,每个点随机取20株进行发病率和病情指数统计。以病害发生的严重程度划分病情级数:0级为整株叶片无病斑;1级为植株下部小于等于10%的叶片上有少量病斑;2级为大于10%,小于等于30%的植株叶片上有病斑;3级为大于30%,小于等于60%的叶片有病斑; 4级为大于60%的叶片有病斑。以5个取样点的平均发病率和病情指数(方仲达,1998)评估调查地点南美蟛蜞菊霜霉病发生情况。采集症状典型的病叶及带病植株,带回实验室进行病原鉴定。
1.2 病害症状观察
对采集的蟛蜞菊霜霉病病害标本进行症状观察,记录病斑颜色、大小、发病部位。
1.3 病原菌形态鉴定
选择具有典型症状的新鲜叶片样本,在发病叶片背面刮取霉层制成临时玻片置于光学显微镜(Olympus BX53)下,观察病原菌的形态,并记录病原菌的孢囊梗、孢子囊大小和形状等形态特征。根据霜霉菌形态特征及寄主范围进行病原菌属的鉴定(余永年,1998; Choietal.,2009; Voglmayretal.,2008)。
1.4 病原菌rDNA-ITS及LSU序列扩增及分析
刮取并收集蟛蜞菊霜霉病叶背面的霉层,利用真菌DNA抽提试剂盒(货号:D3390-04,Omega Bio-Tek)提取病原菌的DNA。使用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATAT-GC-3′)进行ITS序列扩增(Rajaetal.,2017);引物LR0R(ACCCGCTGAACTTAAGC)和LR7(TACTACCACCAAGATCT)进行LSU序列的扩增(Mctaggartetal.,2015)。PCR反应体系为20 μL,其中Taq PCR Master Mix10 μL,模板DNA1 μL,上下游引物各1 μL,ddH2O 7 μL。PCR反应程序为:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环,16 ℃保存。
将PCR产物进行电泳检测,如产物单一则对PCR产物直接进行回收、纯化备用。将纯化得到的PCR产物用试剂盒(货号:D101,TAKARA)进行T克隆,操作方法:在微量离心管中分别加入pMD18-T载体1 μL,目标DNA 4 μL和5 μL的溶液I,混匀后置于16 ℃过夜;将连接好的反应体系全部加入到100 μL的JM109大肠杆菌的感受态细胞中混匀后,置于冰上放置30 min,再将其置于42 ℃下热激45 s,然后在冰中放置1 min,加入890 μL LB(luria-bertani)培养液,37 ℃振荡培养60 min,将培养液涂布在含有氨苄青霉素的LB平板培养基上37 ℃培养12 h,挑取白色菌落,使用菌落PCR法确定载体中插入片段的长度大小,选取6个正确的克隆送生工生物工程(上海)股份有限公司测序得到ITS和LSU序列。
将获得的ITS和LSU序列分别在NCBI网上进行序列比对,下载与之相似性高的相关序列,以马铃薯晚疫病菌致病疫霉Phytophthorainfestans(Mont.) de Bary和荔枝霜疫霉PeronophythoralitchiiChen ex Koetal.作为外围群,应用MEGA 7系统发育软件的最大似然法(Kumaretal.,2016)分别构建基于 LSU和ITS 序列的系统发育树,其中自展支持重复1000次。根据向日葵霜霉病菌P.halstedii(Farl.) Berl.& De Toni的ITS结构分析方法(Springetal.,2006; Thinesetal.,2005),结合序列的同源比对结果,对分离自南美蟛蜞菊上的霜霉病菌ITS序列进行结构注释。
2 结果与分析
2.1 病害调查结果
病害调查结果发现,南美蟛蜞菊霜霉病在广州火炉山、白云山和天鹿湖等森林公园零星发生,但在华南农业大学校内发生较严重,发病较重的地块发病率可达50%~70%,病情指数达30~35,病害严重限制了发病植株下部叶片的生长。病害一般发生在植株下部荫避区,发病初期叶子正面出现不规则的淡黄色病斑,病健交界处清晰可见,病斑直径1.0~5.5 mm(图1A),叶背面出现清晰可见的白色霉层(图1B、C)。发病后期叶面病斑变灰褐色,叶片病组织变薄并坏死(图1D),直至整个叶片逐渐死亡,叶背面霉层消失。

图1 南美蟛蜞菊霜霉病症状Fig.1 Symptoms of downy mildew on S. trilobata A:病害叶部症状(正面); B和C:病害叶部症状(背面); D:病害在田间的症状。 A: Disease symptoms on leaf (upside); B and C: Disease symptoms on leaf (downside); D: Disease symptoms in the field.
2.2 病原菌形态学特征
由图2可见,南美蟛蜞菊霜霉病病原孢囊梗从气孔伸出,无色,有隔膜,常为直角或近直角的单轴分枝,长260.0~500.0 μm,宽12.0~13.5 μm,孢囊梗单轴分枝3次,分枝宽6.5~8.5 μm,分枝末端较尖细。孢子囊着生在孢囊梗上,呈椭圆形或卵圆形,乳突不明显,表面光滑,无色,大小(长×宽)为(17.5~25.0) μm× (12.0~18.0) μm。根据寄生在菊科植物上的霜霉病菌记录,共有3种单轴霉属菌物,分别是寄生在苍耳XanthiumsibiricumPatrin ex Widder上的苍耳单轴霉P.angustiterminalisNovot.、寄生在向日葵HelianthusannuusL.和金光菊RudbeckialaciniataL.上的向日葵单轴霉P.halstedii和澳大利亚报道的寄生在南美蟛蜞菊上的蟛蜞菊单轴霉P.sphagneticolaeMetaggart & R.G.Shivas (余永年,1998; Komjátietal.,2007; Leeetal.,2020; Mctaggartetal.,2015)。本菌孢囊梗比向日葵单轴霉的稍短,游动孢子囊更趋近于圆形且较小,与寄生在菊科植物上的另外2种单轴霉形态非常相近,根据其寄主拟鉴定为蟛蜞菊单轴霉。

图2 南美蟛蜞菊霜霉病病原形态特征Fig.2 Morphological characteristics of P. sphagneticolae parasitic on S. trilobata A:具分枝的孢囊梗;B:游动孢子囊。 A: Sporangiophore with branches; B: Sporangia.
2.3 系统发育分析
克隆测序得到南美蟛蜞菊霜霉病病原物的LSU序列(GenBank 登录号:MW298155),在NCBI网上进行序列比对,结果显示:本菌(2-LSU)与来自澳大利亚的南美蟛蜞菊上霜霉病菌P.sphagneticolae相似性最大,达到99.86%。而基于LSU序列的系统发育分析(图3)显示,本菌与寄生在菊科植物向日葵和金光菊上的向日葵单轴霉同样紧密地聚在一个分枝上,与寄生菊科植物苍耳上的苍耳单轴霉和牛蒡Arctotissp.上的马氏单轴霉P.majewskiiConstant.& Thines以及寄生于伞形科植物上的细叶芹单轴霉P.chaerophylli(Casp.) Trotter和雪白单轴霉P.nivea(Unger) Schröt.较远地聚在一枝,且自展支持率较低。致病疫霉和荔枝霜疫霉在LSU系统发育分析中与单轴霉属的其他种在最外围聚在一起。

图3 基于LSU序列单轴霉属真菌种的系统发育树Fig.3 Phylogenetic tree obtained from a maximum likelihood analysis of the LSU region
对寄生在不同科属植物上的单轴霉ITS序列系统发育分析结果(图4)显示,有3个自展支持率较高的分枝:分枝Ⅰ将本菌(ITS序列的登录号:MW306664)与寄生在菊科植物上的向日葵单轴霉和苍耳单轴霉聚在一起,说明这3个菌株亲缘关系密切,然而,同源比对结果显示,本菌与向日葵单轴霉ITS序列相似度只有89%,与苍耳单轴霉相似度为78%;分枝Ⅱ将侵染伞形科植物的细叶芹单轴霉和雪白单轴霉聚在一枝;分枝Ⅲ是侵染牻牛儿苗科老鹳草属植物的4个不同种的单轴霉(老鹳草单轴霉P.geranii(Peck) Berl.& De Toni, 林生老鹳草单轴霉P.geranii-sylvaticiSăvul.& O.Săvul., 微小单轴霉P.pusilla(de Bary) J.Schröt.和威氏单轴霉P.wilsoniiVoglmayr, Fatehi & Constant.)。由此可见,除了侵染凤仙花的凤仙花单轴霉P.obducens(J.Schröt.) J.Schröt.和侵染葡萄的葡萄生单轴霉P.viticola(Berk.& M.A.Curtis) Berl.& De Toni在较远的地方与侵染菊科植物的单轴霉聚在一枝外,ITS序列系统发育分析可以较好地区分寄生在不同科属植物上的单轴霉,并且不与外围群聚在一个分枝上。
2.4 序列结构及相似性比较分析
通过对来自南美蟛蜞菊和向日葵上的霜霉病菌rDNA-ITS序列进行同源比对,构建该序列结构示意图,结果(图5)显示,本研究克隆测序得到蟛蜞菊霜霉病菌ITS序列长为2228 bp,ITS2含有3个重复的序列(PsR1-PsR3),该结构与来自向日葵霜霉病菌的ITS序列相似,不同的是后者含有4个重复序列(PhR1-PhR4)。正因为含有多个重复序列才使得这2种病原菌的ITS序列显著长于其他病原菌的ITS序列。二者重复序列相似度比较结果如表1所示,蟛蜞菊霜霉病菌ITS序列自身的重复序列相似度达90%以上,而与向日葵霜霉病菌ITS的重复序列相似度为83.4%~89.0%,平均为85.9%,可见二者重复序列之间还有一定的差异。在ITS序列注释的基础上,结合ITS序列和LSU序列的系统发育分析,本研究认为,获得的南美蟛蜞菊霜霉病菌与向日葵霜霉病菌分属不同的种,根据寄主的属及形态特征将其鉴定为蟛蜞菊单轴霉P.sphagneticolae。

图4 基于ITS序列单轴霉属真菌种的系统发育树Fig.4 Phylogram obtained from a maximum likelihood analysis of ITS sequences of P. species
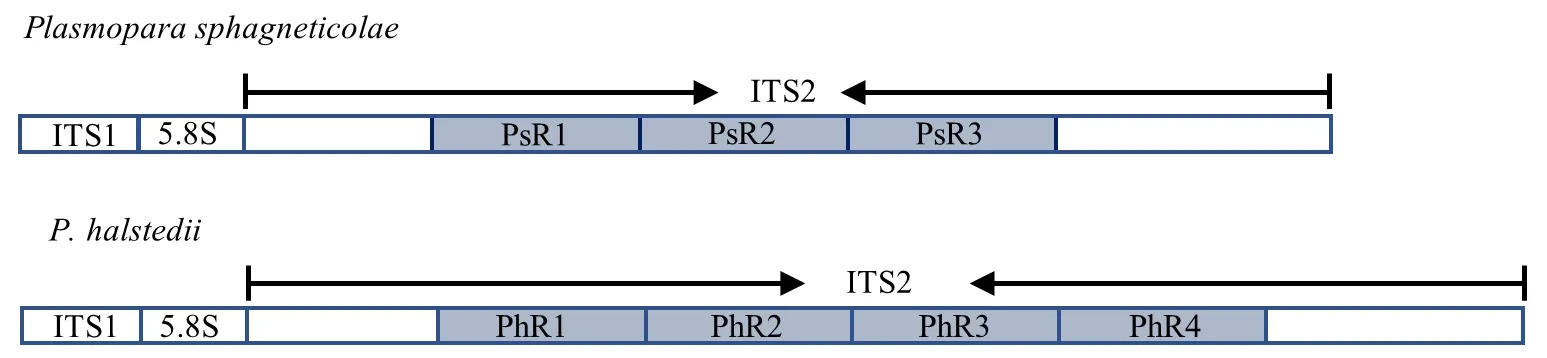
图5 蟛蜞菊单轴霉和向日葵单轴霉ITS序列结构Fig.5 ITS sequence structures of P. sphagneticolae and P. halstedii ITS序列包括ITS1区、5.8S 核糖体DNA区和ITS2区。向日葵单轴霉ITS序列结构引自Thines et al. 2005. PsR1-PsR3代表蟛蜞菊单轴霉ITS2区中的重复序列,PhR1-PhR4代表向日葵单轴霉ITS2区中的重复序列。 ITS sequence includes ITS1 region, 5.8S ribosomal DNA and ITS2 region.Structure of the ITS sequence in P. halstedii according to Thines et al. 2005.PsR1-PsR3, repetitive units of ITS2 from P. sphagneticolae; PhR1-PhR4, repetitive units of ITS2 from P. halstedii .

表1 蟛蜞菊单轴霉和向日葵单轴霉ITS2区序列相似性Table 1 Sequence similarity of repetitive units of ITS2 region in P. sphagneticolae and P. halstedii
3 讨论
LSU序列分析结果显示,来自广东的南美蟛蜞菊霜霉病菌与澳大利亚的南美蟛蜞菊霜霉病菌紧密地聚在一起,并且与向日葵单轴霉以较高的自展支持率聚在一个分枝上,同时与寄生菊科植物上的苍耳单轴霉和马氏单轴霉以及非菊科植物上的单轴霉聚在同一个分枝上,但自展支持率较低。这一结果与来自澳大利亚的南美蟛蜞菊霜霉病菌LSU序列系统发育分析一致(Mctaggartetal.,2015),说明LSU系统发育分析不能将南美蟛蜞菊霜霉病菌与其他寄生在菊科植物上和非菊科植物上的霜霉菌区分开。故在此基础上进行ITS序列分析,结果表明,分自菊科向日葵族(南美蟛蜞菊、向日葵和苍耳)的单轴霉以较高的自展支持率聚在一个大的分枝中,并且在较小的分枝水平上不同的种也能被很好地区分开来,说明来自菊科向日葵族植物上的单轴霉亲缘关系紧密。其ITS2序列的结构分析表明,南美蟛蜞菊霜霉病菌与向日葵霜霉病菌重复序列之间的平均相似性只有85.9%,而同一菌内的重复序列相似性达到90%以上。而苍耳单轴霉的ITS2区也含有多个重复序列,且与向日葵单轴霉ITS2区的重复序列同源,致使其ITS2长达2815 bp(Komjtietal.,2007)。鉴于来自向日葵族的单轴霉ITS2区均含有多个同源的重复序列,但不同种的重复序列数不同,且重复序列不同会导致病原菌的致病型发生改变(Springetal.,2006),再结合病原菌的形态特征比较结果,本研究将采自广东广州的南美蟛蜞菊霜霉病病原鉴定为蟛蜞菊单轴霉。
据统计,除了本研究鉴定的蟛蜞菊单轴霉,已报道寄生在菊科植物上的单轴霉属菌物还包括侵染向日葵和金光菊的向日葵单轴霉、侵染苍耳的苍耳单轴霉、侵染牛蒡属植物的马氏单轴霉等(Choietal.,2009; Leeetal.,2020; Mctaggartetal.,2015; Riveraetal.,2014)。在本研究中,虽然LSU系统发育分析将寄生在菊科植物上的单轴霉属菌物聚在一个分枝上,但不能区分寄生在其他科植物上的单轴霉,且自展支持率较低,表明单独LSU序列分析不足以进行单轴霉属种的分子鉴定。而ITS序列的系统发育分析能够清晰地区分来自不同科植物的单轴霉,虽然GenBank数据库中很多单轴霉属的种缺乏ITS序列,但本研究认为,相比LSU序列,ITS序列更适用于单轴霉属的种类鉴定。本研究中,系统发育分析也支持单轴霉属菌物属于多谱系的霜霉菌这一论点,认为其可以侵染多种科属的寄主植物(Thinesetal.,2009)。基于ITS序列结构分析,本研究支持将侵染菊科向日葵族植物的单轴霉属细分成多个小种,而不是只有一个大种:向日葵单轴霉(Choietal.,2009)。更多侵染菊科植物的霜霉病菌ITS序列的克隆和种的鉴定有待进一步研究。
利用天敌昆虫和病原限制其寄主植物的生长和蔓延是一种较为理想的入侵植物生物防控方法。比如利用拟锈病菌SynchytriumsolstitialeWidmer防治美国西部的一种入侵杂草黄矢车菊CentaureasolstitialisL.(Eskandarietal., 2011),利用薇甘菊颈盲蝽PachypeltismicranthusMu & Liu和薇甘菊柄锈菌Pucciniaspegazzinide Toni防治我国的外来入侵植物薇甘菊MikaniamicranthaKunth(李志刚等,2006;李云琴等,2019)。这些天敌昆虫和病原菌都具有一定的专化性,固定取食或寄生于限定的寄主植物上,病原菌也不能人工培养,但其是一种对非寄主的本土植物友好且安全的生防资源。本研究鉴定的蟛蜞菊单轴霉也是一种典型的专性寄生菌,虽不能人工培养,但作为国内南美蟛蜞菊上发现的第一个天然发生的病害病原,该菌极具生防潜力。然而,其扩大培养方案和致病寄主范围等还需进一步研究。

