桦木酸在胃肠道癌症中的作用机制
李怀玉,陈 云,胡子毅,谭飞燕,刘培喆,邓慧灵,叶 菁
(1.江西中医药大学a.研究生院2019级; b.附属医院急诊科; c.研究生院2021级; d.临床医学院中医内科学教研室,南昌 330006;2.赣南医学院第一附属医院消化科,江西 赣州 341000)
胃肠道癌症(GICs)是世界范围内最为常见的癌症,是导致癌症相关死亡的主要原因之一。2020度GLOBOCAN统计[1]显示:结直肠癌(CRC)、胃癌(GC)、肝细胞癌(HCC)和食管癌(OC)的发病率与死亡率均在所有癌症中位列前十,而胰腺癌(PC)也因较差的预后成为第七大癌症相关死因。目前GICs治疗方式多样,包括手术治疗、放疗、化疗、抗体靶向治疗及免疫治疗,但均存在各自的局限性,并有可能导致GICs的进一步发展[2-6]。寻找新的有效药物一直是GICs研究的重点,而在自然界中挖掘天然的抗肿瘤分子是其重要的方向之一[7],桦木酸(BA)是一种主要从桦木中提取的羽扇豆烷型五环三萜类化合物,它表现出抗肿瘤、抗病毒、抗高血脂以及抗炎等多种药理特性[8]。自1995年首次发现BA能抑制黑色素瘤细胞活性以来[9],BA的抗肿瘤作用一直被广泛研究。如今,BA已被证实对包括GICs在内的人体多种肿瘤细胞具有抑制作用。随着有关BA抗GICs活性的基础研究日益深入,其背后越来越多的内在机制被阐明,更是引起了学界对BA的浓厚兴趣。本文就BA作用于GICs的相关机制进行综述并展开讨论,以期为后续研究提供建设性框架以及理论指导。
1 BA抑制GICs细胞增殖
细胞周期失控引发的持续异常增殖是肿瘤的基本特征之一。作为肿瘤发生的重要一环,细胞周期调控通路被认为是抗肿瘤的核心靶点之一。在几种不同的GICs模型中,BA均表现出了显著的增殖抑制效应,只不过其阻滞的细胞周期阶段稍有差异:GC中SGC-7901、MGC-803细胞主要被阻滞于G0/G1期[10-11];HCC中PLC/PRF/5、MHCC97L细胞主要阻滞于G2/M期[12],HepG2细胞阻滞于S期[13];PC中BxPC-3、AsPC-1、PANC-1细胞以及BALB/C裸鼠(接种AsPC-1或PANC-1细胞)体内的肿瘤细胞主要阻滞于G0/G1期[14-15]。细胞周期是多种蛋白共同调控的结果,目前BA已被证实可上调细胞周期蛋白依赖激酶(CDKs)中的CDK4[15]和细胞周期蛋白激酶抑制因子(CKIs)中的p21[16]和p27[17],还可下调细胞周期蛋白中的cyclin D1[10-11,13,15-16,18-19]和cyclin B1[10-11],从而抑制GICs细胞的增殖。其中,p27上调是由BA降低S期激酶相关蛋白2(Skp2)稳定性从而抑制了p27泛素化降解所致。细胞分裂周期相关蛋白5(CDCA5)作为后期促进复合物(APC)的底物,是S期和G2/M期染色单体稳定结合的主要调节器[20],BA可下调其表达从而实现对CRC中HT29细胞的增殖抑制[16]。
增殖细胞核抗原(PCNA)参与DNA修复、染色质重塑以及细胞周期的调节,并在许多癌细胞中过表达。GC中BGC-823、MNK45细胞以及OC中TE-11细胞的增殖受BA抑制同时,其胞内PCNA表达水平均出现了不同程度的下调,这表明BA抗GC和OC与PCNA的调节有关[18,21]。核纤层蛋白作为细胞核的主要中间丝,主要在DNA的复制及转录中发挥作用。多数GICs中核纤层蛋白下调较为常见,但在PC中则是以过表达为特点[22],下调核纤层蛋白B1也是BA抑制PC细胞增殖的机制之一[15]。细胞增殖受多条通路调控,以β-catenin及其下游分子构成的经典Wnt信号通路失调是引发增殖异常的常见原因。有研究[19]表明BA能通过抑制β-catenin下调cyclinD1和原癌基因c-Myc的异常表达,从而抑制PC中PANC-1细胞的增殖。见表1,图1A。
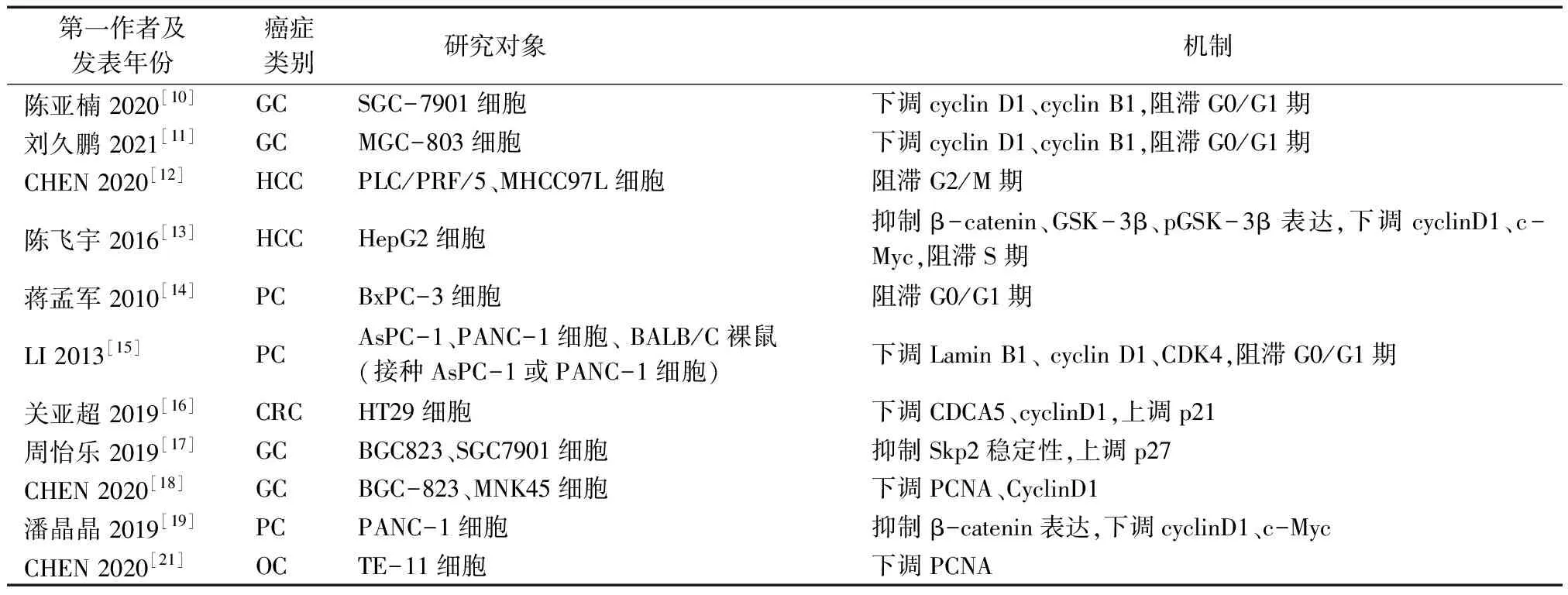
表1 BA调控GICs细胞周期的相关机制
2 BA抑制GICs细胞侵袭与转移
肿瘤细胞的转移性扩散无论对于GICs患者还是研究者来说都是一个挑战。从临床角度来看,绝大多数GICs致死病例都与肿瘤的转移有关。有效阻止肿瘤侵袭及转移是GICs治疗的首要任务。在肿瘤转移的过程中,上皮间充质转化(EMT)是调节肿瘤侵袭与转移的主要因素之一,它参与了入侵-转移级联反应中的绝大多数环节[23]。EMT的主要特征有细胞间黏附丧失,上皮标志物表达降低及间质标志物表达上升。作者既往的研究[24]发现BA能抑制GC中SNU-16细胞的侵袭及转移活性,并引起神经钙黏蛋白下调以及上皮细胞钙黏蛋白上调,这表明BA可通过阻止EMT进程来抑制GC细胞的侵袭与转移。EMT过程受多条信号转导通路的调节,TGF-β/Smads通路是其中的重要途径之一,BA抑制CRC中HCT116细胞的侵袭与转移的能力便与其下调该通路中TGF-β、Smad2/3蛋白的能力有关[25]。
基质金属蛋白酶(MMPs)是肿瘤侵袭与转移过程中作用最突出的蛋白酶家族,其活性受组织内在金属蛋白酶抑制剂(TIMPs)调节。肿瘤细胞可通过激活MMPs的活性破坏细胞外基质(ECM),引发组织重塑,最终穿过ECM构成新的转移灶。Skp2、CDCA5不仅在细胞周期中发挥作用,对于MMPs也具有调节功能。在CRC中的HCT116、HT29细胞[16,26]以及GC中的SGC7901、BGC823细胞[17]中,BA表现了显著的侵袭与转移抑制能力,其机制不仅包括对TIMP-2的上调,还包括对Skp2、CDCA5的表达抑制,从而下调MMP-2、MMP-9。
血管扩张刺激磷蛋白(VASP)对细胞骨架具有重要的调节功能,能够促进肌动蛋白形成突出膜结构并维持其结构稳定性[27]。近几年来,陆续有学者在各类GICs中发现VASP表达异常,VASP在GICs侵袭与转移中的作用逐渐受到重视。有研究[18]指出VASP在GC的BGC-823细胞中存在过表达,而BA能通过抑制NF-κB下调GC细胞中VASP的含量,从而阻止GC细胞的侵袭与转移。见表2,图1B。

表2 BA抑制GICs细胞侵袭与转移相关机制
3 BA诱发GICs细胞凋亡
程序性细胞死亡(PCD)的抵抗能力是癌症的十大基本特征之一[28],在PCD的各种途径中,有关细胞凋亡的研究最为广泛。目前公认的二大细胞凋亡途径包括死亡受体(DRs)介导的外源性途径和线粒体介导的内源性途径,半胱氨酸蛋白酶(caspases)与Bcl-2家族是整个细胞凋亡过程的核心分子集团。目前众多研究均认为内源性线粒体途径是BA诱发GICs细胞凋亡的主要机制。一般而言,BA能引发GICs胞内Bcl-2下调以及Bax上调,从而使线粒体膜电位降低[14,26,29-30]。随着线粒体功能逐渐丧失,细胞色素C(Cyt C)[31-32]与凋亡抑制蛋白(IAPs)[12]释放增加,进一步引发caspase-3、caspase-9上调,促进PARP裂解并最终导致GICs细胞的凋亡。WANG等[33]研究发现BA能促进CRC中HCT116、SW480、HT29细胞内PARP裂解,但不能改变三者胞内Bax的表达水平,这与ZENG等[26]报道的HCT-116细胞中Bax上调的结果相互矛盾,因此有必要进行进一步的核实。活性氧分子(ROS)有极强的氧化能力,在细胞内主要由线粒体产生,其大量存在时能以正反馈形式改变线粒体膜的通透性,导致线粒体受损而触发细胞凋亡。CRC中的HCT-116细胞以及HCC中的HepG2细胞在BA作用下均出现了ROS上调,其中HCC细胞内ROS的上调受抑癌基因p53的调控[26,31]。作为“基因守护者”,活化的P53能与众多靶基因的调控序列相结合,以调节细胞代谢的一系列过程。该研究指出p53可通过促进氧化还原因子p66shc生成以及促进miR-21表达而抑制Sod2提升HCC细胞中ROS的含量,继而激发氧化应激反应诱发细胞凋亡[31]。此外,有研究[34]指出人参皂甙Rh2与BA联用促进HCC中HepG2细胞、A549细胞凋亡的疗效要优于单用,这表明人参皂甙Rh2可能对BA诱导的线粒体凋亡途径具有协同作用。
与TNF超家族的其他成员不同,肿瘤坏死因子相关凋亡诱导配体(TRAIL,亦称Apo2L)能介导DRs选择性诱导肿瘤细胞发生凋亡。但由于多种原因,TRAIL受体激动剂(TRAs)在临床试验中显现的实际效益相当有限[35]。有研究[36]发现重组Apo2配体(rh-Apo2L)与BA联用后,体内外模型中的HCC细胞对TRAIL触发的外源性凋亡途径变得更为敏感。当前虽无证据表明BA能直接通过DRs途径促进GICs细胞凋亡,但BA可以通过增强TRAIL活性,降低肿瘤细胞对TRAs的耐药性,为其临床应用创造新的可能。见表3,图1C。

表3 BA诱发GICs细胞凋亡相关机制
4 BA启动GICs细胞自噬
自噬是细胞自我消化的代谢调控过程,在饥饿、缺氧或其他特定细胞应激条件下,自噬允许细胞大分子被溶酶体降解并作为代谢前体循环到代谢及生物合成途径中。自噬一方面可使细胞达到应激适应规避死亡,另一方面又可构成另一种细胞死亡—自噬性细胞死亡[37]。哺乳动物雷帕霉素靶蛋白(mTOR)作为自噬的关键调节因子,一直是自噬研究的热门靶点。有研究[29,33,38]表明BA对GICs细胞mTOR的抑制既受AMPK/mTOR、PI3K/Akt/mTOR通路的调控,又受非mTOR依赖通路中P53的影响。自噬主要包括自噬小泡形成、自噬小泡延伸、自噬溶酶体形成与降解3个过程,大部分研究认为BA对GICs细胞自噬整个过程均具有促进作用。BA能通过上调Beclin1、ATG7、ATG12、ATG5,下调p62,促进LC3-Ⅰ向LC3-Ⅱ转化等途径增加自噬通量而增强GICs细胞的自噬[29,33,39]。个别研究[12]发现BA处理HCC的MHCC97L细胞后,虽然能促进LC3-Ⅰ向LC3-Ⅱ转化,但引发的是p62上调、自噬溶酶体形成与降解的抑制,这表明BA虽能诱导MHCC97L细胞自噬,但其对自噬下游环节的阻断使得最终的自噬通量处于较低水平。细胞凋亡与自噬之间关系复杂,BA在诱导GICs凋亡的同时也引发自噬的产生,两种过程共同决定着GICs的发展趋势。采用自噬抑制剂预处理后,观察BA对GICs细胞凋亡的影响是目前研究两者关系的常用方法。关于BA对GICs细胞自噬与凋亡的影响,现有证据呈现出2种相反的观点:有的研究[29]发现自噬被阻断的情况下,HCC中HepG2细胞、SMMC-7721细胞的凋亡均受到了抑制,说明两者在HCC中相互协调;而另有研究[33]数据表明,自噬受阻后,CRC中HCT116、SW480和HT29细胞的凋亡均得到了增强,说明自噬在CRC中主要起保护性作用。见表4,图1D。

表4 BA启动GICs细胞自噬相关机制
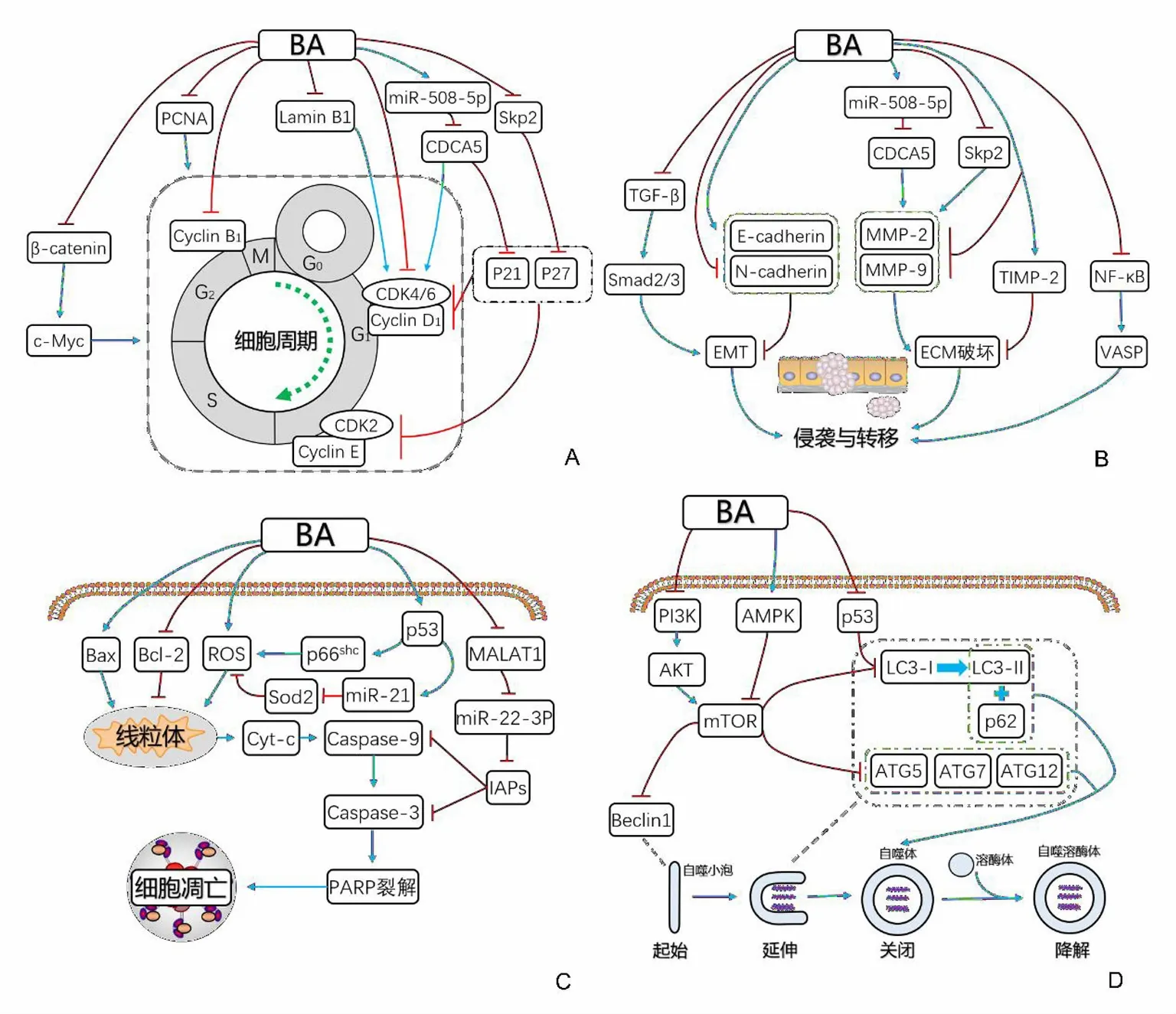
图1 BA抗GICs的相关机制
5 BA抑制GICs干细胞
作为具有干细胞类似特征的癌细胞亚群,肿瘤干细胞(CSCs)以其独特的自我更新、分化能力与肿瘤的生长、转移以及耐药性密切联系在一起。GICs中的CSCs于2007年在CRC中被首次报道[40],随后陆续在各类GICs中被发现。目前数据表明BA对HCC[13]、PC[41]干细胞均具有抑制作用。在HCC中,陈飞宇[13]以干细胞标志分子CD44、CD90、CD133和CD326的表达水平为鉴定依据,在体外无血清培养体系中成功富集了HepG2干细胞,并发现BA能通过阻止细胞周期抑制HepG2干细胞增殖,并促进其凋亡,其中高浓度(40 μmol·L-1)BA主要阻滞HepG2干细胞于S期,而低浓度(10 μmol·L-1)BA将其阻滞于G0/G1期[13]。在PC中以胰腺导管腺癌最为常见,因其细胞亚群具有干细胞样特征,故被称为胰腺癌干细胞(PCSCs),清除PCSCs是治疗这种难治性GICs的关键目标之一。SUN等[41]研究发现BA不仅能减少PC中MIA PaCa-2和PANC-1细胞肿瘤球的形成,还能通过激活AMPK来阻止EMT进程进而抑制其侵袭与转移,并下调Sox2、Oct4、Nanog等CSCs标志物表达,抑制其干细胞特性。由于CSCs在不同GICs中均存在异质性,而与CSCs相关的特异性标记物又相对匮乏,以BA靶向CSCs的肿瘤治疗方案还需进行大量的研究。
6 BA增敏GICs治疗药物
肿瘤细胞同时对多种抗肿瘤药物产生耐药性的现象称为多重药耐药性(MDR)。MDR是癌症治疗失败的主要原因之一,癌症患者生存率很大程度上取决于肿瘤细胞MDR的水平[42]。MDR是多种不同机制共同作用产生的结果,了解肿瘤细胞产生MDR的机制对抑制其耐药性的产生尤为重要。目前研究数据表明BA能从促进细胞凋亡、抑制突变型p53、促进细胞焦亡以及抑制表皮细胞生长因子受体(EGFR)4个方面分别降低CSCs中CRC[33,43]、OC[21]、PC[41,44]细胞的MDR。p53是一个重要的抑癌基因,参与细胞的多种生理过程,大部分癌症中突变型p53可以帮助细胞规避凋亡命运,加速肿瘤的进展及化疗耐药性的产生,这种现象称为突变型p53的功能增益(GOF)[45]。BA与阿霉素和5-FU联用能明显抑制CRC中SW-480细胞内突变型p53的表达并降低其Ser15位点磷酸化的水平,从而改善这类依赖于降解突变型p53蛋白的化疗药物在CRC中的疗效[33]。细胞焦亡是一种新型的PCD方式,广泛参与肿瘤的发生发展。与细胞凋亡不同的是,焦亡常伴有细胞膜溶解的炎症反应。由Caspase-1前体、NLR家族蛋白与凋亡相关斑点样蛋白(ASC)构成的炎症小体可活化Caspase-1继而触发经典细胞焦亡途径,对炎症小体的准确调控有助于GICs的治疗以及胃肠道稳态的维持[46]。有研究[21]发现BA与顺铂联用在体内外均能促进OC中TE-11细胞炎症小体的释放,诱导细胞焦亡并提高其对顺铂的敏感性;同时BA联合顺铂(DDP)能抑制TE-11细胞CSCs标记物SOX2、OCT4、CD133的表达,说明BA对顺铂的增敏作用与其抑制CSCs的能力存在联系。此外,BA联合吉西他滨抑制PC中Panc-1细胞也与CSCs的抑制有关[41]。EGFR的过表达已在PC中被证实,然而绝大多数初期受益于EGFR抑制剂的PC患者终究会因肿瘤MDR的逐渐形成而失去有效药物[47]。肿瘤细胞对EGFR抑制剂的耐药性与STAT3反馈性激活有关[48]。有研究[44]表明BA可与Panc-1、MIA PaCa-2细胞内STAT3蛋白的Lys-591、Ser-613位点稳定结合,抑制其磷酸化以提高EGFR酪氨酸激酶抑制剂(TKI)吉非替尼对PC细胞的抑制效果。见表5。
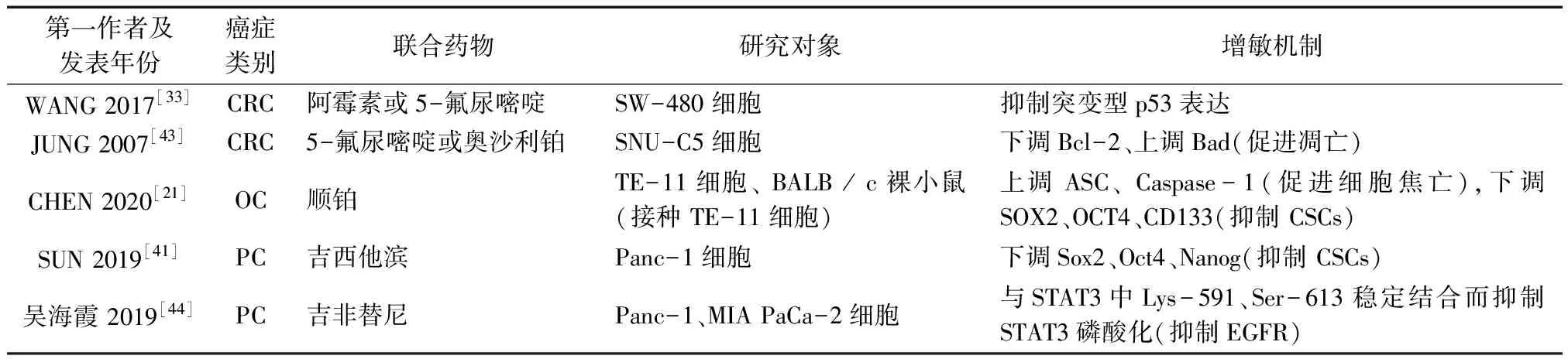
表5 BA增敏GIC治疗药物相关机制
7 展望
对正常细胞的非特异性毒性,如化疗导致的肝肾毒性与神经累积性病变[49],以及肿瘤耐药细胞的形成是传统GICs治疗的两大局限性。BA凭借其优异的抗肿瘤活性和较低的毒副作用成为了肿瘤治疗研究的热点,在GICs研究领域内更是如此。绝大部分的研究均指出BA在抗GICs上呈剂量依赖性,并不具有明显的细胞毒性。此外,BA能从多方面抑制不同GICs细胞的MDR,这为抗MDR联合疗法提供了新思路。本文首次对BA抗GICs机制进行梳理,但目前已完成的关于BA抗GICs的研究仍有待深入,例如:BA对GICs细胞凋亡、自噬以及p53的影响尚存在争议,对于BA能否从抑制炎症反应、改善有氧糖酵解以及阻滞肿瘤血管形成等角度抑制GICs的问题还没有明确解答。综上所述,BA无疑具有成为临床治疗GICs的重要药物的潜力,但其抗肿瘤机制还有待大量研究进一步阐明。

