苯甲酸质子转移平衡常数的测定方法
肖 玲,李 宇
(海军工程大学化学与材料教研室,湖北 武汉 430033)
目前研究苯甲酸的电离常数主要是利用电导法[1]、pH计法[2]、电位滴定法[3-4]、分光光度法[5-7]等几种方法。刘长增等[6]用中和曲线法测定了弱酸的电离常数;石秋忠等[7]采用Origin,Statistica,Excel等软件处理电位滴定法中的滴定数据,与传统的终点确定方法进行比较,提出了较为精确的滴定终点确定方法;魏永巨[8]由电位滴定数据导出求算弱酸电离常数与混合酸组分浓度的通用公式;王夔等[9]详细地给出了电位法测定多元酸电离常数的不同情况的数据处理方法。刘绪良等[10]利用生成函数的概念,推导出计算弱酸电离常数的精确公式来计算苯甲酸的电离常数。
1 实验部分
1.1 实验仪器级试剂
酸度计:EL20型,梅特勒公司;电导率仪:CON510型,北京中科科尔仪器有限公司;电子天平:AE2000型,梅特勒公司;移液管;容量瓶;烧杯。苯甲酸、氢氧化钠均为分析纯,国药集团化学实际有限公司。
1.2 实验原理
(1)缓冲溶液法
当c(C6H5COOH)=c(C6H5COONa)时:pH=pKa
(2)电导法
苯甲酸的质子转移平衡常数与解离度存在如下关系:

在一定温度下,电解质溶液的电导G与溶质的性质及浓度c有关。为了便于比较不同溶质的溶液的电导,常采用摩尔电导Λm。它表示在1 cm的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率κ乘以此溶液的全部体积。若溶液的浓度为c(mol/L),则含有1单位物质的量电解质的溶液体积V=10-3/c,于是溶液的摩尔电导Λm为:
根据稀释定律,若电解质溶液的浓度越小,则其电离越大。无限稀释时,若电解质也可看作是完全解离的,即此时的解离度α=100%。从而可知,在一定温度下,某浓度c的摩尔电导Λm与无限稀释时的摩尔电导Λm之比即为该弱电解质的解离度,即:
所以有苯甲酸的电离常数为:
上式可变形为:
因为Λmc=κ,所以上式变为:
(3)吸光光度法
A=ε·c
假设高酸度时,弱酸全部以酸式形式存在(即c=[HL]),测得的吸光度为AHL,则:
AHL=εHL[HL]
在低酸度时,弱酸全部以碱式形式存在(即c=[L-]),测得的吸光度为AL-,则:
AL-=εL-[L-]
整理得:
2 结果与分析
2.1 缓冲溶液法
用移液管移取25.00 mL的苯甲酸溶液至锥形瓶,加入两滴酚酞指示剂,用标准的NaOH溶液滴定,至溶液由无色变为粉红色,且半分钟不褪色,再用移液管移取25.00 mL醋酸溶液至锥形瓶,配成1:1的苯甲酸-苯甲酸钠缓冲溶液,摇匀,测定溶液的pH值,平行测定三次,测得的数据与计算结果如表1所示:

表1 缓冲溶液法数据处理
2.2 电导法
(1) 配制的不同浓度的苯甲酸溶液。
(2) 在25 ℃条件下,用电导率仪测定配制苯甲酸溶液时所用的二次蒸馏水的电导率值,记为κ(水),测量三次取平均值;
(3) 在25 ℃条件下,由低浓度到高浓度,用电导率仪测定不同浓度的苯甲酸溶液的电导率值κ(测量值),并将测得的值经过标准曲线的校正得到κ;
(4) 则苯甲酸溶液的真实电导率值为, ,
(5) 根据公式计算的值,将测得的不同浓度苯甲酸与对应的作图1,通过直线的斜率计算苯甲酸的电离常数。
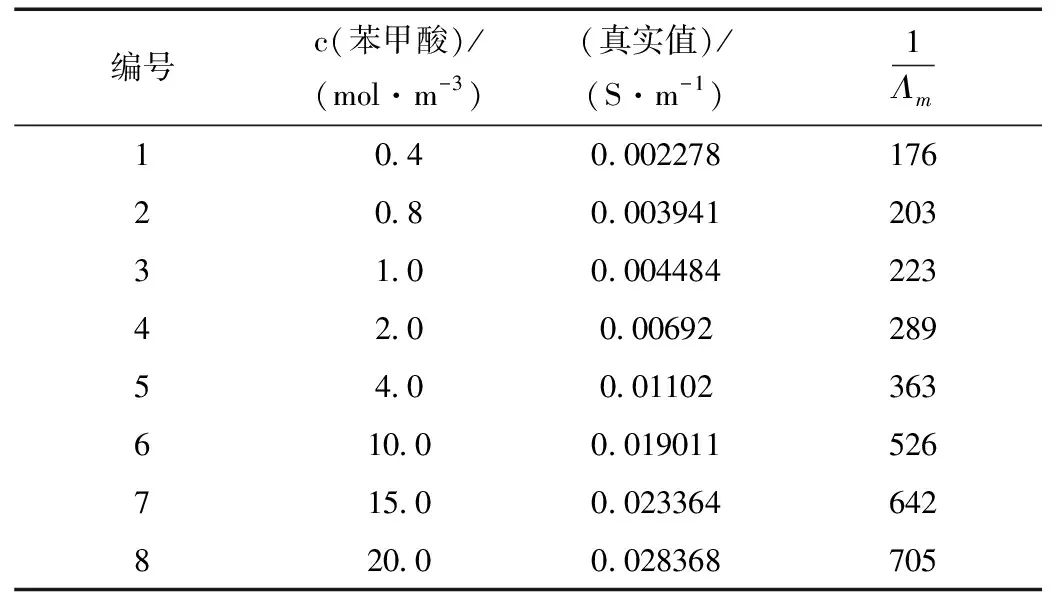
表2 电导法测定数据处理

图1 电导率与摩尔电导率倒数之间关系Fig.1 relationship between electroconductivity and reciprocal of molar conductivity
由直线方程知直线的斜率为20876,则:
κ=1/[(3.82×10-2)2×1000×20876]=5.90×10-5
将测量值与文献值比较得相对误差为5%符合实验误差的要求。
2.3 吸光光度法
在不同pH值下,配制浓度为0.001 mol·L-1苯甲酸溶液。测定其在强碱溶液中的吸光度值为0.8691,强酸性溶液中吸光度值为0.5302,pH分别为6.86, 4.9, 4.39, 4.65的吸光度值如表2所示。
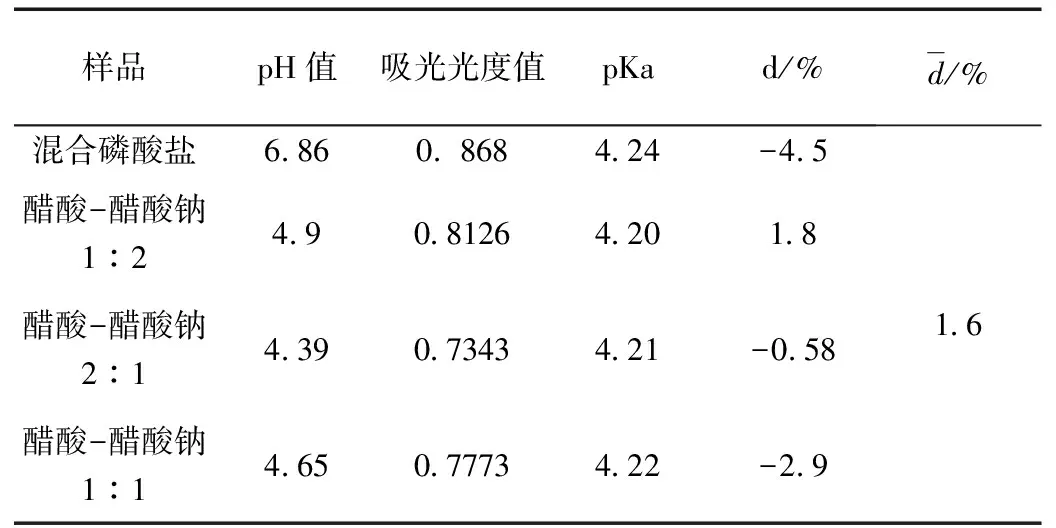
表2 吸光光度法测定数据处理
通过测定不同pH值下,苯甲酸的吸光度值,得到苯甲酸的质子转移平衡常数为6.06×10-5, 将测量值与文献值比较得相对误差为1.6%符合实验误差的要求。
3 结 语
(1)三种方法测定苯甲酸质子转移平衡常数的结果都在误差范围之内,符合无机化学和普通化学实验的要求。
(2)缓冲溶液法原理简单,不需要准确标定苯甲酸的浓度,得到1:1的缓冲溶液体系,用酸度计测量pH值方法简单,可作为非化学专业开设普通化学实验内容。
(3)吸光光度法原理复杂,综合性强,利用了简单的仪器分析知识,适合分析化学实验开设。

