黄芪甲苷对脂多糖诱导的巨噬细胞炎症反应及核因子κB受体活化因子配体/骨保护素系统表达的影响
邵帅,鲁美丽,高秀秋,王洪新
(锦州医科大学 1.附属第二医院牙周科;2.药学院药理教研室,辽宁 锦州 121000)
牙周炎是一种发生在牙周支持组织的慢性破坏性疾病。而牙周袋袋壁的炎症与牙槽骨的吸收是牙周炎的典型特点[1]。牙周炎的发生及发展过程与牙周致病菌有着密不可分的联系,牙周致病菌释放的毒力因子如白细胞毒素、脂多糖(lipopolysaccharide,LPS)、牙龈素等能够直接引起牙周局部刺激,致使白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性细胞因子水平显著上升[2]。大量证据表明,过度分泌核因子受体激活因子κB配体(the receptor activator of nuclear factor-κB ligand,RANKL)是破骨形成的关键因素。骨保护素(osteoclastogenesis inhibitory factor,OPG)是RANKL的诱饵受体,增加OPG的表达可抑制或延迟破骨细胞的发生。因此,OPG与RANKL的比值表示骨稳态[3]。
黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)为羊毛酯醇形的四环三萜皂苷,是中药黄芪的主要活性成分之一。研究[4]发现AS-Ⅳ有很好的抗炎效果,如LPS诱导的器官损伤、缺血再灌注损伤、过敏性疾病等。然而,对AS-Ⅳ在牙周炎症及骨稳态方面药理作用的相关研究较少,ZHANG等[5]探讨了AS-Ⅳ对实验性牙周炎大鼠炎症和免疫功能的影响,但对研究机制并没有明确的阐述。因此,本研究拟探讨AS-Ⅳ在体外对LPS诱导的RAW264.7细胞炎症的作用,以及对RANKL/OPG表达的影响。
1 材料与方法
1.1 试剂
AS-Ⅳ(含量>98%)购自南京景竹生物科技有限公司。小鼠巨噬细胞系RAW264.7购自中国上海细胞库;DMEM 培养基、胎牛血清购自美国Bio-Rad公司;LPS和DMSO购自美国Sigma公司;细胞计数试剂(cell counting kit-8,CCK-8)、ELISA试剂盒购自北京索莱宝科技有限公司;β-actin、Toll样受体4(Tolllike receptor 4,TLR4)、磷酸化核因子κB抑制剂α(phosphonated inhibitor of kappa-B,P-IκBα)、磷酸化核因子κB(phospho-nuclear factor kappa-B P65,P-NF-κB P65)、RANKL、OPG抗体购自美国Abcam公司。
1.2 细胞培养
RAW264.7细胞用含10%胎牛血清的DMEM培养基,置于37 ℃、5%CO2的培养箱中培养。收集对数期细胞用于实验。
1.3 细胞活力检测
1.3.1 细胞活力:RAW264.7细胞悬液以5 000/孔的细胞密度接种于96孔板,每孔100 μL。设置调零组(培养基)、对照组(细胞+培养基)、AS-Ⅳ 组(10、25、50、100 μg/mL),每组3个复孔,处理24 h后每孔加入10 μL CCK-8,置于培养箱培养2 h后,酶标仪在 450 nm 处测量吸光度。
1.3.2 细胞毒性:设置调零组、对照组、LPS(2 μg/mL)组和LPS+AS-Ⅳ组(10、25、50、100 μg/mL),细胞悬液以5 000/孔的细胞密度接种于96孔板,每孔100 μL,待细胞达到生长对数期后,LPS+AS-Ⅳ组分别加入相应浓度的AS-Ⅳ,培养24 h后,除对照组,调零组外加入相应浓度的LPS共同孵育24 h后每孔加入10 μL CCK-8,置于培养箱培养2 h后,酶标仪在450 nm 处测量吸光度。
1.4 ELISA检测IL-1β、IL-6、TNF-α炎性细胞因子含量
将细胞分为空白对照组、LPS组、AS-Ⅳ 50 μg/mL和AS-Ⅳ 100 μg/mL 4个组。以1×106/孔的接种密度接种于6孔板中。药物处理后,吸取细胞培养基,收集上清,3 000 r/min 离心 10 min。按照 ELISA 试剂盒说明书,测定细胞培养基中IL-1β、IL-6和TNF-α的表达水平。
1.5 实时PCR检测RANKL和OPG mRNA的表达
实时PCR检测RAW264.7细胞中RANKL和OPGmRNA的表达。提取细胞的总RNA反转录合成cDNA,扩增。按照试剂盒的步骤进行实验操作。反应条件为预变性95 ℃、30 s;循环反应 95 ℃、5 s;60 ℃、30 s,共40个循环;溶解曲线95 ℃、15 s、60 ℃、1 min、95 ℃、15 s。以GAPDH为内参,采用2-ΔΔCT法分析。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.6 Western blotting 检测相关蛋白表达
用裂解液提取细胞中蛋白,然后使用 BCA 蛋白测定试剂盒测量蛋白浓度。将样品蛋白在8%~12%SDS-PAGE 凝胶上分离,并转移至PVDF膜上。膜用1%BSA封闭1.5h,然后分别与TLR4、P-IκBα、P-NFκB P65、RANKL和OPG一抗 4 ℃孵育过夜。二抗在室温孵育 2 h。采用 Image-J 软件分析结果。
1.7 统计学分析
采用 SPSS 25.0 统计软件进行数据分析,数据均以表示。多组间显著性检验采用单因素方差分析和 LSD 法。P< 0.05 为差异有统计学意义。
2 结果
2.1 AS-Ⅳ对RAW264.7对细胞活力的影响
RAW264.7细胞经不同浓度AS-Ⅳ处理后,其细胞活力无显著变化(P> 0.05),见图1。RAW264.7细胞在不同浓度的AS-Ⅳ预处理24 h后,再经LPS刺激24 h,与对照组相比,LPS组细胞活力显著下降(P<0.01);10 μg/mL组细胞活力与LPS组无统计学差异(P> 0.05);25 μg/mL组与LPS组比较细胞活力有显著差异(P< 0.05);50 μg/mL、100 μg/mL组与LPS组比较细胞活力有统计学差异(P< 0.01)。见图2。

图1 不同浓度AS-Ⅳ对RAW264.7细胞活力的影响Fig.1 Effects of different concentrations of AS-Ⅳ on RAW264.7 cell viability

图2 不同浓度AS-Ⅳ对LPS刺激的RAW264.7细胞活力的影响Fig.2 Effects of different concentrations of AS-Ⅳ on viability of RAW264.7 cells stimulated by LPS
2.2 AS-Ⅳ对IL-1β、IL-6、TNF-α炎性细胞因子释放的影响
与对照组相比,LPS组IL-1β(741.00±11.00)、IL-6(915.33±12.22)和TNF-α(616.33±11.15)释放量显著增高(P<0.01);与LPS组相比50μg/mL和100μg/mL组IL-1β(523.3±14.05,234.3±12.10)、IL-6(611.33±8.51,305±11.14)和TNF-α(407.67±14.98,193.67±9.45)释放量显著降低(P<0.01)。见图3。
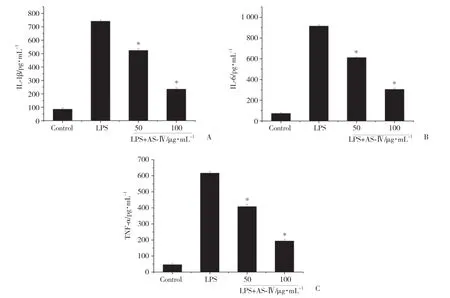
图3 AS-IV对炎性细胞因子表达的影响Fig.3 Effect of AS-IV on expression of cytokines
2.3 AS-Ⅳ对RANKL和OPGmRNA表达的影响
与对照组相比,LPS组RANKLmRNA(0.17±0.06)表达显著上调(P<0.01);与LPS组相比,50μg/mL和100μg/mL组RANKLmRNA(0.43±0.08,0.61±0.04)表达显著降低(P<0.01);与对照组相比,LPS组OPGmRNA(5.27±0.63)的表达显著下降(P<0.01);与LPS组相比,50μg/mL和100μg/mL组OPGmRNA(3.09±0.44;2.20±0.36)表达显著上调(P<0.01);与对照组相比,LPS组OPG/RANKL的比值(0.03±0.01)大幅度降低(P<0.01);与LPS组相比50μg/mL组OPG/RANKL的比值(0.14±0.03)升高(P<0.05),100μg/mL组OPG/RANKL的比值(0.28±0.02)显著上升(P<0.01)。见图4。
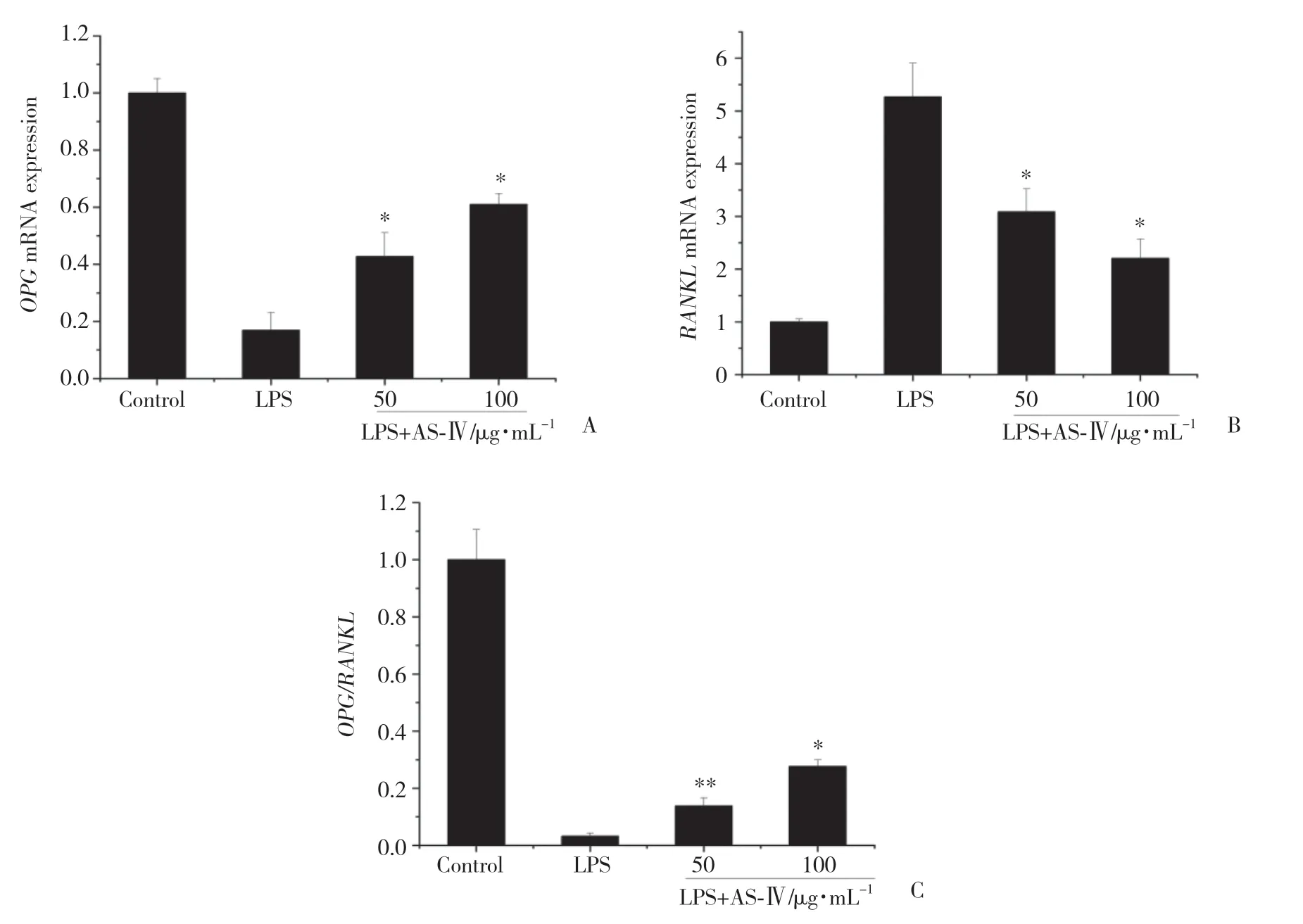
图4 AS-IV对RANKL/OPG系统的影响Fig.4 Effect of AS-IV on the RANKL/OPG system
2.4 AS-Ⅳ对NF-κB信号通路以及OPG、RANKL蛋白表达的影响(图5)

图5 AS-Ⅳ对NF-κB信号通路以及OPG、RANKL蛋白表达的影响Fig.5 Effects of AS-IV on the NF-κB signaling pathway and RANKL/OPG protein expression
与对照组相比,LPS组TLR4(3.66±0.50)、P-P65(3.36±0.13)、P-IκBα(6.73±0.05)和RANKL(3.82±0.23)蛋白表达显著升高(P<0.01),OPG(0.20±0.09)蛋白表达、OPG/RANKL比值(0.05±0.005)显著降低(P<0.01);与LPS组相比,50μg/mL和100μg/mL组TLR4(2.57±0.35,1.84±0.25)、P-P65(2.25±0.15,1.59±0.14)、P-IκBα(3.34±0.02,1.49±0.07)和RANKL(1.88±0.06,1.15±0.04)蛋白表达显著降低(P<0.01);OPG(0.27±0.07,0.62±0.05)蛋白表达、OPG/RANKL比值(0.14±0.01,0.54±0.03)显著升高(P<0.01)。
3 讨论
牙周炎的特点是牙周组织的炎症和牙槽骨的吸收[3]。牙周炎症的发生加速了炎症细胞浸润[6]。本研究探讨了AS-Ⅳ对LPS介导的RAW264.7细胞炎症反应的抑制作用以及对细胞内骨代谢相关蛋白表达产生影响。
LPS是革兰氏阴性菌的外膜成分,是巨噬细胞表面TLR4表达的配体[7]。LPS介导炎症反应主要通过介导NF-κB信号通路来实现。NF-κB是一类由P50和P65组成的蛋白家族。其中,P65是促炎基因表达的重要调节因子[8]。不仅如此,NF-κB控制TNF-α、IL-1β和IL-6表达在炎症反应中起到重要作用。TNF-α、IL-1β和IL-6作为重要的促炎介质,在牙周炎过程中显著上调,通过影响白细胞的活性积极参与牙周组织的危害[9]。这些细胞因子通过炎症细胞的招募和激活在不同程度上参与炎症的产生和发展。因此,本研究中选择了TNF-α、IL-1β和IL-6来检测AS-Ⅳ对这些细胞因子产生的影响。大量研究[10-11]已经证实NF-κB信号通路在调节炎症反应方面的重要作用。牙周炎症可能通过抑制NF-κB的激活得到缓解。Western blotting结果显示,AS-Ⅳ能过抑制LPS诱导的NF-κB激活与TLR4的表达。LI等[12]研究证实TLR4可介导LPS刺激的人牙龈成纤维细胞中NF-κB的激活。通常,NF -κB与其抑制剂IκBα结合,并以非活性形式存在于细胞质中[13]。在LPS的刺激下,IκB-α蛋白被磷酸化和降解,而NF-κBP65可能从细胞质转入细胞核,上调炎症介质[14]。ELISA和Western blotting结果显示,AS-Ⅳ通过调节NF-κB通路抑制了这些炎性细胞因子的产生,证实了AS-Ⅳ在调节相关的免疫应答方面具有潜在的作用。
破骨细胞的分化是通过破骨前细胞表面的RANK与其配体RANKL[15]结合来调控的,从而激活NF-κB信号通路。研究[16]表明,NF-κB亚单位P50和P52的缺失导致小鼠破骨细胞分化缺陷和骨硬化,NF-κB通路控制破骨形成。AMARASEKARA等[17]证明LPS可与破骨细胞前体相互作用,如骨髓巨噬细胞,或间接激活牙龈成纤维细胞和支持破骨细胞形成的成骨细胞,还通过诱导RANKL表达参与破骨细胞分化。因此,在骨稳态中,OPG和RANKL的表达与激活对牙槽骨吸收和代谢至关重要。OPG是一种分泌蛋白,是RANKL的诱饵受体,在成骨细胞分化过程中分泌[18]。分泌型OPG与RANKL结合,通过阻止RANKL-RANK的结合,抑制破骨细胞形成,从而降低破骨细胞形成和骨吸收[19]。此外,IL-1和TNF-α也能通过促进RANKL的产生,促进破骨细胞的聚集,并促进骨破坏[20]。Western blotting和实时PCR结果显示,AS-Ⅳ增加了OPG的表达,降低RANKL的表达。此外,AS-Ⅳ增加了OPG/RANKL比值。这表明AS-Ⅳ可能通过阻断RANKL-RANK结合和牙槽骨重塑来抑制破骨细胞的形成。
综上,AS-Ⅳ可以抑制 LPS 诱导的 RAW264.7巨噬细胞的炎症反应,其抗炎作用主要体现在介导NF-κB信号通路抑制炎性细胞因子 TNF-α、IL-6 和IL-1β 的生成,并且AS-Ⅳ还可以调节OPG/RANKL通路调节骨代谢相关蛋白的表达。这可能是其防治各种慢性炎症疾病重要作用机制。本研究为临床应用AS-Ⅳ治疗牙周炎提供了理论依据。

