延龄草甾体皂苷对脑缺血大鼠星形胶质细胞GFAP、Cx43及Wnt3a/Dvl3信号通路的影响
李慢中,欧阳俊摇,杨乐,庄雨明,詹宇,邹海艳,赵晖
1.首都医科大学附属北京世纪坛医院药学部,北京 100038;2.首都医科大学中医药学院,北京 100069;3.临床合理用药评价北京市重点实验室,北京 100038
延龄草为百合科延龄草属植物延龄草Maxim.的干燥根及根茎,具有镇静安神、活血止血通络等功效。临床常用于治疗高血压、神经衰弱、眩晕头痛及脑震荡后遗症等。甾体皂苷为延龄草的主要活性成分。药理研究显示,延龄草甾体皂苷(TSTT)能降低局灶性脑缺血大鼠梗死体积,减轻神经细胞损伤,改善脑血流灌注。但其抗脑缺血损伤的作用机制尚不明确。
星形胶质细胞是中枢神经系统数量最多、分布最广的胶质细胞,对维持神经元结构和功能具有重要作用。脑缺血后,星形胶质细胞激活并大量增殖,活化的星形胶质细胞可摄取细胞毒性物质,维持中枢微环境稳定,并为神经元提供养分,保护神经元。缝隙连接蛋白43(Cx43)构成的半通道及缝隙连接是脑缺血后星形胶质细胞-神经元间信息传递及物质转运的重要途径。研究显示,Wnt信号通路可调控星形胶质细胞缝隙连接蛋白,影响星形胶质细胞功能及神经元存活。本研究采用免疫荧光染色检测大鼠缺血脑组织星形胶质细胞标志蛋白胶质纤维酸性蛋白(GFAP)和Cx43表达,分析TSTT对星形胶质细胞活化及缝隙连接通讯的影响,利用实时荧光定量PCR检测Wnt3a和Dvl3基因表达,分析TSTT对Wnt3a/Dvl3信号通路的调控作用,探讨TSTT保护神经元-星形胶质细胞的作用机制。
1 材料与方法
1.1 动物
8周龄SPF级雄性SD大鼠72只,体质量300~320 g,北京维通利华实验动物技术有限公司提供,动物生产许可证号SCXK(京)2016-0011。饲养于首都医科大学实验动物中心,使用许可证号SYXK(京)2018-0003,饲养温度20~25 ℃,相对湿度40%~50%,自由摄食饮水。适应性饲养1周后进行实验。本实验经首都医科大学实验动物伦理委员会审批(AEEI-2018-052)。
1.2 药物及制备
延龄草药材购自湖北恩施,由首都医科大学中医药学院李佳副教授鉴定为百合科延龄草属植物延龄草Maxim.的干燥根及根茎。TSTT由首都医科大学中药药效物质基础研究实验室制备,每克提取物相当于原药材16.55 g,使用时分别称取65、33 mg TSTT用10 mL蒸馏水溶解。银杏叶提取物片(金纳多),40 mg/片,德国威玛舒培博士药厂,批号1380817,将60 mg金纳多溶于10 mL蒸馏水,配制成浓度为6 mg/mL溶液。
1.3 主要试剂与仪器
无水乙醇(北京化工厂,批号B0301002),羊血清(北京中杉金桥有限公司,批号ZLI-9021),GFAP抗体(美国Millipore,货号MAB360),Cx43抗体(英国Abcam,货号ab66151),动物组织总RNA提取试剂盒、FastQuant cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂(北京天根生化科技有限公司,货号分别为DP431、KR106、FP205)。ASP300全自动脱水机(德国Leica),101-OAB电热鼓风干燥箱(天津市泰斯特仪器有限公司),Mastercycler pro梯度PCR仪(德国Eppendrof),CFX Connect荧光定量PCR仪(美国Bio-Rad),Eclipse生物显微镜(日本Nikon),NIS-Elements Basic Research图像采集分析系统(日本Nikon),HT7700透射电镜(日本Hitachi)。
1.4 造模
参考文献[8]采用线栓法建立大脑中动脉栓塞致局灶性脑缺血大鼠模型。60只大鼠经异氟烷(5%诱导、2%维持)麻醉后,仰卧位固定,颈正中皮肤消毒后切口,暴露右侧颈总动脉、颈外动脉和颈内动脉,分离迷走神经。结扎颈总动脉和颈外动脉,动脉夹夹住颈内动脉远心端,在颈总动脉分叉处剪一小口,将尼龙线圆钝端插入颈内动脉,撤掉动脉夹,将尼龙线缓慢送入18~20 mm,有阻力感后停止进线,结扎动脉残端,缝合皮肤。大鼠完全清醒后进行神经行为学观察,出现左侧肢体障碍者(不能完全伸展左前肢,行走时向左侧倾倒或转圈)纳入实验。另取12只大鼠作为假手术组,相同方法麻醉后,仅暴露动脉分支,不闭塞中动脉。
1.5 分组及给药
造模过程中11只大鼠死亡、1只大鼠造模失败,最终48只成模大鼠纳入实验。将成模大鼠随机分为模型组、金纳多组和TSTT低、高剂量组,每组12只。给药剂量根据课题组前期研究结果确定,TSTT低、高剂量组分别予33、65 mg/kg TSTT溶液灌胃,金纳多组予60 mg/kg金纳多溶液灌胃,灌胃体积10 mL/kg,造模后2 h灌胃给药1次,之后每24 h灌胃1次,连续15 d。假手术组和模型组灌胃等体积生理盐水。
1.6 取材
每组随机选取2只大鼠,异氟烷麻醉后用300 mL生理盐水快速左心室灌注冲洗,4%多聚甲醛-2.5%戊二醛-0.1 mol/L磷酸盐缓冲液心内灌注固定,灌注时间60 min,待大鼠固定完全后,断头取脑,切取缺血灶周围1 mm×1 mm×1 mm组织,放入2.5%戊二醛中固定,用于电镜观察。
每组随机选取5只大鼠,异氟烷麻醉后用300 mL生理盐水快速左心室灌注冲洗,4%多聚甲醛心内灌注固定,灌注时间45 min,待大鼠固定完全后,断头取脑,置于4%多聚甲醛中4 ℃固定1周,切取大脑前囟-0.4~0.4 mm冠状面组织,放入包埋盒中石蜡包埋,切取0.5 μm石蜡切片,用于免疫荧光染色。
每组随机选取5只大鼠,异氟烷麻醉后断头处死,迅速剥离脑组织,分离缺血边缘脑组织,放入液氮中,置于-80 ℃冰箱保存,用于实时荧光定量PCR检测。
1.7 透射电镜观察
0.2 mol/L磷酸盐缓冲液漂洗脑组织,24 h后锇酸固定至组织完全变黑。脱水,包埋,烤箱加温聚合,超薄切片机连续切片(100 nm),制备6~10张连续超薄切片,裱于独眼铜网,对切片进行醋酸双氧铀和枸橼酸铅双重染色,置于电镜下观察神经元和星形胶质细胞超微结构。
1.8 免疫荧光染色
石蜡切片置于烘箱中60 ℃烤片60 min,常规脱蜡水化,柠檬酸盐缓冲液高热修复抗原20 min,冷却至室温后用10%羊血清封闭60 min,加入GFAP(1∶600)和Cx43(1∶100)一抗,4 ℃孵育48 h,复温后加入Alexa488-IgG(1∶300)和DyLight594-IgG(1∶200)二抗,37 ℃避光孵育120 min,DAPI封片,置于生物显微镜下观察,图像采集分析系统进行分析。在缺血边缘皮层、纹状体各选取3个视野,分别统计GFAP和Cx43阳性表达的积分光密度。
1.9 实时荧光定量PCR检测
按试剂盒说明提取大鼠缺血边缘脑组织总RNA,以总RNA为模板反转录合成cDNA,配制扩增反应体系混合液进行PCR。PCR反应条件:95 ℃预变性15 min,95 ℃变性10 s,共40个循环,52 ℃退火31 s,72 ℃延伸30 s。以β-actin为内参,采用2法计算目的基因相对表达量。引物由日本Takara公司合成,引物序列见表1。

表1 各基因PCR引物序列
1.10 统计学方法
采用SPSS21.0统计软件进行分析。计量资料以±表示,方差齐用方差分析,组间比较用LSD检验,方差不齐采用Kruskal-Wallis非参数检验。<0.05表示差异有统计学意义。
2 结果
2.1 延龄草甾体皂苷对模型大鼠神经元和星形胶质细胞超微结构的影响
假手术组大鼠神经元形态规则,细胞核较大,核膜清晰,核仁明显,染色质分布均匀,电子密度低,细胞质内可见多种细胞器;星形胶质细胞结构规则,胞核呈卵圆形,核膜清晰,染色质分布均匀,细胞器结构清晰完整。模型组大鼠神经元胞核明显固缩,核膜不规则,核仁消失,染色质呈块状聚集在细胞核周围,电子密度增加,细胞质内细胞器明显减少、结构疏松,可见大量空泡;星形胶质细胞肿胀明显,细胞核形状不规则,核膜模糊,染色质消融,核周出现空白区,细胞器减少,结构疏松。与模型组比较,TSTT低、高剂量组和金纳多组大鼠神经元和星形胶质细胞超微结构损伤明显减轻。见图1。
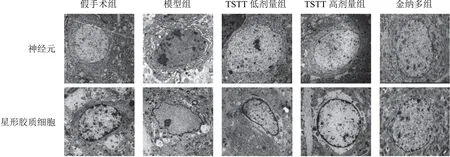
图1 各组大鼠神经元和星形胶质细胞超微结构(×1 500)
2.2 延龄草甾体皂苷对模型大鼠缺血边缘皮层、纹状体胶质纤维酸性蛋白和缝隙连接蛋白43表达的影响
与假手术组比较,模型组大鼠缺血边缘皮层、纹状体GFAP和Cx43表达显著升高(<0.01);与模型组比较,TSTT低、高剂量组和金纳多组大鼠缺血边缘皮层、纹状体GFAP和Cx43表达显著降低(<0.01)。见图2、图3、表2。
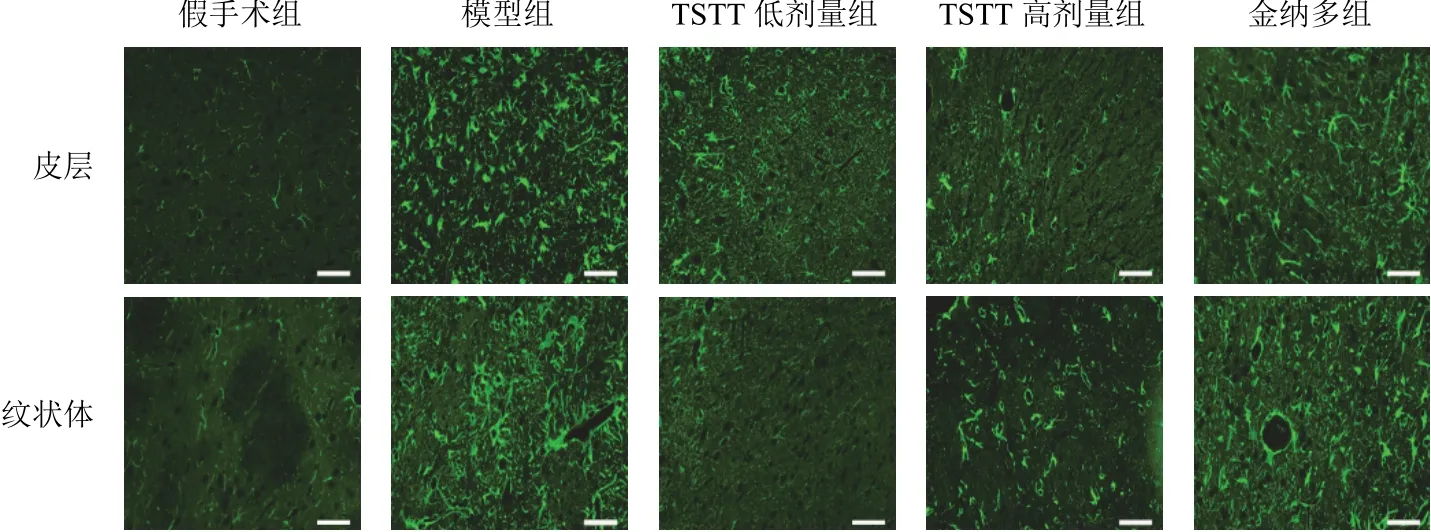
图2 各组大鼠缺血边缘皮层和纹状体GFAP阳性表达(免疫荧光染色,标尺=50 μm)
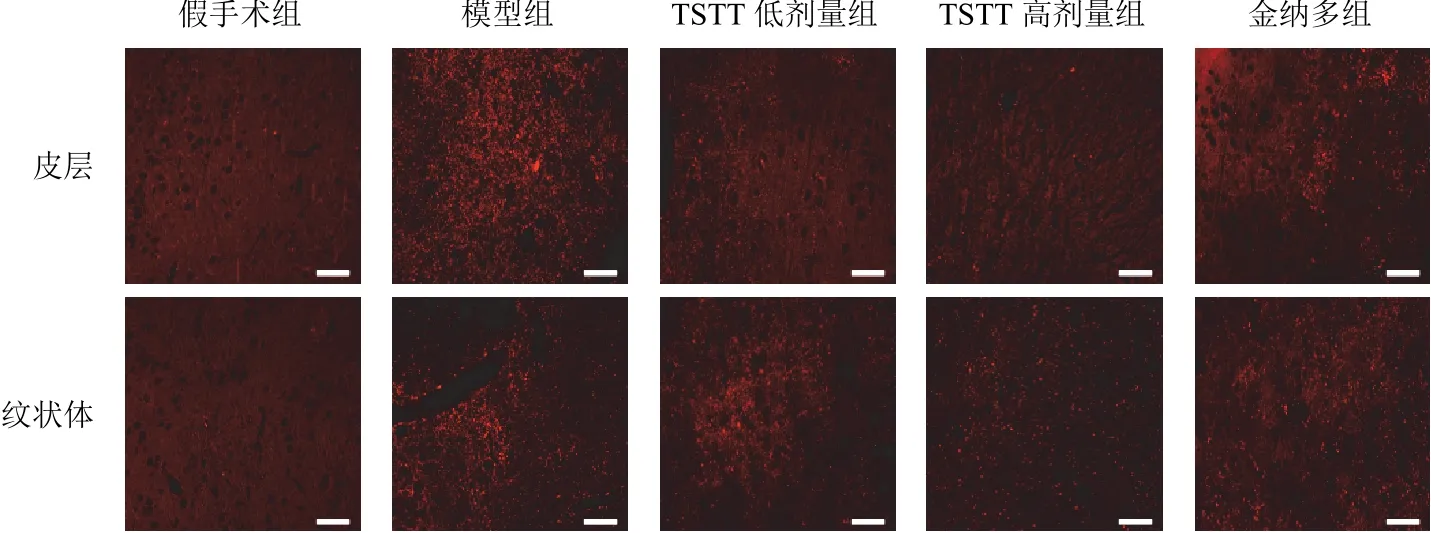
图3 各组大鼠缺血边缘皮层和纹状体Cx43阳性表达(免疫荧光染色,标尺=50 μm)
表2 各组大鼠缺血边缘皮层、纹状体GFAP和Cx43表达比较(±s,积分光密度)
2.3 延龄草甾体皂苷对模型大鼠缺血边缘脑组织Wnt3a、Dvl3基因表达的影响
与假手术组比较,模型组大鼠缺血边缘脑组织Dvl3基因表达显著降低(<0.01),Wnt3a基因表达有升高趋势,但差异无统计学意义(>0.05);与模型组比较,TSTT高剂量组和金纳多组大鼠缺血边缘脑组织Wnt3a和Dvl3基因表达显著升高(<0.05,<0.01),TSTT低剂量组大鼠缺血边缘脑组织Dvl3基因表达显著升高(<0.05)。结果见表3。
表3 各组大鼠缺血边缘脑组织Wnt3a和Dvl3基因表达比较(±s)
3 讨论
星形胶质细胞对维持神经元结构和功能至关重要,是治疗脑缺血损伤的潜在靶点。脑缺血后,星形胶质细胞大量激活,呈肥大、增生样改变。活化的星形胶质细胞对神经元具有双重作用:一方面通过增加摄取谷氨酸、清除氧自由基以及分泌神经营养因子发挥神经元保护作用;另一方面也可诱导炎症反应,促进神经细胞凋亡。因此,调节星形胶质细胞功能对维持神经元功能、促进脑卒中康复具有重要意义。
本研究利用透射电镜观察神经元和星形胶质细胞超微结构发现,模型组大鼠神经元出现核固缩、核仁消失,星形胶质细胞出现明显肿胀、染色质消融等病理变化。免疫荧光染色结果显示,模型组大鼠缺血边缘皮层、纹状体星形胶质细胞标志蛋白GFAP表达明显升高,TSTT低、高剂量可以明显减轻神经元和星形胶质细胞超微结构损伤,降低大鼠缺血边缘皮层、纹状体GFAP表达,提示TSTT可抑制脑缺血大鼠星形胶质细胞过度活化,减轻神经元损伤。
Cx43是星形胶质细胞最主要的缝隙连接蛋白,在星形胶质细胞间、星形胶质细胞-神经元间及细胞外环境间进行信息传递和物质运输中具有重要作用。Cx43不仅向神经组织提供营养,维持细胞外离子平衡,还可调控离子和细胞扩散。研究显示,Cx43是脑缺血损伤中的重要调节因子。脑缺血损伤后Cx43表达升高,促进星形胶质细胞通过缝隙连接释放大量炎症因子和趋化因子,加剧神经炎症反应。同时,Cx43过表达会诱导谷氨酸受体激活,产生自由基,进一步作用于细胞膜生成脂质过氧化物,导致神经元死亡,造成大脑的不可逆性损伤。研究发现,通过药物干预或Cx43抑制剂下调Cx43表达,可缩小脑梗死体积,保护神经元,促进神经功能康复。本实验结果显示,TSTT可下调大鼠缺血边缘皮层、纹状体Cx43表达,改变星形胶质细胞缝隙连接功能,对缺血脑组织发挥保护作用。
Wnt通路在真核生物中高度保守,对细胞增殖、迁移、凋亡和干细胞维持等具有重要作用。Wnt蛋白是Wnt通路的启动因子,分为Wnt1和Wnt5a两个亚族。Wnt3a是Wnt-1亚族的重要成员,可激活经典的Wnt通路。Wnt信号激活后,Wnt蛋白与七次跨膜受体卷曲蛋白或低密度脂蛋白受体相关蛋白家族结合,募集胞质中的散乱蛋白(Dvl)至胞膜附近,将信号传至胞内,参与下游靶基因转录及表达的调控。研究发现,Wnt信号在星形胶质细胞生成和活化过程中扮演重要角色。Wnt3a可抑制星形胶质细胞活化,降低局灶性脑缺血大鼠缺血边缘GFAP表达,减轻炎症反应,且对Cx43蛋白表达具有广泛的调控作用。本研究发现,模型组大鼠缺血边缘脑组织Wnt3a基因表达较假手术组有升高趋势,可能与脑内源性神经再生激活、神经前体细胞向神经元细胞及神经胶质细胞分化有关。TSTT可上调模型大鼠缺血边缘脑组织Wnt3a和Dvl3基因表达,提示TSTT调控Wnt3a/Dvl3信号通路在抑制星形胶质细胞异常活化过程中发挥重要作用,其具体机制有待进一步研究。前期研究表明,延龄草甾体皂苷类成分能抑制局灶性脑缺血大鼠炎症因子如肿瘤坏死因子α、白细胞介素-1β和白细胞介素-6释放,抵抗超氧化物歧化酶和丙二醛氧化损伤,保护神经元。
综上所述,TSTT可通过降低脑缺血大鼠缺血边缘皮层、纹状体GFAP和Cx43表达,上调缺血边缘脑组织Wnt3a/Dvl3基因表达,抑制星形胶质细胞异常活化,减轻脑缺血大鼠神经元和星形胶质细胞超微结构损伤。

