野生蜜环菌(ArmillariaMellea)的分离纯化及抑菌作用
穆燕 律凤霞 艾鑫 赵文君


摘 要:分离纯化野生蜜环菌菌丝培养物,研究菌丝体代谢物质对大肠杆菌、金黄葡萄球菌、志贺氏菌和副溶血性弧菌的抑制作用.采集野生蜜环菌子实体,获得遗传同一性菌丝体纯培养物,振荡培养获得菌丝体代谢液,观察其对致病菌的抑菌效果.实验结果表明,分离纯化得到的菌丝体纯培养物与蜜环菌遗传同一,菌丝体代谢液对大肠杆菌、金黄葡萄球菌、志贺氏菌和副溶血性弧菌等食品中常见的致病菌具有较好的抑制作用
关键词:蜜环菌;组织分离;分子鉴定;致病菌
[中图分类号]180.6140 [文献标志码]A
随着人们对食品安全的高度重视,天然食品防腐剂的价值被越来越多的人认可和重视.许多食药用菌具有天然的抑菌效果[1-3],既能提供食药用成份,也可替代化学防腐剂,保证食品纯天然质量.蜜环菌(Armillaria mellea)俗称榛蘑,属白蘑科蜜环菌属的一种好氧性兼性寄生真菌[4],广泛分布于世界各地,在我国的黑龙江、吉林、青海、浙江、湖南、贵州等省常见.[5]本实验研究蜜环菌代谢物质对食品中常见致病菌的抑制作用,探讨蜜环菌菌丝体在食品中的食药用价值.
1 材料与仪器
1.1 试验材料及仪器
实验材料 9月末10月初野外采集蜜环菌子实体.采集到的蜜环菌子实体棕黄色或浅土黄色,中央部颜色稍深,菌盖表面密生小鳞片或丛卷毛状鳞片,开伞的菌盖边缘多波浪形,内部具有放射状条纹,菌柄长柱形稍弯曲,纤维质,内部松软,符合蜜环菌子实体表型特征.
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、志贺氏菌(Shigella Castellani)、副溶血性弧菌(Vibrio Parahemolyticus)由牡丹江师范学院生命科学学院微生物实验室提供.
实验仪器 PCR试剂盒(宝生物工程有限公司产品),真菌DNA提取试剂盒(QIAGEN公司产品),双面超净工作台,恒温光照培养箱,全自动高温蒸汽灭菌锅,PCR仪,恒温水浴锅.
1.2 培养基
PDA加富培养基 20%马铃薯,2%葡萄糖,1%酵母浸粉,1%琼脂粉,0.3%磷酸二氢钾,0.15%硫酸镁,0.01%维生素B1.
液体培养基配方 20%马铃薯、2%葡萄糖、1%酵母浸粉、0.3%磷酸二氢钾、0.15%硫酸镁、0.01%维生素B1.
2 试验方法
2.1 野生蜜环菌子实体组织分离
组织分离法分离菌丝体.在超净工作台上,用75%酒精消毒蜜环菌子实体表面,掰开蘑菇伞顶组织,无菌解剖刀割取内部小块菌肉,接种于平板PDA加富培养基中.重复接种三板,23 ℃恒温暗培养.观察菌丝生长状态,保证菌落单一,无污染.
2.2 蜜环菌液体培养
选择组织分离后单一无污染的菌落,无菌环境下挑取边缘菌丝转接至液体培养基,23℃恒温振荡培养15 d.
2.3 蜜环菌子实体及菌丝体DNA分子鉴定[6]
纯培养物液体振荡再培养,过滤获得蜜环菌菌丝体球,用真菌DNA提取试剂盒分别提取子实体和菌丝体DNA,以真菌ITS通识引物对DNA进行PCR扩增,反应体系及反应条件见表1.
PCR产物经1%琼脂糖电泳验证,子实体DNA和菌丝体DNA的PCR产物各选两个特异条带清晰的送生物公司测序,测序结果在NCBI网站BLAST比对,确定分离得到的菌丝体和子实体之间的遗传同一性.
2.4 蜜环菌代谢液抑菌实验
致病菌活化 取出低温保存的致病菌大肠杆菌、志贺氏菌、金黄葡萄球菌和副溶血性弧菌,无菌环境下分别转接到LB液体培养基中,37℃,200 rpm恒温震荡培养24 h,得到致病菌菌悬液.
蜜环菌代谢液制备 振荡培养15 d的蜜环菌培养液,无菌条件下过滤得滤液,加10%的1×PBC缓冲液.
牛津杯法[7]验证抑菌效果 超净工作台内将融化的LB固体培养基10~15 mL倒入培养皿内,放置凝固作为底层.将活化后的4种致病菌菌悬液与40 ℃左右的LB固体培养基按1∶2的比例混合,分别倒入已凝固的LB固体培养基平皿上,倒入量约10~15 mL,在混合培养基凝固前迅速均匀摆放4个无菌牛津杯.待培养基凝固后在每个牛津杯中注满蜜环菌代谢液,移到37 ℃恒温环境静置培养16~20 h后,观察抑菌效果,测量抑菌圈直径.
3 结果与分析
3.1 蜜环菌组织分离培养
组织分离法培养的菌丝体表现为白色致密菌丝,培养后期菌落内部有菌索形成(图1).
3.2 蜜环菌分离菌液体培养
蜜环菌纯化菌恒温振荡液体培养15 d后得到大小均匀的白色菌球,代谢液清澈,菌球清晰可见,无菌条件过滤得清澈滤液.
3.3 蜜环菌子实体及菌丝体DNA分子鉴定
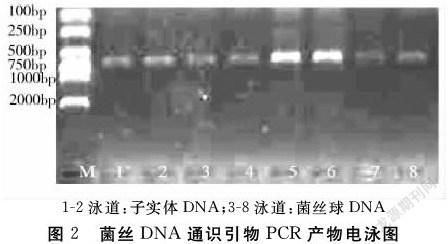
过滤得到的菌球与子实体同时提取DNA,以真菌ITS通识引物进行PCR扩增,扩增产物经1%琼脂糖电泳分离(图2).
依DNA 2 000 bp maker可见:2个子实体DNA和5个菌丝体DNA的PCR产物均在大于750 bp处出现特异条带,菌丝体PCR产物比子实体PCR产物条带清晰且亮度高.测序结果表明:
子实体DNA和菌丝体DNA序列相同.测序序列在NCBI网站进行Nucleotide BLAST比对,与网站公布MW418 555.1同源性达100%,确定采集的子实体和分离的纯培养物为东北蜜环菌.
3.4 蜜环菌代谢液抑菌效果
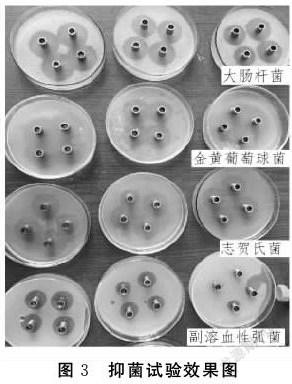
蜜环菌代谢液对4种致病菌的抑菌效果见图3.四组试验培养基中牛津杯周围均出现明显的抑菌圈,不同致病菌中的抑菌圈大小和透明度有明显差异.对大肠杆菌的抑制效果表现为抑菌圈直径大且透明度高,对金黄葡萄球菌和志贺氏菌的抑制效果为抑菌圈直径大但透明度不高,对副溶血性弧菌的抑菌效果为抑菌圈直径较小但透明度高.
4 结论
蜜环菌代谢液对食品中常见大肠杆菌、金黄葡萄球菌、志贺氏菌和副溶血性弧菌等食品中常见致病菌具有较好的抑菌效果,蜜环菌代谢液对不同致病菌抑菌效果的差异可通过提高添加深度和纯度进一步进行研究.蜜环菌生长不需要苛刻的培养条件,组织培养容易获得大量菌锁及菌丝体,液体培养容易获得大量菌球及代谢液,可弥补子实体季节性生长的限制.
参考文献
[1]Pinchu k I V,Bressoll ier P,Verneuil B,et al.In vitro anti H eli-cobacter pylori activity of the probiotics train Bacillus subtilis 3 isdue to secretion of antibiotics[J].Antimicrob Agents Chem other,2001,45:3156-3161.
[2]倪锦虹,彭亮聪.食用菌提取物的抑菌作用研究进展[J].食品安全导刊.2021(09):150-151.
[3]罗青,王国霞.药食用真菌抑菌作用的研究进展[J].郑州师范教育,2018,04(3):30-32.
[4]袁媛,刘景圣.蜜环菌液体深层发酵培养基的优选[J].农产品加工,2009(7):57-59.
[5]聂维.黑龙江榛蘑产业现状及生长环境调查探究[J].种子科技,2021,05(3):110-112.
[6]赵世明,律凤霞.番茄早疫病病原菌分离纯化及分子鉴定[J].牡丹江师范学院学报;自然科学版,2020(04):31-34.
[7]熊莉,朱谦慧.在本科微生物实验教学中拓展抑菌实验的探索[J].实验科学與技术,2020,04(09):88-92.
编辑:琳莉

