水分胁迫下发草(Deschampsia caespitosa)叶片脯氨酸及其代谢产物变化
罗巧玉,陈 志,马永贵,王彦龙,拉毛叶,马玉寿,*
1 青海师范大学生命科学学院,高原科学与可持续发展研究院,青海省青藏高原药用动植物资源重点实验室,西宁 810008 2 青海大学农牧学院,西宁 810008
水分是限制植物生长重要的非生物因子之一,影响植物的生存、生理代谢、生长发育乃至地理分布[1—2]。同时,水分胁迫是植物生长发育过程中经历的最常见、最普遍的胁迫因子[3—4]。干旱、淹水、高温、冰冻或盐渍等都能引起水分胁迫[5—8]。水分胁迫对植物的影响主要体现在细胞活性、组织和器官功能上[9]。水分胁迫下植物体内积累大量活性氧,水分代谢平衡被打破,细胞原生质脱水、水势下降,导致植物在形态和功能上发生重大变化[10]。为保护自身免受伤害,植物进化出有效的抗氧化系统以清除过多的活性氧[11—12]。其中脯氨酸(proline,Pro)作为一类分布广泛的重要渗透调节物质,在防止水分胁迫对植物造成伤害中起重要作用[13]。Pro的生物合成途径有2条,包括以谷氨酸(glutamate,Glu)为底物的Glu途径和以鸟氨酸(ornithine,Orn)为底物的Orn途径[12]。Glu途径中Glu生成谷氨酸半醛(glutamic-γ-semialdehyde,GSA)是可逆反应,Δ1-吡咯琳-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)是限速酶、Δ1-吡咯琳-5-羧酸脱氢酶(Δ1-pyrroline-5-carboxylate dehydrogenase,P5CDH)是逆反应的催化酶[7]。Orn途径中鸟氨酸转氨酶(ornithine aminotransferase,δ-OAT)是关键酶[14]。GSA和Δ1-吡咯琳-5-羧酸(Δ1-pyrroline-5-carboxylate,P5C)是Pro代谢途径的中间产物,可以自发地相互转化。Pro降解过程是合成过程的逆过程,Δ1-吡咯琳-5-羧酸还原酶(Δ1-pyrroline-5-carboxylate reductase,P5CR)是催化酶、脯氨酸脱氢酶(proline dehydrogenase,ProDH)是限速酶[7]。目前,关于Pro对干旱[5,15]、水涝[6,16]、盐[15,17]、冻融[12,18]等胁迫中的响应规律已有较多报道,但不同植物对干旱和水涝胁迫的耐受、抵御机制不尽相同[12—13,16],而且有关从干旱到水涝的梯度水分胁迫下Pro积累以及Pro合成途径中酶活性、底物及中间产物动态变化等的研究较少。
发草(Deschampsiacaespitosa)别名无芒发草、小穗发草,是禾本科(Gramineae)发草属(Deschampsia)多年生草本植物,具有耐寒、耐旱、耐水淹、耐盐碱、耐重金属等优良特性[19—21]。发草适口性好、营养物质含量高,是值得大力推广的优良牧草[22]。同时,发草茎叶柔软、耐修剪,是良好的地被草坪植物[23]。研究表明,发草适生范围广,不仅能够生长于草原等旱生环境,而且能够生长于河滩、沼泽等湿生生境[24—26]。沼泽湿地及边缘过渡带具有周期性淹水和出露交替的特征,水分条件经常发生极端干旱或淹水的变化[27],发草在长期进化中已适应极端干旱或淹水交替变化的特殊土壤水分条件。目前关于发草的研究仅见于其作为藏嵩草(Kobresiaschoenoides)、青藏苔草(Carexmoorcroftii)群落的伴生种的调查、发草的分布与起源以及形态学特征[24—26],水分胁迫下发草抗逆性特征的研究尚少。因此,研究干旱、水涝两种截然相反的水分逆境下发草Pro生理应答机制,对该物种抗旱/涝育种、植被修复选种和资源利用等具有重要意义。
本研究以发草为供试植物,利用盆栽模拟水分胁迫试验方法,研究从干旱到水涝的梯度水分胁迫下发草Pro积累状况及其代谢途径中底物和关键酶的动态变化规律,分析发草Pro代谢对干旱和水涝胁迫的响应特点,为进一步研究发草及发草属植物的耐受/抵御水分胁迫机制奠定基础,也为高寒沼泽湿地旱涝“共耐性”植物的深入研究及利用发草开展退化高寒沼泽湿地植被恢复提供理论基础。
1 材料与方法
1.1 栽培基质
土壤基质为河沙和壤土的混合物,壤土取自青海省果洛藏族自治州玛沁县大武镇高寒草甸,沙和土以1∶1(体积分数)混合均匀。其理化性质为:全氮0.31%、全磷0.26 mg/g、全钾19.58 mg/g、有机质1.45%、pH 7.63(水土比为1∶1)、电导率225.52 μS/cm(水土比为5∶1)。
1.2 供试植物
供试植物发草种子由青海大学畜牧兽医科学院草原研究所提供,是经过多年野生栽培驯化的新品系。挑选饱满一致、无病害种子,用2% NaClO3浸泡消毒5—10 min,用蒸馏水漂洗3—5次后备用。
1.3 实验设计
本研究于青海师范大学城北校区(36.742°N,101.749°E)进行。该试验点海拔2390.6 m,夏季平均气温16.4 ℃。2018年9月将发草种子直接播种于装有3 kg供试土壤的底部带孔盆钵(直径20 mm,高25 mm)内,3—5 d出苗,待幼苗稳定后进行定苗,每盆定苗10株。期间对幼苗进行正常水分管理。冬季将植物转移至温室内过冬,2019年4月中下旬天气转暖时将植物转移至室外露天培养。7月25日发草植株长至25 cm时进行水分胁迫处理,具体水分处理[28—29]如表1所示。采用完全随机设计,每个处理设10个重复。干旱处理及植物正常需水量处理的盆钵底放置盆托,水涝处理的盆钵底放置水桶以免水分流出。田间持水量采用环刀法测定[30],用环刀采集具代表性原状盆土进行土样吸水使土壤水分达到饱和,排除重力水后烘干称重。水分处理过程中,原地搭建遮雨棚,雨棚两侧通风,不影响温度和湿度。遮雨棚内放置便携式气象仪(霍尔德HED-SQ,中国),监测实时气象数据。水分处理期间大气温度和湿度状况如图1所示。用土壤水分传感器(ProCheck,USA)监测土壤含水量进行水分控制[28—31],每两天补充损失水分以控制土壤水分达到处理条件,并设置1个无植物盆土作为对照,估计土壤表面蒸发水分量。水分处理期间各处理的土壤含水量如图2所示。每次浇水时间为18:00—19:00。浇水过程中观察并记录植株性状变化。水分胁迫处理共持续28 d,分别在试验处理前及处理后7、14、21、28 d取植物叶片。用蒸馏水漂洗后拭干表面水分,装入冻存管经液氮速冻,置于-80 ℃冰箱保存备用。

表1 发草水分胁迫处理设计Table 1 Treatment design of D. caespitosa about water stress

图1 水分处理期间的大气温度和湿度状况Fig.1 Atmospheric temperature and humidity conditions during water treatments

图2 水分处理期间不同水分处理下土壤含水量状况Fig.2 Soil water content under different water treatmentsHW:重度水涝胁迫Heavy waterlogging stress;MW:中度水涝胁迫Medium waterlogging stress;LW:轻度水涝胁迫light waterlogging stress;CK:对照Control check;LD:轻度干旱胁迫Light dry stress;MD:中度干旱胁迫Medium dry stress;HD:重度干旱胁迫Heavy dry stress
1.4 测定指标与方法
Pro含量测定采用酸性茚三酮显色法[32],酶液提取参照Lutts 等方法[33]。Glu、Orn、GSA、P5C含量及P5CDH、P5CR活性测定采用上海江莱生物科技有限公司生产的酶联免疫分析试剂盒。P5CS活性测定采用Garci-Ríos等[34]方法:100 mmol/L Tris-HCl(pH 7.2)缓冲液(包含25 mmol/L MgCl2、75 mmol/L Glu、5 mmol/L ATP、0.4 mmol/L NADPH)中加入粗酶液启动反应,340 nm下测定吸光值的减少量。δ-OAT活性测定采用Charest等[35]的方法:在0.2 mol/L Tris-KOH(pH 8.0)缓冲液(包含5 mmol/L Orn、10 mmol/L α-酮戊二酸、0.25 mmol/L NADH)加入粗酶液启动反应,340 nm下测定吸光值的减少量。ProDH活性测定采用Lutts等[33]方法:0.15 mol/L Na2CO3-HCl(pH 10.3)缓冲液(包含15 mmol/L L-脯氨酸、1.5 mmol/L NAD+)中加入粗酶液启动反应,340 nm下测定吸光值的增加量。以上指标每处理重复测定3次。
1.5 数据分析
采用SPSS 22软件对试验数据进行单因素方差分析(One-way ANOVA),采用LSD法在显著水平为5%条件下进行比较,当P<0.05时,差异显著。数据结果均用“平均值±标准误”表示,并用利用Origin 2017软件作图。
2 结果与分析
2.1 水分胁迫下发草生长以及叶片Pro含量的变化
水分胁迫下发草的生长受到抑制,随着水分胁迫时间增长,植物受到的抑制效果越明显。干旱胁迫下发草叶片由鲜绿色变成墨绿泛白状态,随着干旱胁迫时间增长,叶片不断萎蔫,直至21 d后重度干旱处理下发草死亡。水涝胁迫下发草叶片颜色变化不明显,但是随着水涝胁迫时间增长,叶片及枯落物腐烂发臭,28 d后重度水涝处理下发草地上部分全部腐烂。
根据不同处理对发草Pro含量的方差分析结果(表2)可知,水分处理、处理时间及水分处理和处理时间的互作对发草Pro含量的影响极显著(P<0.01)。由图3发现,未进行水分处理前,所有植物Pro含量均无显著性差异。水分处理下发草Pro含量均显著高于对照。随着处理时间增长,Pro含量呈现增加趋势。其中中度干旱处理下Pro含量最大,达到142.10 μg/g鲜重。除了重度水涝和重度干旱处理下发草Pro含量一直升高外,其他水分处理21 d前后Pro含量逐渐下降或者趋于稳定不再继续升高。上述结果表明,干旱到水涝的梯度水分胁迫下发草Pro含量均显著增加,从而参与渗透调节来抵制逆境。随着处理时间增长,Pro含量增加,但除了重度干旱和重度水涝胁迫外,其他水分胁迫处理21 d前后Pro含量趋于稳定。
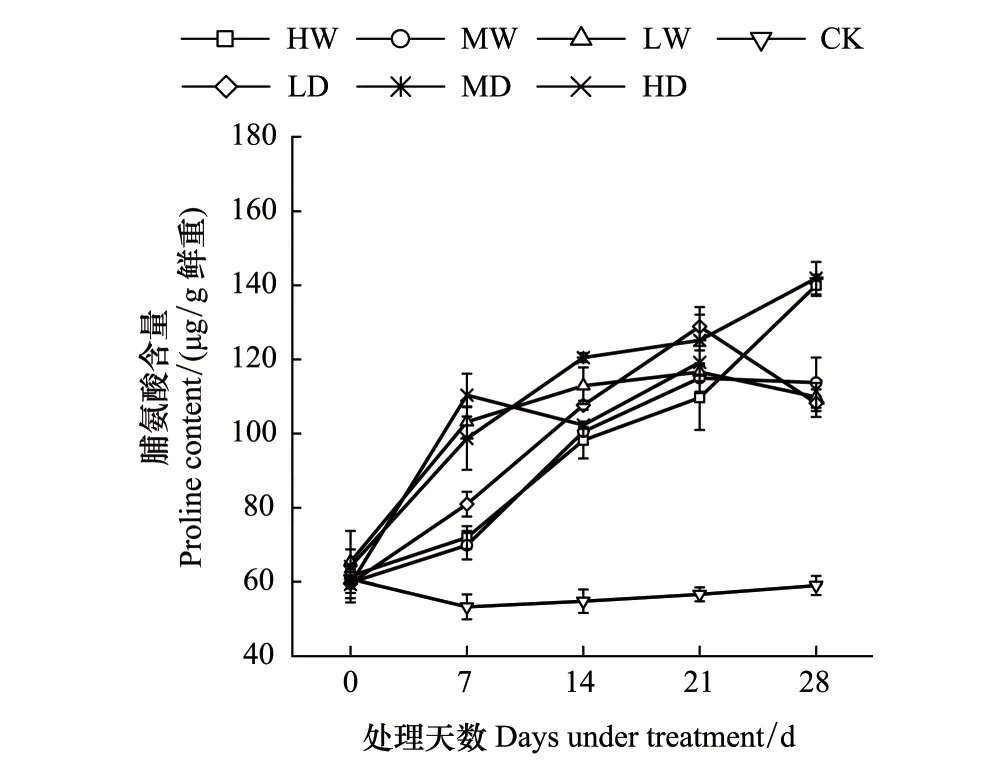
图3 不同水分处理下发草叶片脯氨酸含量的动态变化 Fig.3 Dynamic changes of proline content in D. caespitosa leaves under different water treatments
2.2 水分胁迫下发草叶片Pro代谢底物和中间产物含量的变化
植物Pro代谢途径包括Glu途径和Orn途径,Glu和Orn分别是这两种代谢途径中的底物。根据不同处理对发草Pro代谢途径中底物、中间产物含量的方差分析结果(表2)可知,水分处理及水分处理和处理时间的互作对发草Glu和Orn含量的具有极显著影响(P<0.01);处理时间对发草Glu含量也具有极显著影响(P<0.01)。从不同水分处理下发草Pro代谢底物Glu和Orn含量的动态变化(表3)发现,未进行水分处理前,所有植物间Glu和Orn含量均无显著性差异。重度干旱和水涝处理在7 d时Glu含量显著下降(P<0.05),其中重度干旱处理下Glu含量为9.56 μg/g鲜重。轻度干旱处理下Glu含量无显著变化,直到21 d时迅速降低。随着处理时间增长,Glu含量上升,28 d时趋于稳定。其中轻度水涝处理下Glu含量最高为20.43 μg/g鲜重。28 d时重度水涝、中度水涝和轻度干旱处理下发草Glu含量显著低于对照(P<0.05)。重度干旱处理7 d Orn含量显著降低(P<0.05)。中度和轻度水分处理下Orn含量有升高趋势。水涝处理后Orn含量无变化,14 d后发草Orn含量显著降低(P<0.05)。综上所述,干旱到水涝的梯度水分胁迫下发草Glu和Orn含量均显著减少,Glu和Orn共同参与Pro代谢途径以生成更多Pro。

表2 不同处理对发草叶片脯氨酸及其代谢途径中底物、中间产物含量的方差分析结果Table 2 Results of ANOVA for the effects of water treatment and treatment time on the content of proline and its substrates and intermediates of the metabolic pathway in D. caespitosa leaves
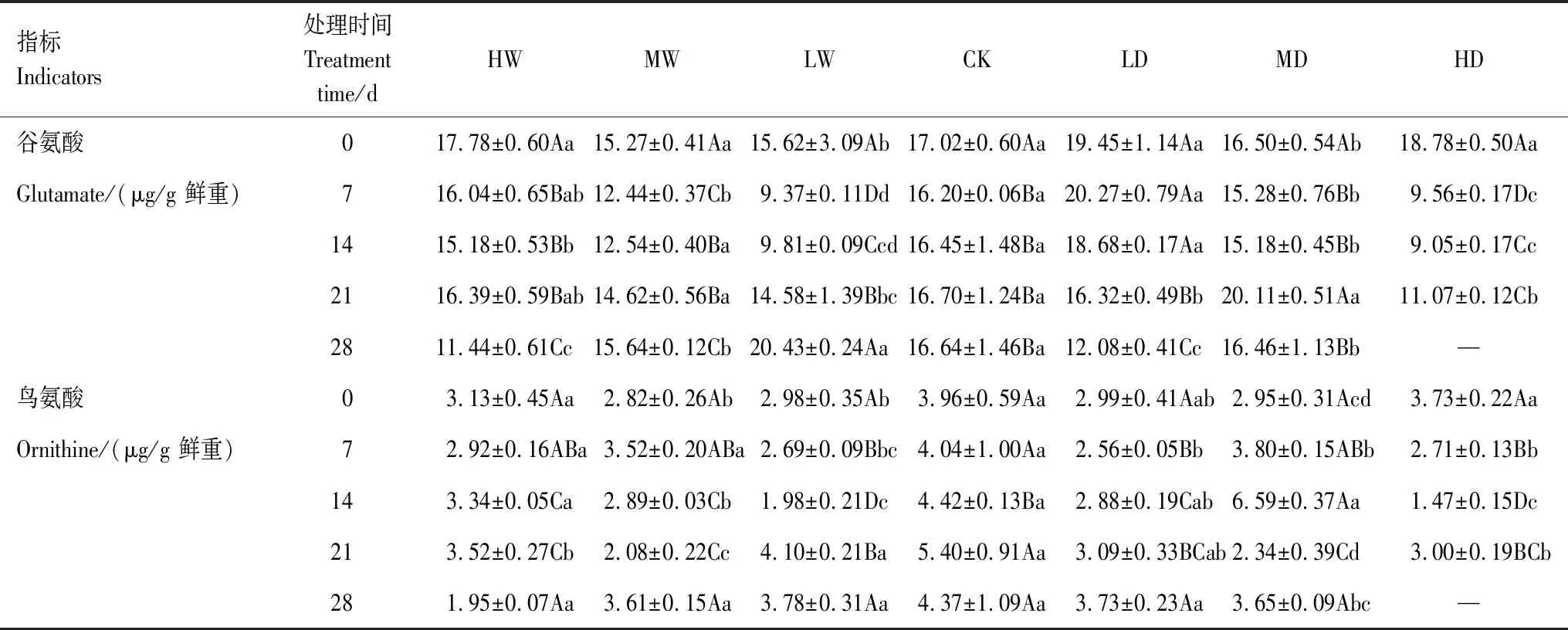
表3 不同水分处理下发草叶片脯氨酸代谢底物谷氨酸和鸟氨酸含量的动态变化Table 3 Dynamic changes of glutamate and ornithine content in D. caespitosa leaves under different water treatments
GSA和P5C是植物Pro合成途径中的中间代谢产物。根据不同处理对发草Pro及其代谢途径中底物、中间产物含量的方差分析结果(表2)可知,水分处理、处理时间及水分处理和处理时间的互作均对发草GSA和P5C含量具有极显著影响(P<0.01)。从不同水分处理下发草Pro代谢中间产物GSA和P5C含量的动态变化(表4)发现,未进行水分处理前,发草叶片的GSA和P5C含量均无显著性差异。水分处理后发草GSA和P5C的含量随着处理时间增加,但未呈现明显规律。重度水涝、轻度水涝、轻度干旱、中度干旱、重度干旱处理下发草GSA含量显著升高(P<0.05)。干旱到水涝的梯度水分胁迫下发草P5C与GSA含量变化趋势基本一致。

表4 不同水分处理下发草叶片脯氨酸代谢中间产物谷氨酸半醛和Δ1-吡咯啉-5-羧酸含量的动态变化Table 4 Dynamic changes of Glutamine hemialdehyde and Δ1-pyrroline-5-carboxylate content in D. caespitosa leaves under different water treatments
2.3 水分胁迫下发草叶片Pro代谢关键酶活性的变化
P5CS、P5CDH、δ-OAT、P5CR和ProDH是植物Pro合成途径中的关键酶。根据不同处理对发草Pro代谢关键酶活性的方差分析结果(表5)可知,水分处理及水分处理和处理时间的互作均对发草叶片中影响Pro代谢的关键酶P5CS、P5CDH、δ-OAT、P5CR和ProDH的活性具有极显著影响(P<0.01),处理时间对发草叶片δ-OAT的活性也具有极显著影响(P<0.01)。
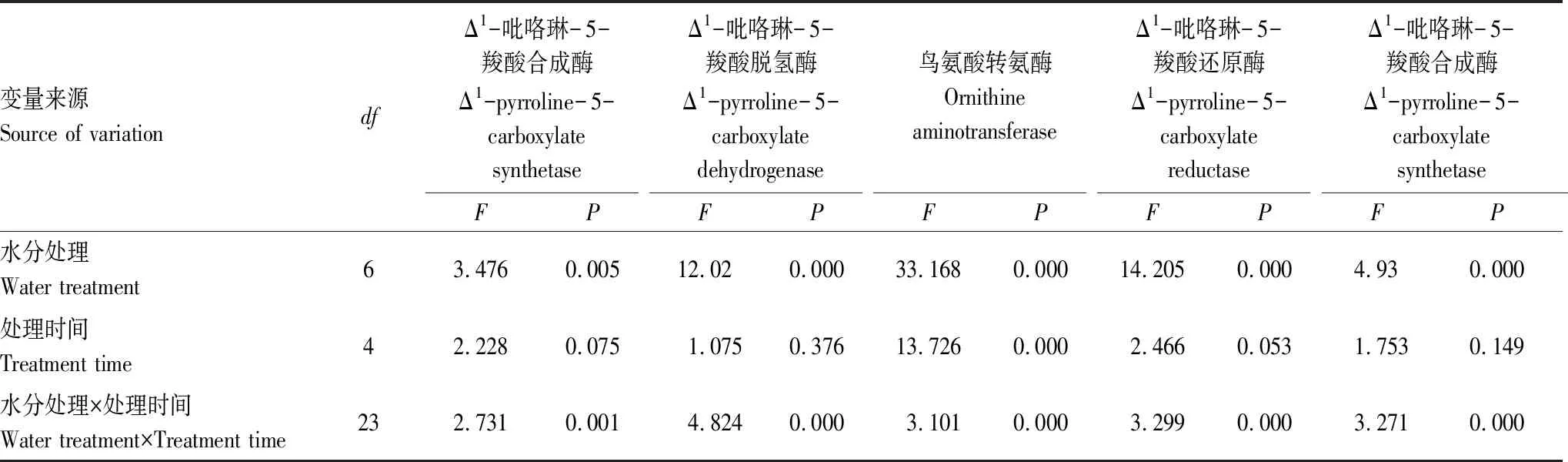
表5 不同处理对发草叶片Pro代谢关键酶活性的方差分析结果Table 5 Results of ANOVA for the effects of water treatment and treatment time on the key enzymes activity of Pro in D. caespitosa leaves
P5CS是Glu途径中的限速酶,Glu在P5CS的催化作用下生成GSA,进而生成Pro。从不同水分处理下发草Pro代谢关键酶活性的动态变化(表6)表明,水分处理后P5CS活性呈现增强趋势。重度水涝和中度水涝处理下不同处理时间P5CS的活性无显著变化。轻度水涝处理下P5CS的活性于28 d时最强。轻度干旱处理P5CS的活性呈先增强后降低趋势。处理14 d,重度干旱处理P5CS的活性显著增强为9.49 U/g鲜重。处理21 d时降低到7.93 U/g鲜重。Glu途径中Glu生成GSA是可逆反应,P5CDH是逆反应的催化酶。水分处理后P5CDH活性下降,变化趋势与P5CS活性的变化相反。δ-OAT是Orn途径中的关键酶,可将Orn转化为GSA,进而合成Pro。除重度水涝外,水分处理后δ-OAT活性均呈增强趋势。不同水分处理下δ-OAT活性增强的时间不一致,处理7 d时,轻度水涝处理和重度干旱处理下发草叶片δ-OAT的活性显著增强(P<0.05);处理14 d时,轻度干旱处理和中度干旱处理下发草叶片δ-OAT的活性显著增强(P<0.05)。P5CR是Pro生物合成通路中的关键酶,将P5C还原成Pro。水分处理前期P5CR的活性无显著变化,但随着处理时间增加,轻度干旱、重度干旱、轻度水涝和重度水涝处理下活性增强显著。ProDH是Pro降解反应的限速酶,将Pro降解为P5C。随着水分处理时间增加,发草ProDH活性显著下降。21 d时水分胁迫下发草ProDH活性显著低于对照植物,尤其在轻度水涝和重度水涝处理下ProDH活性降低显著。

表6 不同水分处理下发草叶片脯氨酸代谢关键酶活性的动态变化Table 6 Dynamic changes of the key enzymes activity of proline in D. caespitosa leaves under different water treatments
2.4 水分胁迫下发草叶片Pro代谢中各代谢物、关键酶之间的相关性
对水分胁迫下发草Pro代谢途径中Pro、Glu、Orn等10个指标进行相关性分析(表7),结果表明:发草Pro含量与Glu和Orn含量、ProDH活性具有显著负相关(P<0.05),与GSA和P5C含量及δ-OAT活性具有极显著正相关(P<0.01);Glu含量与GSA含量、δ-OAT活性间存在极显著负相关(P<0.01),与P5CS和P5CR活性间存在极显著正相关(P<0.01);Orn含量与P5C含量、P5CR活性具有极显著正相关(P<0.01),与GSA含量具有显著正相关(P<0.05),与P5CDH活性存在显著负(P<0.05);GSA含量与P5C含量、δ-OAT活性间具有极显著正相关(P<0.01),与ProDH活性具有显著负相关(P<0.05);P5C含量与P5CR活性间存在极显著正相关(P<0.01),与δ-OAT活性间具有显著正相关(P<0.05);P5CS活性与P5CR活性间具有极显著正相关(P<0.01);P5CDH活性与δ-OAT活性间具有显著正相关(P<0.05)。

表7 发草叶片Pro代谢中各代谢物、关键酶之间的相关性Table 7 Correlation analysis of metabolites and key enzymes of Pro metabolism in D. caespitosa leaves
3 讨论
3.1 水分胁迫对发草叶片Pro含量变化的影响
Pro是分子透性最大、极易溶于水的相容性渗透剂和抗氧化剂,在植物体内分布广泛并以游离状态存在。Pro的水合能力很强,在抵抗水分胁迫中发挥重要作用[5,17]。Pro的积累可提高细胞液浓度,有效保持渗透平衡,使水分进入细胞或降低水分从细胞中流出,防止细胞过度缺水而变形[7];Pro和酶相互作用可以稳定蛋白
质的结构,保持细胞膜完整性,防止膜蛋白变性[6];Pro具有保护光复合物Ⅱ的作用[36],维持逆境胁迫下植株正常的光合作用[37]。因此,逆境中植物体内Pro含量升高既可能是植物适应性的表现,也可能是植物细胞受损的表征[5,15—16]。大量研究将Pro含量高低作为衡量植物抵抗逆境能力强弱的指标[38—39]。因此,发草体内Pro含量高低可作为衡量在水分胁迫环境下发草抗逆性强弱的指标。本研究结果表明,干旱到水涝的梯度水分胁迫下,发草叶片Pro含量均显著升高(P<0.05),说明发草植株内Pro含量的升高是主动积累的过程,通过积累Pro来缓解水分胁迫损伤。本研究结果证实植物受到干旱、水涝等水分胁迫时会通过积累Pro来增强对逆境的抵抗能力[38—39]。随着处理时间延长,水分胁迫下发草植株内Pro含量升高,但21 d前后Pro含量不再增加甚至有下降趋势。前期和中期,生长于水分逆境下的发草叶片内Pro含量逐渐积累,调节发草细胞质渗透压,稳定了生物大分子的结构,提高了发草抗逆性,保证生理代谢正常进行。后期,发草逐渐对水分逆境产生适应性,体内Pro含量保持稳定。目前,其他植物与发草对水分逆境抗逆性强弱的比较研究尚无报道,但本研究中重度干旱和重度水涝胁迫下发草分别于处理21 d和28 d后死亡,表明发草对水涝和干旱具有较强的耐受性及旱涝“共耐性”特征。任青吉等[40]对高寒沼泽化草甸上的华扁穗草(Blysmussinocompressus)、草地早熟禾(Poapratensis)、发草等51种植物的叶片形态特征和光合生理进行了比较研究,发现发草的水分利用效率(water use efficiency,WUE)最高为3.76 μmolCO2/mmolH2O,而蒸腾速率(transpiration rate,Tr)最低为4 mmol H2O m-2s-1。高的水分利用效率和低的蒸腾速率保证了发草可以在水分状况较差的土壤上正常生长。
3.2 水分胁迫对发草叶片Pro代谢中各代谢物含量及关键酶活性变化的影响
不同植物、甚至同一植物在不同环境条件下Pro累积的代谢途径不相同[6,15—16]。总体来说,逆境胁迫下Pro的积累一方面是Pro合成代谢加快,另一方面是Pro氧化分解速率降低[11]。水分胁迫下,植物体内Pro代谢关键酶活性变化直接决定Pro的积累状况。本研究发现,干旱到水涝梯度水分胁迫下,发草叶片内Glu途径中底物Glu的含量和Orn途径中底物Orn的含量均显著下降(P<0.05),同时P5CS活性、δ-OAT活性、P5CR活性均显著增强(P<0.05),表明Pro合成代谢中Glu途径和Orn途径加强。P5CS活性、δ-OAT活性、P5CR活性增强可能是水分胁迫时植物体内诱导一些具有脱氨、同分异构或氧化蛋白质中氨基酸残酶的活性增强,使P5CS、甜菜碱醛脱氢酶(BADH)、δ-OAT、P5CR的转录水平上调[41]。而ProDH活性显著降低(P<0.05),表明Pro分解代谢受到抑制,说明水分胁迫条件下发草Pro含量升高是通过合成代谢的加强和分解代谢的抑制而主动积累的结果,与Das等[6]的研究结果相似。通过Pro含量与Pro代谢中各代谢物、关键酶之间的相关性分析发现Pro含量与δ-OAT活性具有显著性正相关(P<0.01),而与P5CS无显著相关性,可能与P5CS受Pro的负反馈调节有关,当Pro含量增加时负反馈调节抑制了P5CS活性,而δ-OAT活性不受Pro的反馈调节[42]。
4 结论
干旱到水涝的梯度水分胁迫下,发草叶片通过提高其Pro含量来缓解渗透胁迫造成的伤害。发草叶片内Pro含量的升高是主动积累的过程,是Glu途径和Orn途径共同作用的结果。持续21 d的重度干旱处理和持续28 d的重度水涝处理时发草死亡,共同表明发草对水涝和干旱具有较强的耐受性。

