苯并吡喃类近红外荧光探针在生物医学中的研究进展
刘 敏 高 川 李 升
(1. 佳木斯大学 临床医学院,黑龙江 佳木斯 154007;2. 佳木斯大学附属第一医院检验科,黑龙江 佳木斯 154007)
生物体内各种活性物质处于平衡状态是维持生理过程所必须的。在外部条件的刺激下,体内活性物质的异常表达如活性氧、硫醇、酶学等,使机体出现炎症、组织损伤、甚至癌变等一系列复杂的过程[1,2]。因此实时的检测活性物质的变化,对疾病的早期诊断及治疗具有重要意义。二氰亚甲基-4H-吡喃(dicyanomethylene-4H-pyran,DCM)是最常见的近红外荧光染料,具有典型的供体-π-受体(D-π-A)结构,含有供电子基的供体在分子内电荷转移(ICT)作用下将电子转移至受体,光激发时吸收热量,发射出近红外波长并发生红移,产生高的荧光响应[3,4],克服了其他染料紫外/可见光发射、短波长、小斯托克斯位移的缺点[5,6],因此受到研究者的青睐。本文重点介绍DCM近红外荧光探针在生物医学中的进展,并对该领域在今后的应用进行了展望。
1 DCM类近红外荧光探针在生物医学中的应用
1.1 用于生物体内酶学的检测
酶是维持体内相对稳定重要的一员,酶的过量表达与各种疾病发生发展紧密相连。因此建立敏感,简便的酶学检测方法有重要意义,同时为临床诊断提供新的方法。
氨基肽酶N(Aminopeptidase N,APN)是一种水解蛋白质和氨基酸末端残基的重要蛋白水解酶,属于锌金属肽酶家族,在信号的转导,神经肽的降解,免疫应答等方面发挥重要的作用[7]。此外作为肿瘤标志物,参与肿瘤的侵袭转移,血管生成[8]。Li等[9]开发了可激活的双电子荧光探针(two-photon near-infrared (NIR) fluorescence probe,DCM-APN)(图1),用于APN的检测,该探针由DCM发光基团,L-丙氨酸识别基团,在APN存在时与DCM-APN相互作用,水解丙氨酸形成DCM-NH2,氨基作为供电子基团,通过分子内电荷转移(ICT),发出近红外荧光。结果表明DCM-APN在662 nm,pH=4.75~10.27,荧光增强[9]。具有时间和浓度依赖性,较高的敏感性和特异性,重要的是该探针能区分正常组织和肿瘤组织,能在溶酶体进行定位,对肿瘤的早期诊断十分重要。
亮氨酸氨基肽酶(Leucine aminopeptidase,LAP)是蛋白水解酶,是M1,M17肽酶家族的一员[10]。作为肿瘤标志物,与卵巢上皮癌、乳腺癌和胆管梗阻等疾病的发生密切相关[11]。Gu等[12]人开发了可激活的定量近红外荧光(LAP-targeting near-infrared fluorescent probe,DCM-Leu探针)(图2)用于LAP的检测,该探针由近红外荧光基团DCM和识别基团L-亮氨酸经酰胺键连接构成,在加入LAP裂解酰胺键,在660 nm处释放近红外荧光。结果表明DCM-Leu加入LAP后荧光比显著增强,且溶液由最初的黄色变为红色,表明反应生成了DCM-NH2,同时随着时间延长和浓度增加,荧光强度也发生显著变化并且对LAP有较高的选泽性,通过三维共聚焦成像实现细胞内LAP的原位检测[12]。
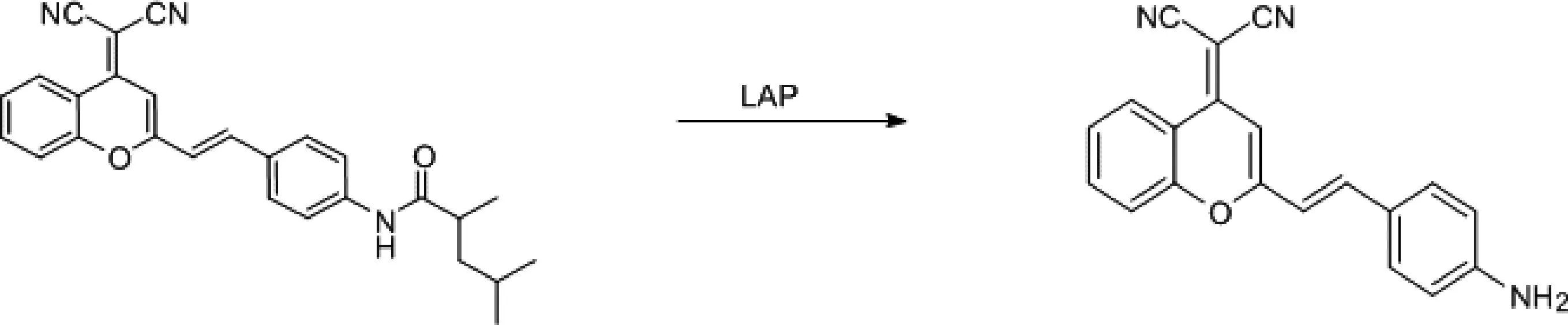
图2 DCM-Leu探针的结构和DCM-Leu对LAP的检测机理Fig. 2 The structure of DCM-Leu probe and the detection mechanism of DCM-Leu on LAP
谷氨酰转肽酶(g-glutamylTranspeptidase,GGT)是膜相关的外生酶,临床上常作为肝损伤,肝毒性的标志物[13]。GGT的过表达还与卵巢癌、宫颈癌有关[14]。Zhang 等[15]合成了双光子的近红外荧光探针(two-photon fluorescent “turn-on” GGT sensor,DCM-GA)(图3)用于检测发生药物性肝损伤时GGT的活性,该探针由DCM衍生物为荧光基团,r-谷氨酰胺为识别基团,在GGT存在时r-谷氨酰胺裂解,恢复DCM的荧光发射。双光子的荧光探针具有更长的红光发射,更深的组织穿透,低检测限(小于0.057 U/L),更适合生物体内GGT的检测[15]。
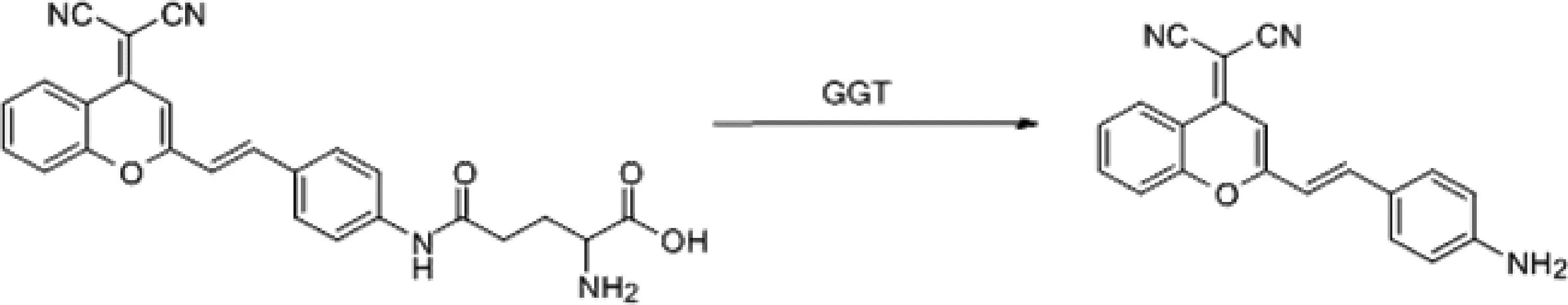
图3 DCM-GA探针的结构和DCM-GA对GGT的检测机理Fig. 3 The structure of DCM-GA probe and the detection mechanism of GGT by DCM-GA
1.2 用于抗肿瘤药的释放
肿瘤在所有疾病中位居首位,因其不可逆转,而损害机体的器官组织[16]。临床上肿瘤的治疗主要以射线,药物,手术为主[17]。药物治疗作为常用的方式之一,因其对细胞,组织,器官具有毒副作用,因此寻找高效的方法是研究者不断探索的方向[18]。而前药可以实时的监测药物的释放,减少副作用,提高药物的疗效而备受研究者关注[19]。
Cao等[20]开发了可激活的糖化纳米囊荧光探针(Lac-SS-DCM)(图4)用于监测抗肿瘤药盐酸阿霉素(doxorubicin hydrochloride,DOX)的释放和靶向肿瘤的能力,Lac-SS-DCM由两亲性的物质构成,一部分是具有疏水基团的近红外荧光染料(DCM),另一部分是有亲水基团的乳糖衍生物,两者通过二硫键相连,此时Lac-SS-DCM表现为荧光淬灭。在肿瘤发生时肿瘤表面的糖蛋白异常表达。在GSH存在时,二硫键断裂,释放出DCM-NH2,近红外荧光开,而纳米囊上的乳糖与肿瘤表面的糖蛋白结合,实现肿瘤的靶向能力,结果证实了在肝癌细胞中,GSH存在时,Lac-SS-DCM荧光显著增强[20]。而装载抗肿瘤药DOX-Lac-SS-DCM显现出高的药物利用度和抗肿瘤效果。随后Liu等[21]开发了近红外前药(DCM-S-PPT)(图5)用于抗癌药鬼臼毒素(podophyllotoxin,PPT)的靶向释放,DCM-S-PPT由DCM衍生物通过二硫键与PPT连接而成,在谷胱甘肽存在时激活DCM-S-PPT,释放抗癌药物PPT。将两亲性共聚物(Mpegdspe)作为纳米载体包覆在DCM-S-PPT上增强了PPT的滞留效应,对肿瘤有较好的靶向性[21]。另外Wu等[22]设计了近红外前药双氰基甲基-4H-吡喃装载聚乙二醇(PEG-PLA纳米粒子)(图6)治疗癌症,该前药由DCM及CPT以二硫键相连。在肿瘤细胞高表达GSH,使得二硫键断裂,释放出抗肿瘤药(CPT)和发出强烈的近红外荧光。而用PEG-PLA包载提高药物的渗透性及降低CPT在血中的清除速度,使CPT大量积聚在肿瘤细胞中。实验将结果表明在加入GSH后,产生比色和光谱的显著变化,颜色从黄色变为粉色,在665 nm发出近红外荧光,且灵敏度高,特异性强,在PH=6~9, 20 min,即可完成荧光响应[22]。体外实验显示低毒性,高荧光特性;体内荷瘤小鼠成像有强荧光,移植瘤实验表明肿瘤重量,体积减小,组织切片显示肿瘤细胞发生凋亡[22]。
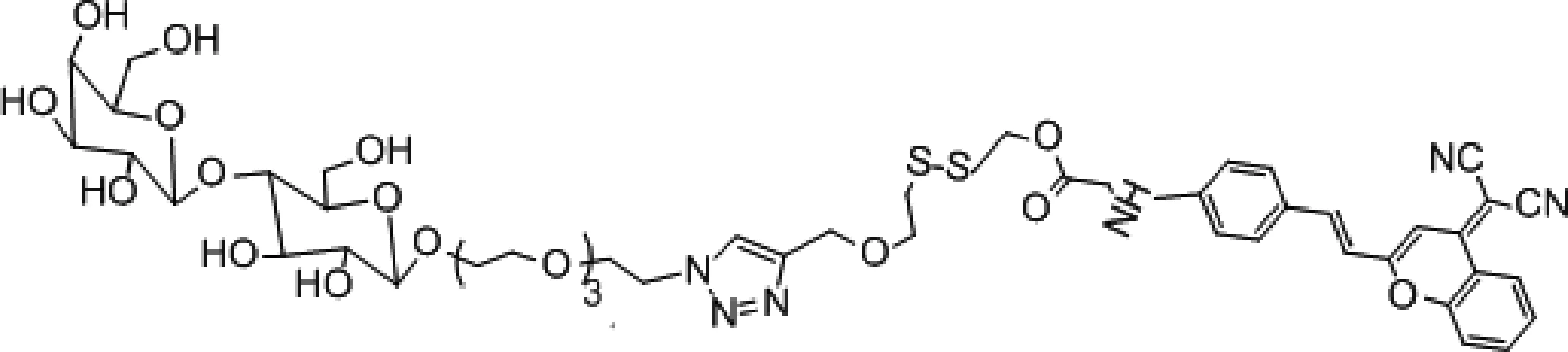
图4 糖化纳米囊荧光探针Lac-SS-DCM的结构Fig. 4 The structure of thesaccharified nanocapsule fluorescent probe Lac-SS-DCM
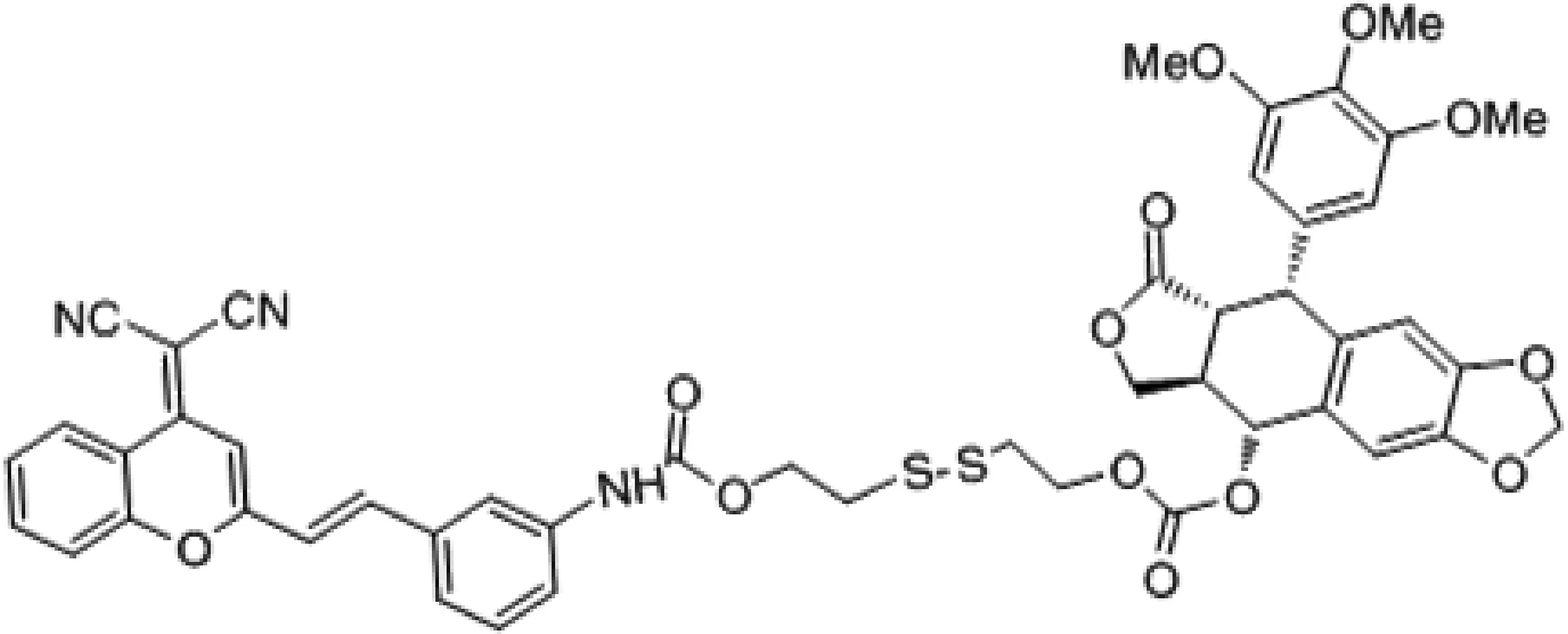
图5 近红外前药DCM-S-PPT的结构Fig. 5 The structure of the near-infrared prodrug DCM-S-PPT
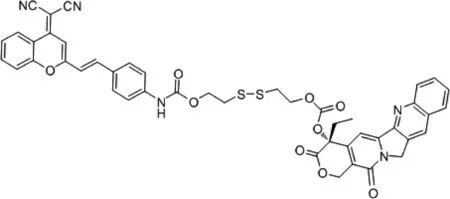
图6 装载聚乙二醇PEG-PLA纳米粒子的前药结构Fig. 6 Prodrug structure of PEG-PLA nanoparticles loaded with polyethylene glycol
2 结语
本文对近年来DCM的近红外荧光探针在生物医学的研究进展进行了综述。DCM染料由于具有红光发射,大Stokes位移受广大研究者的追捧。另外DCM近红外荧光探针有强的渗透能力,能无创的对细胞组织进行检测且自发荧光干扰小广泛用于生物医学领域。尽管DCM近红外荧光探针在合成和设计上具有诸多优点,但仍存在一些问题有待优化。基于DCM类染料的诸多优点开发越来越多的近红外荧光探针用于活性物质的检测将是未来的重要研究方向。DCM染料在生物医学领域的不断扩大,将会出现更多新的设计策略,更多的探针不断涌现,为生物医学做出更大的贡献。

