铁氧体磁性复合材料去除阴离子污染物的研究进展
梁旭鹏
(齐齐哈尔大学 化学与化工学院,黑龙江 齐齐哈尔 161006)
铁的氧化物和一种或几种其它金属氧化物组成的复合氧化物称为铁氧体,铁氧体按晶体结构可分为尖晶石型、磁铅石型、石榴石型、钙钛矿型。不同的元素组成和晶体结构使得它们的磁性和热稳定性等物理化学性质有所差异,其中尖晶石型铁氧体,因其具有高比表面积、形貌可调以及在外磁场下易分离的显著优势,在水处理领域引起了广泛的关注。吸附法是目前去除阴离子污染物最经济的方法[1],铁氧体的超顺磁性可以实现吸附剂的快速分散与回收,有效避免二次污染,且节约了成本,但用通常方法制备的铁氧体粒径较小,表面能大,容易发生团聚,限制了其吸附能力,可以通过构建复合结构有效抑制团聚,同时也增加了新的吸咐位点。
1 铁氧体磁性纳米材料的制备及其官能团修饰
常见的用于铁氧体磁性纳米材料的制备方法有:共沉淀法、微乳液法、水热法、溶剂热法。
共沉淀法是将沉淀剂加入到含两种或多种阳离子的溶液中,发生沉淀反应,后进行干燥或锻烧, 从而得到所需纳米粒子。共沉淀法优点是操作简单,产物粒径小,缺点是受反应条件限制容易团聚,且难于控制多种金属离子(超过两种)沉淀反应过程,使得产物均匀性较差。
微乳液法通过将反应空间限制到微小的液滴内解决了上述团聚问题,是制备单分散磁性材料的常用方法,产物形貌可控、粒径可调且分散性好,同时因前驱体组成原子排列较为规整,所以所需焙烧温度相对沉淀法通常更低,但由于用到表面活性剂、有机溶剂等材料,导致成本升高,反应复杂。
水热法是以水为溶剂,利用反应釜高温高压的条件,将通常难溶或不溶的物质溶解和重结晶的制备方法。优点是产物形貌可控、不易团聚且磁性较强,可以得到理想的化学计量组成,缺点是需要耐高温和高压的设备,且生产周期较长,不利于大规模生产。溶剂热法在水热法的基础上将溶剂变为有机物质,优点是借此改变形貌、引入官能团以及可提高反应温度增强磁性[2],缺点是由于使用有机溶剂增加了成本、可能带来环境污染。
官能团修饰是指以小分子有机物作为材料,将特定的官能团通过化学方式接枝到基体表面以提高其性能[3],例如,含氮、含氧和含硫基团嫁接后的吸附剂对重金属离子表现出更强的亲和性与选择性[4]。Liu等[5]以乙醇作为溶剂,尿素作为均相沉淀剂和软模板剂,采用溶剂热法合成了羧基和氨基功能化的磁性空心多孔椭圆NiFe2O4微球,作为固相萃取材料用于测定痕量重金属前的预富集。Aoopngan等[6]以乙醇胺为表面改性剂,采用共沉淀法合成了胺基化的MgFe2O4NPs,对刚果红最大吸附量可达71.4 mg/g,优于普通羟基化的MgFe2O4NPs(67.6 mg/g)。再生循环实验表明,乙醇基洗脱剂对吸附剂的再生效果优于水基洗脱剂。
2 铁氧体磁性复合材料的制备方法
构建复合结构可以改变孔隙结构和比表面积,促进内扩散以及增加表面吸附位点;也能引入特定的官能团,提高对阴离子污染物的吸附能力与选择性。铁氧体磁性复合材料按组分类别可分为三种,第一种是由铁氧体与无机物复合形成。常用的无机材料有活性炭、沸石、粘土矿物、碳纳米管和石墨烯等;第二种是由铁氧体与聚合物或生物质材料等有机物复合形成。果壳、橘皮等生物质和相应的生物炭以及聚乙烯亚胺(PEI)、聚吡咯(PPy)、壳聚糖等有机聚合物含有丰富的官能团,铁氧体与这些有机物复合通常比直接在表面接枝的官能团数量要多,同时也解决了大多数有机物分离难的问题。第三种是对铁氧体进行有机-无机复合改性,结合前两种复合途径的优势,进一步提高吸附性能。
制备铁氧体磁性复合材料,需根据结合物质的种类,进行相应的操作。与无机物或生物质复合的方法主要有沉淀法,水热法,超声混合法;与聚合物复合的方法主要有吸附法、原位聚合法、交联法。吸附法是通过静电能或氢键使聚合物吸附到铁氧体表面上,作用力相对较弱;原位聚合法是将铁氧体分散在单体溶液中,然后进行聚合反应,实现表面涂覆或接枝;交联法是通过交联反应,将铁氧体纳米粒子包裹或镶嵌以提高复合材料的耐酸碱性和机械强度。
3 铁氧体磁性复合材料去除阴离子污染物
3.1 重金属阴离子污染物
铬的存在形式多样,其中Cr(VI)具有高迁移性、毒性、致癌性和诱变性,而Cr(III)毒性较小,很容易生成氢氧化物沉淀。Li等[7]分别采用水热法和溶剂热法合成了EDTA插层的镁铝水滑石(LDH-EDTA)及其磁改性物(Mag-LDH-EDTA),磁性复合物中Fe3O4附着在水滑石表面,并由乙二胺引入了氨基官能团,两种材料对Cr(VI)的最大吸附量分别为47.62 mg/g 和32.46 mg/g。Deng等[8]通过水热法合成NiFe2O4纳米粒子,再用沉淀法制得NiFe2O4/ZnAl-EDTA LDH吸附剂,当pH=6.0时对Cr(VI)的最大吸附量为77.22 mg/g。上述研究表明,层间的EDTA可以与Cr(VI)发生离子交换,该过程受pH影响较小,同时EDTA也可参与还原Cr(VI)的反应,进一步提高吸附性能,同时比较发现磁改性对材料的吸附量并没有产生较大的影响。Lyua等[9]采用化学聚合法制备了一种具有三维分层珊瑚状纳米结构的聚苯胺基吸附剂(CL-PANI),在此基础上用沉淀法和原位聚合法分别制备CL-PANI@Fe3O4和Fe3O4@CL-PANI两种组合模式的磁性复合材料,用于吸附铬。研究表明,复合材料中的Fe3O4能与Cr(III)发生表面络合加以固定,并且改变了原先CL-PANI对Cr(VI)的吸附过程,使还原反应在静电吸附过程之前发生。通过两种磁性粒子比较,发现Fe3O4@CL-PANI的吸附平衡时间更短,吸附性能更好,且铁不容易受到腐蚀,在pH=2时最大吸附量达到416.6 mg/g。Sun等[10]利用吸附法合成了核壳结构的Fe3O4@PEI,并通过水热法将MoS2负载到MP微球表面,制备了新型三维花状MP@MoS2,当pH=3.0时对Cr(VI)的最大吸附量为192.30 mg/g。其优异的吸附性能得益于大比表面积的特殊形貌和大量的含硫、含氮官能团,主要吸附机理为外层络合吸附、静电吸附以及氧化还原反应。该材料在酸性条件下具有良好的稳定性,并且经NaOH或EDTA·2Na洗涤后可循环使用。Wang等[11]制备由聚间苯二胺、氧化还原石墨烯和镍铁氧体构成的三元复合材料(PmPD/rGO/NFO),用于去除废水中的Cr(VI)。结果表明该吸附剂对Cr(VI)的吸附性能受酸碱度影响较大,当pH=3时吸附量最高,达到502.5 mg/g。NFO有助于抑制石墨烯薄层的堆叠和折皱的产生,rGO提供大的比表面积以及含氧官能团,而PMPD通过静电吸引以及氧化还原能力起到主要的吸附作用,同时材料的形貌效应也强化了材料的吸附性能。
水源砷污染是世界范围内的难题,有许多国家饮用水中的砷含量超标。砷按价态分为As(V)和As(III),As(III)具有更强的毒性和迁移性,从饮用水中摄取砷会导致高血压、糖尿病、皮肤癌以及膀胱癌。Huong等[12]利用改进共沉淀法合成了MnFe2O4包覆氧化石墨烯(GO)薄片的磁性纳米复合材料,用于去除水中As(V)。电镜表征得出,氧化石墨烯薄片减少了MnFe2O4NPs的团聚,并使复合材料在水中更好地分散。研究表明,当pH=1~2时该吸附剂对As(V) 的最大吸附量为240.385 mg/g,优于各单一组分的吸附性能,并且能够快速吸附以及循环使用,具有成为低成本、高效吸附剂的潜力。Ma等[13]通过共沉淀法,在静电吸引和氢键的作用力下将Fe3O4微球与MgAl-LDH结合,后经焙烧制得Fe3O4@Mg-Al-O微米级吸附剂,对As(V)的最大吸附量达到170.02 mg/g,且在pH=4.0~9.0的条件下都有较高的吸附性能。实验研究发现,适当比例的Fe3O4可以增大比表面积从而提高吸附量,CO32-对吸附性能的影响较大,原因可能是Fe3O4@Mg-Al-O对多价阴离子的亲和力更强,该吸附剂去除As(V)的机理为表面羟基(M-OH)与As(V)发生配体交换。
3.2 非金属阴离子污染物
磷是水生环境中促进生物生长的微量营养物质之一,然而过量的磷排入水中会导致水体富营养化,使水体生态环境遭到破坏。Inkoua等[14]制备了柚皮(GP)和Fe3O4/GP介孔生物质材料应用于磷酸盐的去除。用溶剂热法复合不仅使Fe3O4粒子均匀地分布在GP表面,而且其高温的合成环境扩大了孔径,使复合材料的孔隙结构更有利于吸附位点与污染物的接触。在25 mL初始浓度为50 mg/L的溶液中,0.05 g Fe3O4/GP对磷酸盐的去除率达到99.02%,且不受酸碱度的影响。Ding等[15]通过模板沉淀法将介孔CeO2负载到Fe3O4@SiO2纳米粒子的表面,制备了一种具有双层核壳结构的新型磁性吸附剂Fe3O4@SiO2@mCeO2,用于去除水中的磷酸盐。当pH=6时对磷酸盐的最大吸附量为64.07 mg/g,Cl-和SO42-有利于P的吸附,而HCO3-不利于P的吸附。机理研究表明,吸附剂表面羟基取代磷酸根形成内层络合物在吸附过程中起关键作用。再生循环实验表明,以NaOH作为洗脱剂,浓度越高,解析率越大,当浓度为1 mol/L时解析率达到96.58%。
Jung等[16]通过Fe3+和Mg2+沉淀在生物炭前驱体表面,然后进行热解合成了新型MgFe2O4/生物炭磁性复合材料(MFB-MCs)吸附磷酸盐,当吸附温度为20 ℃、pH=3时最大吸附量达到487.99 mg/g,比单一的生物炭和MgFe2O4具有更高的吸磷能力。循环吸附-解析实验中,通过比选得到0.5 M的NaOH溶液作为洗脱剂,在5次再生循环实验后仍有较高的吸附量。
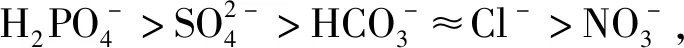
3.3 阴离子染料污染物
刚果红(CR)是一种联苯胺类直接偶氮的阴离子染料,可导致水体透明度下降,影响水生生物的光合作用,造成食物链破坏;严重刺激眼睛、皮肤、消化道、生殖器和呼吸道,且在人体中代谢成的联苯胺是一种致癌物质。Jia等[19]通过尿素水解水热法制备MgAl-LDH/CoFe2O4纳米纤维,用于去除水中CR。研究表明,焙烧前和焙烧后的复合材料对CR的最大吸附量分别为213.2 mg/g和49.8 mg/g,而仅CoFe2O4纳米纤维没有吸附能力。飞等[20]开发了一种用Fe3O4改性高岭土的简易固相合成方法,以高岭土、尿素以及硝酸铁为原料在高压釜直接反应制得,形成二维混合纳米结构。添加的Fe3O4通过断开连接SiO4四面体和AlO6八面体之间的键有效活化高岭土,并且增大比表面积,极大提高了吸附剂对CR的吸附性能,最大吸附量可达138.5 mg/g。Ma等[21]通过沉淀法将木质素包覆在氧化铁表面,高温煅烧炭化的同时将Fe2O3转化为Fe3O4,生成磁性木质素基生物炭纳米粒子,在酸性及接近中性的条件下(pH=5.0~7.0)都具有良好的吸附能力,当吸附温度为20 ℃, pH=5时达到最大吸附量为113.0 mg/g,吸附机理为CR与吸附剂表面存在静电引力以及π-π堆积作用。Etemadinia等[22]通过溶胶凝胶法包裹SiO2,为铁氧体提供大量羟基官能团便于黄芪胶(TG)涂覆,所合成的ZnFe2O4、ZnFe2O4/SiO2和ZnFe2O4/SiO2/TG对CR的最大吸附量分别为49.37 mg/g、75.227 mg/g和159.90 mg/g。为避免铁氧体中重金属元素对环境造成污染,Beyki等[23]通过沉淀法得到无毒的CaFe2O4,并用其制备磁性镁铝混合氧化物,再包裹聚邻苯二酚形成三元复合纳米材料吸附CR,在pH=2时最大吸附量达到500 mg/g。吸附机理包括π-π堆积作用、聚合物与染料的疏水作用、氢键、水滑石的阴离子交换;从形貌角度来说,聚合物粘连形成的沟槽也有助于吸附。
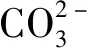
3.4 酚类有机阴离子污染物
酚类化合物是一种疏水和可离子化的有机弱酸性化合物,对其吸附能力大多依赖于解离程度。酚类化合物具有毒性,可与蛋白质反应,造成慢性或急性中毒。刘瑜等[27]采用溶剂热法成功合成了具有绒球状结构的Fe3O4/CS磁性纳米材料,具有超顺磁性和良好的分散性,对五氯酚钠的去除率达到91.5%。熊振湖等[28]通过沉淀法将Fe2+和Fe3+沉积在羧化的碳纳米管内部和表面制备功能化吸附剂,用于去除三种硝基苯酚异构体,结果表明当pH=5~6时去除率均高于80%。由于Fe3O4耐热性差,梁艳莉等[29]采用热稳定性更好的CoFe2O4作为基体,包覆PDA后用高温原位还原负载Pt,对硝基苯酚具有良好的吸附与降解性能。
4 总结与展望
铁氧体磁性纳米粒子元素组成丰富且形貌可调,同时还可以与无机物或聚合物结合形成多种类型的复合材料。其制备方法和各组分的组合模式决定了吸附剂的形貌结构,进而影响到比表面积、孔隙结构、磁性能以及吸附性能。为了获得稳定、环保、高效的铁氧体磁性复合材料,对未来研究提出展望:
(1) 通过实现各组分在形貌或内部微观结构的协同作用,来提高铁氧体磁性复合材料的吸附性能和磁分离效率。
(2) 关注复合材料的稳定性和磁回收率。在吸附过程中由于组分溶解和脱落致使材料结构不完整,以及磁回收固液分离不彻底,都可能会造成二次污染。
(3) 从实际应用的角度来看,吸附剂的可重复使用性是实现工业化的前提,目前对解析液种类及浓度的选取研究较少。
(4) 在研究单一组分吸附机理的基础上,考虑多组分污染物的协同吸附,从而找到合适的应用路径。

