鸭源禽副黏病毒4 型对鸡的致病性分析
刘建华,孙佳琪,郑学功,阿里木江·喀迪尔,加尔肯,祖力亚江·阿不都热合曼,胡 月,古丽孜巴·艾尔肯,冉多良
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.新疆沙雅县草原工作站,新疆 沙雅 832200)
禽副黏病毒(Avian paramyxoviruses,APMV)属于副黏病毒科(Paramyxoviridae)、禽腮腺炎病毒属(Avulavirus),可感染禽类。根据红细胞凝集抑制及神经酰胺酶抑制试验(HI-NI),APMV 至少可以分为20 个血清型(APMV-1~APMV-20)[1],其中APMV-1也称为新城疫病毒(Newcastle disease virus,NDV),在所有APMV 中的危害最为严重。而其他血清型APMVs 对家禽的致病性低,很少被人研究,因而严重制约了禽副黏病毒病的防控。自1978 年从香港地区野鸭体内分离出APMV-4 至今,该病毒频繁自野生水禽中被发现[2-5],但国内外也有研究者从家禽体内分离到该病毒,提供了APMV-4 可在野禽与家禽种间传播的有力证据[6-8]。蛋鸡自然感染APMV-4后除了出现白壳蛋产量增加的症状,其余临床症状并不明显。但有研究者通过比对APMV-4 F蛋白的裂解位点序列发现,APMV-4 F1亚基的N端与NDV强毒株及APMV-2一样,为苯丙氨酸(F)残基,而APMV-2与NDV是APMVs导致鸡发病的主要血清型。所以AP⁃MV-4也可能具有这两种病毒的强致病性。
目前对野鸭源APMV-4 的报道大多为病毒的分离鉴定及遗传进化学分析,对于其在鸡体内的致病机理及对鸡的潜在致病性尚不清楚。为了解野鸭源APMV-4 新疆分离株对鸡的致病性,本研究对雏鸡分别采用气囊感染及模拟自然感染两种方式,分析APMV-4 对鸡的致病性及其同居感染的能力,为禽副黏病毒病的防控提供参考依据。
1 材料与方法
1.1 主要实验材料 APMV-4 新疆分离株由新疆农业大学动物医学学院传染病研究室从新疆福海县野鸭体内分离鉴定并保存;SPF 鸡胚购自济南赛斯家禽科技有限公司,由本研究室自行孵化;TRlzol 试剂、反转录试剂盒、探针法荧光定量PCR 试剂盒剂购自TaKaRa 公司。
1.2 病毒的浓缩与纯化 将20 mL 含APMV-4 的尿囊液分别经3 000 r/min、6 000 r/min、12 000 r/min 4 ℃差速离心后,取上清,再经38 000 r/min 4 ℃离心2.5 h,弃上清,用1 mL PBS 重悬沉淀。通过HA试验测定浓缩纯化后病毒液的血凝效价,再用PBS将其血凝效价稀释到28。
1.3 实验设计 将200 μL 血凝效价为28的病毒液经尾胸气囊途径接种一周龄SPF 鸡12 只;24 h 后另取12 只SPF 鸡同居饲养,作为自然感染组,以模拟病毒的自然感染;另将200 μL PBS 经尾胸气囊途径接种一周龄SPF 鸡12 只,设为阴性对照组。
1.4 各组鸡的临床症状观察 接种病毒后每天观察雏鸡的饮食、精神、粪便等临床表现,参照Rahman 等人对NDV 感染鸡的临床症状评分标准将临床症状分为0~3 分:正常0 分,出现打喷嚏或稀便1 分,呼吸困难2 分,死亡3 分,并在实验结束后统计各组鸡临床症状得分[9]。
1.5 各组鸡排毒及血清抗体的检测 感染后0、2 d、5 d、9 d、14 d 采集各组雏鸡的咽拭子、泄殖腔试子及血清;拭子利用本研究室建立的APMV-4 探针荧光定量PCR 方法[10]检测雏鸡的排毒情况及同居感染能力;利用HI 试验测定各组鸡血清中APMV-4 特异性HI 抗体的阳转情况。每个样品3 个重复。
1.6 各组鸡各组织病毒载量的检测及其病变观察感染后5 d、9 d、14 d 每组分别迫杀4 只雏鸡,采集气管、肺脏、脾脏、小肠及脑组织,经液氮研磨后提取组织匀浆中的总RNA,利用随机引物反转录为cDNA 后作为模板,利用本研究室建立的APMV-4探针荧光定量PCR 方法[10]检测雏鸡不同组织中的病毒载量,每个样品3 个重复;另一部分各组织样品置于10%福尔马林溶液中固定,经脱水、透明、透蜡后制成组织切片,HE 染色后观察各组织的病变。
1.7 数据处理与分析 利用GraphPad Prism 8 统计软件绘图,并采用单因素ANOVA 检验,进行各组的统计学差异分析,P<0.05 表示差异显著,P<0.01表示差异极显著,P>0.05 表示差异不显著。
2 结 果
2.1 各组鸡临床症状观察及评分 一周龄SPF 鸡分别经尾胸气囊途径和模拟同居两种方式感染APMV-4 后,观察各组鸡的临床症状并统计临床评分。结果显示,无论何种方式感染,鸡的临床症状均于感染后第5 d~9 d 最为明显,而后逐渐恢复。其中气囊感染组鸡在感染后第3 d 开始出现临床症状,主要表现为喷嚏、腹泻,但精神状态尚可;感染后第5 d,有部分鸡气管出现哕音,且精神沉郁;感染后第7 d,气囊感染组中一只鸡出现下肢麻痹、食欲废绝等症状,并于第2 d 死亡。自然感染组鸡在感染后第4 d 开始出现临床表现,以喷嚏、腹泻为主。通过临床症状评分得出,气囊感染组评分略高于自然感染组(表1)。在整个实验过程中PBS 对照组的精神、采食、排便情况等均无异常。结果表明,野鸭源APMV-4 可引起鸡的临床症状,其中气囊感染方式引起的临床症状较自然感染方式严重。

表1 鸡以不同方式感染APMV-4后的临床症状评分结果Table 1 Results of clinical symptom scores of chicks infected with APMV-4 in different ways
2.2 各组鸡排毒量的检测结果 以不同方式感染APMV-4 后不同时间,分别采集各组雏鸡的咽拭子、泄殖腔试子,利用荧光定量PCR 检测各组鸡经咽或泄殖腔的排毒情况。结果显示,两组鸡自感染后第2 d 开始排毒,且咽的排毒量显著高于泄殖腔的排毒量(P<0.05),其中气囊感染组鸡的排毒量显著高于自然感染组(P<0.05);感染后第5 d,气囊感染组及自然感染组鸡的排毒量均显著升高而后减少。PBS对照组鸡的咽拭子和泄殖腔拭子均未检测到病毒(图1)。结果表明,鸡感染野鸭源APMV-4 后可经咽和泄殖腔两种途径排毒,排毒量在感染后第5 d达到峰值,且气囊感染方式的排毒量高于自然感染方式。示,气囊感染组与自然感染组鸡各组织中的病毒载量差异均不显著(P>0.05)(图3)。PBS 对照组鸡的各组织中均未检测到病毒(图略)。结果表明,野鸭源APMV-4 主要分布于鸡的气管和肺脏,且不同感染方式对病毒在各组织中的增殖影响不大。

图1 APMV-4以不同方式感染鸡后的排毒量检测Fig.1 Virus shedding of chickens infected with APMV-4 via different ways
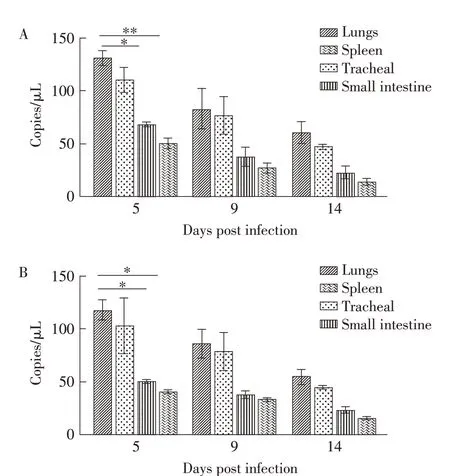
图3 鸡以气囊接种(A)及模拟自然感染方式(B)感染APMV-4后各组织的病毒载量检测结果Fig.3 Detection results of viral load in tissues of chickens infected with APMV-4 by air sac infection(A)and simulated natural infection(B)
2.3 各组鸡血清HI 抗体效价的检测结果 各组雏鸡以不同方式感染APMV-4 后的不同时间采血,通过HI 试验测定其中HI 抗体水平的变化情况。结果显示,感染后第9 d,气囊接种组雏鸡检测到抗体效价≥4log2;自然感染组鸡在感染后第12 d 检测到抗体效价≥4log2;无论何种感染方式,鸡的平均HI抗体效价均在感染后第14 d 达到峰值,分别为6.75log2(气囊感染组)及3.75log2(自然感染组),前者HI 抗体水平均显著高于后者(P<0.05)。对照组鸡均未检测到HI 抗体(图2)。结果表明,鸡无论以何种方式感染野鸭源APMV-4 均可产生特异性HI 抗体,与自然感染相比,气囊方式感染的鸡产生的抗体水平较高。

图2 鸡以不同方式感染APMV-4后HI抗体水平的变化Fig.2 Changes of HI antibody levels in chickens infected withAPMV-4 via different ways
2.4 各组鸡各组织脏器病毒载量的检测结果 鸡以不同方式感染APMV-4 后的不同时间迫杀各组鸡并取其各脏器组织,利用荧光定量PCR 检测各组织中的病毒载量。结果显示,两种方式感染雏鸡后的气管及肺脏中的病毒载量均高于其在其他组织中的病毒载量。且两组鸡的小肠、脾组织中也可检测到少量病毒载量,脑组织中未检测到病毒。各组织中的病毒载量均于感染后第5 d 达到峰值,而后逐渐减少。对各组鸡组织的病毒载量统计学分析结果显
2.5 各组鸡的组织病理学观察 取感染后第5 d、9 d、14 d 各组鸡的气管、肺、脾脏、小肠与脑组织,制备病理切片,经HE 染色后在显微镜下观察其组织病理学变化。结果显示,两种方式感染鸭源APMV-4 的雏鸡气管黏膜均出现炎性细胞浸润、水肿、增厚甚至脱落;肺泡间隔增厚,肺泡腔内附着大量纤维素及炎性细胞;上述病理变化于感染后第5 d 最严重而后逐渐恢复。对照组鸡的气管和肺脏均未见明显病变(图4);各感染组鸡的小肠、脾脏、大脑均未见有明显病理变化(图略)。结果表明,野鸭源APMV-4 主要侵害鸡的气管与肺脏,各组鸡各组织的病理变化与相应组织病毒载量的检测结果基本一致。
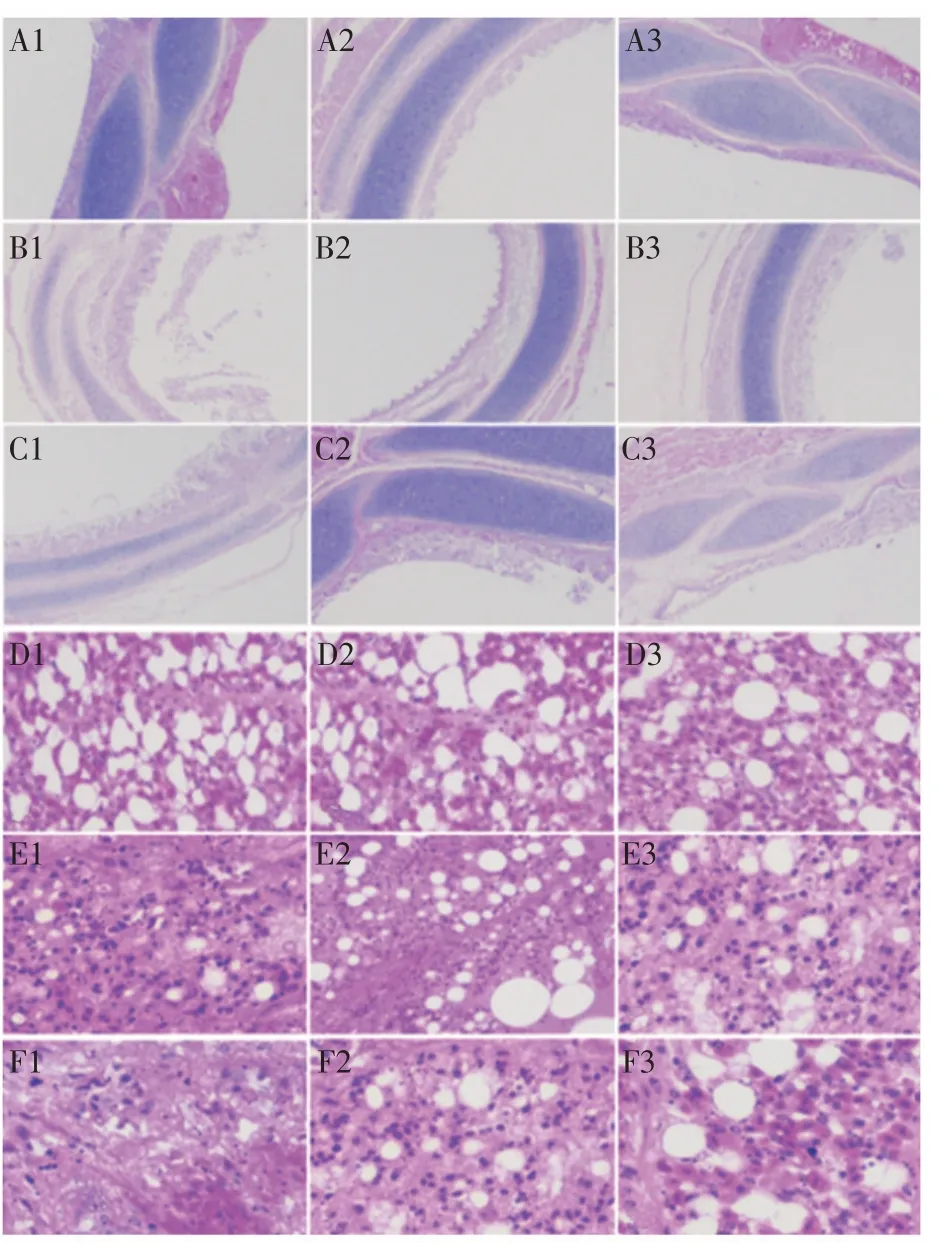
图4 鸡以不同方式感染APMV-4后的病理组织学观察Fig.4 Histopathological observation of chickens infected with APMV-4 via different ways
3 讨 论
APMV-4 主要感染雁形目野生鸟类,自然感染的家禽,除蛋鸡会出现白壳蛋产量增加的症状外,不表现出明显的临床症状[11-13]。本研究中的APMV-4新疆分离株是2017 年张慧敏等人从新疆福海县野鸭体内分离得到,经过毒力测定发现,该分离株的鸡胚平均致死时间(MDT)大于120 h,脑内致病指数(ICPI)为0;经遗传进化学分析得知,该分离株F 蛋白裂解位点的序列为DIPQRF,与无毒力NDV 的裂解位点相似[14]。本研究结果发现,气囊感染和自然感染APMV-4 新疆分离株后均会引起一周龄SPF 鸡呼吸道及肠道的病理变化,且雏鸡腹泻的临床表现贯穿于整个感染过程;组织病理学观察显示雏鸡肺脏的病理变化最为明显,脑组织未见有明显的病理变化,脾脏和小肠仅见有少量的炎性细胞浸润,这与Warke 等人的研究结果一致[15]。不同的是,本研究中无论何种感染方式,APMV-4 新疆分离株在鸡肺脏中的病毒载量始终高于在其他组织中的病毒载量;自然感染组鸡产生HI 抗体的时间较气囊感染组的晚且抗体效价低,且该组鸡的平均HI 抗体效价在感染后第14 d 达到峰值,约为4log2,与Nayak 等的研究结果一致[16]。
当外源微生物侵入机体后,机体的防御是由各个系统协调、合作共同完成的[17-19]。本实验结果显示,鸭源APMV-4 以不同方式感染鸡后第5 d、9 d、14 d 排毒量无明显差异,但在感染后第2 d 这两组鸡的排毒量差异显著,气囊感染组鸡的排毒量更高。这可能是由于自然感染组的雏鸡是在气囊感染组鸡接种24 h后放入造成的差异。程二财等人将NDV GXGF12001 株接种鹌鹑,结果发现感染后第8 d 该病毒在脾脏中的载量显著低于感染后第5 d和第11 d,但抗体水平随时间增加呈升高趋势,Toll 样受体3(TLR3)、TLR7、IFN-α 和禽防御素9(AvBD-9)同样呈上升趋势,IL-6 呈先下降后升高的趋势[20]。本实验中,鸭源APMV-4 无论以何种方式感染鸡,病毒在鸡体内各组织中的复制水平均无明显差异,但抗体效价却差异显著,其中气囊感染组雏鸡的HI 抗体效价更高,推测可能与各组雏鸡各组的细胞因子表达水平有关。雏鸡经不同途径感染鸭源APMV-4 后的临床症状、抗体效价、排毒量、各组织病毒载量与细胞因子表达水平的联系也是本研究室后续的研究方向。
本研究将野鸭源APMV-4 新疆分离株以不同方式感染一周龄SPF 鸡后,对其出现的临床症状评分并判定不同感染方式所致鸡临床症状的差异。同时通过对各组鸡排毒量、排毒规律、组织的病毒载量、抗体效价检测及鸡组织病理学观察等,较全面评估了该株病毒对鸡的致病性,为全面探究APMV-4 对鸡的致病机制及分析APMV-4 是否可以作为新的病毒载体提供实验数据参考。

