苋菜AtrADH2基因克隆及表达分析
肖 昉 王 乐 郑友峰 赖钟雄 刘生财* 牟建梅
(1.福建农林大学 园艺植物生物工程研究所,福州 350002;2.苏州市农业科学院,江苏 苏州 215000)
苋菜(AmaranthustricolorL.)为双子叶植物门石竹目苋科苋属的1年生草本植物,是一种短日照植物,临界光周期值为15 h[1]。在高温短日照条件下可提前形成花原基进而开花[2]。作为一种优质蔬菜,苋菜中含有人体必需的营养物质,如钙、膳食纤维、必需氨基酸[3]、蛋白质、维生素、矿物质和酚类等[4],具有药用价值和丰富的营养价值,以嫩茎叶为可食用部分,是一种无公害绿色食品。苋菜苗中除根外,其余部位含有丰富的甜菜色素,是获得甜菜色素的重要来源之一。‘苏苋1号’叶片玫红色,茎杆浅红色,叶片中具有丰富的甜菜色素,‘苏苋2号’叶片浅绿偏黄,2个品种均具有生长周期短的特点[5-6]。
甜菜色素是一种含氮水溶性色素,其生物合成开始于酪氨酸的大量积累[7]。酪氨酸途径是由莽草酸途径的最终产物预苯甲酸盐(Prephenate)合成[8],在自然界中存在2条不同的途径[9-10],在绝大部分植物中,预苯酸经转氨作用产生的预苯胺酸被认为是酪氨酸合成的前体物质[9],预苯胺酸在预苯胺酸脱氢酶(Arogenate dehydrogenase,ADH/TyrAa)的脱氢和脱羧作用下直接生成酪氨酸[11],ADH对酪氨酸的合成具有强烈的反馈抑制作用[12]。Lopez-Nieves等[13]发现在甜菜中BvCYP76ADα、BvDODAα、BvMYB1和BvADHα基因的存在与甜菜色素在甜菜中的分布密切相关,表明BvCYP76ADα、BvDODAα、BvMYB1和BvADHα基因对甜菜中甜菜色素合成具有上调作用;由ADH介导的Tyr(L-tyrosine)途径对于植物的正常生长和发育必不可少,Oliveira等[12]通过敲除拟南芥AtADH2/TyrA2导致其叶片生长缓慢,抑制AtADH1/TyrA1基因的瞬时表达导致拟南芥花药受损而降低了种子产量。
光周期影响植物体内一些次生代谢产物的产生[14-15],次生代谢产物主要包括萜烯类、酚类和含氮化合物3大类。有研究表明,光周期有利于萜烯类物质的积累如24 h白光处理有利于未成熟越橘浆果中类胡萝卜素生物合成相关基因的表达[16];也有利于酚类物质的积累如较长光周期处理有利于海棠叶片和愈伤组织中花青素含量的积累及生物合成关键基因的表达[17],但光周期调控甜菜色素生物合成的机制尚不明确。
本研究以‘苏苋1号’‘苏苋2号’苋菜品种为试验材料,分析不同光周期条件和组织部位对苋菜甜菜色素含量的影响,同时,基于苋菜Blue-Dark转录组数据库(登录号SRA:SRR11196359-SSR11196364),通过RT-PCR技术克隆获得苋菜AtrADH2基因的cDNA序列,并对其蛋白序列进行生物信息学分析,最后采用qRT-PCR技术检测AtrADH2基因及甜菜色素代谢合成相关基因表达情况,旨在为进一步研究AtrADH2基因在甜菜色素代谢过程中的功能提供参考依据。
1 材料与方法
1.1 材料
供试材料‘苏苋1号’‘苏苋2号’苋菜种子,由苏州市农业科学院提供。
1.2 方法
1.2.1光周期处理
将30粒苋菜种子播种于培养基质中,培养基质为丹麦品式泥炭土,pH 5.5,分别在8 h/16 h、12 h/12 h、16 h/8 h和20 h/4 h(Light/Dark)光周期条件下进行生长,温度为(25±1) ℃,光照强度为125 μmol/(m·s),培养15 d(幼苗期)后取苋菜不同组织部位(叶和茎)样品。
1.2.2不同组织部位处理
将30粒‘苏苋1号’苋菜种子播种于培养基质中,培养基质为丹麦品式泥炭土,pH 5.5,放置在温度为(25±1) ℃、光照强度为125 μmol/(m·s)、光周期条件为12 h/12 h条件下生长,培养45 d(开花期)后分别取苋菜不同组织部位(根、茎、叶和花)样品。
所有样品均在上午9:00—10:00取样,用于甜菜色素含量测定及qRT-PCR表达分析,取样后用液氮冻存置于-80 ℃冰箱保存备用。3次生物学重复。
1.2.3苋菜总RNA提取及cDNA合成
取0.15 g苋菜处理材料,采用天漠微量RNA提取试剂盒(北京天漠科技开发有限公司,中国)进行RNA提取,采用超微量分光光度计(Thermo Electron Corp, USA)测定RNA的OD值和浓度,并使用1%琼脂凝胶进行电泳检测其完整性。采用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金生物技术有限公司,中国)进行cDNA(500 ng)合成用于RT-PCR,采用Hifair Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR(上海翊圣生物科技有限公司,中国)进行cDNA(50 ng)合成用于qRT-PCR,所得cDNA模板置于-20 ℃冰箱保存,用于后续试验。
1.2.4苋菜AtrADH2基因克隆
根据关键词“arogenate dehydrogenase”在苋菜Blue-Dark转录组数据库(登录号SRA:SRR11196359-SSR11196364)检索,根据转录组数据FPKM值获得1条ADH2序列(转录组编号:Unigene44099_All)并采用DNAMAN 9.0设计特异性引物(表1),以‘苏苋1号’‘苏苋2号’cDNA为模板进行RT-PCR扩增,25 μL体系为cDNA(50 ng)模板1 μL,AtrADH2-ORF-F/R 1 μL,TapMix 12.5 μL,ddH2O 9.5 μL。RT-PCR程序设定为:94 ℃预变性3 min,94 ℃变性30 s,50~60 ℃退火30 s,72 ℃延伸90 s,共重复35个循环,最后72 ℃ 延伸10 min。PCR产物经1%琼脂凝胶电泳后切胶回收,采用胶回收试剂盒进行纯化回收,将回收后的目的片段与pMD18-T进行连接后转入大肠杆菌DH5α中,经菌液PCR后选择阳性克隆测序。
1.2.5苋菜AtrADH2蛋白生物信息学分析
苋菜AtrADH2基因氨基酸序列、核苷酸序列同源性和不同物种间的ADH蛋白序列通过NCBI-Blast(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)在线分析;AtrADH2蛋白序列分别采用在线软件进行预测分析:理化性质ExPASy Protparam(https:∥web.expasy.org/protparam/),蛋白结构域NCBI-CDS(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),功能位点(https:∥prosite.expasy.org/),二级结构SPOMA(https:∥npsa-prabi.ibcp.fr/),三级结构SWISS-MODEL(https:∥swissmodel.expasy.org/),亚细胞定位WoLF PSORT(https:∥wolfpsort.hgc.jp);采用MEGA 5.0邻接法(Neighbor-joining)进行不同物种间ADH蛋白系统进化树的构建,参数重复值设置为1 000。
1.2.6苋菜甜菜色素含量测定
取液氮研磨后的样品0.05 g用1.5 mL预冷无水乙醇4 ℃提取30 min,4 ℃离心10 min(10 000 r/min);弃上清,用预冷蒸馏水重悬沉淀后4 ℃提取30 min,4 ℃离心10 min(10 000 r/min);取上清液冰上待测。采用紫外分光光度计分别在538 nm和465 nm处测定甜菜红素和甜菜黄素的吸光值,3次生物学重复。计算甜菜红素和甜菜黄素含量公式如下:
式中:C为甜菜色素含量,mg/g;A为吸光值;DF为稀释倍数;M为甜菜色素的相对分子质量(M甜菜红素=550 g/mol、M甜菜黄素=308 g/mol);ε为甜菜色素的摩尔吸光系数[ε甜菜红素=60 000 L/(mol·cm)、ε甜菜黄素=48 000 L/(mol·cm)];L为比色皿厚度,cm;V为提取液总体积,mL;m为样品质量,g。
1.2.7实时荧光定量PCR表达分析
根据AtrADH2基因(GenBank登录号:MT982371)和甜菜色素代谢途径相关基因AtrCYP76AD1(GenBank登录号:KY792593)、AtrDODA(GenBank登录号:KP165399)和AtrMYB1(GenBank登录号:KU557504)基因的CDS序列,采用DNAMAN 9.0软件设计实时荧光定量PCR引物(表1),以AtrSAND[18]为内参基因,以生长15 d(幼苗期)的不同光周期条件不同苋菜品种的组织部位(叶和茎)及45 d(开花期)的不同组织部位(根、茎、叶和花)为cDNA模板,采用罗氏LightCycler480(Roche,Basel,Switzerland)仪器分别检测其表达情况。qRT-PCR反应采用20 μL体系:Hieff qPCR SYBR Green PCR Master Mix 10 μL,Forward/Reverse Primer(10 μmol/L)各0.5 μL,cDNA模板(2 ng)2 μL,ddH2O 7 μL。qRT-PCR程序设定为:95 ℃预变性 5 min,95 ℃变性 10 s,59 ℃退火 12 s,共重复40个循环,3次生物学重复。使用2-ΔΔCt计算相对表达量,通过SPSS 24.0计算差异显著性水平并使用GraphPad prism 6.1作图。

表1 引物序列Table 1 Primer sequence

图2 AtrADH2蛋白结构域预测(a)、功能位点分析(b)及三级结构预测(c)Fig.2 Domain prediction (a), functional site analysis (b), and the tertiary structure prediction (c) of AtrADH2 protein
2 结果与分析
2.1 苋菜AtrADH2基因克隆
使用引物AtrADH2-ORF-F和AtrADH2-ORF-R对苋菜AtrADH2基因的cDNA序列进行ORF验证,获得1条长度约为1 200 bp的条带(图1)。经测序后表明‘苏苋1号’和‘苏苋2号’的ADH2基因序列无差异,ADH2基因开放阅读框(Open Reading Frame, ORF)长1 197 bp,共编码398个氨基酸,并将其命名为AtrADH2(GenBank登录号:MT982371.1)。

M:Marker DL 5 000;A:‘苏苋1号’AtrADH2-ORF扩增条带;B: ‘苏苋2号’AtrADH2-ORF扩增条带。M: Marker DL 5 000; A: AtrADH2-ORF amplified band of ‘Su Amaranth 1’; B: AtrADH2-ORF amplified band of ‘Su Amaranth 2’.图1 苋菜AtrADH2基因的ORF扩增Fig.1 ORF amplification of AtrADH2 gene
2.2 苋菜AtrADH2蛋白生物信息学分析
采用ProParam在线网站分析AtrADH2基因编码蛋白质的理化性质。该蛋白分子式为C1969H3137N559O590S19,相对分子质量为44.69 ku,理论等电点为8.36,脂肪系数为84.47,不稳定系数为35.72,平均疏水性为-0.301;采用NCBI-CDS在线网站分析AtrADH2基因编码蛋白质的结构域,该蛋白有1个特殊位点,为PLN02256,Arogenate dehydrogenase位点,属于NADB_Rossmann超级家族,具有1个NADB保守结构域(图2(a));采用PROSITE预测该蛋白的功能位点,发现功能位点PDH_ADH位于序列的中间偏后位置(图2(b));采用SPOMA在线网站分析该蛋白的二级结构,该蛋白无规则卷曲占比最大,为41.46%,α-螺旋次之,为38.44%,延伸链为16.08%,β-转角最少,为4.02%;采用SWISS-MODEL在线网站构建获得AtrADH2蛋白的三级结构,AtrADH2蛋白的该模型是以苯甲酸酯脱氢酶1(Prephenate dehydrogenase 1)作为结构基础建模,两者序列相似性为51.78%(图2(c));采用WoLF PSORT亚细胞定位显示,该蛋白主要定位于叶绿体。
2.3 苋菜AtrADH2蛋白序列比对及系统进化树分析
通过DNAMAN 9.0软件将苋菜AtrADH2蛋白序列与藜麦(Chenopodiumquinoa)、碧桃(Prunuspersica)、甜菜(Betavulgaris)、罂粟(Papaversomniferum)、菠菜(Spinaciaoleracea)和番茄(Solanumlycopersicum)的ADH蛋白序列进行多重序列比对分析。结果显示:这6种植物均含有NADB_Rossmann 1个保守结构域,该结构域包含了1个GXGXXG基序特征(图3);NCBI-Blastp结果表明,由苋菜AtrADH2编码的氨基酸序列与藜麦、碧桃、甜菜、罂粟、菠菜和番茄ADH蛋白序列的相似度分别为98%、94%、93%、93%、82%和78%;通过MEGA 5.0将苋菜AtrADH2蛋白序列与NCBI登录的38种植物的ADH蛋白序列进行系统进化树分析。结果表明,39种ADH蛋白聚为4个小分支,苋菜AtrADH2蛋白与含甜菜色素植物的甜菜、藜麦及菠菜的ADH蛋白聚为1个分支且与甜菜BvADHα亲缘关系最近(图4)。

绿框表示GXGXXG基序;红框表示β1e-β1f环路残基。相似性:黑色=100%;深灰色≥75%;灰色≥50%。The green box represents the GXGXXG motif, and the red box represents β1e-β1f loop residues.Similarity: black=100%; dark gray ≥75%; gray ≥50%.图3 AtrADH2与其他物种ADH氨基酸序列多重序列比对Fig.3 Multiple alignment of AtrADH2 with other species ADH amino acid sequences
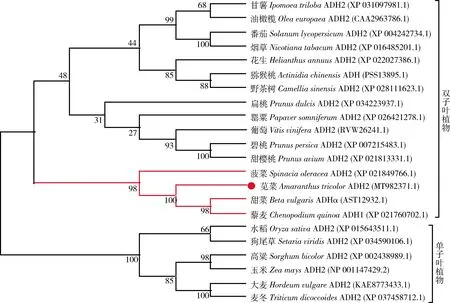
分支上的数值表示1 000次重复抽样符合聚类的百分数。The number on the branch represents the percentage of 1000 repeated samples in accordance with the clustering.图4 AtrADH2与其他物种ADH蛋白序列系统进化树分析Fig.4 Phylogenetic tree analysis of AtrADH2 and other species ADH protein sequences
2.4 不同光周期条件对苋菜幼苗生长的影响
在不同光周期条件下生长15 d后通过表型观察发现,‘苏苋1号’除根部外全株呈现红色,‘苏苋2号’除根部外全株呈现浅绿色;‘苏苋1号’‘苏苋2号’在相同光周期条件下生长趋势基本一致,在8 h/16 h光周期条件下苋菜植株茎细小,叶片数少于其它光周期条件(图5(a)和(b))。

从左至右光周期条件为:8 h/16 h、12 h/12 h、16 h/8 h和20 h/4 h。The conditions of the photoperiod from left to right is 8 h/16 h, 12 h/12 h, 16 h/8 h and 20 h/4 h, respectively.图5 不同光周期条件下生长15天后苋菜幼苗的形态结构Fig.5 Morphological structure in different photoperiod conditions grown 15 days of amaranth seedlings
2.5 不同光周期条件及组织部位对苋菜甜菜色素含量的影响
不同光周期条件下其甜菜色素含量变化有所差异。在不同光周期条件下生长15 d后,‘苏苋1号’叶中的甜菜色素含量在12 h/12 h光周期下有所下降,而茎中的甜菜色素含量总体呈现上升趋势(图6(a)和(b));不同组织部位其甜菜色素含量也有所差异,根中的甜菜色素含量最低,茎与花之间的甜菜色素含量无明显差异,叶中的甜菜色素含量最高(图6(c))。

不同大写字母表示P<0.01水平差异极显著,不同小写字母表示P<0.05水平差异显著。下同。Different uppercase letters indicate extremely significant difference level at P<0.01, and different lowercase letters indicate significant difference level at P<0.05. The same below.图6 不同光周期条件及组织部位‘苏苋1号’甜菜色素含量Fig.6 Betalain content in different photoperiod conditions and tissues of ‘Su Amaranth 1’
2.6 AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在不同光周期条件下的表达影响
采用qRT-PCR技术分析苋菜AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在苋菜不同光周期条件下的表达情况。结果表明,AtrCYP76AD1、AtrDODA和AtrMYB1基因在‘苏苋1号’叶中8 h/16 h光周期条件下其相对表达量最高,16 h/8 h光周期条件下其相对表达量最低;在‘苏苋1号’茎中AtrCYP76AD1和AtrMYB1基因其表达趋势基本一致,呈现先上升后下降的趋势,AtrDODA基因在‘苏苋1号’茎中其相对表达量趋势与其叶基本一致;AtrADH2基因在‘苏苋1号’叶中12 h/12 h光周期条件下其相对表达量最高,16 h/8 h光周期条件下其相对表达量最低;茎中16 h/8 h光周期条件下其相对表达量最低(图7(a)、(b)、(c)和(d))。

图7 AtrCYP76AD1(a)、AtrDODA(b)、AtrMYB1(c)和AtrADH2(d)基因在‘苏苋1号’不同光周期条件下的相对表达量Fig.7 Relative expression level of AtrCYP76AD1(a), AtrDODA(b), AtrMYB1(c) and AtrADH2(d) genes in different photoperiod conditions of ‘Su Amaranth 1’
AtrCYP76AD1基因在‘苏苋2号’叶中12 h/12 h光周期条件下其相对表达量最高,茎中呈现下降趋势(图8(a));AtrDODA基因在‘苏苋2号’叶中8 h/16 h光周期条件下其相对表达量最高,茎中16 h/8 h光周期条件下其相对表达量最低(图8(b));AtrMYB1基因在‘苏苋2号’叶中8 h/16 h光周期条件下其相对表达量最低,茎中20 h/4 h光周期条件下其相对表达量最低(图8(c));AtrADH2基因在‘苏苋2号’叶和茎中12 h/12 h光周期条件下其相对表达量均最高(图8(d))。

图8 AtrCYP76AD1(a)、AtrDODA(b)、AtrMYB1(c)和AtrADH2(d)基因在‘苏苋2号’不同光周期条件下的相对表达量Fig.8 Relative expression level of AtrCYP76AD1(a), AtrDODA(b), AtrMYB1(c) and AtrADH2(d) genes in different photoperiod conditions of‘Su Amaranth 2’
2.7 AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在不同苋菜品种的表达影响
采用qRT-PCR技术分析苋菜AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在不同苋菜品种的表达情况。结果表明,AtrCYP76AD1和AtrDODA基因在‘苏苋1号’叶和茎的相对表达量均显著高于‘苏苋2号’叶和茎的相对表达量(图9(a)和(b));AtrMYB1基因在‘苏苋1号’叶的相对表达量显著高于‘苏苋2号’叶的相对表达量,在‘苏苋1号’茎的相对表达量显著低于‘苏苋2号’茎的相对表达量(图9(c));AtrADH2基因在‘苏苋1号’叶和茎的相对表达量均显著低于‘苏苋2号’叶和茎的相对表达量,推测AtrADH2基因可能对甜菜色素合成有负调控作用(图9(d))。
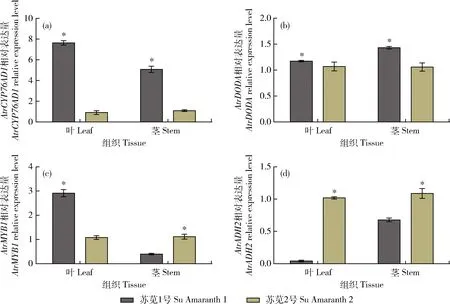
*表示P<0.05水平差异显著。下同。* indicate P<0.05 significant difference level. The same below.图9 AtrCYP76AD1(a)、AtrDODA(b)、AtrMYB1(c)和AtrADH2(d)基因在不同苋菜品种的相对表达量Fig.9 Relative expression level of AtrCYP76AD1(a), AtrDODA(b), AtrMYB1(c) and AtrADH2(d) genes in different amaranth varieties
2.8 AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在不同组织部位的表达影响
采用qRT-PCR技术分析AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在‘苏苋1号’苋菜不同组织部位(根、茎、叶和花)的表达情况。结果表明,AtrCYP76AD1、AtrDODA和AtrMYB1基因在茎中的相对表达量最高(图10(a)、(b)和(c)),AtrADH2基因在不同的组织部位存在差异性,在根中的相对表达量最高,茎中的相对表达量最低,推测AtrADH2基因可能对甜菜色素合成有负调控作用(图10(d))。

图10 AtrCYP76AD1(a)、AtrDODA(b)、AtrMYB1(c)和AtrADH2(d)基因在‘苏苋1号’不同组织部位的相对表达量Fig.10 Relative expression level of AtrCYP76AD1(a), AtrDODA(b), AtrMYB1(c) and AtrADH2(d) genes in different tissues of ‘Su Amaranth 1’
2.9 AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在不同时期的表达影响
采用qRT-PCR技术分析AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因在‘苏苋1号’苋菜不同生长时期叶和茎的表达情况。结果表明,与幼苗期相比,AtrCYP76AD1、AtrDODA和AtrMYB1基因叶中的相对表达量在开花期显著下降,而茎中的相对表达量显著提高(图11(a)、(b)和(c));AtrADH2基因叶中的相对表达量在开花期显著提高,而茎中的相对表达量无明显差异(图11(d))。

图11 AtrCYP76AD1(a)、AtrDODA(b)、AtrMYB1(c)和AtrADH2(d)基因在‘苏苋1号’不同时期的相对表达量Fig.11 Relative expression level of AtrCYP76AD1(a), AtrDODA(b), AtrMYB1(c) and AtrADH2(d) genes in different period of ‘Su Amaranth 1’
3 讨论与结论
3.1 苋菜AtrADH2基因分析
酪氨酸是所有生物体蛋白质合成所必需的芳香族氨基酸,是甜菜色素等次生代谢产物的前体物质[7,19],本研究通过RT-PCR技术首次在苋菜中获得了ADH2基因的ORF序列,并提交于NCBI-GenBank将其命名为AtrADH2,基因登录号为MT982371.1。生物信息学分析表明,AtrADH2蛋白属于NADB_Rossmann超级家族,具有1个NADB保守结构域,包含了1个GXGXXG基序特征,该家族中的蛋白质还包含第2个结构域,负责特异性结合底物并催化特定的酶促反应,Schenck等[20]表示该保守结构域中β1e-β1f环路上的残基有助于特异性底物催化反应的正确定位。该蛋白亚细胞定位于叶绿体;通过同源性比较发现,AtrADH2与BvADHα亲缘关系最近,并与石竹目植物菠菜、藜麦的ADH蛋白序列聚为1个分支,表明AtrADH2在生物进化过程中是相对保守的。
3.2 不同光周期对苋菜AtrADH2基因表达的影响
光周期可以影响植物营养生长发育、植物体内一些次生代谢产物的产生和植物化学物质的积累[14-15]。有研究表明,对三角梅进行遮光处理后,其甜菜红素的含量和4,5-DOPA基因的表达量均表现出下降趋势[21],苋菜老叶中的甜菜色素含量比新叶低[22]。本次研究发现,其甜菜红素和甜菜黄素的含量在12 h/12 h光周期条件有下降趋势,推测可能与出现的叶片数和光照日长有关。此外,DODA基因[23]和细胞色素P450酶基因[24-25]是甜菜色素代谢过程中的关键基因,有研究表明,AtrCYP76AD1、AtrDODA和AtrMYB1基因的表达受到光质[26]、温度[27]和赤霉素[28]等环境因素和生长调节剂的影响,与甜菜色素含量变化趋势相同。本研究发现,AtrCYP76AD1、AtrDODA、AtrMYB1和AtrADH2基因的相对表达量均受到了光周期的影响。
3.3 不同品种、时期及组织部位对苋菜AtrADH2基因表达的影响
BvADHα基因在甜菜中的表达具有组织特异性。有研究表明,BvADHα基因在红甜菜和甜菜品种子叶和下胚轴中均有表达,且红甜菜子叶表达最高[13],BvADHα基因的表达模式与甜菜色素合成基因(BvCYP76AD1α和BvDODAα)、BvMYB1转录因子具有相似性,对甜菜色素合成具有正向调控作用[13]。Ohno等[29]研究发现,BpADH基因在白色三角梅和红色三角梅中均有表达,且白色三角梅表达较高,BpADH基因与甜菜色素合成相关基因BpCYP76AD1和BpDODA1基因的表达模式趋势相反。Oliveira等[12]研究发现,拟南芥中酪氨酸的积累对ADH酶活性具有反馈抑制作用。本研究通过qRT-PCR技术发现,AtrADH2基因在不同苋菜品种中其表达具有差异性,AtrADH2基因在‘苏苋1号’叶和茎的相对表达量均低于‘苏苋2号’叶和茎的相对表达量;AtrADH2基因在‘苏苋1号’苋菜品种不同组织部位中的表达也具有组织特异性,AtrADH2基因在‘苏苋1号’苋菜品种的根、茎、叶和花中均有表达,且在根中的表达量最高,茎中的表达量最低,表明AtrADH2基因可能对苋菜中甜菜色素的合成有负调控作用。此外,对不同生长时期的叶和茎中基因的表达情况进行分析发现,AtrCYP76AD1、AtrDODA和AtrMYB1基因在开花期叶中其相对表达量显著下降,茎中其相对表达量显著提高,与甜菜色素含量趋势相同,而AtrADH2基因在开花期叶中其相对表达量显著上升,茎中其相对表达量无明显差异,与甜菜色素含量趋势相反,进一步说明AtrADH2基因可能对甜菜色素合成具有负调控作用。
综上所述,光周期是影响苋菜生长及甜菜色素产生的重要环境因子,影响甜菜色素生物合成过程中相关基因的表达,AtrADH2基因可能是调控苋菜甜菜色素合成的重要基因,其表达存在组织特异性,可能对苋菜甜菜色素的合成起负调控作用,其反馈抑制作用及功能有待进一步研究。

