枸杞多糖对尼罗罗非鱼生长发育、消化酶活性及肠道组织形态的影响
陶云开 高雪梅 袁宗伟 郭忠宝 陈诏 张旭 陈少翠 唐瞻杨 黄婷



摘要:【目的】明確枸杞多糖对罗非鱼机体生长发育及消化功能的影响,为罗非鱼健康养殖提供理论参考,同时为促进罗非鱼养殖产业的可持续健康发展提供新思路。【方法】在尼罗罗非鱼基础饲料中添加5个不同剂量(0~2000 mg/kg)的枸杞多糖,进行40 d的养殖试验后测量尼罗罗非鱼的体重及全长,计算相对增重率(WG)、相对增长率(LG)、特定生长率(SGR)和饲料系数(FCR),采用ELISA试剂盒分别检测淀粉酶(Amylase)、蛋白酶(Protease)及脂肪酶(Lipase)活性,并采集前肠、中肠和后肠组织制作切片,通过光学显微镜观察肠道组织形态的变化特征。【结果】于基础饲料中添加不同剂量枸杞多糖对尼罗罗非鱼的生长发育均起促进作用,其中以添加1500 mg/kg处理组的促进效果最佳,至养殖试验结束时尼罗罗非鱼的终末全长、终末体重、WG、LG和SGR均达最高值,分别为13.45 cm、48.74 g、6.96%、0.94%和5.19%/d;而FCR最小,仅为1.88。尼罗罗非鱼中肠组织的蛋白酶和淀粉酶活性在1500 mg/kg处理组中显著升高(P<0.05,下同),胃组织的蛋白酶和淀粉酶活性、肝脏组织的脂肪酶活性也是以1500 mg/kg处理组最高,但与对照组(0 mg/kg)相比无显著差异(P>0.05)。肠绒毛长度在尼罗罗非鱼前肠组织中以1500 mg/kg处理组的最短(0.351 mm)、在后肠组织中则以1500 mg/kg处理组的最长(0.320 mm),与对照组(0 mg/kg)相比差异显著;肌层厚度在前肠和中肠组织中均以500 mg/kg处理组的最厚,分别为0.089和0.087 mm,在后肠组织中则以1000 mg/kg处理组的最薄(0.065 mm)、2000 mg/kg处理组的最厚(0.099 mm)。【结论】枸杞多糖可提高罗非鱼的消化酶活性,改善其肠道组织形态,从而影响罗非鱼的生长发育,且以添加剂量为1500 mg/kg的效果最佳。
关键词: 尼罗罗非鱼;枸杞多糖;生长发育;消化酶;肠道组织形态
中图分类号: S965.125 文献标志码: A 文章编号:2095-1191(2022)02-0577-08
Effects of Lycium barbarum polysaccharides on growth, digestive enzyme activity and intestinal tissue morphology
of Nile tilapia (Oreochromis niloticus)
TAO Yun-kai GAO Xue-mei YUAN Zong-wei GUO Zhong-bao CHEN Zhao ZHANG Xu CHEN Shao-cui TANG Zhan-yang HUANG Ting
(1Guangxi Aquatic Products Breeding Center, Nanning 530031, China; 2Guangxi Academy of
Fishery Sciences, Nanning 530021, China)
Abstract:【Objective】This study clarified the effects of Lycium barbarum polysaccharide(LBP) on the growth, development and digestive function of tilapia. The research results provided theoretical reference for healthy tilapia aquaculture and new ideas for promoting the sustainable and healthy development of tilapia aquaculture industry. 【Method】Five different doses (0-2000 mg/kg) of LBP were added to the basic feed of Nile tilapia for a 40-day breeding experiment. After the experiment, the body weight and full length of Nile tilapia were measured to calculated the relative weight gain rate (WG), relative growth rate (LG), specific growth rate (SGR) and feed coefficient (FCR). ELISA kits were used to detect the activities of amylase, protease and lipase. The foregut, midgut and hindgut tissue sections of the experimental fish were prepared to observe the changes of intestinal tissue morphology. 【Result】Adding different doses of LBP to the food could promote the growth and development of Nile tilapia. The group supplemented with 1500 mg/kg had the best promo-ting effect, and the final full length, final body weight, WG, LG and SGR reached the highest, which were 13.45 cm, 48.74 g, 6.96%, 0.94% and 5.19%/d, respectively. FCR was the smallest, only 1.88. The activities of protease and amylase in midgut tissue significantly increased in 1500 mg/kg treatment group (P<0.05, the same below). The activities of protease and amylase in stomach tissue activities of lipase in liver tissue were also the highest in 1500 mg/kg treatment group. The However,there was no significant difference compared with the control group (0 mg/kg) (P>0.05). The villus length of the foregut tissue was the shortest (0.351 mm) and the villus length of the hindgut tissue was the longest (0.320 mm) in the 1500 mg/kg treatment group, representing significante difference compared with the control group (0 mg/kg). The muscle layer thickness in the foregut and midgut tissues were the thickest in the 500 mg/kg treatment group, at 0.089 and 0.087 mm, respectively. The muscle layer thickness of hindgut tissue was the thinnest (0.065 mm) in the 1000 mg/kg treatment group, and was the thickest (0.099 mm) in the 2000 mg/kg treatment group. 【Conclusion】LBP can promote the growth and development of Nile tilapia by increasing the activity of digestive enzymes and improving the morphology of intestinal tissue. Adding 1500 mg/kg LBP to the feed has the best effect.
Key words:Nile tilapia; Lycium barbarum polysaccharide; growth and development; digestive enzyme; intestinal tissue morphology
Foundation items: National Modern Agriculture Industry Technology System Construction Project (CARS- 46)
0 引言
【研究意义】水产养殖业的蓬勃发展,不仅促进了社会经济的增长,还解决了大量的就业难题。据估计,未来30年全球人口总数将持续增加,水产养殖业在解决蛋白食品需求量不断增加等问题中发挥着重要作用(Manage,2018)。尼罗罗非鱼(Oreochromis niloticus)由于生长速度快、出肉率高,已发展成为全世界养殖最多的鱼类之一。近年来,罗非鱼产量持续增加,预计到2030年世界范围内的罗非鱼总产量将达730万t(Behera et al.,2018;Hien et al.,2018)。抗生素等化学药物在罗非鱼养殖过程中常用于改善其生长性能,然而大量化学药物的使用,极易造成严重的环境污染(Armstrong et al.,2005)。Mesalhy和Albutti(2014)研究认为,过量使用抗生素养殖罗非鱼会通过食物链对人体健康产生不良影响。Xin等(2019)研究报道,抗生素等新兴污染物使用量的不断增加,将严重威胁罗非鱼产业的可持续发展。中药富含生物碱及挥发油等活性物质,在促进水生动物生长发育、提高消化水平和增强抗应激能力等方面发挥重要作用,且具有来源广、成本低、无药物残留、毒副作用小、不产生抗药性等优点。因此,探究中药在罗非鱼养殖中的使用效果,对推进罗非鱼产业的可持续发展具有重要意义。【前人研究进展】近年来,中药在水产养殖业中得到广泛应用且效果良好。Citarasu(2010)研究认为,中药在鱼类的生长发育和刺激消化等方面具有积极的作用;Radhakrishnan等(2014)研究发现,中药可提高罗氏沼虾(Macrobrachium rosenbergii)的消化能力,提高其生长性能;Elabd等(2016)研究证实,投喂甘草和黄芪能有效提高鲈鱼(Perca flavescens)的生长参数;Huang等(2020)研究发现,在饲料中添加适量中药混合物剂可显著改善欧洲鳗鲡(Anguilla anguilla)的生长性能、消化酶活性及血清生化指標;He等(2020)研究表明,中药可增强鲫鱼(Carassius auratus auratus)的抗病能力。枸杞(Lycium barbarum)多糖是枸杞子中最重要的药用成分,其主要成分为鼠李糖、葡萄糖及半乳糖等多种糖类,是一种糖—蛋白聚合物,因具有天然的抗氧化及促进酶合成等生物活性,在改善机体生长发育、提高消化水平等方面具有重要作用(刘英娟等,2015;孙甜甜等,2018;张琛等,2021)。王大会等(2020)指出,枸杞多糖可增强饵料诱食效果,提高水产动物的生产性能,并改善其肉质。袁增宝等(2020)研究表明,枸杞多糖可提高鲤鱼(Cyprinus carpio)对饲料的利用率并促进其生长。【本研究切入点】目前,有关枸杞多糖在罗非鱼机体生长发育及消化等方面的研究鲜见报道。【拟解决的关键问题】对比分析不同枸杞多糖添加剂量下罗非鱼生长性能、消化酶活性和肠道组织形态的差异,探讨枸杞多糖对罗非鱼机体生长发育及消化功能的影响,为罗非鱼健康养殖提供理论参考,同时为促进罗非鱼养殖产业的可持续健康发展提供新思路。
1 材料与方法
1. 1 试验材料
供试尼罗罗非鱼由广西水产科学研究院特色淡水鱼综合试验基地提供,选取体表无伤痕、活力强、大小均一的个体进行饲养试验。试验开始前将尼罗罗非鱼置于水温(28.0±0.5)℃、pH 8.0的条件下暂养7 d。供试基础饲料购自百洋产业投资集团股份有限公司,基础饲料营养水平见表1。枸杞多糖购自上海源叶生物科技有限公司,规格为50% UV,颜色呈棕色,粉状,易吸潮。
1. 2 试验方法
参照Eman等(2014)的方法,设计5个枸杞多糖添加剂量(G1~G5),分别为0(G1,对照)、500(G2)、1000(G3)、1500(G4)和2000(G5)mg/kg。将枸杞多糖溶于水后均匀喷涂在基础饲料表面,饲料混合均匀晾干后,置于干燥处低温保存(Brum et al.,2018)。按枸杞多糖添加剂量共设5个处理组,每处理组3个重复,每个重复50尾尼罗罗非鱼。试验开始时将750尾尼罗罗非鱼(体重6.12±2.75 g、全长6.92±0.49 cm)随机平均分到15个150 L的水箱中,保持养殖环境与暂养环境一致,进行40 d的养殖试验。试验用水为曝晒自来水,养殖期间每3 d换水1次。每天9:00和17:00各饱食投喂1次,投食1 h后将剩余饲料捞出,晒干称重并记录。
1. 3 指标测定
1. 3. 1 生长指标测量 养殖试验结束时,测量尼罗罗非鱼的体重及全长,计算相对增重率(WG)、相对增长率(LG)、特定生长率(SGR)和饲料系数(FCR)(马钊等,2020;张宇航等,2020),计算公式如下:
WG(%)=(W-W)/W×100
LG(%)=(L-L)/L×100
SGR(%)=(lnW-lnW)/t×100
FCR=W/(W–W)
式中,W为初始体重(g),W为终末体重(g),W为饲料消耗量,L为初始全长(cm),L为终末全长(cm),t为养殖时间(d)。
1. 3. 2 消化酶活性检测 养殖试验结束时,对所有试验鱼饥饿处理24 h,每处理组随机取3尾尼罗罗非鱼,采用MS-222进行麻醉处理,然后迅速在冰盘上采集肝脏、胃和中肠组织,置于-80 ℃冰箱暂存以备消化酶活性检测。按照ELISA试剂盒(江苏泽雨生物科技有限公司)说明检测淀粉酶(Amylase)、蛋白酶(Protease)和脂肪酶(Lipase)活性。
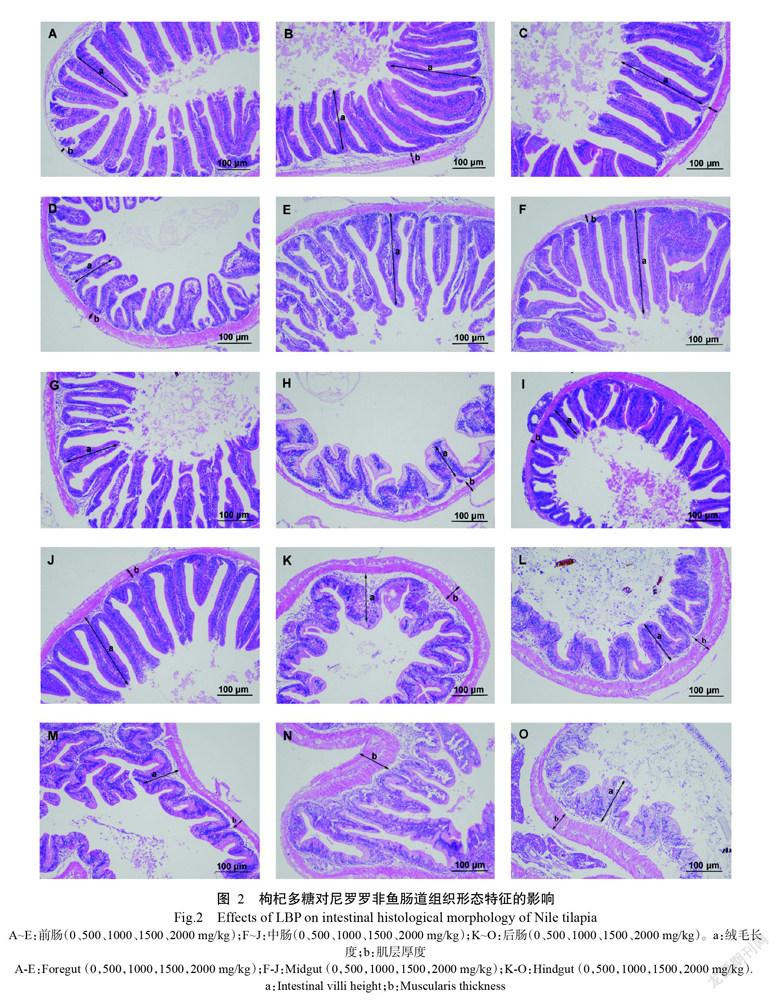
1. 3. 3 肠道组织形态分析 尼罗罗非鱼饥饿处理24 h后,每处理组随机选取3尾进行MS-222麻醉处理,迅速解剖采集前肠、中肠和后肠组织,各肠段长度约1 cm,浸入pH 7.2~7.4的磷酸盐缓冲液中清洗内容物,使用4%多聚甲醛通用型组织固定液(Biosharp)固定24 h(王坛等,2019)。参照Zhang等(2017)制作组织切片的方法,将固定好的样品经脱水、浸蜡、包埋、切片、脱蜡、苏木精—伊红(H-E)染色等过程制作肠道组织横断面切片,每个组织制作5张石蜡切片。最后使用光学显微镜对每张肠道组织切片进行观察拍照,每个组织选取拍照效果较好的3张切片备用。在备用的每张肠道组织切片中,随机选取3根完整绒毛以Image-Pro Plus 6.0分别测量绒毛高度(mm)和肌层厚度(mm),并求取平均值。
1. 4 统计分析
试验数据采用SPSS 17.0进行单因素方差分析(One-way ANOVA)及Duncan’s多重比较,并以GraphPad Prism 5.0进行绘图。
2 结果与分析
2. 1 枸杞多糖对尼罗罗非鱼生长发育的影响
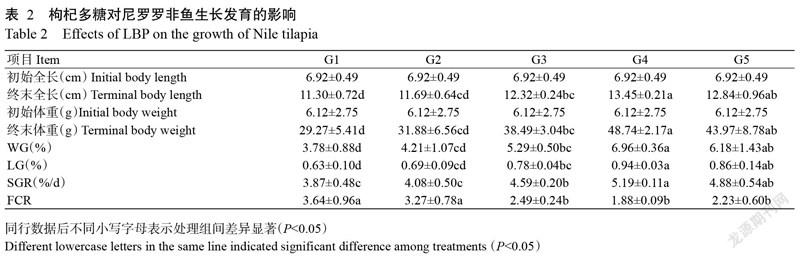
由表2可知,于基础饲料中添加不同剂量枸杞多糖对尼罗罗非鱼的生长发育均起促进作用,其中以G4处理组的促进效果最佳,至养殖试验结束时尼罗罗非鱼的终末全长、终末体重、WG、LG和SGR均达最高值,分别为13.45 cm、48.74 g、6.96%、0.94%和5.19%/d,与G1、G2和G3处理组的差异达显著水平(P<0.05,下同)。FCR以G4处理组的最小(1.88),其次是G5处理组(2.23),二者差异不显著(P>0.05,下同)。
2. 2 枸杞多糖对尼罗罗非鱼消化酶活性的影响
由图1可知,经过40 d的养殖各处理组尼罗罗非鱼肝脏中的蛋白酶活性无显著差异;G2~G5处理组的中肠组织蛋白酶活性均显著高于对照组(G1),尤其以G4处理组最高,达524 U/L;在胃组织中,G4处理组的蛋白酶活性也最高,达532 U/L,但与对照组相比无显著差异,而G3和G5处理组显著低于G4处理组。在尼罗罗非鱼肝脏中,各处理组间的淀粉酶活性也无显著差异;在中肠组织中,G2~G5处理组的淀粉酶活性均显著高于对照组,尤其以G4处理组最高,达4139 mU/L;在胃组织中,G4处理组的淀粉酶活性也最高,达6303 mU/L,但与对照组相比无显著差異。在尼罗罗非鱼肝脏中,脂肪酶活性以G4处理组最高,达8247 mU/L,与对照组间无显著差异,但显著高于G5处理组;在中肠和胃组织中,脂肪酶活性均以G3处理组的最高,分别为4457和4131 mU/L,但各处理组间的差异均不显著。
2. 3 枸杞多糖对尼罗罗非鱼肠道组织形态的影响
肠道是鱼类消化和吸收营养的主要场所,可分为黏膜层、黏膜下层、肌层和浆膜层。肠绒毛是肠道内部营养物质消化吸收的主要部位,而肌层主要作用于肠道蠕动,促进食物的推进及排放。因此,肠绒毛长度及肌层厚度直接影响着营养物质的吸收与运输。各处理组尼罗罗非鱼前肠、中肠、后肠组织的形态特征如图2所示。由尼罗罗非鱼前肠、中肠、后肠组织切片的肠绒毛长度和肌层厚度测量值绘制曲线(图3)可知,与对照组相比,肠绒毛长度在尼罗罗非鱼前肠组织中以G4处理组的最短(0.351 mm)、G2处理组的最长(0.526 mm),二者差异显著;在中肠组织中,肠绒毛长度排序为G1处理组>G5处理组>G2处理组>G4处理组>G3处理组,即G3处理组的肠绒毛长度最短,为0.298 mm;在后肠组织中,肠绒毛长度排序为G4处理>G5处理>G3处理>G1处理>G2处理,以G4处理组的肠绒毛长度最长,为0.320 mm,与对照组相比差异显著。在肌层厚度方面,前肠的肌层厚度排序为G2处理组>G4处理组>G5处理组>G3处理组>G1处理组,其中,G2~G5处理组肌层厚度均显著高于对照组,以G2处理组的最厚(0.089 mm);中肠的肌层厚度排序为G2处理组>G5处理组>G4处理组>G1处理组>G3处理组,也是以G2处理组的最厚,为0.087 mm;在后肠组织中则以G3处理组的最薄(仅为0.065 mm),以G5处理组的最厚(0.099 mm),具体排序为G5处理组>G4处理组>G1处理组>G2处理组>G3处理组。综上所述,以G2处理组前肠的肠绒毛最长,G4处理组后肠的肠绒毛最短,且各处理组的后肠肠绒毛均较前肠、中肠的肠绒毛短。在肌层厚度方面,以G5处理组的后肠肌层最厚,G1处理组的前肠肌层最薄,且各处理组的后肠肌层均较前肠、中肠的肌层厚。
3 讨论
多糖是机体的主要成分之一,几乎参与整个生命过程。枸杞多糖是一种由多种酸性杂多糖和多肽或蛋白构成的复合多糖,因具有天然的抗氧化、抗病毒等生物活性,在畜牧业和水产养殖生产中的应用前景广阔(谭连杰等,2019)。利用枸杞多糖提高动物的生产性能是多糖研究领域的热点之一。已有研究表明,枸杞多糖可改善养殖动物的生长性能,在饲料中添加2 g/kg枸杞多糖对草鱼(Ctenopharyngodon idella)的WG、FCR和SGR均有显著促进作用(Wing et al.,2016),添加10 g/kg枸杞多糖可显著提高石斑鱼的WG和SGR(Tan et al.,2019)。李宇敏等(2018)研究发现,饲料中添加不同剂量的枸杞多糖可不同程度促进獭兔的生长发育。本研究结果显示,在基础饲料中添加1500 mg/kg枸杞多糖可显著提高罗非鱼的WG、LG和SGR,降低其FCR,与前人的研究结果(Wing et al.,2016;Tan et al.,2019)相似。
蛋白酶、脂肪酶及淀粉酶等内源性消化酶在动物营养物质消化方面发挥重要作用,其活性严重影响着水产动物的消化水平(Mohamed et al.,2019)。已有研究表明,在仿刺参(Apostichopus japonicas Selenka)体内注射枸杞多糖可显著提高其肠道消化酶活性和生长性能(樊英等,2014)。类似研究结论在枸杞多糖对肉鸡等其他动物的研究中也得到证实(Long et al.,2020)。本研究结果表明,尼罗罗非鱼中肠组织的蛋白酶和淀粉酶活性在1500 mg/kg处理组中显著升高,表明饲料中添加1500 mg/kg枸杞多糖可提高罗非鱼的消化能力。多糖的结构组分与其生理功能密切相关,枸杞多糖复杂的结构组分和构象特征决定其生物学功能的多样性(Talarico et al.,2005;孙甜甜等,2018)。故推测枸杞多糖在尼羅罗非鱼中肠组织中利用不同组分间的结构修饰,有效改善罗非鱼肠道组织中的消化酶活性,从而提高对饲料的利用率,促进其生长发育。
肠道是鱼类进食后消化吸收的重要器官,肠绒毛作为肠道内部消化吸收的主要部位,其长度决定了肠道内部消化吸收的表面积(朱传忠等,2018)。Caspary(1992)研究认为,肠绒毛长度增加促使小肠接触营养物质的面积增大,从而增强小肠对营养物质的吸收,即肠绒毛形态与机体生长发育密切相关。本研究发现,在基础饲料中添加1500 mg/kg枸杞多糖后尼罗罗非鱼后肠绒毛长度最长,表明罗非鱼的消化吸收能力最强,生长发育最快。此外,发现在基础饲料中添加枸杞多糖对尼罗罗非鱼前肠、中肠的绒毛长度无显著促进作用。鱼类进食后营养物质在肠道内的流动速度和消化率与肠道肌层厚度密切相关(Smirnov et al.,2004)。肌层厚度影响肠道肌肉的蠕动能力,肌层越厚蠕动能力越强,越有利于肠道内物质的运输(麦浩彬等,2020),反之,较薄的肌层减少了肠道蠕动速度,增加食物在肠道内的停留时间,从而延长营养吸收的时间(Liu et al.,2018)。前人研究表明,枸杞多糖不同组分间的构象可改善前肠组织细胞的增殖分化,促使其分泌更多分泌物以促进消化吸收(樊英等,2014)。本研究结果发现,在基础饲料中添加1500 mg/kg枸杞多糖能有效提高罗非鱼前肠的肌层厚度,且此时生长性能最佳。故推测饲料中添加的枸杞多糖促进了前肠组织细胞的增殖分化,从而促使其前肠肌层厚度增加,提高食物在罗非鱼前肠中的运输速度,同时促进前肠组织分泌物的产生及食物在下游消化道的消化吸收,有效提高消化效率。由于枸杞多糖存在特殊的结构组成和构象差异,其含有的-COOH和-NH等基团还会促进肠道组织细胞发生凋亡(樊英等,2014)。本研究在基础饲料中添加1000 mg/kg枸杞多糖后,尼罗罗非鱼后肠组织肌层厚度显著降低,推测是-COOH和 -NH等基团的促凋亡作用致使罗非鱼后肠肌层厚度变薄,从而延长食物在肠道内的停留时间,提高营养物质的吸收效率,最终促进罗非鱼的生长发育。
4 结论
枸杞多糖可提高罗非鱼的消化酶活性,改善其肠道组织形态,从而影响罗非鱼的生长发育,且以添加剂量为1500 mg/kg的效果最佳。
参考文献:
樊英,于晓清,李乐,李天保,叶海斌,王勇强. 2014. 不同免疫增强剂对仿刺参肠道消化酶活性及组织结构的影响[J]. 水产学杂志,27(4):46-51. [Fan Y,Yu X Q,Li L,Li T B,Ye H B,Wang Y Q. 2014. Effect of different immunostimulants on digestive enzyme activities and histological structure in intestine of sea cucumber,Apostichopus japonicus[J]. Chinese Journal of Fisheries, 27(4):46-51.] doi:10.3969/j.issn.1005-3832.2014.04.010.
李宇敏,杨美璐,吴峰洋,陈宝江,谷子林,陈赛娟,刘亚娟. 2018. 枸杞多糖对生长獭兔营养物质表观消化率及氮代谢的影响[J]. 饲料工业,39(17):61-64. [Li Y M,Yang M L,Wu F Y,Chen B J,Gu Z L,Chen S J,Liu Y J. 2018. Effects of lycium barbarum polysaccharides on apparent digestibility and nitrogen metabolism of nutrients in growing rex rabbits[J]. Feed Industry,39(17):61-64.] doi:10.13302/j.cnki.fi.2018.17.014.
刘英娟,杜金梁,贾睿,曹丽萍,王佳豪,殷国俊. 2015. 枸杞多糖对四氯化碳致建鲤急性肝损伤的保护作用[J]. 浙江农业学报,27(1):37-43. [Liu Y J,Du J L,Jia R,Cao L P,Wang J H,Yin G J. 2015. Protective effects of Lycium barbarum polysaccharides against carbon tertrachloride (CCl4)-induced liver accurate injury in Carprinus carpoivar Jian[J]. Acta Agriculturae Zhejiangensis,27(1):37-43.] doi:10.3969/j.issn.1004-1524.2015.01.08.
马钊,张艺杰,赵硕,何文娜,卢冰霞,胡庭俊,陈忠伟,何颖. 2020. 贞苓增免散对罗非鱼生长性能及免疫功能的影响[J]. 饲料研究,43(12):46-50. [Ma Z,Zhang Y J,Zhao S,He W N,Lu B X,Hu T J,Chen Z W,He Y. 2020. Effect of Zhenlingzengmian powder on growth performance and immune function of tilapia[J]. Feed Research,43(12):46-50.] doi:10.13557/j.cnki.issn1002-2813.2020.12.013.
麦浩彬,郭鑫伟,王金港,迟淑艳,董晓慧,杨奇慧,刘泓宇,章双. 2020. 摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼幼鱼肠道组织形态和菌群组成的影响[J]. 大连海洋大学学报,35(1):63-70. [Mai H B,Guo X W,Wang J G,Chi S Y,Dong X H,Yang Q H,Liu H Y,Zhang S. 2020. Effects of dietary protein levels on intestinal tract histomorphology and microflora composition in juvenile pearl gentian grouper (Epinephelus lanceolatu ♂×E. Fuscoguttatus ♀)[J]. Journal of Dalian Ocean University,35(1):63-70.] doi:10.16535/j.cnki.dlhyxb.2019-123.
孙甜甜,高云航,孙卓,娄玉杰,周海柱. 2018. 枸杞多糖研究进展[J]. 中国兽药杂志,52(12):75-80. [Sun T T,Gao Y H,Sun Z,Lou Y J,Zhou H Z. 2018. Research advan-ces of Lycium barbarum polysaccharides[J]. Chinese Journal of Veterinary Drug,52(12):75-80.] doi:10.11751/ISSN.1002-1280.2018.12.12.
谭连杰,林黑着,黄忠,周传朋,荀鹏伟,黄倩倩,于万峰,黄小林,虞为. 2019. 枸杞多糖对卵形鲳鲹生长性能、抗氧化能力及血清免疫、生化指标的影响[J]. 动物营养学报,31(1):418-427. [Tan L J,Lin H Z,Huang Z,Zhou C P,Xun P W,Huang Q Q,Yu W F,Huang X L,Yu W. 2019. Effects of Lycium barbarum polysaccharide on growth performance,antioxidant capacity,serum immune and biochemical indexes of juvenile golden pompano (Trachinotus ovatus)[J]. Chinese Journal of Animal Nutrition,31(1):418-427.] doi:10.3969/j.issn.1006-267x.2019.01. 049.
王大会,胡强,李泰君. 2020. 枸杞及枸杞多糖在水产养殖中的应用分析[J]. 江西水产科技,(3):43-45. [Wang D H,Hu Q,Li T J. 2020. Application of Lycium barbarum and Lycium barbarum polysaccharide in aquaculture[J]. Jiang-xi Fishery Science and Technology,(3):43-45.] doi:10.3969/j.issn.1006-3188.2020.03.018.
王坛,赵金鑫,刘东来,孔纯,华雪铭,吴钊,王刚,冯悦,杨景丰,刘韬. 2019. 饲用溶菌酶对吉富罗非鱼消化道组织结构和营养物质消化吸收的影响[J]. 渔业科学进展,40(6):76-87. [Wang T,Zhao J X,Liu D L,Kong C,Hua X M,Wu Z,Wang G,Feng Y,Yang J F,Liu T. 2019. Effects of dietary lysozyme on the digestive tract structure and nutrient digestibility of GIFT tilapia (Oreochromis niloticus)[J]. Progress in Fishery Sciences,40(6):76-87.] doi:10.19663/j.issn2095-9869.20180918001.
袁增宝,姚琼,王安香,向枭. 2020. 枸杞多糖对鲤生长性能和肝胰脏抗氧化能力的影响[J]. 生物资源,42(3):307-312. [Yuan Z B,Yao Q,Wang A X,Xiang X. 2020. Effects of Lycium barbarum polysaccharide on growth performance and hepatopancreatic antioxidant capacity of carp[J]. Biotic Resources,42(3):307-312.] doi:10.14188/j.ajsh.2020.03.007.
张琛,杨建军,王晨,马洁,杨涓,刘根红,郑蕊,郑国琦. 2021. 宁夏枸杞果实细胞壁蛋白适宜提取方法研究[J]. 南方农业学报,52(9):2534-2542. [Zhang C,Yang J J,Wang C,Ma J,Yang J,Liu G H,Zheng R,Zheng G Q. 2021.Optimization of extraction method of the cell wall protein of Lycium barbarum L.[J]. Journal of Southern Agriculture,52(9):2534-2542.] doi:10.3969/j.issn.2095-1191.2021.09.024.
张宇航,高扬,李文红,杨卓,温晴宇,徐鹏. 2020. 低温停食和复温后投喂频率对奥尼罗非鱼幼鱼生长的影响[J]. 西南农业學报, 33(9):2125-2131. [Zhang Y H,Gao Y,Li W H,Yang Z,Wen Q Y,Xu P. 2020. Effects of feeding frequency after food deprivation with low temperature and rewarming on growth of hybrid tilapia juvenile (Oreochromis niloticus×O. aureus)[J]. Southwest China Journal of Agricultural Sciences,33(9):2125-2131.] doi:10.16213/j.cnki.scjas.2020.9.036.
朱傳忠,孙陆宇,解文丽,易敢峰. 2018. 3种饲料添加剂对吉富罗非鱼幼鱼生长性能、消化酶活性和肝、肠组织结构的影响[J]. 淡水渔业,48(2):94-99. [Zhu C Z,Sun L Y,Xie W L,Yi G F. 2018. Effects of 3 feed additives on the growth performance,digestive enzyme activity,liver and intestine histological structure for the juvenile genetically improved farmed tilapia,Oreochromis niloticus[J]. Freshwater Fisheries,48(2):94-99.] doi:10.3969/j.issn. 1000-6907.2018.02.014.
Armstrong S M,Hargrave B T,Haya K. 2005. Antibiotic use in finfish aquaculture: Modes of action, environmental fate,and microbial resistance[J]. Environmental Effects of Marine Finfish Aquaculture,(5):341-357. doi:10.1007/b136017.
Behera B K,Pradhan P K,Swaminathan T R,Sood N,Paria P,Das A,Verma D K,Kumar R,Yadav M K,Dev A K. 2018. Emergence of tilapia lake virus associated with mortalities of farmed Nile tilapia Oreochromis niloticus (Linnaeus 1758) in India[J]. Aquaculture,484(1):168-174. doi:10.1016/j.aquaculture.2017.11.025.
Brum A,Pereira S A,Cardoso L,Chagas E C,Chaves F C M,Mouriño J L P,Martins M L. 2018. Blood biochemical parameters and melanomacrophage centers in Nile tilapia fed essential oils of clove basil and ginger[J]. Fish and Shellfish Immunology,74:444-449. doi:10.1016/j.fsi. 2018.01.021.
Caspary W F. 1992. Physiology and pathophysiology of intestinal absorption[J]. American Journal of Clinical Nutrition,55(1):299S-308S. doi:10.1093/ajcn/55.1.299s.
Citarasu T. 2010. Herbal biomedicines:A new opportunity for aquaculture industry[J]. Aquaculture International,18(3):403-414. doi:10.1007/s10499-009-9253-7.
Elabd H,Wang H P,Shaheen A,Yao H,Abbass A. 2016. Feeding Glycyrrhiza glabra(Liquorice) and Astragalus membranaceus(AM) alters innate immune and physiological responses in yellow perch (Perca flavescens)[J]. Fish and Shellfish Immunology,54:374-384. doi:10.1016/ j.fsi.2016.04.024.
Eman Z,Engy R,Fatma A,Hebata A M,Tarek I. 2014. Effects of dietary Astragalus polysaccharides(APS) on growth performance,immunological parameters,digestive enzymes,and intestinal morphology of Nile tilapia (Oreochromis niloticus)[J]. Fish and Shellfish Immunology,38:149-157. doi:10.1016/j.fsi.2014.03.002.
He M S,Liu G Y,Liu Y H,Yang K C,Qi X Z,Huang A G,Liu T Q,Wang G X,Wang E L. 2020. Effects of geniposide as immunostimulant on the innate immune response and disease resistance in crucian carp[J]. Aquaculture,529(2):735713. doi:10.1016/j.aquaculture.2020.735713.
Hien V D,Seyed H H,Preetham E,Sudaporn T,Chanagun C,Sanchai J,Sompong D. 2018. Effects of orange peels derived pectin on innate immune response,disease resistance and growth performance of Nile tilapia(Oreochromis niloticus) cultured under indoor biofloc system[J]. Fish and Shellfish Immunology,80:56-62. doi:10.1016/j.fsi.2018.05.049.
Huang Z F,Lu J,Ye Y L,Xu A L,Li Z B. 2020. Effects of dietary Chinese herbal medicines mixture on growth performance,digestive enzyme activity and serum biochemical parameters of European eel,Anguilla anguilla[J]. Aquaculture Reports,18:100510. doi:10.1016/j.aqrep. 2020.100510.
Liu W,Wu J P,Li Z,Duan Z Y,Wen H. 2018. Effects of dietary coated protease on growth performance,feed utilization,nutrient apparent digestibility,intestinal and hepatopancreas structure in juvenile Gibel carp (Carassius auratus gibelio)[J]. Aquaculture Nutrition,24(1):47-55. doi:10.1111/anu.12531.
Long L N,Kang B J,Jiang Q,Chen J S. 2020. Effects of die-tary Lycium barbarum polysaccharides on growth performance, digestive enzyme activities,antioxidant status, and immunity of broiler chickens[J]. Poultry Science,99(2):744-751. doi:10.1016/j.psj.2019.10.043.
Manage P M. 2018. Heavy use of antibiotics in aquaculture: Emerging human and animal health problems—A review[J]. Sri Lanka Journal of Aquatic Sciences,23:13-27. doi:10.4038/sljas.v23i1.7543.
Mesalhy A S,Albutti A. 2014. Antimicrobials use in aquaculture and their public health impact[J]. Journal of Aquaculture Research & Development,5(4):1000247. doi:10.4172/2155-9546.1000247.
Mohamed S H,Eman Y M,Mohamed R S,Amina A S A R. 2019. Exogenous xylanase improves growth,protein digestibility and digestive enzymes activities in Nile tilapia,Oreochromis niloticus,fed different ratios of fish meal to sunflower meal[J]. Aquaculture Nutrition,25(4):841-853. doi:10.1111/anu.12903.
Radhakrishnan S,Saravana P,Bhavan C,Seenivasan R,Shanthi R. 2014. Influence of medicinal herbs (Alteranthera sessilis,Eclipta alba and Cissus quadrangularis) on growth and biochemical parameters of the freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture International,22(2):551-572. doi:10.1007/s10499-013-9666-1.
Smirnov A,Sklan D,Uni Z. 2004. Mucin dynamics in the chick small intestine are altered by starvation[J]. The Journal of Nutrition,134(4):736-742. doi:10.1111/j. 1365-277X.2004.00513.x.
Talarico L B,Pujol C A,Zibetti R,Faría P,Noseda M D,Duarte M,Damonte E B. 2005. The antiviral activity of sulfated polysaccharides against dengue virus is dependent on virus serotype and host cell[J]. Antiviral Research,66(2-3):103-110. doi:10.1016/j.antiviral.2005.02.001.
Tan X H,Sun Z Z,Ye C X,Lin H Z. 2019. The effects of die-tary Lycium barbarum extract on growth performance,liver health and immune related genes expression in hybrid grouper (Epinephelus lanceolatus ♂×E. fuscoguttatus♀) fed high lipid diets[J]. Fish and Shellfish Immunology,87:847-852. doi:10.1016/j.fsi.2019.02.016.
Wing Y M,Clare H I L,Wai M C,Yu B M,Ming H W. 2016. Enhancing growth and non-specific immunity of grass carp and Nile tilapia by incorporating Chinese herbs (Astragalus membranaceus and Lycium barbarum) into food waste based pellets[J]. Environmental Pollution,219:475-482. doi:10.1016/j.envpol.2016.05.055.
Xin Y,Virender K S,Hui L. 2019. Environmental antibiotics and antibiotic resistance: from problems to solutions[J]. Frontiers of Environmental Science & Engineering,13(3):47-47. doi:10.1007/s11783-019-1137-0.
Zhang L,Wu Y L,Xu H L,Yao Y F. 2017. Effects of oxidized konjac glucomannan on the intestinal microbial flora and intestinal morphology of Schizothorax prenanti[J]. Aquaculture International,25(1):233-250. doi:10.1007/s10499-016-0025-x.
(責任编辑 兰宗宝)

