基于主成分分析的青熟酸枣果肉初生及次生代谢产物差异变化的研究
杨兴晶,刘妍如*,唐志书*,宋忠兴,常百金,赵艳婷,赵梦利
1陕西中医药大学 陕西省中药资源产业化协同创新中心 陕西省中药基础与新药研究重点实验室,咸阳 712083;2长春中医药大学,长春 130117
酸枣(Ziziphusjujubavar.spinosa)隶属于鼠李科(Rhamnaceae)枣属(Ziziphus)木本植物[1],酸枣果肉、酸枣仁和酸枣叶等产品都有很高的药用价值。《神农本草经》记载酸枣果肉可以作为药用,其具有止血止泻的功能,主治出血、腹泻等症状[2]。相比酸枣仁,酸枣果肉不仅具有药用价值还具有较高的营养价值,酸枣果肉中含有丰富的维生素C[3]、可溶性糖、蛋白质、氨基酸、小分子有机酸、萜类及皂苷类、黄酮类[4]、生物碱类[5]等成分,其中有镇静、催眠活性的三萜皂苷类化合物的含量高于酸枣仁[6]。
酸枣果肉具有改善睡眠、保肝、抗肿瘤、调节免疫力及改善心脑血管疾病[4]、抗氧化[7]等药理作用,可开发甜味抑制、抗抑郁、保肝、抗菌等产品[6]。
已有研究发现,中药材在不同的生长阶段,其体内的成分类型以及含量都会发生很大的变化,造成此种现象的原因可能由于药材植株或果实在生长的过程中,由于光照、水分以及外部条件刺激的不同,进而影响其体内次生代谢产物合成[8,9]。Xiang等[10]对不同生长阶段的贯叶金丝桃进行测定,利用PCA分析出不同生长阶段的贯叶金丝桃药材的最佳采收阶段;Yan等[11]检测了不同成熟期的枣果营养物质含量,分析了枣果成熟过程中营养物质变化规律,结果都可系统、全面地评价药材的质量且为其适宜采收期提供科学依据。测定不同生长阶段药材中的成分类型,可确定其采收期,提高药材中主要有效成分的含量,增强其药用疗效,还可为药材质量提供参考[12]。酸枣果肉在使用方面主要以果汁液体饮料为主[13],不同成熟度的酸枣果肉成分类型对饮料风味也有很大的影响。因此,分析不同成熟期酸枣果肉成分类型差异对成分分析、质量控制和采收期有重要意义。
本研究采收了红果期熟酸枣和青果期青酸枣。以UPLC-Q-TOF-MS/MS技术对青、熟酸枣果肉的主要成分类型进行分析,并结合PCA主成分分析方法,计算两个青、熟酸枣果肉中的初生代谢物的差异,对差异初生代谢物与次生代谢物进行含量测定,最后通过差异代谢物含量差异对生物合成途径的进行分析。
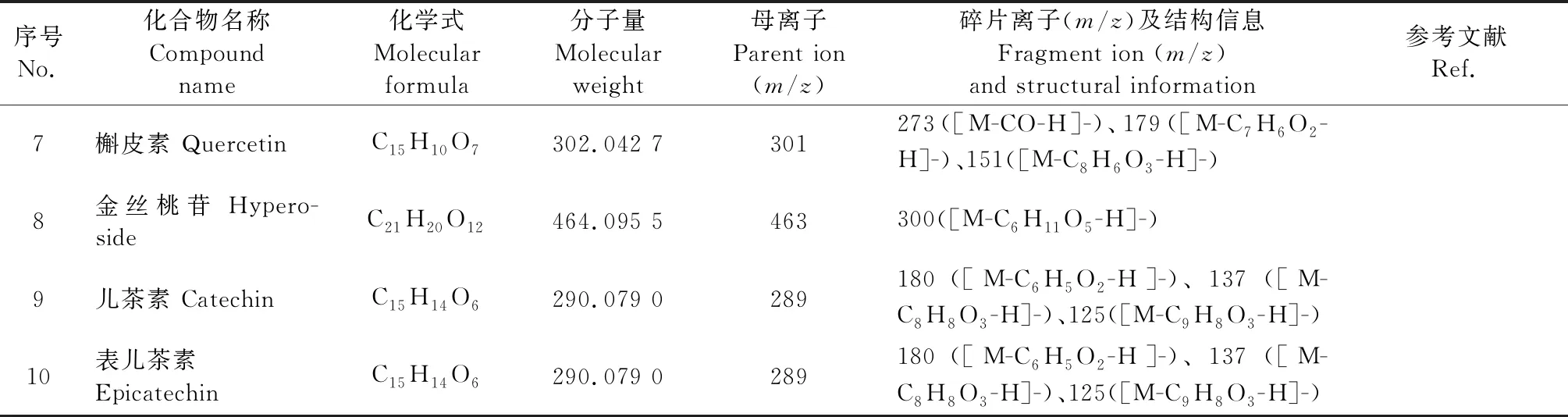
1 材料与方法
1.1 仪器
Agilent1290型高效液相色谱(美国Agilent公司);AB SCIEX 4500 Qtrap三重四级杆线性离子阱质谱仪(美国AB SCIEX公司);Waters ACQUITY UPLC H-Class型超高效液相色谱(美国Waters公司);Triple TOFTM5600三重四级杆飞行时间质谱仪(美国AB SCIEX公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司);十万分之一电子天平(Sartorius科学仪器有限公司);VaCo5型冷冻干燥机(德国Zirbus公司);电热恒温水浴锅(北京中兴伟业仪器有限公司);TQ-200高速多功能粉碎机(上海市天祺盛世科技有限公司),Milli-Q水纯化系统(美国Millipore公司)。
1.2 材料
对照品表儿茶素(批号MUST-17060114,纯度99.51%)购自成都曼斯特生物科技有限公司;儿茶素(批号HC019123198,纯度98%)购自宝鸡辰光生物科技有限公司;齐墩果酸(批号wkq16051205,纯度98%)购自四川省维克奇生物科技有限公司;金丝桃苷(批号111521-201809,纯度94.9%)、芦丁(批号100080-201811,纯度91.7%)、槲皮素(批号100081-201610,纯度99.1%)、熊果酸(批号110742-201421,纯度93.8%)、酸枣仁皂苷B(批号110814-201809,纯度96.2%)购自中国食品药品检定研究院;L-酪氨酸(批号0609-0109)、L-苯丙氨酸(批号624-200104)购自中国药品生物制品检定所。无水乙醇(分析级,安徽安特食品股份有限公司);甲醇(分析级,成都市科隆化学品有限公司);乙腈(色谱级,德国Merck公司);甲醇(色谱级,德国Merck公司);甲酸(批号:H158A,美国Sigma-Aldrich公司);水为超纯水(密理博Milli-Q Integral 5超纯水机制备)。
样品为青果期青酸枣果实与红果期熟酸枣果实(见表1),经陕西中医药大学药学院白吉庆副教授鉴定为鼠李科枣属植物酸枣Zizyphusjujubavar.spinosa的果实。
表1 青、熟酸枣样品的批号及产地
1.3 干燥方法
取各批次红果期熟酸枣果实和青果期青酸枣果实进行清洗,分别取各批次两种果实适量,将果肉与果核分开,留下果肉进行标记,装入不锈钢托盘中均匀摊开,所有样品先进行-80 ℃冷冻处理6 h以上,再将冷冻后的样品放入冷冻干燥仪进行冷冻干燥72 h,干燥后粉碎,过4号筛,记为熟酸枣果肉(SSZ)和青酸枣果肉(QSZ),装袋保存。部分分类如图1所示。

图1 青、熟酸枣果实样品
1.4 溶液的制备
1.4.1 对照品溶液的制备
分别精密称取儿茶素1.52 mg、表儿茶素1.48 mg、槲皮素1.46 mg、金丝桃苷1.54 mg、芦丁1.36 mg、酸枣仁皂苷 B 0.97 mg、齐墩果酸1.38 mg、熊果酸1.10 mg、L-苯丙氨酸1.02 mg、L-酪氨酸0.52 mg对照品置4 mL离心管中,分别加甲醇1.52、1.48、1.46、1.54、1.36、0.97、1.38、1.10、1.02、0.52 mL制成质量浓度为1 mg/mL的对照品溶液,于4 ℃条件下保存备用。
1.4.2 供试品溶液的制备[14]
各精密称取“1.3”项下熟酸枣果肉药材粉末、青酸枣果肉药材粉末约1.0 g(过4号筛),分别置于100 mL锥形瓶中,精密加入70%乙醇20 mL,称定质量,加热回流2 h,放至室温,用70%乙醇补足减失质量,滤过,滤渣用70%乙醇5 mL洗涤,合并洗液与滤液,回收溶剂至干,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,取续滤液,用0.22 μm微孔滤膜滤过,即得供试品溶液。
1.5 成分表征色谱条件
1.5.1 液相条件
采用5600型质谱仪进行成分表征,色谱柱为ACQUITY UPLC®BEH C18柱(50 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸-水溶液(A)-乙腈(B),梯度洗脱程序:0~1 min,5% B;1~30 min,5%→95% B;30~35 min,95% B;35~38 min,95%→5% B;38~40 min,5% B;体积流量为0.3 mL/min;进样量为5 μL;柱温35 ℃;检测波长254 nm。
1.5.2 质谱条件
离子源为电喷雾离子源(ESI),正负离子模式下,采用信息依赖采集(IDA)、动态背景扣除(DBS)和高灵敏度模式采集数据。离子扫描范围m/z100~2 000,正离子模式下源喷射电压(ion spray voltage floating)为5 500 V,负离子模式下源喷射电压为-4 500 V,裂解电压(declustering potential,DP)为80 V,碰撞能量(collision energy,CE)为35 eV,正负离子模式下,雾化气(ion source gas 1,GS1)和辅助气(ion source gas 2,GS2)为氮气,均为50 psi,气帘气(curtain gas,CUR)为35 psi,雾化温度(temperature,TEM)500 e。
1.6 定量色谱条件
1.6.1 液相条件
采用4500型质谱仪进行成分定量,色谱柱为ACQUITY UPLC®B×H C18柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸-水溶液(A)-乙腈溶液(B),梯度洗脱程序为0~11 min,98%→70% A;11~13 min,70%→65% A;13~16 min,65%→55% A;16~19 min,55%→35% A;19~22 min,35%→15% A;22~26min,15%→0% A;26~32 min,0% A;32~35 min,0%→98% A;35~40 min,98% A。柱温30 ℃;流速为0.3 mL/min,进样量为2 μL。
1.6.2 质谱条件
定量质谱分析采用ESI负离子模式进行扫描,检测模式为多反应检测(MRM)。离子化参数为离子喷雾电压,负离子模式-4 500 V;雾化气和辅助气为氮气;离子源温度550 ℃,辅助气GS1,GS2温度为60 ℃,气帘气温度35 ℃,离子扫描范围:100~1 000 Da,扫描速率:200 Da/s,化合物离子对,优化后的采集参数:去簇电压(declustering potential,DP)、碎裂能量(collision energy,CE)和碰撞池出口电压(cell exit potential,CXP)等信息见表2,标准化合物、样品、甲醇空白MRM提取离子流谱图见图2。

表2 青熟酸枣果肉中10种黄酮类、氨基酸、萜类化合物多反应检测参数

图2 青熟酸枣果肉空白、样品及10种对照品负离子模式MRM提取离子图
1.7 统计分析
SPSS 26.0用于统计分析。所有数据均以平均值±标准差表示。组间数据的比较采用独立样本t检验。所有的图表都是用GraphPad Prism 8绘制的,P<0.05表示有统计学意义的差异。
2 结果
2.1 成分表征
青、熟酸枣果肉化学成分表征IDA二级质谱总离子流图见图3。通过Peakview 2.2查看采集数据,以AB SCIEX master view 1.1.0.0中药成分数据库(TCM library 1.0)作为青酸枣果肉和熟酸枣果肉的成分匹配库。通过比对精确质量数、同位素峰度比以及碎片离子裂解规律等信息,初步鉴定出青酸枣果肉和熟酸枣果肉中共有的32个化学成分,其中对10个重要成分进行分析(见表3)。
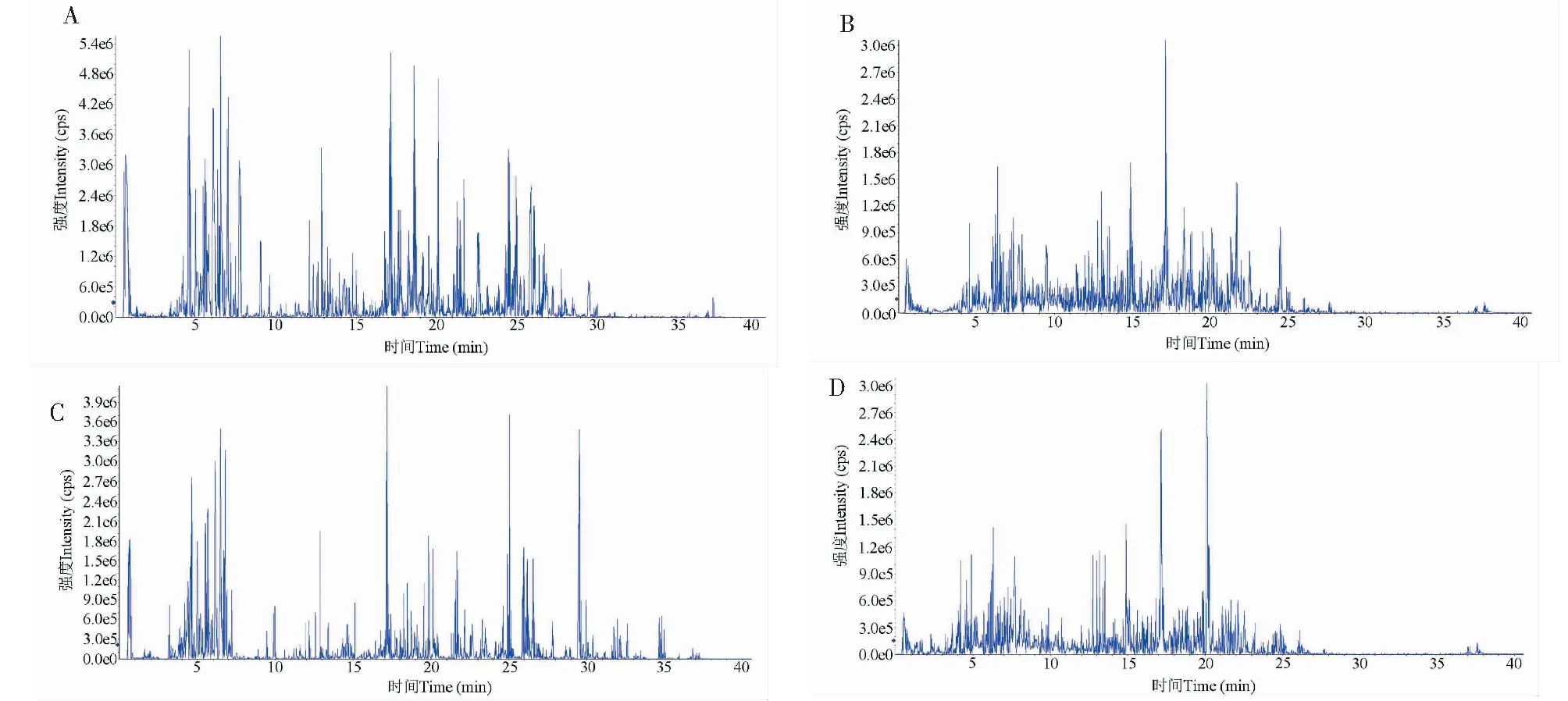
图3 青、熟酸枣果肉化学成分表征IDA二级质谱总离子流图

表3 青、熟酸枣果肉中10个重要共有确定的成分
续表3(Continued Tab.3)
2.2 酸枣果肉差异性成分聚类分析及PCA
2.2.1 聚类分析
为了初步说明样品与样品间是否存在一定关系,本研究选用Cluster Analysis聚类分析进行建模分析。首先对青、熟酸枣果肉样品进行色谱分析,再将处理后的峰面积导入MetaboAnalyst分析平台(https://www.metaboanalyst.ca/),最后采用Cluster Analysis聚类分析方法,对各批数据进行聚类分析,得到树状图结果见图4A。结果表明,青、熟酸枣果肉样品主要分为2类,青酸枣果肉样品归为一类、熟酸枣果肉样品聚为一类。说明青酸枣果肉和熟酸枣果肉的样品在成分上存在一定的差异。

图4 青、熟酸枣果肉聚类与PCA、KEGG结果
2.2.2 PCA
为了更直观地评价模型对样品的分类能力,对各样品数据进行降维处理,通过MetaboAnalyst分析平台,采用PCA方法观察样品差异情况。本研究对青、熟酸枣果肉样品进行成分鉴定与色谱分析,将测定后的青酸枣、熟酸枣相同的成分的峰面积进行处理,将处理并分组后的数据进行采用PCA主成分分析,对各批数据进行主成分分析。
结果得到2个最大特征值的主成分1和主成分2。主成分1第一主成分的贡献率为88.7%,包含差异信息最多,模型拟合能力较好。选取此2个主成分进行模型预测能够反映不同成熟度样品的基本特征。以此2个主成分建立投影,得到散点图(见图4B)。由图可以看出所有青酸枣果肉样品聚在一起,所有熟酸枣果肉样品聚在一起,这一结果与聚类分析结果一致。说明青、熟酸枣果肉在成分上有明显的差异。通过MetaboAnalyst分析平台将处理后的数据进行t检验(P<0.05)与差异代谢物KEGG通路富集分析,t检验得到48个差异代谢物(见图4C、表4),差异代谢物KEGG通路富集分析得到14条代谢途径(见图4D)。结果得到2个重要的差异代谢物L-苯丙氨酸与L-酪氨酸与3个重要代谢途径:苯丙氨酸、酪氨酸和色氨酸的生物合成代谢、苯丙氨酸代谢与酪氨酸代谢。

表4 青熟酸枣果肉中48个差异代谢物
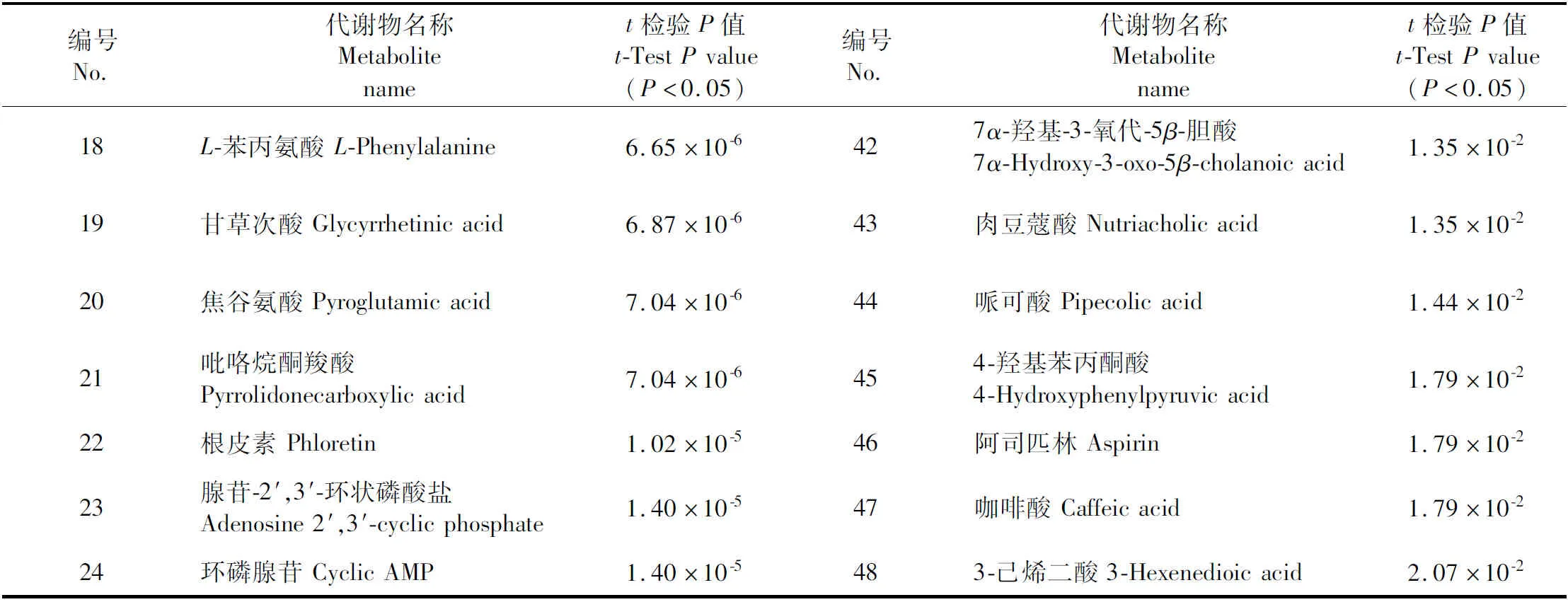
续表4(Continued Tab.4)
2.3 差异代谢物定量方法学考察
根据PCA分析中得到的差异代谢物信息,对已鉴定得到的重要差异初生代谢物及其次生代谢物进行定量方法学考察。
2.3.1 标准曲线、定量限和检测限试验
精密吸取“1.4.1”项下标准工作溶液,配制为不同体积的混合标准溶液,按照优化的液质条件进行测定。将混合标准溶液按梯度体积稀释,精密吸取9个稀释成不同质量浓度梯度的混合对照品溶液,分别注入液相色谱仪,记录色谱图,以标准溶液中化合物浓度(μg/mL)横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,计算各成分的回归方程和线性范围。酸枣果肉中10个不同化合物的线性范围为0.002 3~800.00 μg/mL,且相关系数均大于0.999,表明各对照品线性关系良好。各种化合物的线性方程、相关系数、线性范围及方法定量限、检测限见表5。

表5 10种黄酮类、氨基酸、萜类化合物同时测定方法线性方程、线性范围、定量限和检测限结果
2.3.2 精密度试验
取同一酸枣果肉的供试品溶液,按“1.6.1”项下色谱条件连续进样6次,测得儿茶素、表儿茶素、槲皮素、金丝桃苷、芦丁、酸枣仁皂苷B、齐墩果酸、熊果酸、L-酪氨酸、L-苯丙氨酸各色谱峰的峰面积,计算酸枣果肉中10种化合物峰面积的RSD在1.92%~6.18%之间,表明仪器精密度良好。
2.3.3 稳定性试验
取同一酸枣果肉的供试品溶液,按“1.6.1”项下色谱条件分别于制备后0、2、4、6、10、14、20、24 h进样,测得儿茶素、表儿茶素、槲皮素、金丝桃苷、芦丁、酸枣仁皂苷B、齐墩果酸、熊果酸、L-酪氨酸、L-苯丙氨酸各色谱峰面积,计算酸枣果肉中10种化合物峰面积的RSD在1.15%~6.45%之间,表明供试品溶液在24 h内稳定性良好。
2.3.4 重复性试验
取同一酸枣果肉药材粉末5份,按“1.4.2”项下方法平行制备供试品溶液5份,按“1.6.1”项下色谱条件,进样,测得儿茶素、表儿茶素、槲皮素、金丝桃苷、芦丁、酸枣仁皂苷B、齐墩果酸、熊果酸、L-酪氨酸、L-苯丙氨酸各色谱峰面积,计算酸枣果肉中10种化合物峰面积的RSD在1.48%~3.04%之间,表明此方法重复性良好。
2.3.5 加样回收率试验
精密量取已知含量同一酸枣果肉的供试品溶液各0.5 mL,分别精密加入与酸枣果肉样品含量等同量的混合对照品(儿茶素、表儿茶素、槲皮素、金丝桃苷、芦丁、酸枣仁皂苷B、齐墩果酸、熊果酸、L-酪氨酸、L-苯丙氨酸),在“1.6.1”项色谱条件下进样,计算加样回收率。各成分含量、加入量以及最后得到的平均回收率和RSD的结果均见表6。

表6 10种黄酮类、氨基酸、萜类化合物同时测定加样回收率试验结果(n=6)
2.4 差异成分含量测定
为了更准确地应用定性数据,针对PCA分析中得到的差异代谢物信息,将已鉴定得到的差异初生代谢物及其次生代谢物进行定量分析,以精确研究青酸枣果肉与熟酸枣果肉成分的差异性,按“1.6.1”项下的色谱条件和“1.6.2”项下的质谱条件,采用多反应离子监测(MRM)模式进行定量分析(见表2),结果见图5。
含量测定结果得到青、熟酸枣果肉中差异初生代谢物及其次生代谢物(黄酮类化合物)的含量有较大差异(P<0.01),三萜类成分熊果酸有差异但无统计学意义(P>0.05),酸枣仁皂苷B及齐墩果酸的含量有差异(P<0.05)(见图5),此结果与PCA分析结果一致。
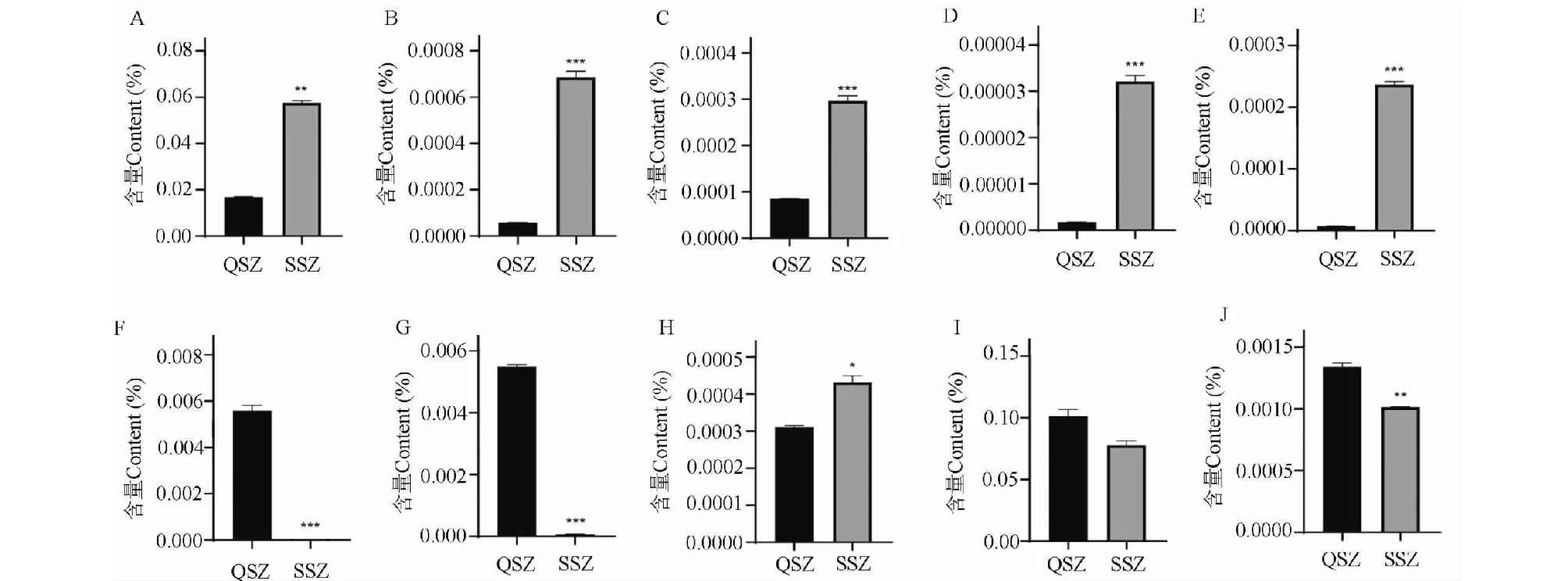
图5 青、熟酸枣果肉中10种黄酮类、氨基酸、萜类化合物含量测定结果
3 讨论
3.1 酸枣中黄酮类成分的生物合成途径分析及验证
根据“2.1”成分表征得到5个黄酮类成分,分别为芦丁、槲皮素、金丝桃苷、儿茶素、表儿茶素。黄酮类成分的合成主要以L-苯丙氨酸和L-酪氨酸为前体物质通过不同的分支合成途径合成黄酮类成分[17](见图6),通过对青酸枣果肉和熟酸枣果肉的代谢产物分析,得到两个果肉中的L-苯丙氨酸和L-酪氨酸的含量有区别,熟酸枣果肉中的两种代谢物的含量大于青酸枣果肉,通过含量测定得到熟酸枣果肉中芦丁、金丝桃苷、槲皮素的含量要大于青酸枣果肉中的含量,也进一步地验证了在酸枣果肉中,由青酸枣到熟酸枣变熟过程中黄酮类成分有明显的变化。

图6 黄酮类化合物合成途
但儿茶素和表儿茶素的含量在熟酸枣果肉中含量均降低,主要是因为儿茶素和表儿茶素主要分布在果实的果皮中,表儿茶素具有较强的涩味,儿茶素既具有涩味又具有苦味,是引起果实涩感的主要物质[18,19],因此在果实未成熟时含有较多的儿茶素和表儿茶素,在果实成熟的过程中儿茶素和表儿茶素的含量在逐渐降低,在果实完全成熟时含量最低,所以在青酸枣到熟酸枣的变化过程中儿茶素与表儿茶素的含量与其他黄酮类的含量呈相反变化。由于儿茶素与表儿茶素决定果实的苦涩味,说明其可为酸枣果肉在食用方面提供科学依据。
3.2 酸枣中萜类成分分析及验证
根据“2.1”成分表征得到4个三萜类成分,分别为酸枣仁皂苷B、熊果酸、齐墩果酸和白桦脂酸,通过含量测定得到熟酸枣果肉中熊果酸和齐墩果酸的含量要小于青酸枣果肉中的含量,出现此现象的原因是这两种代谢物有助于植物防御,如三萜类成分有抗真菌特性并能抗毒素产生[20],因此决定了这两种代谢物在青果中的含量要高于熟果。
4 结论
综上所述,果实类的风味变化是由儿茶素和表儿茶素的含量高低决定的,在酸枣成熟过程中儿茶素与表儿茶素呈逐渐下降的趋势,但其他黄酮类成分又呈现整体上升趋势,说明熟酸枣镇静催眠的作用可能强于青酸枣;而三萜类成分齐墩果酸和熊果酸在青酸枣果肉中的含量高于熟酸枣果肉,说明青酸枣中某些三萜类成分药理活性可能强于熟酸枣。以上研究方法和结果可以为不同成熟度酸枣果肉的成分分析、质量评价和采收期方面的研究提供技术支持和科学依据。

