老年人认知衰弱影响因素的Meta分析
瞿茜,代玲,张萍,胡婉婷
(华中科技大学同济医学院附属同济医院护理部,湖北武汉,430030)
认知衰弱指“个体同时存在躯体衰弱和轻度认知功能障碍,但排除痴呆和其他神经退行性疾病的临床综合征”[1]。研究报道[2],社区老年人认知衰弱的患病率为0.9%~12.0%,临床老年患者认知衰弱患病率高达10.7%~40.0%。认知衰弱增加了老年人发生失能、残疾、住院甚至死亡等不良健康结局的风险,给家庭和社会带来了巨大的精神压力和经济负担[3-5]。研究表明[6],认知衰弱具有可逆性与潜在可逆性,若进行早期筛查、早期干预,多数老年人能恢复正常的认知或减缓向痴呆症的进展。近年来,国内外学者对老年人认知衰弱的影响因素进行了探索[7-8],但是由于研究地区及工具等不同,研究结论不一。本研究通过对老年人认知衰弱危险因素进行Meta 分析,旨在明确老年人发生认知衰弱的危险因素,为临床预警与干预措施的制定提供参考依据。
1 资料与方法
1.1 检索策略
检索Cochrane Library、PubMed、Web of Science、EMBASE、中国知网、万方、维普和中国生物医学文献数据库,并以滚雪球的方式追溯纳入研究的参考文献。检索时限为建库至2021年4月。检索词采用主题词与自由词相结合。英文检索策略为(cogniti*OR cognitive function*)AND(asthenia OR frailt* OR frailness OR frailty syndrome OR debility*OR fatigue)AND(aged OR elderly OR seniors OR old*people OR old patients OR older adults) AND(risk factor* OR influence factor*)。中文检索策略为(认知衰弱OR 认知功能障碍)AND(老年患者OR 老年人OR 老人)AND(影响因素OR 危险因素OR 病因OR 相关因素)。此外,人工检索纳入研究的参考文献,以补充未检索到的信息。本研究已在International Platform of Registered Systematic Review and Meta-analysis Protocols 平台注册,注册号为INPLASY202180097。
1.2 文献的纳入与排除标准
纳入标准: ①纳入人群符合国际营养与衰老研究院(IANA)和国际老年医学及老年病协会(IAGG)修订的诊断标准[1],年龄≥60 周岁;②研究内容为老年人认知衰弱的影响因素;③研究类型为横断面研究、病例对照研究和队列研究;④语言限定为中文、英文。排除标准:①重复发表;②灰色文献、无法获取全文、信息不全或无法进行数据提取的研究。
1.3 文献的筛选与资料提取
由2 名具有循证护理学研究背景的研究者独立完成文献检索、筛选与信息提取,出现疑问或意见不一致时,讨论后决定或咨询第三方协助判断,缺乏的资料与作者取得联系予以补充,若最终无法获得相关数据,则剔除该文献。资料提取内容包括:作者、年份、研究地点、样本量、研究类型、涉及危险因素等。
1.4 文献的质量评价
由2 名研究人员独立对文献进行质量评价,横断面研究采用美国医疗健康研究与质量管理机构(agency for healthcare research and quality,AHRQ)[9]推荐的评价标准对文献进行质量评价,该标准包括11 个条目,总分为11 分,0~3 分为低质量研究,4~7分为中质量研究,8~11 分为高质量研究。队列研究、病例对照研究采用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)[10]对文献进行评价,NOS 量表包括研究人群的选择、可比性、结局的评定9 个条目,量表总分为9 分,0~3 分为低质量研究,4~6 分为中质量研究,7~9 分为高质量研究。
1.5 统计学方法
采用RevMan 5.3 软件进行Meta 分析。提取原始数据,对不同类型的数据全部转换为比值比(odds ratio,OR)作为效应指标,区间估计采用95%可信区间(95%CI)表示。使用Chi-square(I2)检验研究间异质性,若P≥0.1,I2≤50%,提示研究间具有同质性,采用固定效应模型进行合并分析;若P<0.1,I2>50%,提示研究间具有异质性,分析异质性来源,排除后采用随机效应模型分析,必要时进行亚组分析或敏感性分析,或只进行描述性分析。采用Egger 检验评估是否存在发表偏倚。
2 结果
2.1 文献检索结果
检索出相关文献1 300 篇,NoteExpress 去重后获得文献1 259 篇,阅读题目和摘要后,排除与主题不符、研究类型不符、无法获取全文的文献1 173 篇,进一步查找并阅读全文,最终纳入12 篇[4,8,11-20]文献(见图1),其中英文文献10 篇[4,11-18,20],中文文献2 篇[8,19]。

图1 文献筛选流程及结果
2.2 纳入文献的基本特征及方法学质量评价
共纳入12 篇文献[4,8,11-20],其中7 篇文献[4,12-13,15-17,20]为中等质量,5 篇文献[8,11,14,18-19]为高等质量,文献质量符合要求。纳入文献的基本特征及方法学质量评价结果见表1。

表1 纳入文献的基本特征及方法学质量评价
2.3 Meta 分析结果
2.3.1 高龄 6 篇文献[8,11-13,16,20]报告了高龄对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P<0.001,I2=89%),经敏感性分析,KATAYAMA 等[12]和RIVAN 等[20]的研究是异质性的主要来源,排除此两项研究后不存在异质性(P=0.43,I2=0%),采用固定效应进行分析。结果显示,高龄是老年人发生认知衰弱的危险因素[OR=2.96,95%CI=(2.17,4.03),P<0.001],见图2。

图2 年龄与老年认知衰弱关系的森林图
2.3.2 女性 3 篇文献[8,11,17]报告了女性对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间不存在异质性(P=0.370,I2=0%),采用固定效应模型进行分析。结果显示,女性是老年人发生认知衰弱的危险因素[OR=2.14,95%CI=(1.20,3.81),P=0.010],见图3。
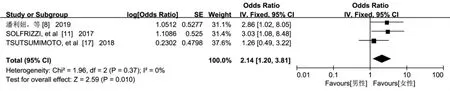
图3 性别与老年认知衰弱关系的森林图
2.3.3 低文化水平 3 篇文献[4,13,19]报告了低文化程度对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P=0.030,I2=71%),经敏感性分析,SHIMADA 等[4]的研究是异质性的主要来源,排除此项研究后不存在异质性(P=0.370,I2=0%),采用固定效应进行分析。结果显示,低文化水平是老年人发生认知衰弱的危险因素[OR=1.74,95%CI=(1.17,2.58),P=0.006],见图4。

图4 文化程度与老年认知衰弱关系的森林图
2.3.4 营养不良 3 篇文献[14-15,18]报告了营养不良对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P<0.001,I2=97%),经敏感性分析,LIU 等[18]的研究是异质性的主要来源,排除此项研究后不存在异质性(P=0.430,I2=0%),采用固定效应进行分析。结果显示,营养不良是老年人发生认知衰弱的危险因素[OR=6.13,95%CI=(4.29,8.76),P<0.001],见图5。
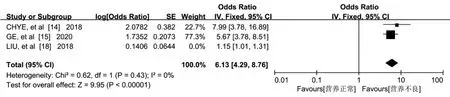
图5 营养状况与老年认知衰弱关系的森林图
2.3.5 缺乏运动 4 篇文献[8,13,16,19]报告了缺乏运动对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P=0.040,I2=65%),经敏感性分析,潘利妞等[8]的研究是异质性的主要来源,排除此项研究后不存在异质性(P=0.360,I2=3%),采用固定效应进行分析。结果显示,缺乏运动是老年人发生认知衰弱的危险因素[OR=2.39,95%CI=(1.76,3.25),P<0.001],见图6。

图6 运动与老年认知衰弱关系的森林图
2.3.6 跌倒史 4 篇文献[4,13,15,17]报告了跌倒史对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P=0.070,I2=57%),经敏感性分析,MA 等[13]的研究是异质性的主要来源,排除此项研究后不存在异质性(P=0.690,I2=0%),采用固定效应进行分析。结果显示,跌倒史是老年人发生认知衰弱的危险因素[OR=1.94,95%CI=(1.44,2.63),P<0.001],见图7。
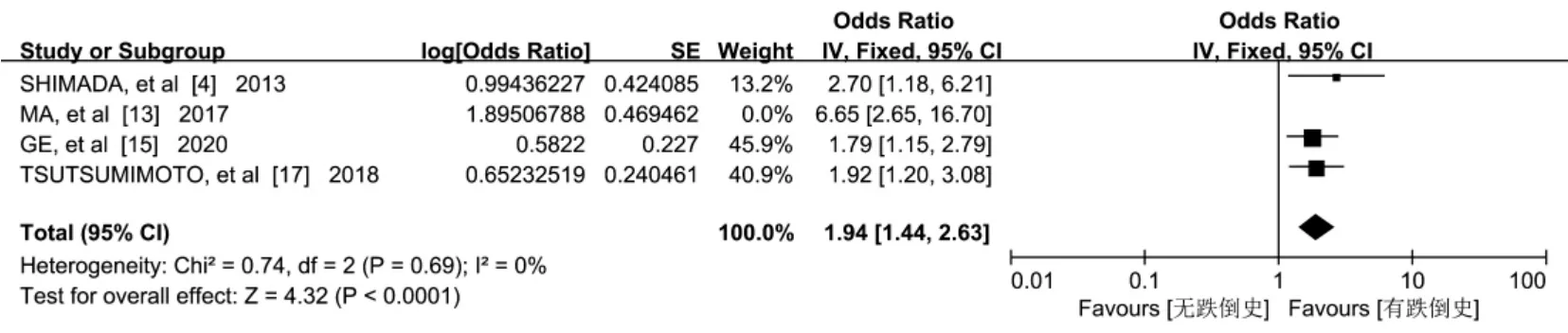
图7 跌倒史与老年认知衰弱关系的森林图
2.3.7 糖尿病 2 篇文献[12,17]报告了糖尿病对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间不存在异质性(P=0.960,I2=0%),采用固定效应模型进行分析。结果显示,糖尿病是老年人发生认知衰弱的危险因素[OR=1.47,95%CI=(1.12,1.93),P=0.005],见图8。

图8 糖尿病与老年认知衰弱关系的森林图
2.3.8 多病共存 4 篇文献[13,15-16,19]报告了多病共存对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P<0.001,I2=84%),经敏感性分析,MA 等[13]和XIE 等[16]的研究是异质性的主要来源,排除此两项研究后不存在异质性(P=0.600,I2=0%),采用固定效应进行分析。结果显示,多病共存是老年人发生认知衰弱的危险因素[OR=2.55,95%CI=(1.69,3.85),P<0.001],见图9。
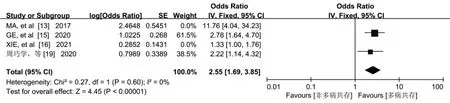
图9 多病共存与老年认知衰弱关系的森林图
2.3.9 睡眠障碍 2 篇文献[15-16]报告了睡眠障碍对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间不存在异质性(P=0.920,I2=0%),采用固定效应模型进行分析。结果显示,睡眠障碍是老年人发生认知衰弱的危险因素[OR=1.80,95%CI=(1.25,2.59),P=0.002],见图10。

图10 睡眠障碍与老年认知衰弱关系的森林图
2.3.10 抑郁 6 篇文献[13,15-16,18-20]报告了抑郁对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P<0.001,I2=97%),根据所应用的抑郁量表不同分为2 个亚组进行合并效应量,结果显示异质性较大(P<0.001,I2=96.9%),故暂不行Meta分析,见图11。
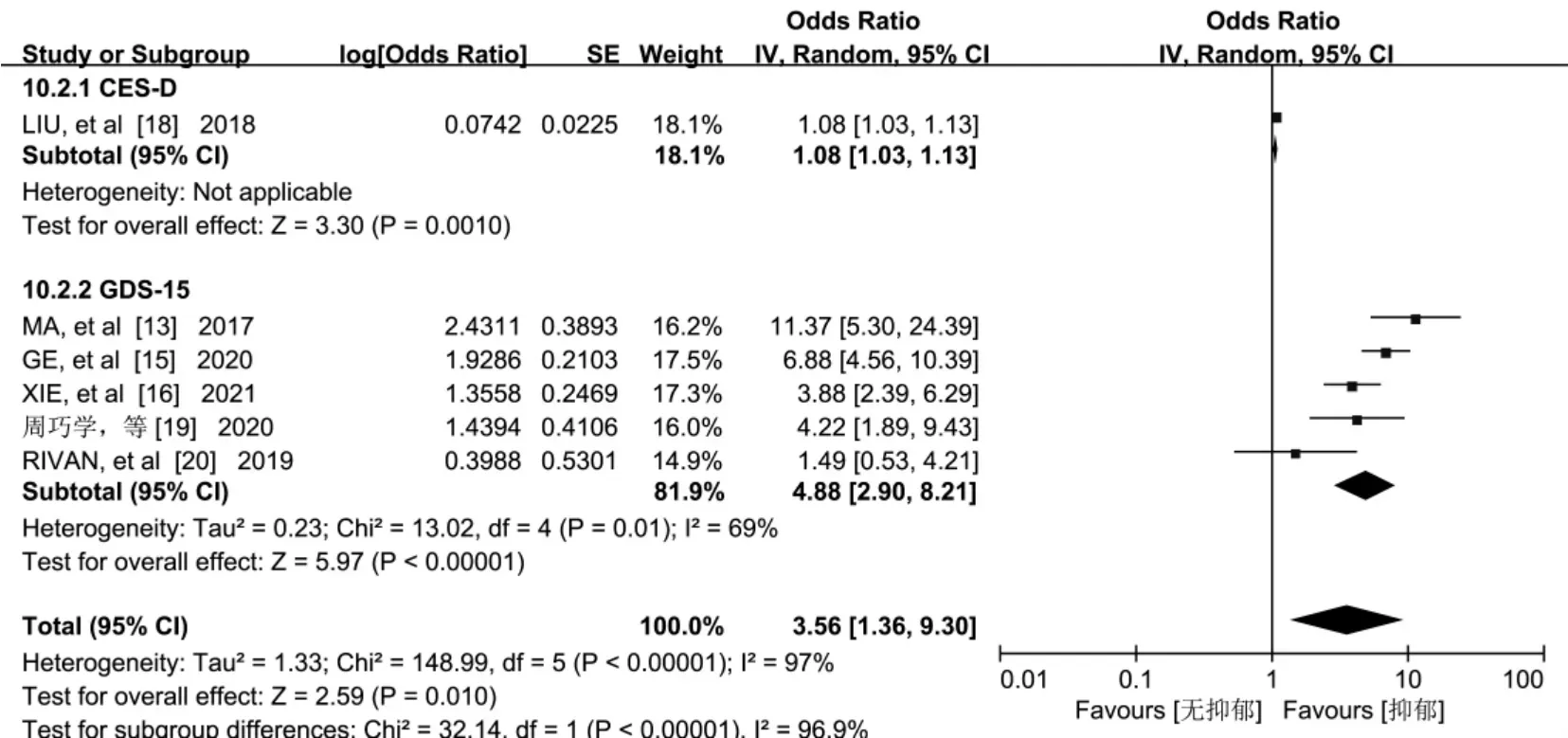
图11 抑郁与老年认知衰弱关系的森林图
2.3.11 听力受损 2 篇文献[12-13]报告了听力受损对老年人认知衰弱的影响,Meta 分析结果显示,研究结果间存在异质性(P=0.020,I2=82%),采用随机效应模型进行分析。结果显示,听力受损不是老年人发生认知衰弱的危险因素[OR=1.82,95%CI=(0.61,5.47),P=0.29],见图12。

图12 听力受损与老年认知衰弱关系的森林图
2.4 发表偏倚
采用Egger 检验对单个指标纳入文献超过5 篇的研究进行发表偏倚分析,结果显示P>0.05,提示无明显发表偏倚。
2.5 敏感性分析
通过剔除对合并结果影响大的文献,对纳入的11 个因素分别采用固定效应模型和随机效应模型进行敏感性分析,结果显示,除“抑郁”外,其他各影响因素2 种模型合并的OR 值及其95%CI 结果比较接近,表明本研究的Meta 分析稳定性较好。
3 讨论
3.1 纳入文献的方法学质量分析
本研究纳入的横断面研究,均明确了资料的来源,严格控制了纳入与排除标准,并陈述了主要结局指标的测量方法。4 篇文献[8,14,18-19]总结了患者的应答率及数据收集的完整性,2 篇文献[8,19]对剔除的患者进行了解释,2 篇文献[14,18]进行了随访;队列研究[11]明确了资料的来源,研究对象具有代表性,可比性强,并进行了相关随访。但因纳入的研究采用的认知衰弱评价工具不尽相同,且部分危险因素纳入文献较少,可能一定程度上影响结果的可信度。尽管如此,本研究严格按照Meta 分析方法对纳入文献的资料进行分析,发表偏倚及敏感性检验结果均显示稳定性较好。总体而言,本研究纳入文献质量均较高,风险偏倚较小,结果具有较高的可信度,可为卫生保健人员制定老年人认知衰弱干预措施提供较可靠参考依据。
3.2 高龄、女性、低文化水平的老年人发生认知衰弱的风险更高
本研究结果显示,高龄与女性是认知衰弱的危险因素。随着年龄的增长,身体的各个器官都在衰老,大脑为认知衰弱的重要起源点,也经历着衰弱,具体表现为海马体萎缩,神经生理储备减少[21-22]。另外,高龄老年人身体功能下降,抵御外界各种应激的能力降低,容易发生认知衰弱。研究表明[11],老年女性认知衰弱的发生率要高于老年男性。可能原因为女性绝经后,雌激素水平下降,容易发生维生素D缺乏,神经系统的保护作用下降,影响了神经-肌肉平衡和大脑神经活动[23],导致认知衰弱的发生。
本研究结果显示,低文化水平是老年人认知衰弱的危险因素。接受教育能刺激神经系统,从而抑制脑内β 淀粉样蛋白的聚集和神经原纤维缠结的形成,因此文化程度与认知衰弱的发生率有关。另外,研究表明[24],接受高等教育的人群健康素养较高,即愿意且有能力主动获取健康知识相关信息,并会利用健康知识维持自身健康。除此之外,文化程度高的患者,用药及治疗依从性较好[25],能在一定程度上降低认知衰弱的发生率。因此,在临床护理中应更关注高龄、女性、文化程度低的老年患者,根据患者情况,制定个性化的健康教育方案,最大程度使患者了解与疾病相关的危险因素,提高患者主观能动性,从而降低认知衰弱的发生率。
3.3 合并糖尿病、营养不良、多病共存的老年人发生认知衰弱的风险更高
本研究结果表明,糖尿病老年患者发生认知衰弱的风险是非糖尿病患者的1.47 倍。一项回顾性分析发现[26],高血糖的脑卒中患者发生认知障碍的患病率更高。这主要是因为糖尿病的病理改变,导致细胞新陈代谢和神经生化紊乱,引起血管基底膜增厚,使脑部缺血缺氧,损害其认知功能[27]。另外,研究表明[28],在控制心血管疾病等混杂因素后,糖尿病患者发生大脑皮质、海马及杏仁核萎缩的风险增加,易发生认知衰弱。除此之外,随着年龄的增长,老年人合并多种慢性病的可能性增加,机体对应激反应的适应性进一步降低,可能导致认知衰弱。因此,加强糖尿病老年患者的管理,重视老年患者多病共存的现象,对降低老年人认知衰弱具有现实意义。
营养不良的老年患者能量及蛋白质摄入不足,导致骨骼肌数量及力量下降,影响躯体活动量。研究表明[29-30],营养不良与衰弱互为因果,并且与认知功能呈正相关。有专家建议,可通过营养支持改善或者维持老年衰弱患者的健康状态[31]。建议在临床中对老年人的营养状况进行监测与评估,根据老年人的营养状况制定个性化干预方案,提高干预效果,改善其营养状况。
3.4 缺乏运动、有跌倒史、睡眠障碍的老年人发生认知衰弱的风险更高
本研究结果显示,缺乏运动是老年人认知衰弱的危险因素,而有跌倒史的老年患者运动水平会大幅度下降。ÁVILA-FUNES 等[32]研究表明,缺乏运动是衰弱患者致残的促发因素。研究表明[33-34],缺乏运动既是身体衰弱的影响因素,又与认知功能障碍密切相关。运动锻炼通过减少肌肉炎性因子,促进合成代谢,增加肌肉蛋白质合成,从而增加肌肉数量,增强肌肉力量,缓解认知衰老过程[35]。有研究显示[36-38],运动锻炼是老年人认知衰弱有效的干预方式。因此,根据患者个体化认知衰弱水平及照顾需求,通过多学科全方位的干预手段,制定合理的护理措施,可延缓老年人认知衰弱的发生。
随着年龄的增长,老年人普遍睡眠深度下降,浅睡期时间延长,甚至伴有睡眠障碍。睡眠障碍可引发一系列躯体及精神心理疾病,最终导致身体衰弱及认知功能障碍。因此,应重视老年人睡眠问题,积极开展改善老年人睡眠质量的干预措施,减轻睡眠障碍对老年人健康的影响。
3.5 有待更多临床试验进一步验证的因素
本研究关于抑郁和老年人认知衰弱的Meta 分析显示异质性较大,故不进行Meta 分析。研究表明[39],衰弱和抑郁有着共同的病理机理。意大利学者SOLFRIZZI 等[11]研究显示,认知衰弱的老年人发生抑郁的比例较高,提示老年人认知衰弱可能与其心理健康相关。抑郁患者通常情绪低落,和外界接触较少,体力活动减少,甚至拒绝服用药物,从而增加认知衰弱发生的概率[4]。因此,应给予老年人更多的社会支持,丰富老年人生活,使其保持乐观、积极的生活态度,减少认知衰弱的发生。
听力受损使患者的听觉信息摄入减少,进一步影响患者的认知功能。NIRMALASARI 等[40]研究显示,60%的老年听力受损患者伴有认知功能障碍。我国学者MA 等[13]对5 708 例社区老年人进行评估,结果显示听力受损为认知衰弱的危险因素。这些结果与本研究结果不完全一致,可能与本次纳入该因素的相关研究少,异质性大等因素有关。
4 结论
通过Meta 分析发现,高龄、女性、低文化水平、合并营养不良、缺乏运动、有跌倒史、糖尿病、多病共存、睡眠障碍的老年人认知衰弱的风险较大。医护人员应及时对老年人进行评估,针对相关因素制定预防与干预措施,减少老年人认知衰弱的发生。个别危险因素纳入文献数量较少,今后有必要开展更多高质量、多中心、大样本的原始研究进行验证,以便客观、全面地评价老年人发生认知衰弱的危险因素。

