硅对秆锈菌侵染燕麦叶片病程相关蛋白活性及酚类物质代谢的影响
李英浩,刘景辉*,吕 品,米俊珍,赵宝平,Allen Xue
(1 内蒙古农业大学 农学院,呼和浩特 010019;2 加拿大农业与农产品部渥太华研发中心,加拿大 渥太华 KIA0C6)
燕麦(AvenasativaL.)是世界上公认的营养保健谷物,其籽粒富含蛋白质、不饱和脂肪酸和β-葡聚糖,同时富含燕麦特有抗氧化物质及多种微量元素等[1],可以降脂控糖、降低心血管疾病风险[2-3]。燕麦具有抗旱、耐盐碱、耐瘠薄、适应性强等特点,是中国北方、西北干旱冷凉等生态脆弱区主要的粮饲兼用及优势特色作物[4]。燕麦秆锈病(Pucciniagraminisf. sp.avenae)作为典型的真菌病害[5],发病初期为圆形暗红色小点,后病斑逐渐扩展出现稍隆起的小疮胞,即夏孢子堆[6]。秆锈病害在燕麦种植的地区和国家都有发生,曾分别于20世纪初和20世纪40年代在北美地区和加拿大西部地区大爆发[7]。秆锈病也是中国燕麦主产区主要病害之一,周期性发生,大幅度降低籽粒产量和质量,严重制约燕麦产业可持续发展。调查结果显示,2008-2009年在吉林白城、2012-2013年在河北张家口,燕麦秆锈病大面积爆发,产量降低10%~15%[8]。因此,如何提高燕麦秆锈病抗性成为中国燕麦生产亟待研究的课题,对中国燕麦主产区发展具有重要意义。
硅是地壳中第二大元素,可以提高某些作物对真菌病害的抵抗力[9],虽然该元素不是植物生长的必要元素,但在提高植物抗病性上有重要作用。例如对水稻白叶枯病[10]、番茄根腐病[11]、黄瓜炭疽病[12]、小麦锈病[13]等病害均有一定的防治效果。诱导抗病性就是利用物理的、化学的以及生物的方法处理植株,改变植物对病害的反应产生局部的或系统抗性的现象[14-16],其抗病效果取决于诱导抗性的强弱和速度。研究表明病程相关蛋白(pathogenesis-related proteins, PR)活性的显著提高,酚类物质的积累以及木质化作用的加强都是诱导抗性的重要机制[17]。有研究发现,水稻侵染稻瘟病菌后,施硅能显著提高叶片病程相关蛋白酶中几丁质酶和β-1,3-葡聚糖酶的活性以及可溶性总酚及木质素含量[18]。Chérif等[19]发现,施硅后黄瓜植株中被侵染的细胞通过积累酚类物质对真菌侵染的反应更迅速,积累的酚类物质具有强烈的抗菌活性,抑制真菌侵入活性维管束系统。在黄瓜和水稻中也发现受硅调控的植保素的积累[20-21]。Rémus-Borel等[22]在研究硅增强小麦白粉病抗性的过程中,在施硅植株中提取到具有很强抗菌能力的化合物。
所有这些发现清晰地表明,硅在感病的植株体内诱导引发了一种生化防卫反应,但迄今为止有关硅增强植物抗病性的作用机理尚不完全清楚,并且关于硅在感染秆锈病的燕麦体内诱导产生抗病的机制尚未见报道。基于上述研究背景,本研究以易感秆锈病的燕麦品种‘坝莜1号’为材料,考察硅对燕麦叶片酚类物质含量和病程相关蛋白活性的影响及其与燕麦秆锈病抗性的关系,以期揭示硅抗燕麦秆锈病的生理机制,为研发新型秆锈病害防治措施提供理论依据。
1 材料和方法
1.1 材 料
试验选用易感秆锈病的燕麦品种‘坝莜1号’为材料(由张家口市农业科学院提供),供试的燕麦秆锈菌从张家口市农业科学院燕麦生产试验田采集,试验所用的硅酸盐(K2SiO3)及其他化学试剂均为分析纯,所用营养液参照Hoagland经典配方进行配置[23]。
1.2 燕麦幼苗培养
试验采用盆栽方法,供试土壤为蛭石与泥炭土按质量比为1∶1的比例混合而成。泥炭土中 N+P+K含量>10 g·kg-1,有机质含量>50 g·kg-1,pH 7.0~8.0。塑料盆高12 cm,直径15 cm,每盆装混合土1 kg。选择大小均匀一致的燕麦种子,使用3%氯酸钠消毒10 min,蒸馏水冲洗3次并晾干后播种在花盆中,每盆20粒。燕麦出苗后将花盆置于日光温室中进行培养。
1.3 接种方法
待燕麦幼苗第一叶充分展开即一叶一心时期,参照李天亚等[24]的方法进行秆锈病菌接种。具体方法为:将分离纯化后的秆锈病菌株置于培养皿内,首先用前端削成扁平的牙签挑取秆锈菌株均匀涂抹于叶片背面,接种时各叶片涂抹菌要定量且保持一致。接种后的叶片用0.05%吐温-20水溶液喷雾形成保湿膜,植株放置在16~18 ℃的黑暗环境中保湿16~20 h后,移入人工温室内进行培养,温度控制在20~25 ℃,14 h(光)/10 h(暗)。
1.4 试验设计
试验共设4个处理,分别为CK(不施硅不接种)、+Si-P(施硅不接种)、-Si+P(不施硅接种)以及+Si+P(施硅接种),每个处理重复3次。从燕麦出苗开始每隔3 d选用含1.5 mmol·L-1K2SiO3(前期的研究结果已证明该浓度防疫效果最佳)的1/2 Hoagland营养液进行浇灌,每盆200 mL,不加硅处理则加入同样浓度的KNO3溶液,以补充由于施硅量不同带来的钾含量的差异。待幼苗长至一叶一心时期进行秆锈病菌接种,分别在接种前(0 d)和接种后(1、3、5、7、9和11 d)采集各个处理下的燕麦叶片样品(第一片叶),用液氮冷冻,在-80 ℃下保存,用于后期指标的测定。
1.5 测试指标及方法
1.5.1 秆锈侵染型分级标准及观察参照Stewart等[25]的方法,燕麦叶片秆锈侵染型具体分为0(免疫)、0;(近免疫)、1(高抗)、2(中抗)、3(中感)、4(高感)和x(混合型)。接种6 d后开始每天观察病斑(夏孢子堆)发展情况,待接种11 d后记载侵染型并拍照。
1.5.2 几丁质酶和β-1,3-葡聚糖酶活性取叶片0.5 g,加入液氮研磨至粉末,再加入7 mL浓度为50 mmol/L乙酸钠缓冲液(pH5.0)匀浆。混合物在4 ℃、15 000×g离心15 min,上清液即为提取的粗酶液,用作几丁质内切酶和外切酶活性的分析。几丁质酶活性测定参照Boller等[26]的方法,β-1,3-葡聚糖酶活性测定参照Joosten等[27]的方法。以每秒催化产生1 mol N-乙酰氨基葡萄糖(GlcNAc)所需的酶量定义为1 katal(kat), 酶活性表示为nkat/mg。
1.5.3 多酚氧化酶活性(PPO)活性称取鲜样叶片0.5 g左右,放入提前预冷的研钵中,加入液氮研磨至粉末,加入0.1 mol/L磷酸钠缓冲液(pH 6.4,含1% PVP)4 mL,充分匀浆后,转入10 mL离心管中。将混合物在4 ℃条件下,15 000×g高速离心30 min上清液用于酶活性测定。参照Qin等[28]的方法进行酶活性测定。
1.5.4 苯丙氨酸解氨酶活性(PAL)活性称取鲜样叶片0.3 g左右,放入提前预冷的研钵中,加入液氮研磨至粉末,用50 mmol/L硼酸钠缓冲液(pH 8.8,含5 mmol/L巯基乙醇和1% PVP) 4 mL (分2次加入),充分匀浆后,转入10 mL离心管中。混合物在4 ℃条件下,15 000×g 高速离心 30 min,上清液用于酶活性测定。参照Qin等[28]的方法进行酶活性测定。以OD290变化0.01为一个酶活力单位(U)。
1.5.5 总可溶性酚(TSP)和木质素含量参照Rodrigues等[29]的方法。取0.1 g冷冻粉末叶片样品至Ependorf管中,加入1.5 mL 80%的甲醇,用铝箔纸将Ependorf管完全包裹,以防止光氧化,于转速150 r/min、室温25 ℃的摇床上振荡过夜。将得到的提取物在离心力为12 000×g下高速离心5 min,之后将上清液转移到新的塑料管中,在-20 ℃低温冰箱中保存,用以测定总可溶性酚的含量。将沉淀也保存在-20 ℃的低温冰箱中,用以测定木质素的含量。
1.6 数据分析
试验数据采用Excel 2016软件进行处理和作图,利用SPSS 22.0软件进行方差分析,并运用Duncan’s检验法对显著性差异进行多重比较。
2 结果与分析
2.1 施硅对燕麦秆锈病抗病性的影响
在接种秆锈病菌的情况下,外源施硅可以明显减少燕麦幼苗叶片的秆锈病菌孢子量,减少病斑大小(图1)。同时,燕麦幼苗叶片的秆锈最高病级由4(高感)转变为2(中抗),且与不施硅相比(表1),施硅处理下秆锈病发生严重度显著降低了35.61%(P<0.05)。
2.2 施硅对接种后燕麦叶片病程相关蛋白酶活性的影响
2.2.1 几丁质酶活性在不接种秆锈病的情况下,施硅与否对燕麦叶片几丁质内切酶和外切酶活性并未产生明显影响(图2),并随接种后天数的延长基本维持平稳状态。在接种秆锈病菌后,燕麦叶片的几丁质外切酶和几丁质内切酶活性在施硅和不施硅处理下均表现出相同的先升后降的变化趋势。其中,两种酶活性在接种初期有一个快速上升阶段,施硅和不施硅处理分别在接种第3天和第1天达到峰值后开始快速下降,在第11天低于不接种时的正常水平;与不施硅处理峰值相比,施硅后叶片几丁质内切酶和外切酶活性的峰值分别提高26.15%和16.67%,且差异均达到显著水平(P<0.05)。以上结果表明施硅能使受秆锈病菌侵染的燕麦叶片中几丁质酶活性维持更持久更高水平,这有助于提高燕麦对秆锈病的抗性。

表1 不同处理对燕麦秆锈病的防效
2.2.2 β-1,3-葡聚糖酶活性从图3中可以看出,在不接种秆锈病菌时,外源施用硅对燕麦叶片β-1,3-葡聚糖酶活性并未产生影响,并基本维持平稳状态。在秆锈病菌侵染的初期,施硅和不施硅处理燕麦叶片β-1,3-葡聚糖酶活性均迅速同步升高,均在接种第3天达到最高值,之后均开始快速降低,而均在第9天再次出现小幅度提升。与不施硅处理相比,在秆锈病菌接种后第1~7天内,施硅处理明显提高叶片β-1,3-葡聚糖酶活性,并且峰值显著提升了18.31%(P<0.05)。说明施硅能诱导受秆锈病菌侵染的燕麦叶片β-1,3-葡聚糖酶活性明显提升,致使燕麦秆锈病抗性增强。

CK.不加硅不接种;+Si-P.加硅不接种;-Si+P.不加硅接种;+Si+P.加硅接种;下同图2 不同处理下燕麦叶片几丁质内切酶和外切酶活性随接种时间的变化CK. No silicon no inoculation; +Si-P. Silicon application no inoculation; -Si+P. No silicon inoculation;+Si+P. Silicon and inoculation; The same as belowFig.2 The activities of chitin endonuclease and chitin exonuclease in oat leaves under different treatments after inoculation

图3 不同处理下燕麦叶片β-1,3-葡聚糖酶活性随接种时间的变化Fig.3 The β-1, 3-glucanase activity in oat leaves under different treatments after inoculation
2.3 施硅对接种后燕麦叶片酚类物质代谢的影响
2.3.1 多酚氧化酶和苯丙氨酸解氨酶活性在不接种秆锈病菌条件下,燕麦叶片多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性基本保持恒定,并且施硅与否对二者无明显影响(图4)。在接种秆锈病菌后,施硅和不施硅处理叶片PPO活性和PAL活性随接种后时间延长均表现为先上升后下降的变化趋势,并均于接种后第3天达到峰值。在整个秆锈病菌侵染过程中,硅处理燕麦叶片的 PPO和PAL活性均始终明显高于同期不加硅处理,其PPO和PAL活性的峰值分别比不施硅处理峰值显著提高了13.04%和9.33%(P<0.05)。可见,受到秆锈病菌侵染后,施硅能促使燕麦叶片中多酚氧化酶和苯丙氨酸解氨酶活性明显提高,有助于增强燕麦对秆锈病的抗性。
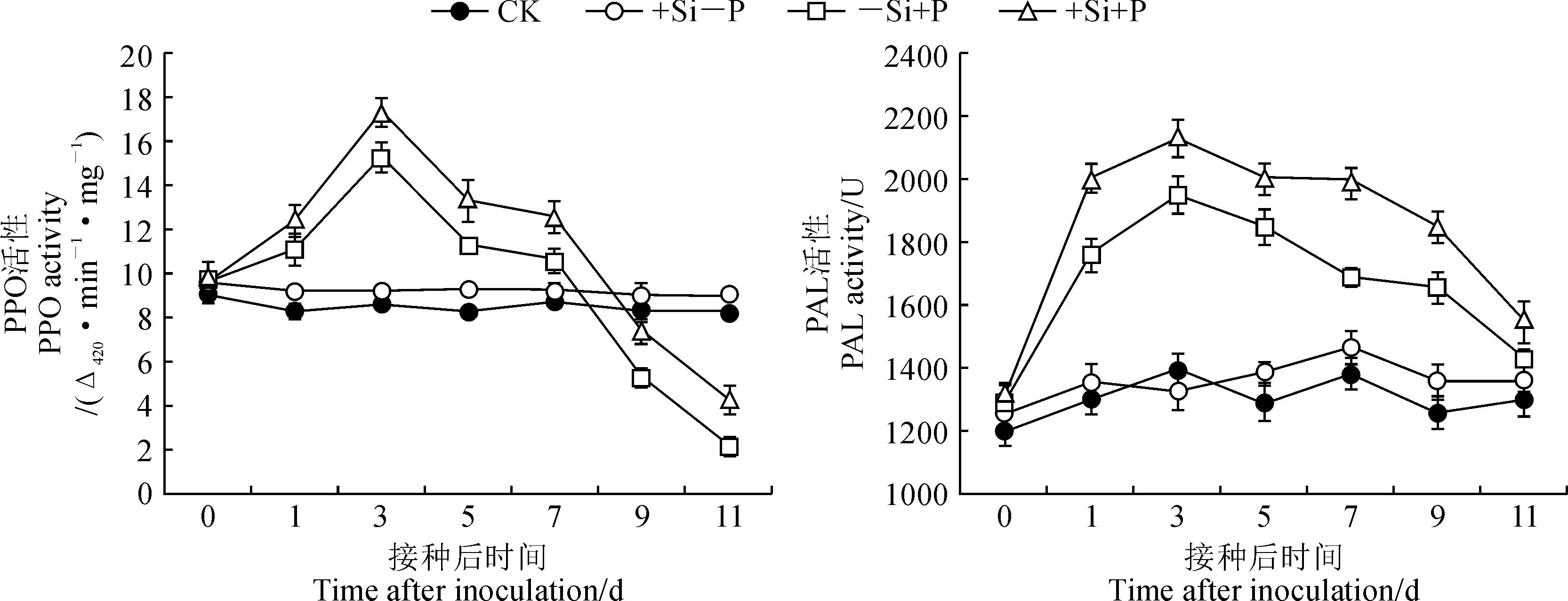
图4 不同处理下燕麦叶片多酚氧化酶和苯丙氨酸解氨酶活性的变化Fig.4 The activities of polyphenol oxidase and phenylalanine ammonia lyase in oat leaves under different treatments
2.3.2 总可溶性酚和木质素含量如图5所示,在不接种秆锈病条件下,施硅处理对燕麦叶片的总可溶性酚(TSP)和木质素含量影响均较小,含量水平基本保持稳定。在接种秆锈病菌后,施硅处理和不施硅处理燕麦叶片中的TSP和木质素含量均快速大幅上升,并均在接种后第3天达到峰值,之后开始缓慢下降;在接种后第1~11天内,施硅处理的燕麦叶片TSP和木质素含量均明显高于同期不施硅处理,且施硅处理后二者的峰值分别显著提高了5.10%和27.81%(P<0.05)。这说明燕麦幼苗接种秆锈病菌后,施硅处理能有效提高燕麦叶片中总可溶性酚和木质素的含量,从而增强燕麦对秆锈病的抗性。

图5 不同处理下燕麦叶片总可溶性酚和木质素含量的变化Fig.5 The contents of total soluble phenol and lignin in oat leaves under different treatments
3 讨 论
当植物受病原物侵染后均能产生诱导抗性,并且在感病初期就能立即启动诱导抗性机制,但其对病原物侵染起到抑制作用并能够杀死病原物[30]。在本研究中,燕麦叶片在接种秆锈病菌后能够快速反应,在侵染初期(0~3 d)叶片内病程相关蛋白活性和酚类物质含量均快速升高达到峰值,以起到抵抗秆锈菌侵染叶片细胞结构的作用。
病程相关蛋白(pathogenesis-related proteins)是由植物寄主基因编码,在病程相关情况下诱导生成的一类蛋白质。植物病原细菌、真菌、病毒和类病毒都可以诱导病程相关蛋白生成。几丁质酶是广泛存在于微生物和植物体内的一类蛋白质,是植物体中与防御有关的一种次生水解酶,几丁质是很多植物病原真菌细胞壁的主要成分,植物受病原真菌侵染后,几丁质酶在植物体内快速积累,从而抑制真菌的生长[31]。β-1,3-葡聚糖酶是一类能够水解以β-1,3-葡萄糖键连接的葡聚糖酶系,它广泛存在于真菌、细菌、藻类、软体动物和高等植物体内。几丁质酶与β-1,3-葡聚糖酶在植物防卫反应中常协同表达,从而增强了植物的抗病性[17]。本研究结果表明,在不接种燕麦秆锈病原菌时,施硅对感病燕麦品种叶片的几丁质酶和β-1,3葡聚糖酶活性影响不显著,但在有病原菌侵染条件下,外源硅可以显著地提高燕麦麦叶片几丁质酶和β-1,3葡聚糖酶活性。这表明硅参与燕麦的生理代谢调节过程,诱导了几丁质酶和β-1,3葡聚糖酶活性的激发,从而促进燕麦对秆锈病的抗病性。杨艳芳报道了类似的研究结果,即外源硅诱导了小麦叶片中几丁质酶和β-1,3葡聚糖酶活性的提升,从而增强小麦对白粉病的抗病性[32]。另外,本研究结果显示,施硅后会推迟秆锈菌侵染下叶片几丁质酶活性峰值到达的时间,并且峰值显著提高,使得叶片几丁质酶提高抗病性的作用更强,时间更持久。
同时,酚类物质具有杀菌活性,能加强植物木质化作用[33]。多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)及总可溶性酚(TSP)都是酚类物质代谢过程中的关键酶,对酚类物质的形成、氧化以及木质素的合成具有重要作用[34]。植物体内酚类物质的来源有两个主要的途径,一是植物原始酚类物质的积累,二是在受病原菌侵染后,宿主细胞作出反应,酚类物质迅速积累。特别是抗病品种在受侵染时,会积累从莽草酸或乙酸途径合成的大量酚类物质。梁永超等研究硅和黄瓜炭疽病的关系后发现,诱导接种能使加硅处理叶片的酚类物质含量明显提高,植株能被成功诱导出系统抗病性蛋白,说明病原物侵染植物后,寄主体内酚类物质变化与寄主抗病性有重要关系[12]。本试验结果表明,施硅能使受秆锈病菌侵染的燕麦叶片中多酚氧化酶活性和酚类物质含量提高,有助于增强燕麦对秆锈病的抗性。但相关研究结果表明,小麦叶片中酚类物质含量均在接种黑胚病菌后第2天达到峰值,然后开始下降[35],而本研究中在接种秆锈病菌后,施硅处理和不施硅处理的燕麦叶片中的酚类物质含量均快速上升,并在接种后第3天才达到峰值,接着开始下降,与前人研究结果不尽相同。这可能是因为植株受到不同病原菌侵染时,处理间植株生长差异较大,结构抗性或物理屏障作用较明显,导致处理间的植株对病原菌的敏感性不一致而造成的。但也有研究指出,施硅对感病植株叶片的酚类物质代谢不会造成影响,这可能因为硅在不同病原物-寄主中作用机理存在差异[12],如黄瓜白粉病和小麦白粉病都是病原物的活体寄生,而黄瓜炭疽病菌乃腐生型,但具体作用机制尚待进一步研究。
结合本试验结果和已发表的研究结果表明,外源硅可通过调节植株体内的生化代谢反应,影响植物抗病相关酶活性,并在侵染位点沉积硅元素从而构建了防病原菌侵入的“物理或机械屏障”,以达到增强植株的系统抗病性,从而抑制植物病害发展。本试验研究了燕麦感染秆锈病初期,叶片内酚类物质代谢能力和病程相关蛋白酶活性的变化,并探讨它们和秆锈病抗性之间的关系,随着病情的进一步扩展和发病级别的升高,各指标变化规律需要进一步研究。

