不同光质对杉木组培苗生根的影响及其机理初探
唐 银,李玲燕,许珊珊,钟明慧,郑雪燕,叶义全*
(1 福建农林大学 林学院, 福州 350002; 2 国家林业局杉木工程技术研究中心, 福州 350002; 3 林木逆境生理生态及分子生物学福建省高校重点实验室, 福州 350002; 4 福建洋口国有林场, 福建南平 353200)
杉木(Cunninghamialanceolata)是中国长江以南地区主要的造林树种,具有材性优良、速生和无病虫害等特性,是一种优质的建筑装饰用材,深受广大林农喜爱[1-2]。第八次全国森林资源清查结果显示,中国杉木人工林造林面积和蓄积量分别占全国人工林造林总面积和人工林总蓄积的19.01%和25.18%,面积和蓄积均居于中国主要造林树种的首位,在促进中国林业健康发展、林农脱贫致富和生态环境改善中发挥重要作用[3]。随着杉木人工林造林面积的不断增大,市场对杉木优质种苗的需求也在不断增长。优质苗木能在造林早期快速生长占据有利生态位,提高造林效果,因此杉木优质苗木的培育是提高造林质量的关键环节[4]。组织培养因其具有周期短、速度快和易实现规模化生产等优点,已成为杉木优质苗木繁育的重要手段之一。尽管目前已有许多学者对杉木组培展开了一系列研究,涉及外植体消毒[5]、愈伤组织诱导[6]、增殖扩繁[7-10]、生根[11]、炼苗移栽[12]等方面,并取得一定的成效。然而,目前杉木组培中仍存在着增殖系数低、生根率不高以及生根不稳定等问题,极大限制了该技术的推广应用。此外,近年来随着一些杉木高世代良种,如‘洋020’等开始在全国杉木产区的逐步推广,极大提升了中国杉木人工林经济效益与良种化水平,然而与这些高世代良种材料相匹配的种苗快繁技术体系尚未完全建立,这也在一定程度上限制了这些材料的推广应用[4,13]。因此,针对杉木高世代良种材料种苗快繁技术中存在的技术瓶颈问题,研究建立与之相匹配的苗木繁育技术是当前杉木苗木培育产业持续健康发展面临的迫切技术需求。
光是影响植物生长的重要环境因子,它不仅是植物生长的能量来源,而且还能作为信号分子参与植物生长发育的调控[14]。在影响植物生长发育和形态建成的光条件中,光强和光质是最为重要的两种因素。大量研究表明,不同光质和光强可通过对植物体内光合碳同化产物合成、运输、分配和内源激素含量等一系列生理过程的影响,从而对植物生长产生重要的调控[15-19]。因此,适宜的光质组合或光强的选择对苗木培育至关重要。值得注意的是,近年来一些研究相继发现不同的光质组合除了能促进植物生长外,它们对组培苗的生根同样具有显著的促进效果。例如,红∶蓝∶远红光=6∶3∶1是最适宜诱导蝴蝶兰(Phalaenopsisssp.)生根的光质组合[20],金线莲(Anoectochilusroxburghii)幼苗生根诱导阶段最适宜的LED光质组合为红∶蓝=8∶2[21]。类似研究结果在黄花高山杜鹃(RhododendronL.)[22]和红心杉(Cunninghamialanceolata)[23]的研究中也有发现。尽管目前也有少量关于光质对杉木组培苗生根的研究报道,但这些研究主要着重分析不同光质对生根和生理的影响,鲜有分析不同光质组合介导的组培苗生根调控机理,目前有关不同光质组合介导的杉木组培苗生根调控机理如何?尚不清楚,而该机理的阐明又是揭示杉木组培苗适应不同光环境的关键所在。
有鉴于此,本试验以杉木优良无性系‘洋020’继代苗为研究材料,首先以白光为对照,比较蓝光、红光以及不同红蓝光组合处理下组培苗生根率的差异,筛选出最适宜‘洋020’生根的光质组合条件。其次,以白光为对照,比较它与生根率最高和生根率最低的光质处理之间在生长、光合色素含量、叶绿素荧光参数、内源激素含量与比值以及叶绿体超微结构之间的差异。旨在从光合、内源激素和叶绿体超微结构等角度揭示不同光质介导的杉木组培苗生根调控机理,从而为杉木组培苗工厂化育苗提供理论依据。
1 材料和方法
1.1 试验材料
本试验在福建农林大学田间实验室进行(26°05′N和119°13′E),以杉木优良无性系‘洋020’继代培养获得的无菌组培苗为材料。
1.2 材料培养与处理
(1) 第一轮试验,设置如下光质配比处理:1)白光对照处理(WCK);2)红光处理(R);3)红∶蓝=2∶1处理(R2B1);4)红∶蓝=3∶1处理(R3B1);5)红∶蓝=4∶1处理(R4B1);6)蓝光处理(B);7)红∶蓝=1∶2处理(R1B2);8)红∶蓝=1∶3处理(R1B3);9)红∶蓝=1∶4处理(R1B4);10)红∶蓝=1∶1处理(R1B1)。将‘洋020’组培继代苗切成长度为(3.0 ± 0.2) cm的茎段转接于生根培养基(1/2 MS+0.3 mg/L IBA)上,每瓶接种3个茎段,每个处理3次重复,每个重复10瓶,随后将转接好的组培苗置于试验设置的不同光质条件下进行培养。其中,培养的光周期与温度条件为光照14 h/25 ℃、黑暗10 h/22 ℃,相对湿度为75%,光照强度为45 μmol·m-2·s-1。生根培养35 d后统计生根率。
(2)第二轮试验,根据第一轮不同光质组合下培养结果,选取白光处理为对照(WCK),同时选取生根率最低(蓝光,B)和生根率最高(红∶蓝=3∶1, R3B1)的处理,共设置3个处理,重新按第一轮试验中方法进行材料准备和培养。培养35 d后,取样进行相关指标观测分析。
1.3 观测指标及方法
1.3.1 植株生物量和苗高取第二轮试验材料,将3个处理中组培苗全部取出,用纯水冲洗干净,并吸干水分,以万分之一的天平来测定植株生物量,同时用直尺测量不同处理下组培苗苗高。
1.3.2 叶片叶绿素荧光动力学参数组培苗叶绿素荧光动力学参数测定参考陶文文等[24]的方法。第二轮试验生根培养处理结束后,使用便携式叶绿素荧光测量仪PAM-2500(WALZ,德国)进行叶绿素荧光动力学参数测定。上午9:00开始进行测定,随机选择组培苗中部的成熟叶片,用湿巾擦净叶片表面后,将其置入暗盒进行20 min的暗适应处理,在弱光条件下测定叶片初始荧光(Fo),随即给叶片一个饱和脉冲光测得叶片最大荧光值(Fm);打开光化光(110.0 μmol·m-2·s-1)持续照射5 min诱导荧光动力学,并隔 20 s 打开饱和脉冲测量光适应下的叶片最大荧光(Fm′);PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学活性(Fv/Fo)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)与实际PSⅡ光化学效率(ФPSⅡ)等相关参数则按照Baker[25]的方法计算。
1.3.3 叶片光合色素含量采用乙醇-丙酮混合浸提方法对杉木叶片的光合色素含量进行测定[26]。第二轮试验结束后,选取与测定叶绿素荧光参数相同部位的成熟叶片,用纯水冲洗干净,吸干叶片表面水分;随后将叶片剪碎并充分混匀,称取0.05 g叶片样品于5 mL离心管中,加入提取液于黑暗条件下浸提3 h,期间每隔0.5 h将离心管拿出上下颠倒混匀;提取结束后于12 000 g下离心10 min,取上清液测定其在663、645和470 mm波长下的吸光值D663、D645、D470;最后根据如下公式计算不同处理下叶片叶绿素(Chl)和类胡萝卜素(Car)含量。
Chla =(12.7D663-2.69D645)×[V/(1000×W)]
Chlb =(22.9D645-4.68D663)×[V/(1000×W)]
Chl(a+b)=(20.2D645+8.02D663)×[V/(1000×W)]
Car=(1000D470-3.27 Chla-104Chlb)/229
式中,V为提取液体积(mL),W为叶片鲜重(g)。
1.3.4 内源激素含量第二轮试验处理结束后,将组培苗茎尖及嫩叶取下,用液氮速冻后放入做好标签的离心管中,将样品送往上海恒远生物科技有限公司用ELLISA酶联免疫法进行赤霉素(GA)、脱落酸(ABA)、生长素(IAA)、细胞分裂素类(CTK)、玉米素核苷(ZR)等激素含量的测定。
1.3.5 叶绿体超微结构叶绿体超微结构按叶义全等[27]的方法进行。第二轮试验处理完毕时,选择不同大小的成熟叶片组织块各10片,用2.5%戊二醛-磷酸缓冲液固定6 h后,然后用0.1 mmol·L-1磷酸漂洗液进行3次漂洗,每次15 min;随即用2%锇酸固定液固定2 h,之后再用0.1 mmol·L-1磷酸漂洗液漂洗3次,每次15 min;分别在以下几个不同体积分数梯度的乙醇洗脱液中进行连续脱水的处理:体积分数为50%乙醇放置15~20 min、体积分数为70%乙醇放置15~20 min、体积分数为90%乙醇放置15~20 min、体积分数为90%乙醇和体积分数为90%丙酮(1∶1,v/v)放置15~20 min、体积分数为90%丙酮放置15~20 min,以上操作需要在冰上进行;体积分数为100%丙酮在室温环境下放置15~20 min,3次。处理结束后将样品送上海师范大学电镜中心进行样品分析和拍照。
1.4 数据处理分析
本试验数据采用SPSS 22.0进行单因素方差分析,不同处理间采用LSD法在0.05水平下进行多重比较。采用Origin 8.5软件作图。
2 结果与分析
2.1 不同光质配比对杉木优良无性体系组培苗生根的影响
不同光质组合处理对杉木优良无性系‘洋020’组培苗生根存在不同的影响(图1),其生根率表现为R3B1(红∶蓝=3∶1)>R4B1(红∶蓝=4∶1)>R(红光)>R1B4(红∶蓝=1∶4)>R1B2(红∶蓝=1∶2)>R2B1(红∶蓝=2∶1)>WCK(白光)>R1B1(红∶蓝=1∶1)>R1B3(红∶蓝=1∶3)>B(蓝光)。其中,B、R1B3、R1B1处理的生根率显著低于WCK,最低的B处理(12.50%)比WCK显著降低74.40%(P<0.05);R1B2、R1B4、R、R2B1处理的生根率均与WCK无显著差异;而R3B1和R4B1处理的生根率显著高于WCK,最高的R3B1处理较对照显著提高45.61%。因此,在后续研究中选择在本试验中生根率最高的R3B1处理、生根率最低的B处理以及WCK进行后续生长和生根调控机理的研究。
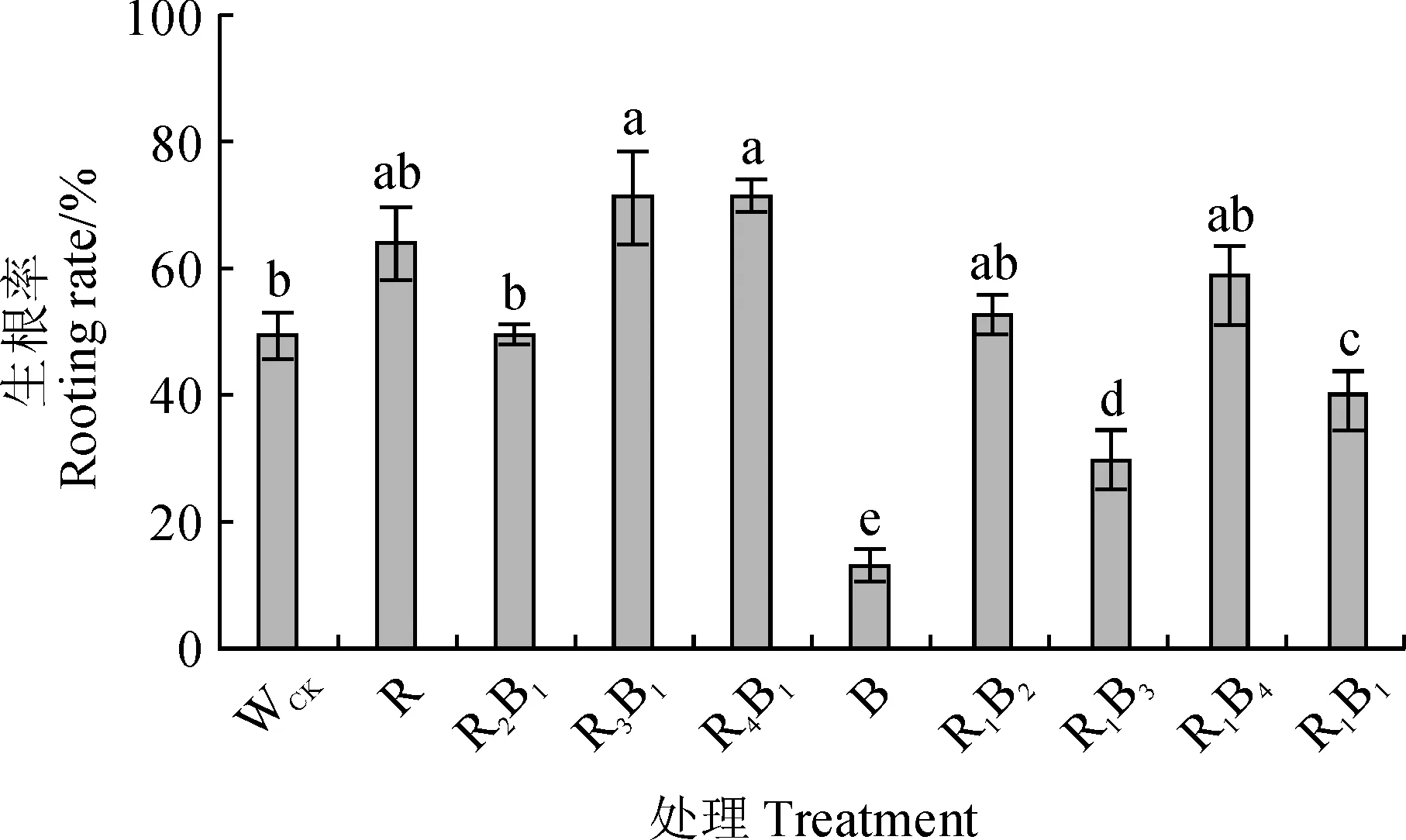
WCK.白光(对照);R.红光; B.蓝光;R2B1.红∶蓝=2∶1;R3B1.红∶蓝=3∶1;R4B1.红∶蓝=4∶1; R1B2.红∶蓝=1∶2;R1B3.红∶蓝=1∶3;R1B4.红∶蓝=1∶4;R1B1.红∶蓝=1∶1;不同字母表示不同处理之间在0.05水平差异显著(P<0.05);下同图1 不同光质条件下杉木组培苗的生根率WCK. White light (control); R. Red light; B. Blue light;R2B1. Red∶Blue=2∶1; R3B1. Red∶Blue=3∶1; R4B1. Red∶Blue =4∶1; R1B2. Red∶Blue =1∶2; R1B3. Red∶Blue =1∶3;R1B4. Red∶Blue =1∶4; R1B1. Red∶Blue =1∶1; The different normal letters indicate significant difference among treatments at 0.05 level (P<0.05). The same as belowFig.1 The rooting rate of tissue cultured seedlings of Cunninghamia lanceolata under different light qualities
2.2 不同光质处理对杉木优良无性系组培苗生长的影响
由图2可知,不同光质处理对组培苗生物量和苗高生长同样存在不同影响,均以R3B1处理最高,WCK居中,B处理最低。其中,R3B1处理杉木组培苗生物量和苗高分别比WCK提高13.54%、7.87%,比B处理分别提高29.93%、18.33%,且与B处理的差异均达到显著水平(P<0.05),R3B1处理苗高与WCK的差异也达到显著水平。说明适当的红、蓝光质组合处理可显著提高杉木组培苗生物量和苗高生长。
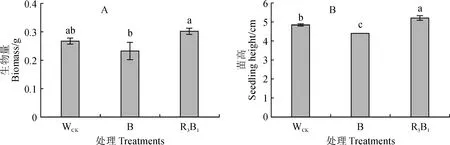
图2 不同光质条件下杉木组培苗的生物量和苗高Fig.2 The biomass and plant height of C. lanceolata seedlings under different light qualities
2.3 不同光质处理对杉木组培苗叶片叶绿素荧光动力学参数和光合色素含量的影响
图3,Ⅰ、Ⅱ显示,在不同光质处理下,组培苗叶片叶绿素荧光动力学参数最大荧光(Fm)、可变荧光(Fv)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学效率(Fv/Fo)和实际PSⅡ光化学效率(ФPSⅡ)均表现为R3B1>WCK>B,而初始荧光(Fo)、非光化学淬灭系数(NPQ)和光化学淬灭系数(qP)均表现为B>WCK>R3B1,但除了Fv/Fo外,上述荧光动力学参数指标在不同光质处理之间均不存在显著差异。其中,R3B1处理的Fv/Fo值比WCK增加0.54%,B处理中Fv/Fo值比WCK减少10.46%(P<0.05;图3,Ⅱ)。同时,在不同的光质条件下,杉木组培苗叶片的叶绿素a、叶绿素b、叶绿素总量以及类胡萝卜素含量均表现为R3B1>B>WCK,而且R3B1处理下杉木组培苗叶片的光合色素含量均与WCK有显著差异(P<0.05),而B处理均与WCK无显著差异(图3,Ⅲ)。可见,R3B1处理能显著提高杉木组培苗叶片的光合色素含量和PSⅡ潜在光化学效率。
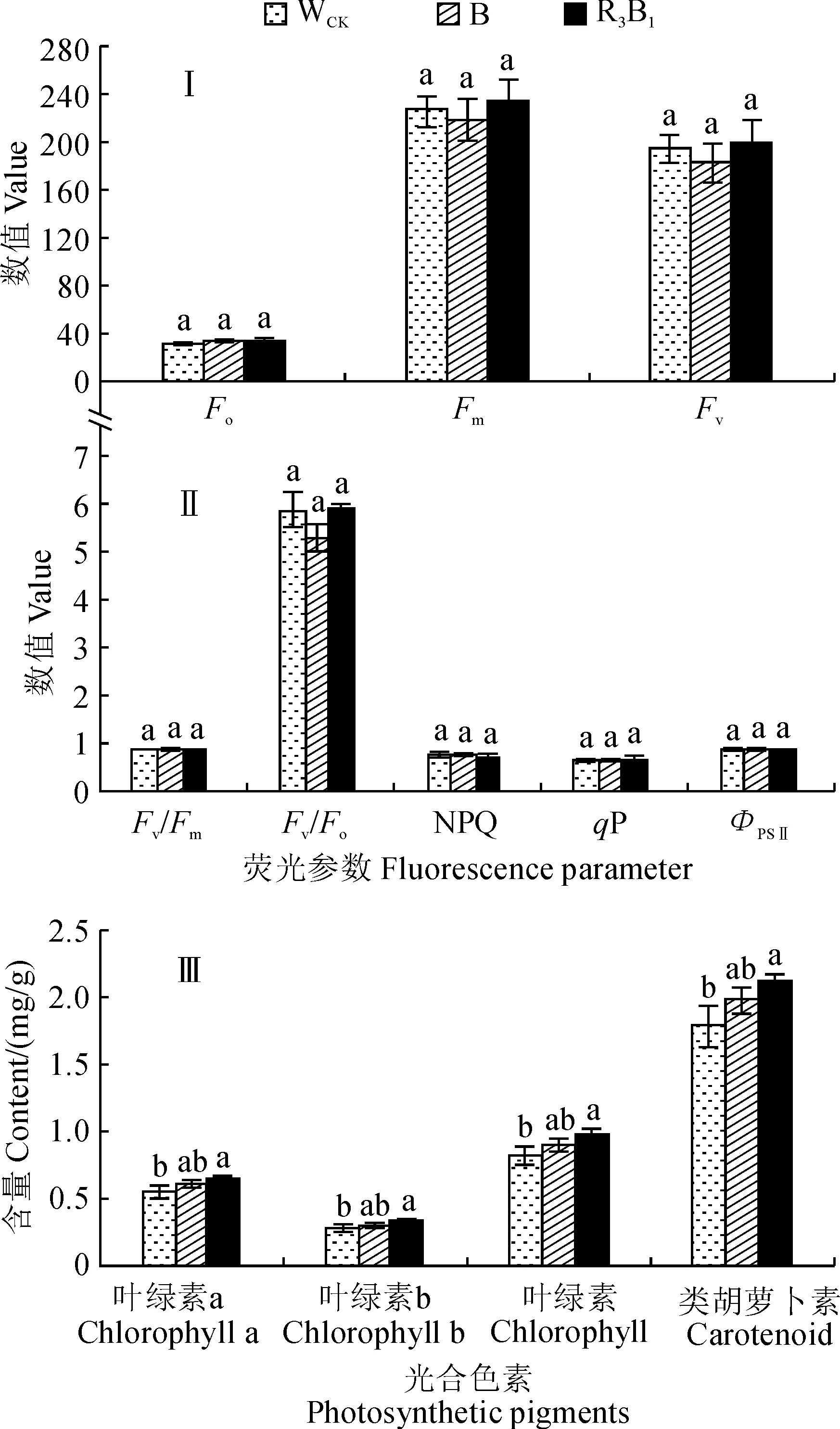
图3 不同光质条件下杉木组培苗叶片的叶绿素荧光动力学参数和光合色素含量Fig.3 The chlorophyll fluorescence kinetic parameters and photosynthetic pigment content in leaves of C. lanceolata seedlings under different light qualities
2.4 不同光质处理对杉木组培苗叶片和茎中内源激素含量和比值的影响
图4显示,不同光质处理下杉木组培苗叶片和茎中内源激素赤霉素(GA)和生长素(IAA)含量均表现为R3B1>WCK>B,且各处理间均差异显著(P<0.05);其中R3B1和WCK处理叶片中GA含量较B处理分别显著增加18.67%、16.41%,其IAA含量则分别显著增加21.31%、8.35%(图4,Ⅰ),而R3B1和WCK处理茎中GA含量分别较B处理显著增加32.06%、13.58%,其IAA含量分别显著增加14.56%、10.18%(图4,C)。同时,杉木组培苗叶片和茎中脱落酸(ABA)和细胞分裂素(CTK)含量均表现为B>WCK>R3B1,且各处理间均差异显著;R3B1、WCK处理叶片中ABA含量分别较B处理显著降低19.37%、5.73%,其CTK含量则分别显著降低14.52%、6.38%(图4,Ⅰ),而二者茎中ABA含量分别较B处理显著降低16.47%、10.33%,CTK含量则分别显著降低12.27%、10.11%(图4,Ⅲ)。杉木叶片和茎中玉米素核苷(ZR)含量在不同光质处理间均不存在显著差异(图4,Ⅰ、Ⅲ)。此外,在不同光质处理下,杉木叶片和茎中不同激素含量比值GA/ABA和IAA/ABA均R3B1处理最大,WCK次之,B处理最小,而CTK/GA比值则表现相反,而且不同处理间大多存在显著差异(图4,Ⅱ、Ⅳ)。以上结果说明不同光质处理能够通过改变植株叶片和茎中的GA和IAA的激素含量以及GA/ABA和IAA/ABA等激素比值进而影响幼苗的生长。
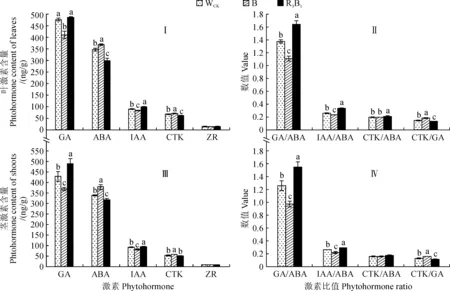
图4 不同光质处理下杉木组培苗叶片(Ⅰ、Ⅱ)和茎中(Ⅲ、Ⅳ)的内源激素含量和比值Fig.4 The contents and ratios of endogenous hormones in leaves (Ⅰ, Ⅱ) and shoots(Ⅲ, Ⅳ) of C. lanceolata seedlings under different light qualities
2.5 不同光质处理对杉木组培苗叶片叶绿体超微结构的影响
不同光质条件对杉木组培苗叶片叶绿体超微结构具有不同的影响(图5)。在白光(WCK)条件下,叶绿体存在体积较小的淀粉粒和嗜锇体颗粒,叶绿体基粒片层数量不多,基质片层排列疏松(图5, A、B);与白光对照相比,在蓝光(B)条件下,叶绿体中淀粉粒体积膨大,基质片层排列松散,基粒片层数量减少(图5,C、D);在红∶蓝=3∶1(R3B1)条件下,叶绿体中淀粉粒和嗜锇体颗粒数量减少,基质片层、基粒片层结构清晰,基粒类囊体排列紧密有序(图5,E、F)。可见,适当的光质条件有利于杉木组培苗叶片叶绿体中碳同化产物的输出,减轻因碳同化产物积累而引起的植物光合作用受抑。

Cw.细胞壁;Chl.叶绿体;Sg.淀粉粒;Os.嗜锇体颗粒;Mit.线粒体;Gl.基粒片层;A-B.白光(WCK);C-D.蓝光(B);E-F.红蓝光(R3B1)图5 不同光质处理下杉木组培苗叶片叶绿体超微结构Cw. Cell wall; Chl. Chloroplast; Sg. Starch granule; Os. Osmiophilic; Mit. Mitochondria; Gl. Grana lamella;A-B. White light (WCK); C-D. Blue light (B); E-F. Red-blue light (R3B1)Fig.5 The chloroplast ultrastructure in leaves of C. lanceolata seedlings under different light qualities
3 讨 论
光是影响植物生长和形态建成的重要因素,不同的光质及其组合对植物生长和形态建成的影响存在一定的差异。本研究发现,在杉木组培苗生根过程中,相较于蓝光而言红光更有利于组培苗生根,在单纯以红光为光源的条件下组培苗生根率远高于蓝光处理,而且以红光为主要光源辅以少量蓝光要比以蓝光为主要光源辅以少量红光的生根率更高,其中红蓝光质组合(R3B1)最有利于杉木组培‘洋020’的生根。这与已有研究中红心杉[23]、菊花等[28]、玉簪[29]和金线莲等[21]的生根结果类似,说明以红光为主要光源的复合光质促进组培苗生根存在一定普遍性,尽管不同种类植物生根对于复合光质中其他光质比例的需求存在差异。
在本研究筛选出适宜‘洋020’生根的最佳光质组合处理基础上,我们进一步以白光为对照,同时结合生根率最低的蓝光处理,分析3个处理之间组培苗叶片光合色素、叶绿素荧光参数、叶绿体超微结构和内源激素含量的差异,以期揭示不同光质组合介导的组培苗生根和生长的调控机理。研究结果表明,不同光质处理间组培苗的生物量表现为红蓝光质组合(R3B1)>白光(WCK)>蓝光(B)。众所周知,植物生物量的积累主要来源于光合碳同化产物的积累,而生物量的积累又与光合色素含量和植物对光能利用率等密切相关[30]。本研究发现,不同光质处理条件下杉木组培苗叶片叶绿素和类胡萝卜素含量均表现为:红蓝光质组合(R3B1)>蓝光(B)>白光(WCK),与上述生物量大小顺序并不完全一致,因此导致不同处理间的组培苗生物量积累的差异,除光合色素含量外,可能还存在其他因素。
进一步分析各处理杉木组培苗叶片叶绿素荧光参数发现,除PSⅡ潜在光化学效率(Fv/Fo)大小表现为红蓝光质组合(R3B1)>白光(WCK)>蓝光(B)外,不同处理间其余叶绿素荧光参数均不存在显著差异。已有研究表明Fv/Fo的提高有利于增加具有活性PSⅡ反应中心的数量,增强将光能转化为化学能的效率,为光合碳同化过程提供充足的能量,进而提高光合效率[31]。因此,红蓝光质组合(R3B1)处理条件下植株叶片具有较高的Fv/Fo值也是导致不同处理间生物量积累差异的原因之一。此外,从叶绿体超微结构来看,在红蓝光质组合(R3B1)条件下叶绿体中淀粉粒和嗜锇体颗粒数量相对少,且基质和基粒片层结构清晰,基粒类囊体排列紧密有序,而在蓝光条件下其片层结构松散,淀粉粒数量增加,且体积大。大量淀粉粒的存在也不利于光合产物的输出,而且还会对植物光合作用产生抑制[32]。因此,不同处理间叶绿体超微结构的差异也是导致杉木组培苗生长差异的可能原因之一。可见,在红蓝光质组合(R3B1)处理条件下,杉木组培苗生物量高于白光和蓝光处理,主要由于红蓝光处理下叶片具有较高的光合色素含量、光能利用率和合理的叶绿体超微结构,从而使植株具有较强的碳同化和输出能力。
植物的生根与内源激素含量关系密切,尤其与生长素(IAA)和细胞分裂素(CTK)的含量及其比值密切相关[33]。一般而言,IAA能促进不定根的形成,而CTK则抑制生根。本研究发现不同光质处理下杉木组培苗叶片和茎中IAA含量均表现为红蓝光质组合(R3B1)>白光(WCK)>蓝光(B),而CTK表现则刚好相反,可见红蓝光质组合(R3B1)处理有利于促进组培苗IAA合成,抑制CTK合成或促进其降解,最终促进组培苗生根。除二者含量外,IAA/CTK比值也是影响植物生根的重要因素。器官分化调控理论认为,IAA/CTK比值大于1时有利于促进不定根形成,而该比值小于1时则有利于不定芽分化,而当该比值接近1时,则倾向于无组织结构的愈伤组织的形成[34]。本研究中发现,在红蓝光质组合(R3B1)处理杉木组培苗叶和茎中IAA/CTK的比值分别为1.67和1.81,分别是蓝光处理的1.42和1.31倍,由此可见,促进IAA的积累,降低CTK的含量,进而提高IAA/CTK比值是不同光质条件下组培苗生根差异的主要原因。
不同光质条件下植物的光形态建成大都通过光受体信号转导途径,调控下游的激素合成相关基因的表达,进而最终实现对植物生长的调控[35]。例如,遮阴条件引起的红光:远红光比值下降会通过光受体隐花色素(phytochrome)调控下游PIF(phytochrome interacting factor)转录因子来增强生长素合成相关基因的表达,增加生长素含量,进而促进植物生长,形成典型的避荫反应[36]。一些研究表明,不同光质也可通过影响植物内源激素的稳态平衡,从而对植物的生长产生影响[37]。苏娜娜等[38]研究发现,红光可促进黄瓜幼苗下胚轴中IAA和赤霉素(GA)的积累,促进黄瓜幼苗的伸长生长,而蓝光下IAA和GA含量显著下降,从而表现出矮化表型。类似地,余让才等[39]研究也表明,与对照相比,蓝光处理显著抑制水稻幼苗GA和IAA的积累,从而抑制幼苗生长。相关研究也发现在红光条件下三叶青具有较高的株高与其具有较高的IAA和GA水平密切相关,而在蓝光下刚好相反,从而使植株表现出矮壮的表型[40]。本研究中,红蓝光质组合(R3B1)处理条件下杉木组培苗叶片和茎中IAA和GA含量显著高于白光和蓝光处理,这与该处理下植株具有较高的苗高结果相一致。尽管目前在杉木中不同光质介导的IAA和GA含量变化调控的确切机制尚不清楚,但一些研究表明这可能与红光可通过光敏色素调控GA和IAA合成相关酶活性,进而促进二者积累,而蓝光可通过增加吲哚乙酸氧化酶活性,促进IAA分解,进而导致IAA含量下降有关[41-43]。因此,上述结果共同表明,不同光质处理引起组培苗苗高生长的差异可能通过不同光质调控GA和IAA水平来实现。此外,作为胁迫型激素,脱落酸(ABA)对植株株高生长通常起着负调控的作用,而且在植物生长发育过程中它与GA存在一定程度的拮抗作用[44]。在本研究红蓝光质组合(R3B1)处理条件下,杉木组培苗叶片ABA含量显著低于蓝光和白光处理,因此具有较低的ABA含量可能也是红蓝光处理下组培苗具有较高苗高的原因之一。值得注意的是,部分研究表明植株的高低与其内源激素含量比值也存在一定关系。例如,在不同桃树品种中,矮化和半矮化桃树品种GA/ABA和IAA/ABA的比值显著低于野生型,而CTK/GA的比值显著高于野生型品种[45]。类似结果在黄瓜中也有发现[46]。在本研究中,红蓝光质组合(R3B1)处理条件下杉木组培苗叶片和茎中GA/ABA和IAA/ABA的比值显著高于白光和蓝光处理,而其CTK/GA的比值显著低于白光和蓝光处理,与前人研究结论类似。因此,具有较高的GA/ABA和IAA/ABA比值以及较低的CTK/GA比值也是红蓝光处理下组培苗具有较高株高的原因之一。
综上所述,不同光质处理可能通过杉木组培苗光合色素含量、光能利用率、内源激素含量等的影响,进而对组培苗的生根和生长产生调控。其中:(1)红蓝光质组合(R3B1)处理下生根率显著高于蓝光和白光对照处理与其具有较高的IAA含量、较低的CTK含量以及较高的IAA/CTK比值有关;(2)红蓝光质组合(R3B1)处理下组培苗苗高显著高于蓝光和白光对照处理与其具有较高的GA和IAA含量、较低的ABA含量以及较高的GA/ABA和IAA/ABA比值有关;(3)与蓝光和白光对照处理相比,红蓝光质组合(R3B1)处理更有利于促进光合色素含量增加,提高叶片光能利用效率以及促进叶片叶绿体基质和基粒片层结构的形成,即增强碳同化产物的输出是红蓝光质组合(R3B1)处理促进组培苗生物量积累的重要原因。

