糖尿病对全膝关节置换术术后急慢性疼痛的影响
蔡俊强 曹明 艾娟 段宋萍 屠伟峰 郄文斌
1中国人民解放军南部战区总医院麻醉科(广州 510010);2南方医科大学第一临床医学院(广州 510599);3广东省中医院麻醉科(广州 510010);4南京医科大学附属科技城医院麻醉学部(江苏 苏州 215009)
国际糖尿病联盟报道,2021年全球20~79 岁人群的糖尿病患病率估计为10.5%(5.366 亿人),到2045年将上升到12.2%(7.832 亿人)[1],且随着糖尿病发病率的增加,现如今合并糖尿病的手术患者越来越多。动物试验发现,阿片类药物对糖尿病大鼠的镇痛作用减弱[2]。临床研究也发现,在全子宫切除术中,糖尿病患者术后疼痛程度更为严重且需要更多的阿片类药物治疗[3],可见,糖尿病的特殊病理生理改变可能促进术后急慢性疼痛的发生发展。此外,糖尿病是导致骨性关节炎(osteoarthritis,OA)出现严重疼痛等症状的独立危险因素,且据报道,接受全膝关节置换术(total knee replacement,TKR)的患者中大约有25.2%的患者合并糖尿病[4],而糖尿病是否促进TKR 术后疼痛的发生发展尚不清楚。因此,本课题组进行了一项观察队列研究,主要研究糖尿病对TKR 术后急慢性疼痛的影响。
1 资料与方法
1.1 一般资料本研究获得中国人民解放军南部战区总医院伦理委员会批准通过(院伦理[2019]6号),并在中国临床试验中心注册(注册号:ChiCTR2000029077)。纳入2019年10月至2021年3月中国人民解放军南部战区总医院骨病关节科诊断为OA 且根据Kellgren-Lawrence 分类诊断为≥3 级OA 拟择期行TKR 的患者60 例,年龄50~75 周岁,ASAⅠ~Ⅲ级,术后自愿进行自控静脉镇痛治疗且同意配合并充分了解本研究者。排除标准:糖尿病前期(空腹血糖受损和糖耐量受损)或糖尿病神经病变(密西根神经病变筛选表MNSI 评分≥2 分),阿片类药物过敏或滥用,椎管内麻醉禁忌证等。脱落标准:术后患者自行退出研究,腰硬联合麻醉穿刺失败,镇痛泵运行故障,术后失访。糖尿病诊断标准:既往诊断为糖尿病患者,或满足以下任一标准:(1)糖尿病症状+任意时间血浆葡萄糖水平≥11.1 mmol/L;(2)空腹血浆葡萄糖水平≥7.0 mmol/L;(3)口服糖耐量试验2 h血糖≥11.1 mmol/L;(4)HbA1c ≥6.5%。
本研究共纳入患者63 例,其中2 例因术中腰硬联合麻醉失败改为全身麻醉,1 例术后失访,共3 例脱落不纳入统计学分析,最终共60 例,其中NC 组30 例,男5 例,女25 例,年龄(60.9±4.8)岁,BMI(26.8±4.2)kg/m2,总住院时间8.0(7.0,10.0)d;D 组30 例,男5 例,女25 例,年龄(61.6±6.0)岁,BMI(26.7±3.4)kg/m2,总住院时间9.0(8.0,11.0)d,两组比较差异无统计学意义(P>0.05)。NC 组OA病史比D 组[8.0(4.5,10.0)年vs.3.0(1.0,6.0)年,P<0.05],术后住院时间NC 组比D 组较短[5.0(4.0,7.0)dvs.6.0(5.0,7.0)d,P<0.05],D 组 血糖值术前(7.0±1.1)mmol/L、切皮后5 min(7.0±1.5)mmol/L、术毕时(8.1±1.5)mmol/L,分别高于NC 组术前(5.5±0.8)mmol/L、切皮后5 min(6.0±1.0)mmol/L、术毕时(6.1±0.9)mmol/L,差异有统计学意义(P<0.05)。
1.2 麻醉及手术所有患者术前均不给予用药,入室开放静脉通道,监测心电图(ECG)、无创血压(NIBP)、脉搏血氧饱和度(SpO2)。术中鼻导管低流量吸氧2 L/min,输注液体量按标准补液方法实施。两组患者均采用腰硬联合麻醉,于蛛网膜下腔给予布比卡因8~13 mg 后置入硬膜外导管,将麻醉平面控制在T8 以下,术中麻醉镇痛不足时硬膜外追加2%利多卡因3~5 mL。所有的麻醉操作均由有5年工作经验的主治麻醉医生或在其指导下的住院医师执行。所有的手术由同一组医生完成,均使用人工关节假体(施乐辉医用产品国际贸易有限公司)。手术结束时所有患者接受静脉镇痛。镇痛泵配方为:2 μg/kg 舒芬太尼和50 mg 多拉司琼,总量120 mL,背景剂量为1.5 mL/h,单次按压剂量为1.5 mL/次,锁定时间为15 min。
术前对患者进行VAS 疼痛评分和机械压痛阈的测量方法宣教,出院前进行VRS(Verbal Rating Scale)疼痛评估方法宣教,减少患者的主观偏差。
1.3 观察指标
1.3.1 机械压痛阈采用电子测痛仪(IITC Life Science;Woodland Hills,CA,USA)记录术前、术后3、6、24、48、72 h 机械压痛阈。
1.3.2 VAS 评分采用数字模拟评分法(VAS 评分),记录术前、术后3、6、12、24、48、72 h 静息和运动时VAS 评分。
1.3.3 舒芬太尼消耗量及镇痛不良反应记录患者静脉镇痛泵术后3、6、12、24、48、72 h 舒芬太尼消耗量,术后72 h 镇痛泵总按压次数及有效按压次数,并记录恶心、呕吐等不良反应。
1.3.4 血清炎性因子测定采用酶联免疫吸附法检测术前以及术后3 h 静脉血中TNF-α、IL-6、IL-10 浓度。IL-6、IL-10 试剂盒由RayBIO 公司生产,产品编号为ELH-IL6、ELH-IL10,产品批次为0802190140、1025190145;TNF-α 试剂盒由睿信公司生产,产品编号为SU-B 11776,产品批次为Oct2020。
1.3.5 术后慢性疼痛术后3、6 个月时对患者进行电话随访,询问并记录患者术后慢性疼痛的发生情况包括是否还有疼痛感以及疼痛程度,疼痛程度采用口述评分量表(VRS)进行评估。VAS 评分、机械压痛阈以及术后慢性疼痛的随访均由对本试验分组情况不了解的护士进行评估。
1.4 统计学方法采用SPSS 21.0 统计软件进行数据统计分析,符合正态分布的连续数据用平均值±标准差表示,并使用两独立样本t检验进行比较。非正态分布的连续变量采用中位数进行描述,并使用Mann-WhitneyU检验进行比较。计数资料采用百分数描述,并使卡方检验进行比较。在所有分析中,P<0.05认为差异具有统计学意义。
2 结果
2.1 两组患者机械压痛阈和VAS 评分比较在静息及运动状态下,与NC 组相比,D 组患者术后3、6、12、24、48、72 h VAS 评分均升高(P<0.05),见表1。D 组患者术前、术后3、6、12、24、48、72 h时的机械压痛阈显著降低(P<0.05),见表2。
表1 两组患者VAS 评分Tab.1 Comparison of VAS in two groups ±s
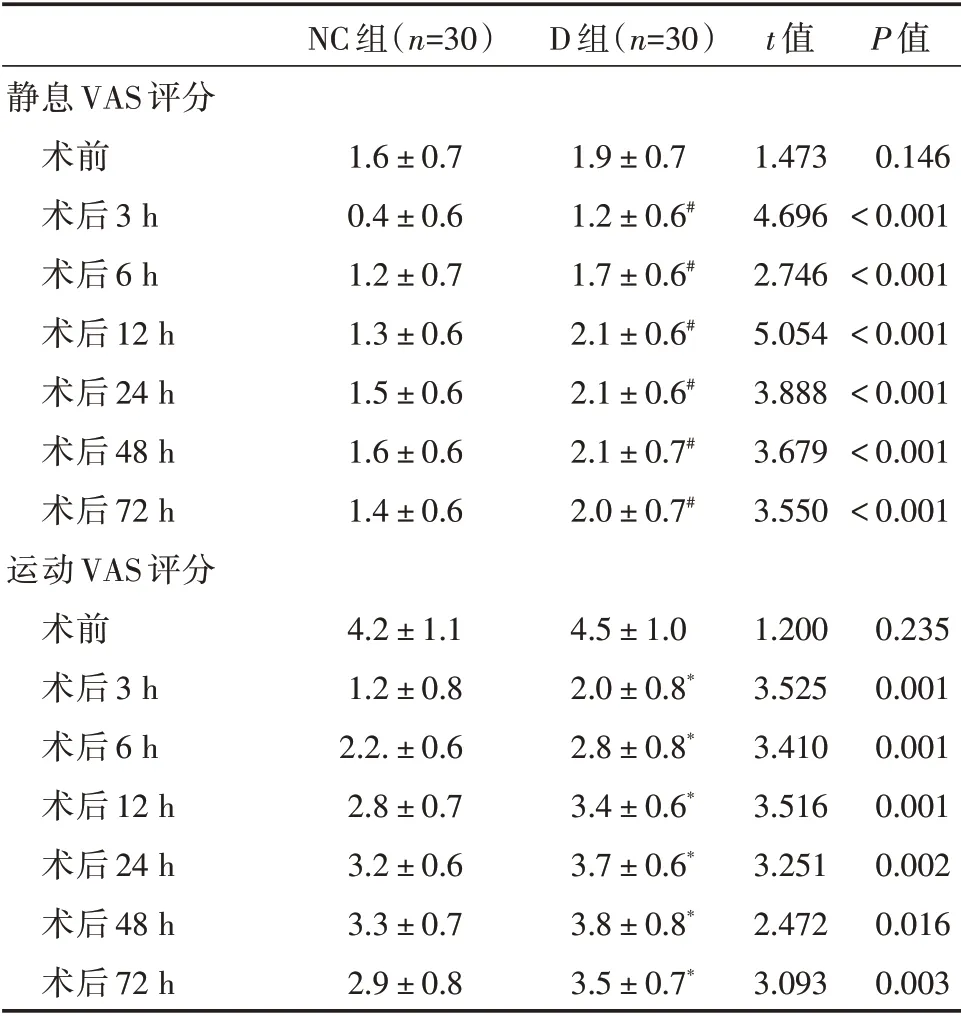
表1 两组患者VAS 评分Tab.1 Comparison of VAS in two groups ±s
注:与NC 组比较,*P<0.05,#P<0.001
NC 组(n=30)D 组(n=30)t 值P 值静息VAS 评分术前术后3 h术后6 h术后12 h术后24 h术后48 h术后72 h运动VAS 评分术前术后3 h术后6 h术后12 h术后24 h术后48 h术后72 h 1.6±0.7 0.4±0.6 1.2±0.7 1.3±0.6 1.5±0.6 1.6±0.6 1.4±0.6 1.9±0.7 1.2±0.6#1.7±0.6#2.1±0.6#2.1±0.6#2.1±0.7#2.0±0.7#1.473 4.696 2.746 5.054 3.888 3.679 3.550 0.146<0.001<0.001<0.001<0.001<0.001<0.001 4.2±1.1 1.2±0.8 2.2.±0.6 2.8±0.7 3.2±0.6 3.3±0.7 2.9±0.8 4.5±1.0 2.0±0.8*2.8±0.8*3.4±0.6*3.7±0.6*3.8±0.8*3.5±0.7*1.200 3.525 3.410 3.516 3.251 2.472 3.093 0.235 0.001 0.001 0.001 0.002 0.016 0.003
表2 两组患者机械压痛阈Tab.2 Comparison of mechanical withdrawal threshold in two groups ±s
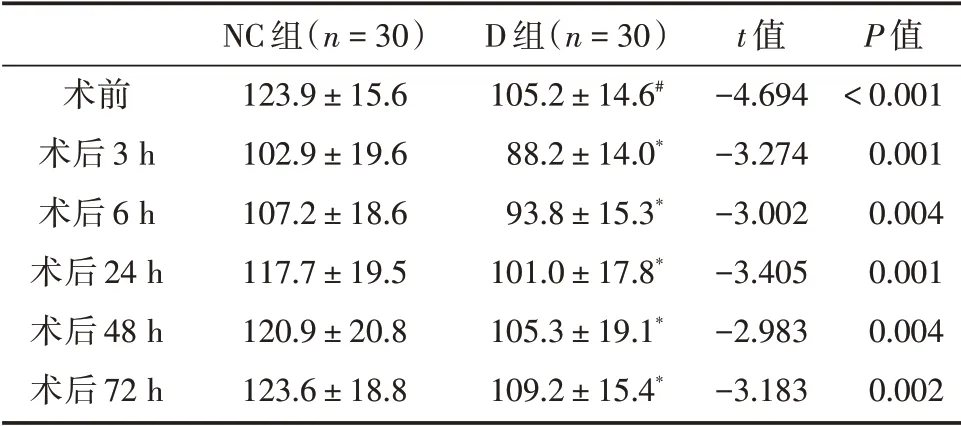
表2 两组患者机械压痛阈Tab.2 Comparison of mechanical withdrawal threshold in two groups ±s
注:与NC 组比较,*P<0.05,#P<0.001
术前术后3 h术后6 h术后24 h术后48 h术后72 h NC 组(n=30)123.9±15.6 102.9±19.6 107.2±18.6 117.7±19.5 120.9±20.8 123.6±18.8 D 组(n=30)105.2±14.6#88.2±14.0*93.8±15.3*101.0±17.8*105.3±19.1*109.2±15.4*t 值-4.694-3.274-3.002-3.405-2.983-3.183 P 值<0.001 0.001 0.004 0.001 0.004 0.002
2.2 两组术后PCA 舒芬太尼用量及不良反应比较与NC 组相比,D 组患者术后镇痛3、6、12、24、48、72 h 时舒芬太尼用量以及术后72 h 内静脉镇痛泵的总按压次数和有效按压次数均明显增加(P<0.05),两组之间恶心呕吐、眩晕的发生率差异均无统计学意义(P>0.05),见表3。
表3 两组术后PCA 舒芬太尼用量及不良反应Tab.3 Consumption of sufentanil and adverse reaction in two groups ±s

表3 两组术后PCA 舒芬太尼用量及不良反应Tab.3 Consumption of sufentanil and adverse reaction in two groups ±s
注:与NC 组比较,*P<0.05
NC组(n=30)D组(n=30)t/χ2/Z值P值舒芬太尼(μg)术后3 h术后6 h术后12 h术后24 h术后48 h术后72 h总按压次数[M(P25,P75),次]有效按压次数[M(P25,P75),次]恶心呕吐[例(%)]眩晕[例(%)]4.55±1.24 9.90±2.52 18.28±4.14 30.48±8.14 41.17±12.21 44.76±13.23 3.0(1.0,7.0)5.76±2.52*12.00±4.35*22.45±7.05*35.52±12.28 51.66±23.99*57.72±27.61*5.0(2.0,11.0)*2.316 2.251 2.749 1.841 2.097 2.281-2.106 0.026 0.029 0.009 0.072 0.042 0.028 0.036 3.0(1.0,6.0)4(13.3)2(6.7)4.0(2.0,9.0)*6(20)3(10)-2.026 0.480 0.218 0.043 0.488 0.640
2.3 两组术前及术后3 h 血清炎性因子比较D组患者术前及术后3 h 血清IL-6、TNF-α 以及IL-10水平,与NC 组患者相比差异无统计学意义(P>0.05),见表4。
表4 两组患者炎性因子比较Tab.4 Comparison of cytokines between the two groups ±s
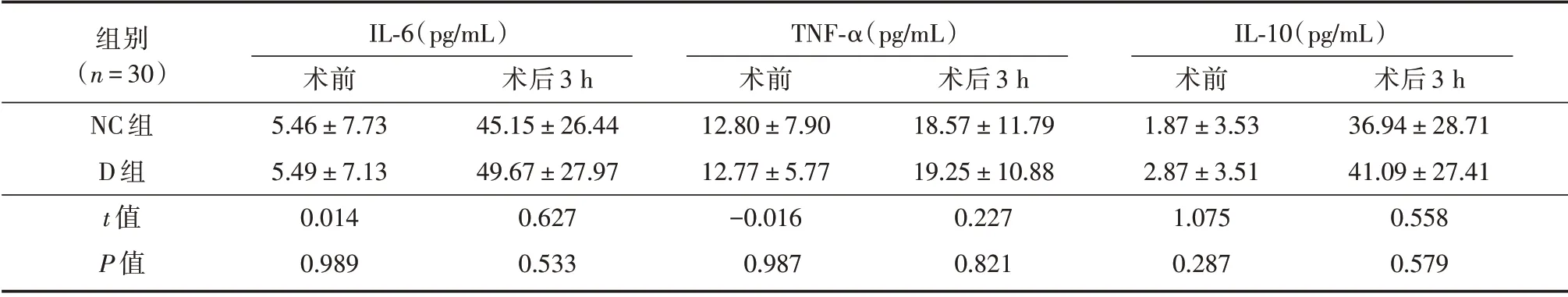
表4 两组患者炎性因子比较Tab.4 Comparison of cytokines between the two groups ±s
组别(n=30)NC 组D 组t 值P 值IL-6(pg/mL)术前5.46±7.73 5.49±7.13 0.014 0.989术后3 h 45.15±26.44 49.67±27.97 0.627 0.533 TNF-α(pg/mL)术前12.80±7.90 12.77±5.77-0.016 0.987术后3 h 18.57±11.79 19.25±10.88 0.227 0.821 IL-10(pg/mL)术前1.87±3.53 2.87±3.51 1.075 0.287术后3 h 36.94±28.71 41.09±27.41 0.558 0.579
2.4 术后慢性疼痛比较D 组术后6 个月时,术后慢性疼痛的发生率和疼痛程度均高于NC 组,差异有统计学意义(P<0.05),术后3 个月时两组之间疼痛发生率和疼痛程度差异无统计学意义(P>0.05),见表5。
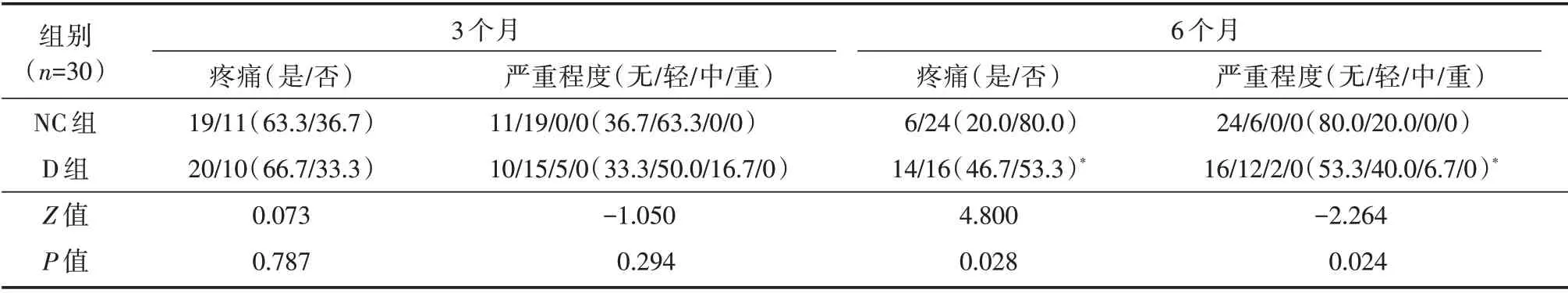
表5 术后3、6 个月内慢性疼痛发生率及严重程度Tab.5 The incidence and severity of chronic postoperative pain at 3rd and 6th months
3 讨论
本实验结果显示,糖尿病患者术前、术后3、6、12、24、48、72 h 的机械压痛阈阈值显著降低,提示糖尿病患者TKR 围术期的痛觉敏感程度高于非糖尿病患者。这与杨小宁等[5]动物实验得出糖尿病大鼠处于痛觉过敏状态且随着病程加重的研究相似,原因可能与高血糖对周围神经的直接毒性引起的局灶损伤有关。糖尿病患者在长期高血糖刺激下,导致细胞内糖基化终末产物的形成、炎性细胞因子升高、多元醇途径的糖代谢增加、氧化应激增强等病理生理改变,这些病理生理改变可导致糖尿病患者发生神经病变,从而导致痛觉敏感性的增加。
本实验发现,糖尿病患者TKR 术后3、6、12、48、72 h 舒芬太尼镇痛用量和术后72 h 内PCA 镇痛泵的总按压次数和有效按压次数,以及术后3、6、12、24、48、72 h 静息和运动VAS 评分均高于非糖尿病患者,这KARCI 等[3]研究结果类似。长期高血糖可导致患者发生阿片受体数量减少和构象变化,使得阿片类药物与阿片受体结合异常,从而导致术后疼痛程度增加以及阿片类药物需要量增加[6],且在临床观察研究中也发现,血糖水平控制不佳是引起糖尿病性神经痛的重要独立危险因素之一,将血糖控制在合理范围可以恢复糖尿病患者神经损伤以及缓解糖尿病神经病理性疼痛[7]。此外,先前的实验也证实处于痛觉过敏状态的患者术后疼痛强度较高[8],这也与本实验研究结果显示糖尿病患者围术期处于痛觉敏感状态相符合。
糖尿病及其并发症可能长期导致不同器官的功能失调,随着糖尿病的进展,糖尿病患者可出现代谢酶活性的改变以及血浆蛋白质结合率的变化等,这些病理生理变化都会对常用药物的药代学及药动学产生影响[9-10]。动物研究[11]发现,吗啡在糖尿病大鼠体内的总清除率和表观分布体积等药代学参数均增加,长期糖尿病引起的蛋白糖基化可能是导致吗啡表观分布体积增加的主要原因,这使得吗啡的镇痛作用减弱,该机制可能是本实验中D 组患者术后72 h 舒芬太尼用量增加以及疼痛程度升高的原因。
此外,高血糖会增加IL-6 或TNF-α 炎性因子的表达,引起炎性反应[12]。IL-6 可以诱导关节伤害性感受器对机械刺激的持久敏感化,是诱导痛觉敏化的主要细胞因子[13]。因为术后急性疼痛与慢性疼痛的发生和发展与术后炎性因子水平的高低呈正相关关系[14],因此,糖尿病患者的慢性炎性状态可能是导致术后发生严重疼痛的原因之一。本实验结果显示,两组之间术前和术后3 h 血清IL-6、TNF-α 以及IL-10 水平相比差异无统计学意义,推测糖尿病术后发生严重疼痛可能与血清中炎症因子差异无关而与局部炎症因子差异有关[15],高血糖可通过氧化应激和多元醇途径增强IL-1β诱导的软骨细胞炎症反应,从而促进软骨细胞分泌IL-6,使得糖尿病患者骨性关节炎软骨中IL-6的释放量明显升高[16],EITNER 等[17]也发现,在糖尿病和终末期膝关节患者的滑膜液中包括IL-6 在内的炎症标志物浓度更高,与疼痛评分呈正相关。
以往研究[18]表明,糖尿病与膝骨性关节炎患者疼痛严重程度的增加有关。本实验观察结果提示,糖尿病患者从患有骨性关节炎到行关节置换术的时长比非糖尿病患者短,这可能与糖尿病促进骨性关节炎进展有关,长期糖尿病可导致关节胶原蛋白糖基化以及活性氧的高表达从而促进骨性关节炎的发展[19]。此外,糖尿病是术后发生感染、伤口愈合不良等不良事件的高危因素[20],可导致患者术后住院时间延长,本实验结果也发现,与非糖尿病患者相比,糖尿病患者术后住院时间延长。
本实验发现,糖尿病患者TKR 术后6 个月慢性疼痛的发生率和疼痛严重程度较严重,这可能与术后急性疼痛的控制不良有关,术后急性期的疼痛没有得到有效的控制,可能导致患者在术后遭受持续性疼痛。本实验的研究结果表明,糖尿病患者术后3 d 疼痛评分以及舒芬太尼消耗量高于非糖尿病患者,这也可能是糖尿病患者术后慢性疼痛的发生率和疼痛程度较高的原因之一。术后慢性疼痛也可能与糖尿病患者处于“慢性低度炎症状态”以及“痛觉敏感状态”有关[21]。另外术后慢性疼痛的发生可能与糖尿病患者术后血糖控制有关,AMUSAT 等[22]的研究显示,糖尿病患者术后血糖控制不良可使得TKR 术后6 个月恢复变得缓慢,且疼痛程度更高。患者血糖控制情况是TKR 术后康复的重要影响因素,与血糖控制良好的患者相比,血糖控制较差的患者围手术期并发症和病死率更高。
本研究存在一定的局限性,虽然排除了糖尿病前期以及糖尿病神经病变的患者,但对于患糖尿病的时长没有进行严格的分类,这可能会出现不同时长的糖尿病病情对患者术后疼痛的影响不同,有待进一步观察。
综上所述,本实验结果表明糖尿病加重TKR术后急性疼痛的严重程度和增加术后镇痛舒芬太尼用量,也增加了术后慢性疼痛的发生率和严重程度,需要进一步的研究来确定糖尿病患者上述变化的潜在机制,为此类手术糖尿病患者完善的术后镇痛提供较好的临床指导依据。

