川芎嗪对脐带间充质干细胞移植缺血性脑卒中迁移率的影响及作用机制
曹慧玲 汪小蓉 朱小飞 张洁 钱世宁
南京中医药大学附属医院检验科(南京 210029)
缺血性脑卒中严重威胁患者的生命,临床以溶栓为主要治疗手段,但溶栓具有时效性,超过时间则疗效不佳,并且溶栓治疗同时还会导致缺血部位的再灌注,有可能进一步加重神经细胞的损伤[1]。缺血再灌注引起的神经损伤给患者后期的生存质量带来极大的困扰,因此,亟待找寻促进神经细胞再生修复进而恢复神经功能的治疗手段。再生医学在组织器官修复治疗领域拥有良好的应用前景[2],干细胞移植是再生医学中重要的一部分,已成为当前热门的治疗手段,研究表明干细胞能有效促进损伤部位细胞的再生与修复,已在临床上得到认可[3],脐带间充质干细胞取自废弃的脐带组织,具有细胞更加原始,自我更新及分化能力更强,免疫源性更低等特点,在移植治疗中展现优势。尽管如此,干细胞移植仍存在移植效率低以及伦理等方面的限制[4],成为亟需解决的问题之一。另外,中医药博大精深,其在治疗脑卒中方面也取得了显著疗效,川芎嗪作为临床常用药物之一,对缺血再灌注损伤的神经细胞有明显的保护作用,促进脑卒中患者神经功能的恢复[5]。曾有研究报道中医药与干细胞联合治疗较单一手段疗效更为显著[6]。然而,国内有关川芎嗪与脐带间充质干细胞联合应用的相关研究较少,前期实验中笔者也发现川芎嗪联合脐带间充质干细胞通过修复神经细胞及抑制炎症反应治疗缺血性脑卒中取得了良好的效果[7],并且体外川芎嗪对脐带间充质干细胞也有良好的促神经分化、促分泌及促转移的作用[8]。川芎嗪处理可能成为解决干细胞移植效率低的有效手段,为进一步探讨川芎嗪对于ucMSCs 移植迁移率的影响及其作用机制,本研究将川芎嗪预处理后的ucMSCs 移植入大鼠脑缺血再灌注模型(MCAO)中,并模拟体内微环境观察药物对干细胞移植后迁移定位的影响,为解决干细胞移植效率难题提供实验数据,也为中药与干细胞联合治疗的临床应用提供依据。
1 材料与方法
1.1 材料实验动物为SD雄性大鼠(250~300 g),购自上海捷思杰实验动物有限公司。实验用药物川芎嗪购自美国Sigma公司。实验用细胞为携带绿色荧光蛋白(GFP)的人脐带间充质干细胞,购自美国Sciencell,Carlsbad 公司。PC12 细胞(大鼠肾上腺嗜铬细胞瘤细胞株)购自南京凯基生物科技有限公司。Transwell 小室购自美国Corning 公司。
1.2 仪器与试剂生物荧光倒置显微镜(日本Olympus BX43);生物倒置显微镜(日本OLYMPUS IX51);蛋白成像系统(英国G:BOXChemiXR5,Syngene);脐带间充质干细胞培养液(7501)由美国Sciencell,Carlsbad 公司提供;SDF-1(BA1389,1∶100)和CXCR4(PA1237,1∶500)均由武汉博士德生物工程有限公司提供;GAPDH(KGAA002,1∶10 000)抗体由南京凯基生物提供;AMD3100 由美国Sigma 公司提供;SDF-1 抗体由英国Abcam 公司提供;IL-1β ELISA 试剂盒由南京凯基生物提供;DAPI 染色试剂盒(KGA215)、全蛋白抽提试剂盒(KGP250)和Western blotting检测试剂盒(KGP1201)均由南京凯基生物科技有限公司提供。
1.3 方法
1.3.1 实验分组随机选择实验动物分为6 组,每组各10 只。正常组:实验大鼠不做任何处理;假手术组:造模过程中不阻塞大鼠中动脉;模型组:建立MCAO 模型,尾静脉给予磷酸盐缓冲液(PBS);ucMSCs 组:尾静脉注射GFP 慢病毒转染人脐带间充质干细胞(ucMSCs)2×106个细胞/只;ucMSCs +TMP 组:实验前TMP(200 μmol/L)预处理ucMSCs 24 h,然后尾静脉注射2×106个细胞/只;ucMSCs+TMP+ADM3100 组:实验前TMP(200 μmol/L)预处理ucMSCs-GFP 24 h,再经100 μg/mL AMD3100 处理8 h,然后尾静脉注射2×106个细胞/只。
1.3.2 建立大鼠缺血性脑卒中模型采用线栓法建立脑中动脉栓塞模型(MCAO),具体方法见参考文献[7],尾静脉输注细胞,7 d 后观察各项指标变化。
1.3.3 荧光显微镜观察携GFP 干细胞的定位预处理:取冰冻组织切片4~5 μm,浸入1%的丙酮固定液,室温固定5 min,晾干,PBS 浸洗3 min×3;灭活酶:每张切片滴加2 滴3%H2O2-甲醇溶液,室温(15~25 ℃)封闭10 min,PBS 浸洗3 次;封闭:滴加1%BSA 50~100 μL,室温孵育20 min;抗原-抗体反应:滴加一抗(1∶100/500 稀释)50~100 μL,37 ℃,湿盒孵育2 h,PBS 浸洗3 次;一抗二抗反应:滴加TRITC(1∶200 稀释)二抗50~100 μL,37 ℃,避光孵育1 h;复染:每张片子滴加配制DAPI 染液50~100 μL,室温避光放置5 min;封片:用防淬灭封片胶封片;观察:荧光显微镜下观察细胞中蛋白的表达情况,取3 个表达区域拍照保存。
1.3.4 Western blot 检测目标蛋白Western blot检测细胞迁移相关蛋白SDF-1 和CXCR4 的表达,具体方法参照文献[8]。
1.3.5 Transwell 检测细胞迁移应用PC12 细胞生长至80%融合后,加入200 μmol/L 的H2O2作用12 h后,去除培养基作为损伤PC12模型。Transwell检测脐带间充质干细胞的迁移能力,小室下层为损伤PC12 细胞或经200 μmol/L TMP 预处理后PC12细胞,上层为1×105ucMSCs,对照孔为未经TMP 处理的ucMSCs 细胞,试验孔为200 μmol/L TMP 预处理24 h以及100 μg/mL AMD3100处理8 h的ucMSCs细胞,具体方法参照文献[8]。
1.4 统计学方法采用SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差表示,多个时间点的行为评分数据采用重复测量方差分析,组间比较用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 尾静脉移植ucMSCs 观察TMP 对干细胞迁移的影响脐带间充质干细胞(ucMSCs)呈成纤维细胞样生长,经慢病毒转染后,GFP 转染率达85%以上(图1A);移植后携带GFP 的移植细胞迁移定位于损伤组织,且TMP 预处理组迁移细胞数量(IOD 2.9×105)远远高于未处理ucMSCs 组(IOD 0.4×105),拮抗剂作用后迁移细胞数则下降至IOD 1.6×105,结果差异均有统计学意义(P<0.05,图1B);蛋白表达显示TMP 处理组和ucMSCs 组中SDF-1 和CXCR4 的表达均显著增加,以CXCR4 升高更为显著,且TMP 处理组明显高于ucMSCs 组和拮抗剂组(P<0.05),说明TMP 预处理提高了ucMSCs 的迁移效率,且与SDF-1/CXCR4 通路密切相关(图2)。
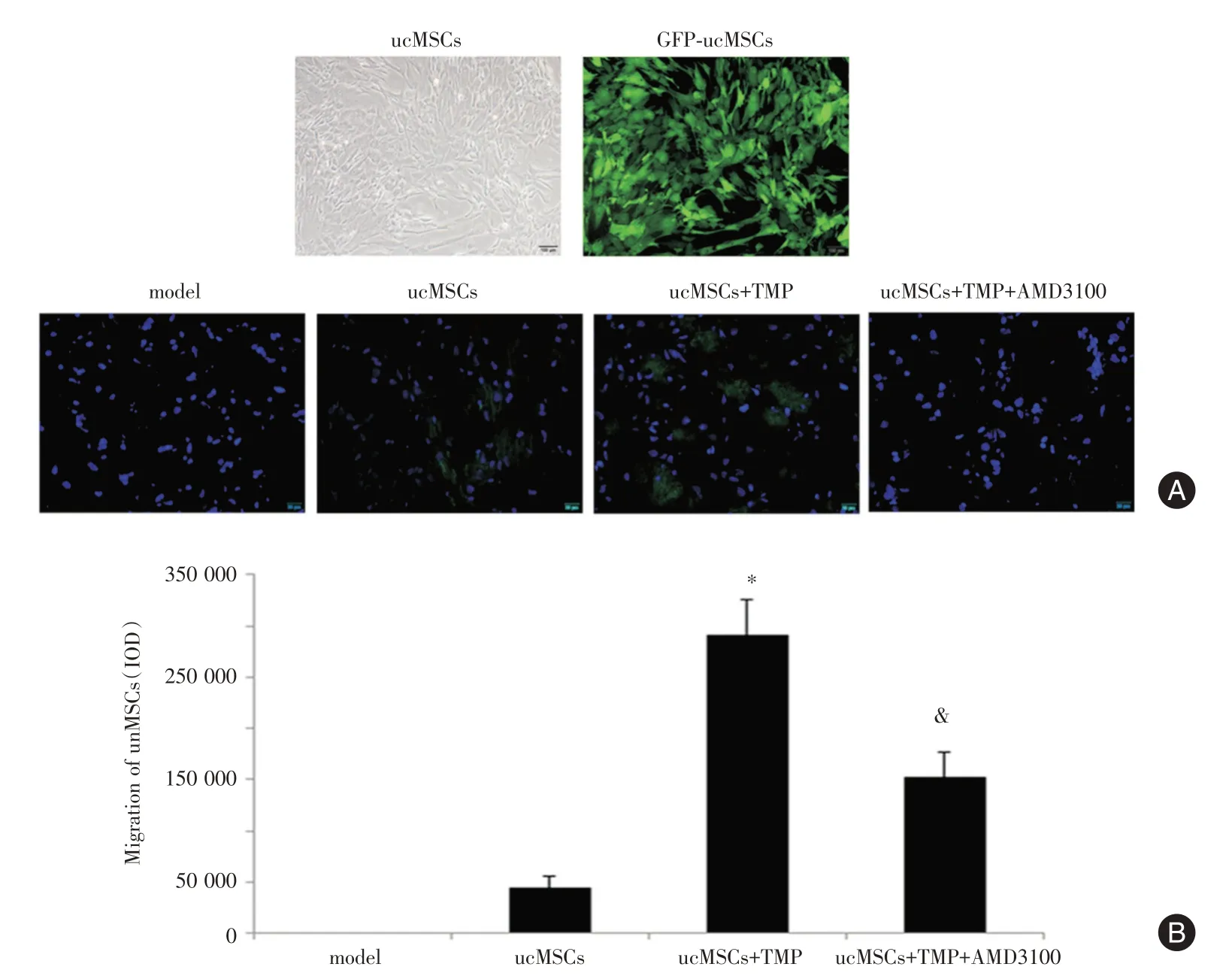
图1 TMP 对GFP-ucMSCs 迁移率的影响Fig.1 The effect of TMP on migration of GFP-ucMSCs
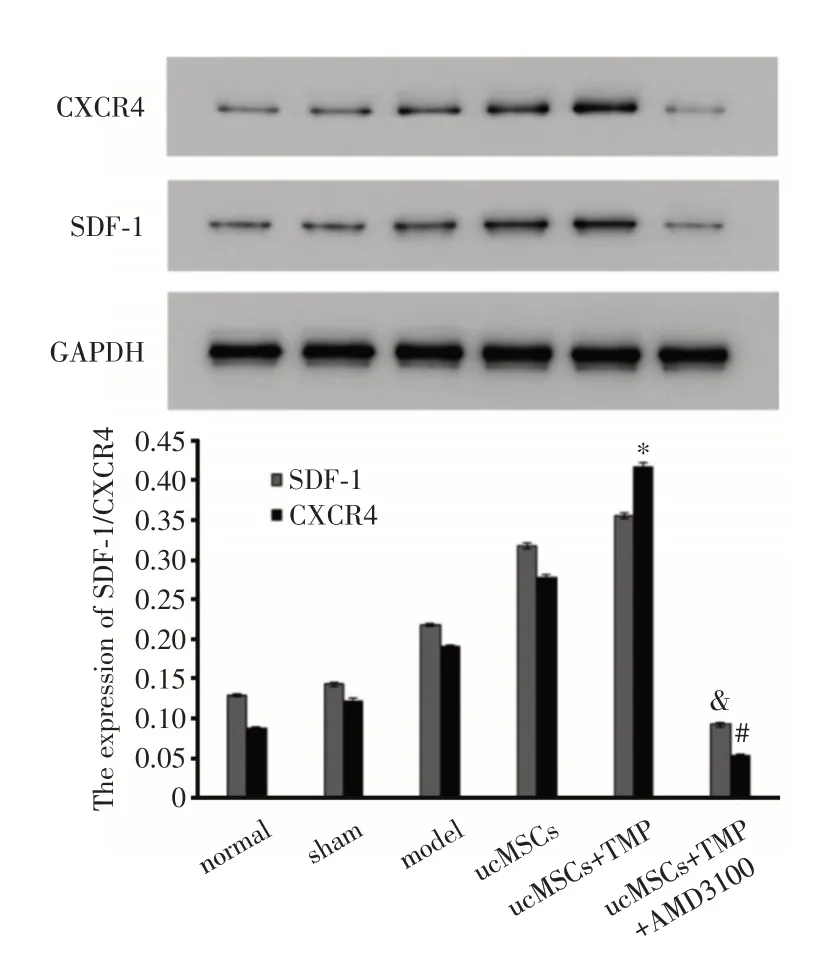
图2 各组SDF-1/CXCR4 蛋白表达Fig.2 The expression of protein SDF-1/CXCR4 in each group
2.2 川芎嗪促进ucMSCs的迁移及作用机制以氧化损伤PC12 细胞作为诱导剂,Transwell 法检测川芎嗪处理前后ucMSCs 的迁移情况,结果显示TMP预处理后ucMSCs 的迁移数量由未处理的每区域20 个提高至88 个(P<0.05),加入拮抗剂后数量降至每区域42 个(P<0.05),并且Western blot 也证实TMP 处理后ucMSCs 的CXCR4 的表达水平显著升高(P<0.05),而且可以被拮抗剂所抑制,明确SDF-1/CXCR4 通路在川芎嗪促进ucMSCs 迁移中的作用机制。见图3-5。
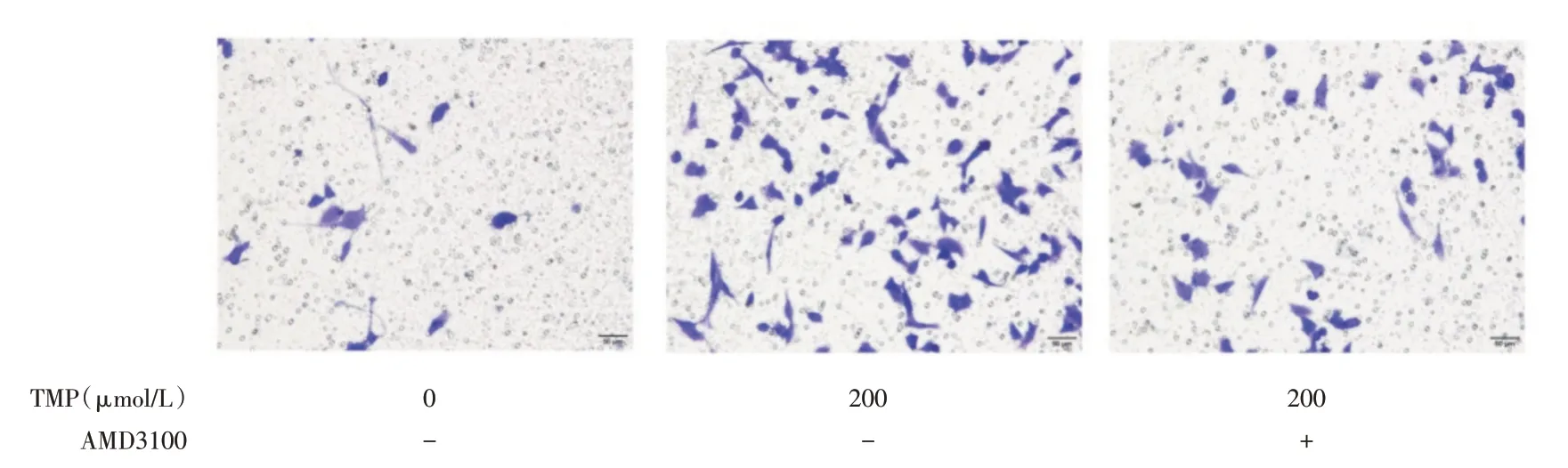
图3 TMP 对ucMSCs 迁移的影响(损伤PC12 诱导)Fig.3 The effect of TMP on migration of ucMSCs(induced by injured PC12 cells)
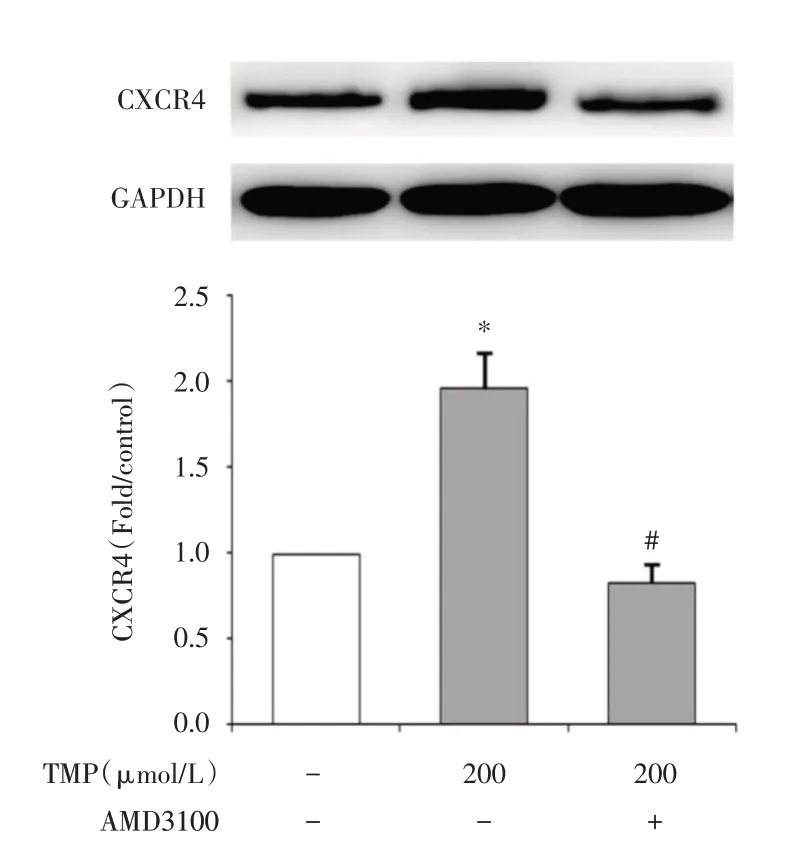
图4 CXCR4 的表达Fig.4 The expression of CXCR4
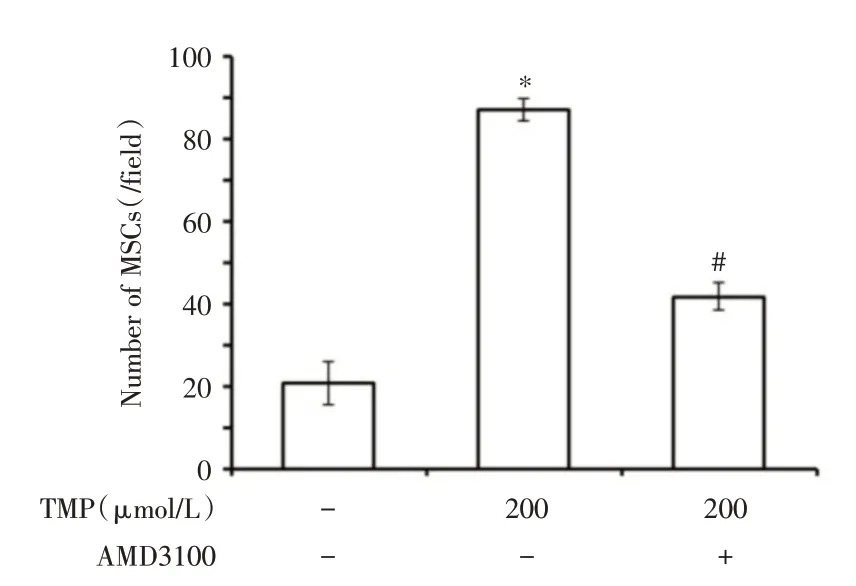
图5 TMP 对ucMSCs 迁移率的影响(损伤PC12 诱导)Fig.5 The effect of TMP on mobility of ucMSCs(induced by injured PC12 cells)
2.3 川芎嗪修复PC12 细胞损伤改善干细胞迁移微环境损伤PC12 经川芎嗪处理后诱导能力下调,ucMSCs 迁移减少,CXCR4 表达下调,TMP 处理PC12 细胞后,其IL-β 的表达显著降低,由17.2 降至13.5 pg/mL(P<0.05),说明TMP 可以修复PC12,进而降低ucMSCs 的迁移,同时抑制受损细胞炎症因子表达,改善移植微环境,见图6、7。
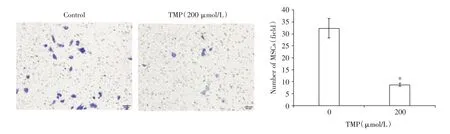
图6 TMP 处理损伤PC12 对ucMSCs 迁移率的影响Fig.6 The effect of injured PC12 pretreated by TMP on mobility of ucMSCs

图7 TMP 降低PC12 炎症因子IL-β 的表达水平Fig.7 The level of IL-β in PC12 cells was decreased by TMP treatment
3 讨论
近年来,干细胞移植治疗在缺血性脑卒中的应用上展现了其优越性[9-10]。有研究[11]显示脐带间充质干细胞在多种临床疾病治疗中显示了良好的效果。为进一步提高ucMSCs 的移植效率,本次研究中采用传统中医药与干细胞相结合的方式探讨中药的相关效用。实验从体内体外分别观察经川芎嗪预处理后的ucMSCs 的迁移能力以及川芎嗪对ucMSCs 移植微环境的影响。结果显示携带绿色荧光蛋白的ucMSCs 移植入模型大鼠体内后会趋化至损伤部位发挥作用,但定位细胞数量较少,而川芎嗪预处理后的ucMSCs 经尾静脉移植缺血性脑卒中大鼠后迁移定位于损伤脑组织的细胞比例显著增加,加入趋化因子受体拮抗剂后,组织中移植细胞数量减少,表明川芎嗪预处理提高了ucMSCs 的迁移能力且可以被抑制。进一步研究发现预处理ucMSCs 移植脑组织中基质细胞衍生因子-1(SDF-1)及其受体CXCR4 的表达显著高于未处理细胞移植组及其它组别,说明川芎嗪预处理后ucMSCs 迁移能力增强的作用机制与SDF-1/CXCR4 轴密切相关[12]。经分析,预处理后ucMSCs细胞自身表达CXCR4 蛋白增加,受损脑组织表达SDF-1 增加,由于CXCR4 是SDF-1 的受体,趋化更多的ucMSCs 向受损部位迁移,LI 等[13]也认为CXCR4 蛋白的高表达有利于MSCs 向缺血组织部位迁移,也有报道SDF-1/CXCR4 轴可以增强大鼠骨髓间充质干细胞的迁移,减轻神经元损伤和细胞凋亡[14],而且有研究证实SDF-1/CXCR4 轴可通过PI3K/Akt 等信号通路促进干细胞迁移[15-16]。
为了进一步解释体内实验中产生的细胞迁移增加的现象,本研究在体外模拟体内进行细胞迁移实验。由于缺血再灌注损伤中氧化应激导致神经细胞损伤是其病理机制中的重要因素[17-18],受损细胞可能会分泌趋化因子定向诱导干细胞迁移,本研究在体外采用H2O2氧化损伤P12 作为诱导细胞,通过Transwell 观察ucMSCs 迁移变化。实验结果显示经TMP 预处理后ucMSCs 诱导迁移的细胞明显多于未处理ucMSCs,且此现象可以被CXCR4 的拮抗剂阻断。蛋白结果证实TMP 预处理后ucMSCs 的CXCR4 蛋白表达显著升高且可以被拮抗剂抑制。因此,笔者认为TMP 可能通过刺激ucMSCs 的CXCR4 表达来提高细胞的迁移能力。另外,本研究还比较了TMP 对损伤PC12 细胞的修复作用是否影响ucMSCs 的迁移,研究发现TMP 处理后的PC12 细胞分泌IL-1β 的水平显著降低,迁移实验也证实TMP 处理后的PC12 细胞的诱导能力下降,ucMSCs 迁移细胞减少。分析原因可能为IL-1β 作为炎症因子对移植细胞的存活是不利的[19],但也是诱导干细胞迁移的重要因子[20],其表达水平下降提示PC12 的诱导能力下降,不能趋化更多的ucMSCs 发生定向迁移,说明TMP 的作用位点不同发挥的作用也不同,当作用于移植细胞则可以提高细胞的迁移率,而作用于受损组织则减少细胞的趋化,但可以改善移植微环境,有利于移植细胞的存活,此与前期实验报道一致[5,7]。本项研究尽管证实TMP 通过调节SDF-1/CXCR4 显著提高ucMSCs 的迁移效率,但对相关信号通路有待进一步的研究分析。
综上所述,本实验从体内外分别研究了川芎嗪对脐带间充质干细胞迁移能力的影响,并发现其作用机制与SDF-1/CXCR4 轴密切相关,说明TMP 通过提高ucMSCs 的CXCR4 蛋白的表达进而提高ucMSCs 的迁移能力,同时TMP 还可以改善移植部位微环境,为在中医药领域找寻提高干细胞移植效率的途径提供实验依据。

