慢病毒敲减质粒pLKO.1-shDAPK1的构建及其对细胞凋亡的影响
秦坤 徐绍业 韩雨 闫建国 夏春波 邵晓云
桂林医学院1人体解剖学教研室,2科学实验中心,3生理学教研室(广西 桂林 541100)
帕金森病(Parkinson's disease,PD)是中枢神经系统常见的进行性、变性性疾病,黑质多巴胺能(dopaminergic,DAG)神经元选择性凋亡被认为是PD 的主要病理变化之一[1]。已有研究发现,DAG神经元轴突终末变性可能是导致PD 发生细胞凋亡的首要因素,而轴突严重变性时可能导致了细胞骨架蛋白——微管的功能异常[2-3]。
死亡相关蛋白激酶1(death-associated protein kinase,DAPK1)是一种编码160 KDa蛋白的钙离子/钙调蛋白(Ca2+/CaM)依赖的丝氨酸/苏氨酸激酶,广泛表达于人、大鼠和小鼠的正常组织中,以脑组织和肺组织表达最强,在多种神经系统疾病(如阿尔茨海默病、中风等)的细胞凋亡过程中发挥重要作用[4]。DAPK1 作为肿瘤抑制因子,可正性调节细胞凋亡,在肿瘤细胞中表达减少,但其在神经退行性病变中则表达增多[5]。而且,DAPK1 还可以调节微管的合成、神经元分化以及微管相关蛋白Tau 的毒性[6]。目前,DAPK1 在PD 中的研究甚少。因此,本研究通过构建pLKO.1-shDAPK1 慢病毒敲减质粒,包装病毒后感染并筛选稳定低表达DAPK1的SH-SY5Y 细胞系,验证DAPK1 在SH-SY5Y 细胞中的蛋白表达水平,并证明在SH-SY5Y 细胞中抑制DAPK1 对细胞凋亡的影响,为进一步研究DAPK1 在PD 中的发病机制奠定基础。
1 材料与方法
1.1 主要材料及试剂慢病毒三质粒系统(载体质粒pLKO.1-TRC、辅助质粒psPAX2 和pMD2.G)及SH-SY5Y 细胞由西安空军军医大学唐都医院杨倩教授惠赠;HEK293T 细胞由我校科学实验中心馈赠;shRNA-DAPK1 引物由生工生物工程(上海)股份有限公司合成;限制性内切酶EcoRⅠ和AgeⅠ、T4 DNA 连接酶购自NEB 公司;DH5α 感受态细胞购自生工生物工程(上海)股份有限公司;DNA分子量Marker 购自北京庄盟国际生物基因科技有限公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自康为世纪生物科技股份有限公司;Lipo3000 转染试剂购自美国赛默飞世尔公司;DMEM 培养基购自美国GIBCO 公司;FBS 标准级胎牛血清购自上海依科赛公司;嘌呤霉素购自翊圣生物科技(上海)有限公司;兔抗人DAPK1 多克隆抗体、鼠抗人GAPDH单克隆抗体均购自美国Proteintech 公司;鼠抗人Caspase-3 单克隆抗体、鼠抗人Bcl-2 单克隆抗体和鼠抗人Bax 单克隆抗体购自Santa Cruz 公司;二抗购自北京中杉;Annexin V-FITC 细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;FACSCanto流式细胞分析仪购自美国Beckman Coulte 公司。
1.2 方法
1.2.1 shRNA 干扰片段设计与合成根据Sigma公司网站Mission shRNA 模块(https://www.sigmaaldrich.cn/CN/zh/semi-configurators/shrna?activeLink),获得shRNA-DAPK1 靶标序列,参考shRNA 设计策略,以CTCGAG 为loop 环,并在引物两端分别加入EcoRⅠ和AgeⅠ酶切位点,最终设计shDAPK1 上游引物为5'-CCGGCCACGTCGATACCTTGAAATTCTCGAGAAGGTATCGACGTGGTTTTTG-3',下游引物为5'-AATTCAAAAACCACGTCGATACCTTGAAATTCTCGAGAATTTCAAGGTATCGACGTGG-3',由生工生物公司合成。将合成的引物稀释为20 μmol/L,95 ℃水浴10 min,自然冷却至室温,-20 ℃储存备用,退火后的引物即为具有粘性末端的双链shDNA 干扰片段。
1.2.2 质粒重组用核酸内切酶EcoRⅠ和AgeⅠ对pLKO.1慢病毒载体进行双酶切,将适量的酶切产物与退火引物在T4 连接酶的作用下4 ℃过夜。次日,将连接产物用DH5α 感受态细胞中进行转化、种板,挑取单克隆摇菌并提质粒后送往生工生物工程(上海)股份有限公司进行测序,最终确定重组慢病毒敲减质粒pLKO.1-shDAPK1构建正确与否。
1.2.3 病毒包装取对数生长期HEK293T 细胞重悬接种,待细胞密度达80%~90%时,用Lipo3000转染试剂将重组慢病毒pLKO.1-shDAPK1 敲减质粒(包括辅助质粒pMD2.G 和psPAX2)转染至HEK293T 细胞中,以空载体pLKO.1-TRC 作为阴性对照(shNC)。转染16 h 后换液,并于72 h 收集上清培养基,用0.45 μm 滤器过滤后获得慢病毒溶液,分装后于-80 ℃保存备用。
1.2.4 病毒感染及稳转细胞系筛选将SH-SY5Y细胞接种到培养皿中,待其汇合度约为40%~50%时,以半量换液方式换为pLKO.1-shDAPK1 或pLKO.1-shNC 慢病毒感染液,继续培养24 h 后更换为正常培养基,当细胞生长至平台期时进行传代,并应用加入5 μg/mL 嘌呤霉素的完全培养基进行筛选,设置未感染病毒的细胞为空白对照组(Control),经过4~6 次嘌呤霉素筛选传代后,当未感染病毒的对照组细胞全部死亡,而感染了病毒的pLKO.1-shDAPK1 或pLKO.1-shNC 组的细胞大量存活,获得敲减DAPK1 的稳定感染细胞系shDAPK1-SY5Y 和阴性对照shNC-SY5Y,并对其进行扩增保种和后续鉴定。
1.2.5 Western blot 检测DAPK1 敲减效率收集稳定感染慢病毒pLKO.1-shDAPK1 或pLKO.1-shNC的SH-SY5Y 细胞总蛋白,BCA 试剂盒测定蛋白浓度,以40 μg 蛋白上样量用10%聚丙烯酰胺凝胶进行蛋白免疫印迹,应用兔抗人DAPK1 抗体(1∶1 000)Western blot 检测shDAPK1-SY5Y 稳转细胞系中DAPK1 的蛋白表达情况。
1.2.6 检测敲减DAPK1 对MPP+诱导的SH-SY5Y细胞凋亡的影响将pLKO.1-shDAPK1 慢病毒感染的SH-SY5Y 稳转细胞系培养至70%左右汇合时加入MPP+(200 μmol/L)作用24 h,同时设置空白对照组(Control),各组分别设置两份,第一份收集细胞总蛋白,以40 μg 蛋白上样量用12%聚丙烯酰胺凝胶进行蛋白免疫印迹,应用鼠抗人Caspase-3单克隆抗体(1∶1 000)、鼠抗人Bcl-2 单克隆抗体(1∶1 000)和鼠抗人Bax 单克隆抗体(1∶1 000)Western blot 检测经MPP+作用后细胞系中Caspase-3、Bcl-2 和Bax 的蛋白表达情况;第二份收集细胞,用1×PBS 重悬并计数,取5×105重悬的细胞,1 000 r/min 离心5 min,弃上清,加入195 μL Annexin V-FITC 结合液轻轻重悬细胞,再加入5 μL Annexin V-FITC,轻轻混匀,最后加入10 μL 碘化丙啶(PI)染色液,轻轻混匀。室温(20~25 ℃)避光孵育10~20 min,筛网过滤并移入流式上样管,立即上机检测,使用FlowJo 软件进行数据分析。
1.3 统计学方法实验所得数据以(±s)表示,实验组和对照组蛋白表达水平采用非配对t检验进行组间差异性检验,使用GraphPad Prism 5 统计软件分析,P<0.05 为差异有统计学意义。
2 结果
2.1 慢病毒质粒pLKO.1-shDAPK1的构建及鉴定将慢病毒骨架质粒pLKO.1-TRC(全长8 901 bp),用EcoRⅠ和AgeⅠ双酶切后得到7 026 bp 和1 875 bp两个片段(图1),回收酶切后的线性载体(7 026 bp)并将其与退火的目的干扰片段用T4 连接酶进行连接,单克隆后进行DNA 测序,测序结果显示,重组慢病毒质粒pLKO.1-shDAPK1 的DNA 序列与所设计的干扰序列完全一致(图2),表明慢病毒敲减质粒pLKO.1-shDAPK1 构建成功。

图1 pLKO.1-TRC 空载质粒酶切产物琼脂糖凝胶电泳Fig.1 Enzyme digestion results of pLKO.1-TRC-vector
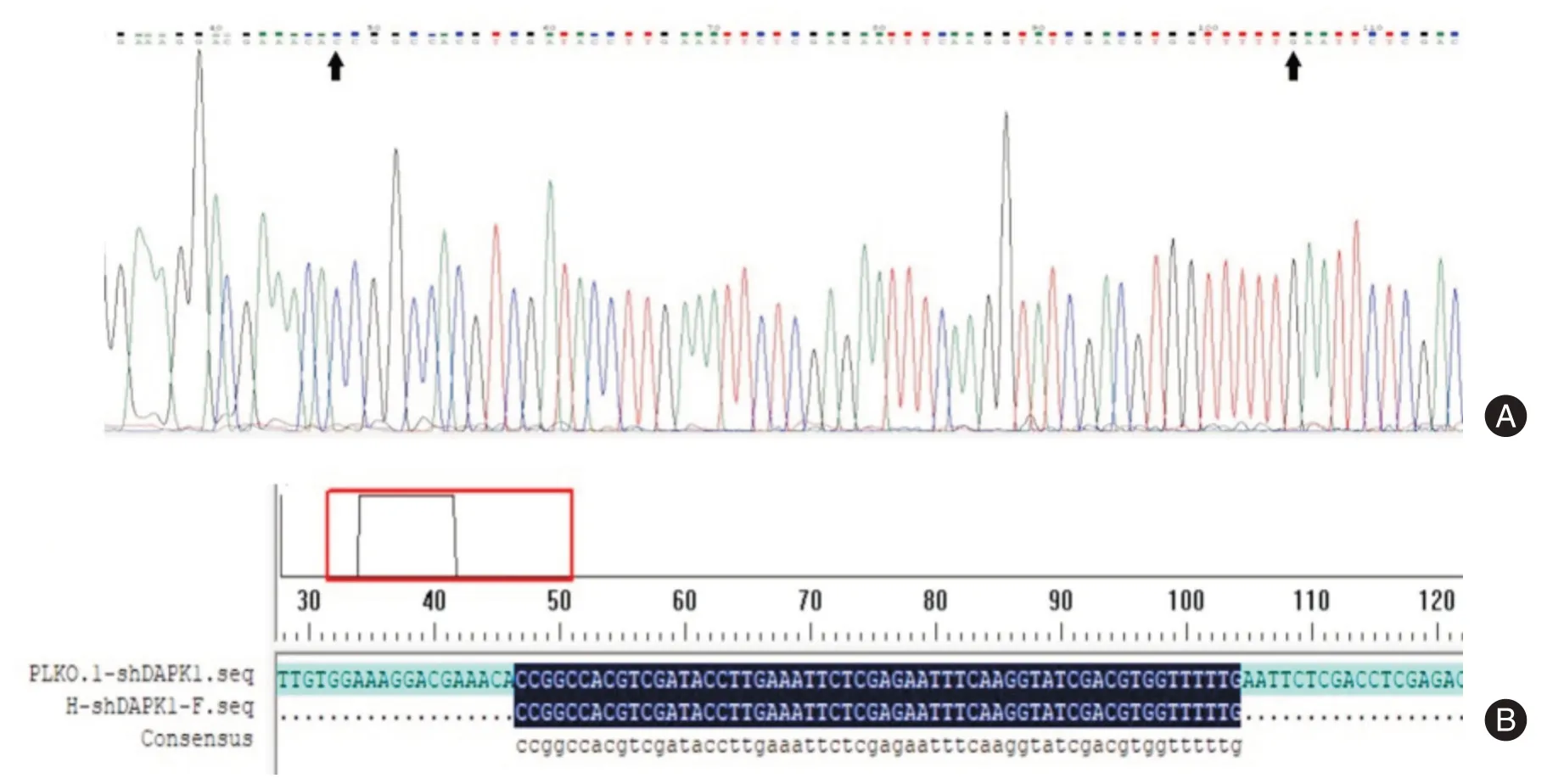
图2 重组PLKO.1-shDAPK1 质粒DNA 测序及序列比对Fig.2 DNA sequencing and sequence alignment of recombinant PLKO.1-shDAPK1 plasmid
2.2 慢病毒包装及稳定干扰DAPK1基因的SH-SY5Y细胞系的建立将pLKO.1-shDAPK1(或pLKO.1-shNC)表达质粒与辅助质粒共转染HEK293T 细胞,转染72 h 后提取细胞总蛋白进行Western blot检测转染效率,结果显示pLKO.1-shDAPK1(或pLKO.1-shNC)质粒被成功转染并在HEK293T 细胞中表达(图3);同时将细胞培养上清病毒液感染SH-SY5Y 细胞,提取具有嘌呤霉素抗性的细胞总蛋白,Western blot 检测结果显示,在感染pLKO.1-shDAPK1 病毒的SH-SY5Y 细胞中DAPK1 蛋白的表达量明显低于对照组(pLKO.1-shDAPK1&pLKO.1-shNC,P<0.000 1;pLKO.1-shDAPK1 & control,P<0.000 1)(图4),表明感染pLKO.1-shDAPK1 慢病毒颗粒的SH-SY5Y 细胞稳定敲减了DAPK1 基因。
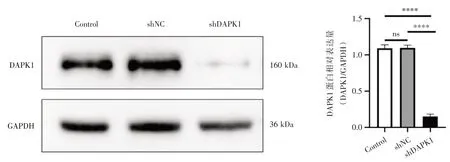
图3 DAPK1 在病毒包装的HEK293T 细胞中的蛋白表达Fig.3 DAPK1 protein expression in HEK293T cells packaged shDAPK1 plasmid by lentivirus

图4 慢病毒感染的SH-SY5Y 稳转细胞系中DAPK1 蛋白表达Fig.4 Expression of DAPK1 protein in SH-SY5Y stably transfected cell line infected
2.3 细胞凋亡相关蛋白在敲减DAPK1的SH-SY5Y稳转细胞系中的表达水平收集经MPP+处理的细胞并提取总蛋白,Western blot 检测结果中,实验组与空白对照组比较,经MPP+处理后Bax表达下降,Bcl-2表达上调,Bax/Bcl-2比值降低,Caspase-3活性下调,差异均有统计学意义(*P<0.05,**P<0.01,***P<0.001,图5)。提示敲减DAPK1 会抑制帕金森病细胞模型中Bax/Bcl-2 比值升高,Caspase-3 活性上调,从而抑制细胞凋亡的发生。

图5 慢病毒感染的SH-SY5Y 稳转细胞系中细胞凋亡相关蛋白表达Fig.5 Expression of apoptosis related proteins in SH-SY5Y stable cell line infected with lentivirus
2.4 流式细胞术检测抑制DAPK1 对细胞凋亡的影响流式细胞仪检测结果显示,对照组(control-MPP+)SH-SY5Y 细胞出现明显凋亡,而DAPK1 敲减组(shDAPK1-MPP+)的细胞凋亡发生率显著下降,差异有统计学意义(P<0.000 1,图6)。

图6 流式细胞术检测SH-SY5Y 细胞凋亡Fig.6 Apoptosis of SH-SY5Y cells was detected by flow cytometry
3 讨论
PD 的主要特征是黑质DAG 神经元的进行性不可逆丢失,异常聚集的α-synuclein 蛋白是PD 的病理学标志物,其过表达可促进多种细胞系和动物模型中凋亡细胞的死亡。研究表明,α-synuclein参与了多种生物过程,包括神经退行性疾病的发病机制和脑功能异常等[7];DAG 神经元凋亡是神经递质变化、氧化应激、线粒体功能损伤、神经营养因子缺乏等多种因素共同作用的结果[8]。但当前对帕金森病的治疗仅限于保护神经细胞,并不能减缓黑质DAG 神经细胞凋亡或退行性变,其主要原因可能是人们对造成神经细胞凋亡或退行性变的分子机制了解甚少。
蛋白激酶是催化末端磷酸基团从ATP 转移到其他蛋白质的酶[9]。通过磷酸化某个蛋白质残基(Tyr,酪氨酸激酶;Ser/Thr,Ser/Thr 激酶),激酶共价调节其他蛋白质的活性,最终控制人类细胞的几乎所有方面,包括细胞增殖、发育和存活[10]。对人类基因组的分析揭示了迄今为止已知的518种激酶,以及几种激酶突变体、脂质激酶和假激酶[11-12]。蛋白激酶家族可分为两大亚组:蛋白酪氨酸激酶(PTKs)和STKs[13-14]。STKs 细分为六个主要亚组,包括cAMP 依赖性蛋白激酶/蛋白激酶G/蛋白激酶C 扩展家族(AGC);钙-钙调蛋白依赖性激酶(CaMK);CDK、MAPK、糖原合酶激酶和CDK 样结构域(CMGC);STE11 和STE20(STE)的同源物;酪蛋白激酶(CK);和酪氨酸激酶样(TKL)组[15-17]。
死亡相关蛋白激酶(death-associated protein kinase,DAPK)家族是STKs 家族中的重要家族之一,在人类细胞中调控多种生物学功能。DAPK 家族结构域包括DAPK1、DAPK2(又名DAPK 相关蛋白激酶1;DRP-1)和DAPK3(又名拉链相互作用蛋白激酶,也称为DAP 样激酶,Dlk),以及DRAK1和DRAK2(DAPK 相关凋亡诱导蛋白激酶1 和2,也分别称为STK-17A 和B;STK17A 和B)[18-19]。DAPK1 是一种在神经元发育过程中高表达的促凋亡激酶,负责多种类型(包括凋亡和自噬)的细胞死亡,与许多神经系统疾病有关,如中风、抑郁症和阿尔茨海默病(Alzheimer's disease,AD)等。DAPK1 是凋亡细胞死亡的正调控因子,在调节神经元细胞死亡中具有关键功能,可以调节多种神经元损伤模型中的细胞凋亡[4,20-22]。研究[23]表明,在成年大脑中,神经元死亡时,DAPK1 重新激活并被招募到突触外NMDAR 复合物中,放大毒性受体功能。在PD 模型小鼠和PD 患者的研究中显示,由于转录因子C/EBPα 降低而导致miR-26a 缺失,从而导致DAPK1 转录后表达升高,miR-26a 的缺失和DAPK1 的过表达都诱导了α-synuclein 的过度磷酸化、聚集和包含的形成,从而进一步导致DAG神经元的死亡和运动异常[24]。抑制DAPK1 已在中风、AD、PD 和慢性应激的动物模型中显示出有益之处,其原因主要是抑制DAPK1 活性或表达可减轻中风小鼠模型中神经元细胞的死亡以及AD动物模型中与AD 相关的神经病理学,表明抑制DAPK1 可能保护神经元免受损伤[20-21,25],提示DAPK1 可能是神经保护的新靶点。
为了进一步探讨PD模型中抑制DAPK1对细胞凋亡的影响,应用慢病毒干扰技术在SH-SY5Y 细胞中敲减DAPK1。慢病毒载体是一种以人类免疫缺陷型病毒为基础发展起来的逆转录病毒载体,其在分子以及细胞生物实验中有着广泛的应用,与其他逆转录病毒相比,可选择的宿主具有多样性,对分裂细胞和未分裂细胞均具有感染能力,能够有效地将目的基因整合到宿主细胞中。同样与传统脂质体转染法相比,慢病毒的转染率更高,并能在载体中持续而稳定的表达,在构建目的基因方面得到广泛应用[26]。本研究选择pLKO.1-TRC、psPAX2、pMD2.G 三质粒系统成功构建并包装了pLKO.1-shDAPK1 慢病毒,Western blot 验证了其感染SH-SY5Y 细胞后敲减DAPK1 的蛋白表达水平,经嘌呤霉素筛选后获得了稳定低表达DAPK1 的SH-SY5Y 细胞系;在应用MPP+诱导shDAPK1-SHSY5Y 细胞构建的PD 细胞模型中,Western blot 与流式细胞仪检测结果均表明抑制DAPK1 可显著降低细胞凋亡的发生率,这对后续进一步研究DAPK1在PD 发病过程中的作用奠定了重要的基础。

