Raf激酶家族在泛癌中的表达、预后及功能研究*
王宏伟,董 严,梁后杰
(陆军军医大学第一附属医院肿瘤科,重庆 400038)
A-Raf、B-Raf和C-Raf/Raf-1是丝氨酸/苏氨酸蛋白激酶家族的3个成员[1-3],参与RAS-RAF-MEK-ERK信号级联反应,这一级联反应参与调控多种过程,包括细胞的凋亡、周期进展、分化、增殖和癌变等[4]。在多种肿瘤中,Raf激酶家族成员的突变影响肿瘤患者的预后及治疗效果。然而部分肿瘤中Raf激酶家族成员的突变率很低,或在其突变率高的肿瘤中Raf激酶家族成员为野生型时,Raf激酶家族成员的表达与肿瘤患者的预后及肿瘤微环境等之间关系整体性的研究很少。因此,本研究基于TCGA数据库大规模转录组学数据,探讨Raf激酶家族基因的表达与肿瘤基质、免疫评分、RNA干性评分(RNAss)、DNA干性评分(DNAss)、微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)及药物敏感性的相关性,阐明Raf激酶家族基因在癌症进展中所起的作用,为进一步研究Raf激酶家族成员作为肿瘤治疗靶点及预后标志物提供参考。
1 材料与方法
1.1 数据下载与处理
通过加利福尼亚大学圣克鲁斯分校(UCSC Xena;https://xena.ucsc.edu/)[5]平台下载癌症基因组图谱(TCGA)数据库泛癌患者的RNA-Seq数据和临床数据,包括肾上腺皮质癌(ACC)、膀胱尿路上皮癌(BLCA)、乳腺浸润癌(BRCA)、宫颈鳞癌和腺癌(CESC)、胆管癌(CHOL)、结肠癌(COAD)、直肠癌(READ)、弥漫性大B细胞淋巴瘤(DLBC)、食管癌(ESCA)、多形成性胶质细胞瘤(GBM)、头颈鳞状细胞癌(HNSC)、肾嫌色细胞癌(KICH)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、急性髓细胞样白血病(LAML)、脑低级别胶质瘤(LGG)、肝细胞肝癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、间皮瘤(MESO)、卵巢浆液性囊腺癌 (OV)、胰腺癌(PAAD)、嗜铬细胞瘤和副神经节瘤(PCPG)、前列腺癌(PRAD)、直肠腺癌(READ)、肉瘤(SARC)、皮肤黑色素瘤(SKCM)、胃癌(STAD)、睾丸癌(TGCT),甲状腺癌(THCA)、胸腺癌(THYM)、子宫内膜癌(UCEC)、子宫肉瘤(UCS)以及葡萄膜黑色素瘤(UVM)。利用肿瘤的全外显子测序数据将每百万碱基对发生的总突变率计算为TMB,基因重复序列中发生插入或删除事件的数量计算为MSI。其中17种癌症类型中少于5例相应的正常组织样本,因此仅使用剩余的16种癌症类型与正常组织进行基因差异表达的差比较。从CellMinerTM数据库下载药物敏感性数据[6]。从The Human Protein Altas(https://www.proteinatlas.org/)平台下载Raf激酶家族免疫组化结果数据。
1.2 细胞培养
从中国科学院细胞库(上海)购获人结肠癌细胞株(CCD841、SW480、SW620、HCT116、LOVO)和人正常结肠上皮细胞株CCD841,肝癌细胞株(HEPG2、SNU449、Huh7)和人正常肝细胞株HL-7702,胃癌细胞株(HGC-27、MKN-45、SNU-1)和人正常胃黏膜上皮细胞株NGEC;均置于含有10%胎牛血清(FBS)的培养基,含有5%二氧化碳的培养箱中37 ℃培养。用1%的青霉素/链霉素处理细胞(碧云天,中国)。
1.3 qRT-PCR检测Raf激酶家族成员mRNA表达水平
利用TRizol试剂从细胞中分离RNA,应用PrimeScript RT试剂盒(DRR037A;TaKaRa Bio,日本)将RNA (2 μg)反转录为cDNA。本研究按照SYBR Green qPCR Master Mix (Invitrogen,美国)说明书进行qRT-PCR技术。将甘油醛3-磷酸脱氢酶(GADPH)作为内参,通过2-ΔΔCt法计算基因相对表达量。 A-Raf引物:上游5′-ATGTTCGTCTCTGCCCTGAT-3′,下游5′-GATGGAGGAGCTCCCAAAAT-3′;B-Raf引物:上游5′-CGGCGACTTCTCGTCGTCTC-3′,下游5′-CTGCATGACGGAGAGGGACA-3′;Raf-1引物:上游5′-TTTCCTGGATCATGTTCCCCT-3′,下游5′-ACTTTGGTGCTACAGTGCTCA-3′。
1.4 生存分析
采用Kaplan-Meier曲线法绘制生存曲线,采用对数秩检验进行比较。使用R包“survminer”和“survival”绘制生存曲线。 应用单变量COX风险比例回归模型,分析泛癌中Raf激酶家族基因表达与患者预后的关系。
1.5 肿瘤微环境分析
应用ESTIMATE算法计算免疫评分和基质评分,预测不同肿瘤中免疫细胞和基质细胞的浸润水平[7]。通过TCGA肿瘤样本的转录组数据和表观遗传学数据计算肿瘤干性评分,RNAss和DNAss用于评估肿瘤的干细胞样特征[8]。
1.6 统计学处理
应用R语言软件(版本3.6.1)进行统计学分析,采用R包“ggplot2”和“forestplot”绘制图。使用t检验比较肿瘤组织与正常组织间Raf激酶家族基因的表达差异。使用Spearman相关检验评估Raf激酶家族基因表达与免疫评分、基质评分、干性评分、TMB、MSI及药物敏感性的相关性,相关性分析中,|r|>0.2为相关。以P<0.05为差异有统计学意义。
2 结 果
2.1 Raf激酶家族在泛癌中的表达
通过比较TCGA数据库中多种肿瘤组织与正常组织Raf激酶家族成员mRNA的表达水平,笔者发现Raf激酶家族成员的表达存在显著的肿瘤间异质性。与正常组织相比,A-Raf在部分肿瘤中显著高表达(BRCA、CHOL、GBM、KICH、LIHC),而在另一部分肿瘤中显著低表达(COAD、KIRC、KIRP、LUSC、THCA、UCEC),见图1A。同时,其他Raf激酶家族成员也表现出不同程度的肿瘤间异质性,B-Raf在CHOL、COAD、KICH、KIRC、KIRP、LIHC、PRAD、STAD中呈较高表达水平,在BRCA、GBM、UCEC中呈低表达水平,见图1B。Raf-1在COAD、ESCA、HNSC、KIRC、KIRP、LUSC、READ、THCA的表达水平相对正常组织均较低,而在BLCA、GBM和LIHC中表达相对较高,见图1C。笔者在消化系统肿瘤包括COAD、LIHC及STAD中进行了验证,运用qRT-PCR检测A-Raf在LIHC,B-Raf在COAD、LIHC、STAD,以及Raf-1在LIHC的癌细胞系中mRNA的表达水平,均相较相应的正常细胞系表达更高,而A-Raf和B-Raf在COAD的癌细胞系中mRNA水平均相较相应的正常细胞系表达更低。同样免疫组化结果发现A-Raf在LIHC,B-Raf在COAD、LIHC、STAD,以及Raf-1在LIHC的癌组织中蛋白的表达水平均相较相应的癌旁组织表达更高,而A-Raf和Raf-1蛋白表达水平在COAD的癌组织中则相较相应的癌旁组织表达更低。上述结果均与TCGA数据库COAD、LIHC及STAD中Raf激酶家族成员的表达差异相符(图2)。
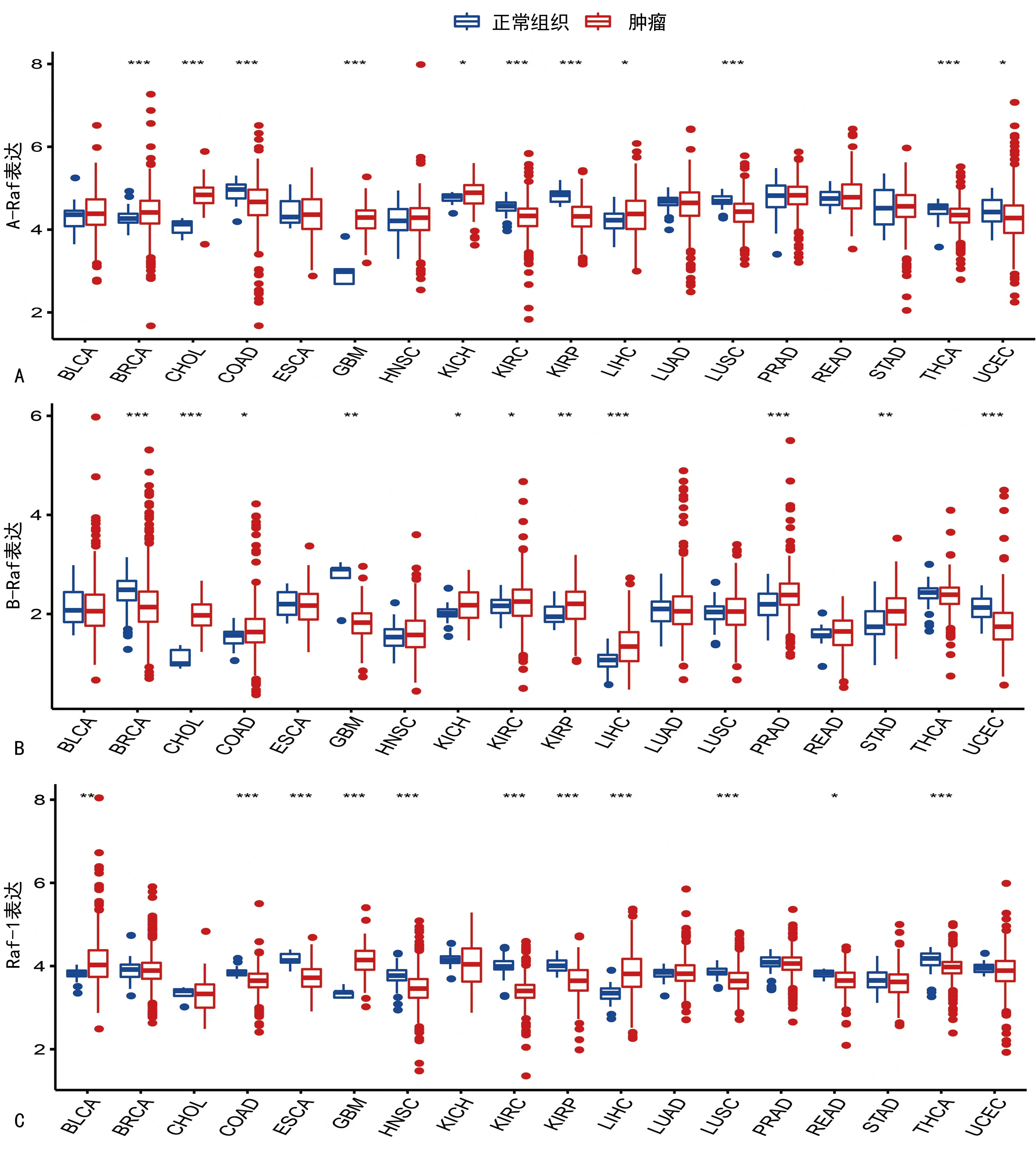
A:A-Raf;B:B-Raf;C:Raf-1;*:P<0.05,**:P<0.01,***:P<0.001,与正常组织比较。
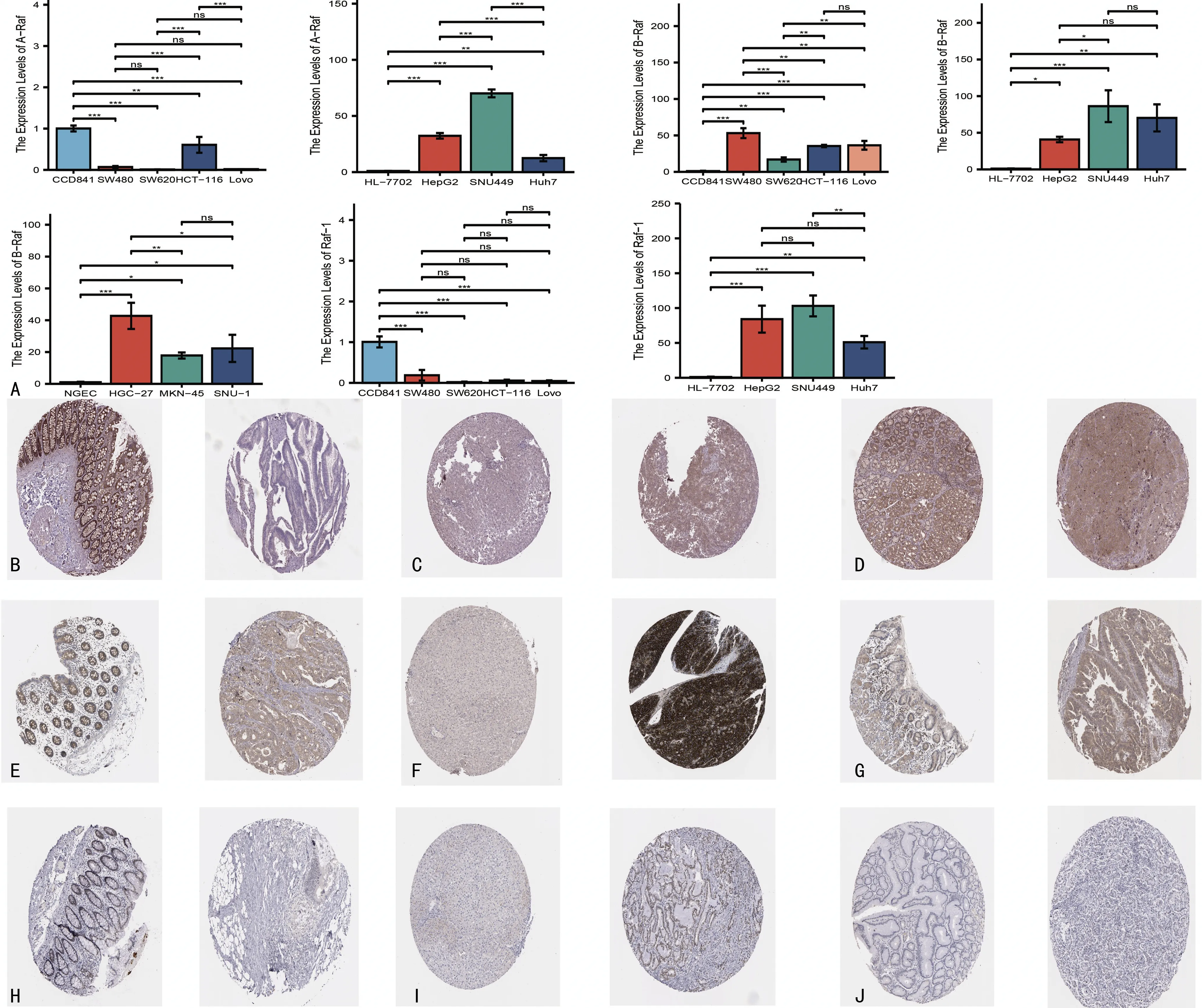
A:Raf激酶家族成员在COAD、LIHC、STAD细胞系和相应正常上皮细胞系中mRNA的表达;B、E、F:A-Raf在COAD、LIHC、STAD癌组织中以及相应的正常组织的表达;C、F、I:B-Raf在COAD、LIHC、STAD癌组织中以及相应的正常组织的表达;D、G、J:Raf-1在COAD、LIHC、STAD癌组织中以及相应的正常组织的表达(免疫组化结果左侧为正常组织,右侧为癌组织)。*:P<0.05,**:P<0.01,***:P<0.001。
2.2 不同Raf激酶家族成员在癌症中的预后作用
本研究使用单变量COX风险比例回归模型,分析TCGA数据库中Raf激酶家族基因的表达对癌症患者的预后影响(图3A,表1)。其中,较高的A-Raf表达与LGG和PCPG患者较差的总体生存有关,与MESO和KIRC患者较好的总体生存有关。而B-Raf在SKCM、KIRC和LAML患者中的高表达与生存优势有关,在UCEC中则与生存劣势有关。ACC和KICH患者中Raf-1的高表达不利于患者的预后,但Raf-1的高表达利于UVM和THYM患者的预后。同时应用Kaplan-Meier曲线分析(图3B),表明A-Raf的高表达与CESC、KIRC、LUAD以及MESO患者生存率的改善显著相关。相反,在LGG和UVM患者中与较差的预后有关。B-Raf的高表达在KIRC、LAML、SKCM患者中有较好的预后,在PRAD患者中与之相反。在KICH和THYM患者中,Raf-1高表达的患者预后差,在UVM患者中相反。
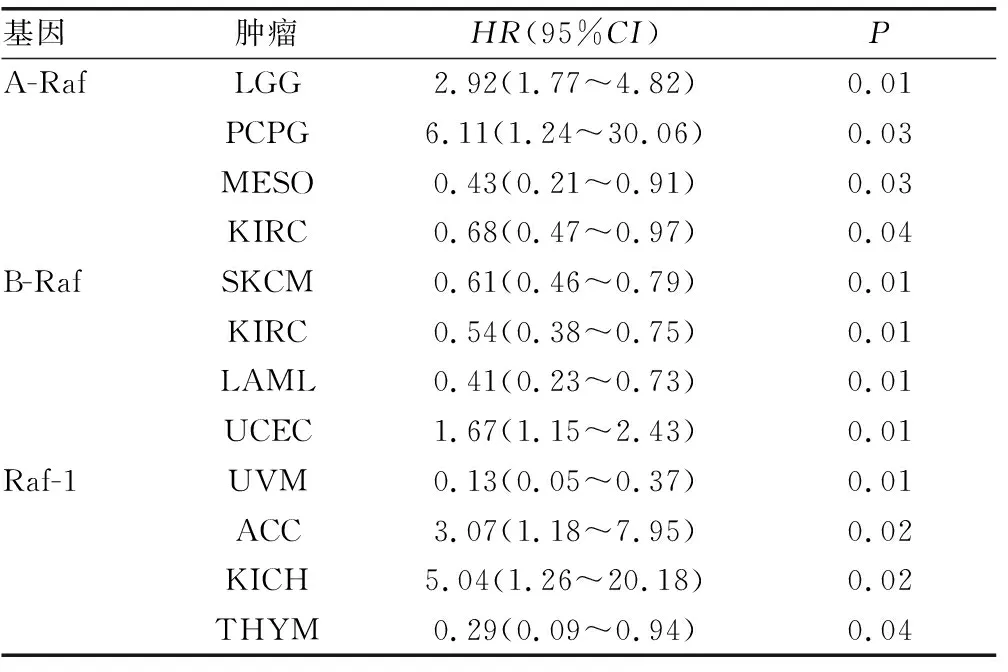
表1 Raf激酶家族基因在多种肿瘤中与预后有关
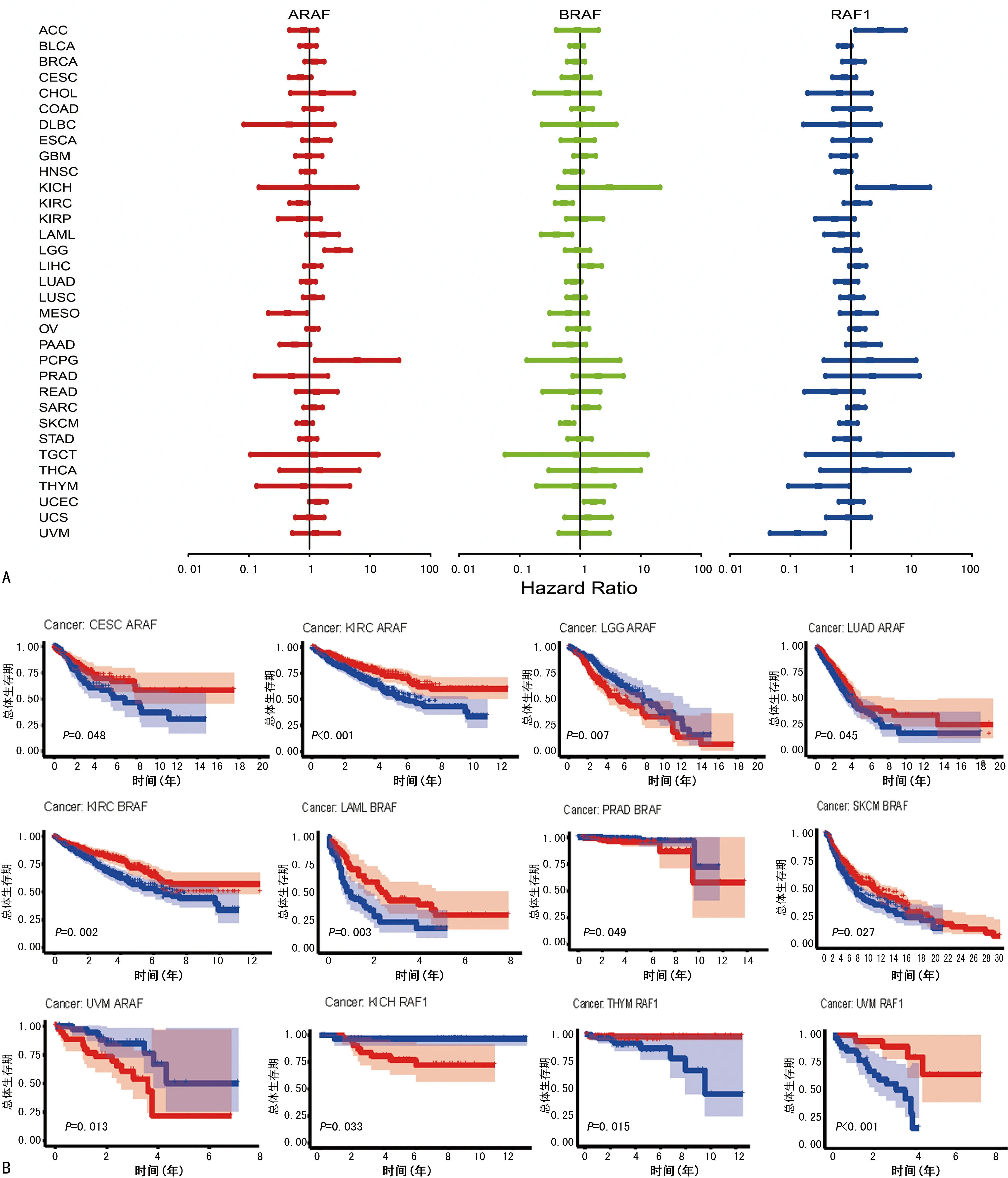
A:单变量COX风险比例回归模型分析Raf激酶家族基因的表达与患者预后的关系;B:KM曲线方法分析Raf激酶家族基因的表达与患者预后的关系。
2.3 Raf激酶家族成员与癌症的肿瘤微环境有关
A-Raf的表达在KIRP、SKCM、TGCT、PCPG和UVM患者中与间质评分呈正相关,在KICH和PAAD中呈负相关(图4A)。B-Raf表达在BLCA、LGG、GBM、THCA、SARC、TGCT和LUSC患者中与间质评分呈负相关。此外,Raf-1表达在GBM、TGCT、SARC、UVM、KICH、LGG、BLCA、THCA以及READ中与间质评分呈负相关,在CHOL、DLBC、UCS和LAML中呈正相关,A-Raf表达在KICH和 TGCT中与免疫评分呈负相关(图4B),在UCS、CHOL、SKCM、LGG、PCPG、MESO、BLCA、SARC、THYM和UVM 中呈正相关。同样B-Raf在LGG、THCA、BLCA、GBM、SARC、KIRP、PCPG、THYM、BRCA、CESC、UCEC、LAML、LUSC、LIHC和KICH中呈负相关。Raf-1在LAML和DLBC 中呈正相关,在GBM、KICH、BLCA、UVM、THCA、SARC和UCEC中呈负相关。此外,泛癌中Raf激酶家族成员的表达与肿瘤干性仍有关(图4C),结果显示,A-Raf的表达在THYM中与RNAss呈正相关,在GBM、TGCT、SARC、UVM、KICH、LGG、BLCA、THCA和READ中,A-Raf的表达与RNAss呈负相关。B-Raf在BLCA、LGG、GBM、THCA、SARC、TGCT和LUSC肿瘤中与RNAss的相关系数显著,并且它们均与RNAss负相关。Raf-1在GBM、TGCT、SARC、UVM、KICH、LGG、BLCA、THCA和READ中呈负相关,在CHOL、DLBC、UCS和LAML中呈正相关。A-Raf的表达在VM和OV患者中与DNAss呈正相关(图4D),在TGCT、PCPG、CESC、BLCA和THYM呈负相关。B-Raf在DLBC、BLCA、THYM和TGCT中呈正相关,在OV中呈负相关。C-Raf在KICH、TGCT、CHOL和GBM中呈正相关,在OV、THYM、UVM、LGG和MESO中呈负相关。
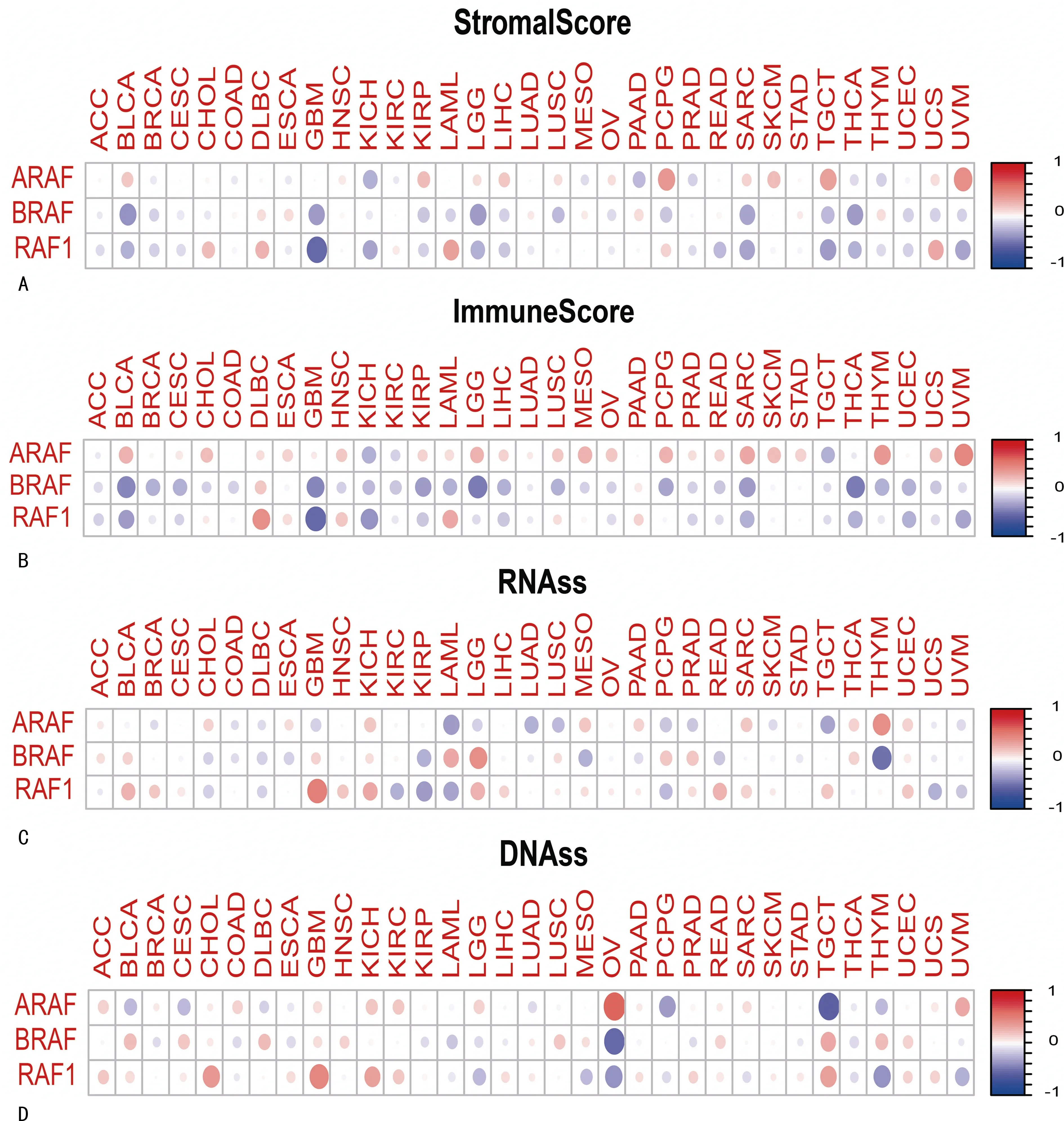
A-B:多种肿瘤中Raf激酶家族基因的表达与肿瘤基质评分和免疫评分有关;C-D:多种肿瘤中Raf激酶家族基因的表达与RNAss和DNAss 有关。
2.4 Raf激酶家族成员与TMB和MSI相关
在多种肿瘤中A-Raf表达与TMB的相关性呈显著相关(GBM、SARC、LGG、COAD、PRAD、THYM和READ),其中在GBM、SARC和LGG中为正相关,而COAD、PRAD、THYM和READ中为负相关(图5A)。同时我们探究A-Raf表达与MSI的相关性,其中在TGCT、SARC、KICH和DLBC中呈显著正相关,而在READ和STAD中呈显著负相关。B-Raf在PRAD和LAML中与TMB呈显著正相关,在BRCA中呈显著负相关(图5B)。B-Raf表达与MSI之间在LUAD、READ、ACC和LUSC中呈正相关,在DLBC中呈负相关。Raf-1与TMB在ESCA、SARC和BLCA中呈正相关,在THYM和KIRC中呈负相关(图5C),与MSI在DLBC中呈负相关。
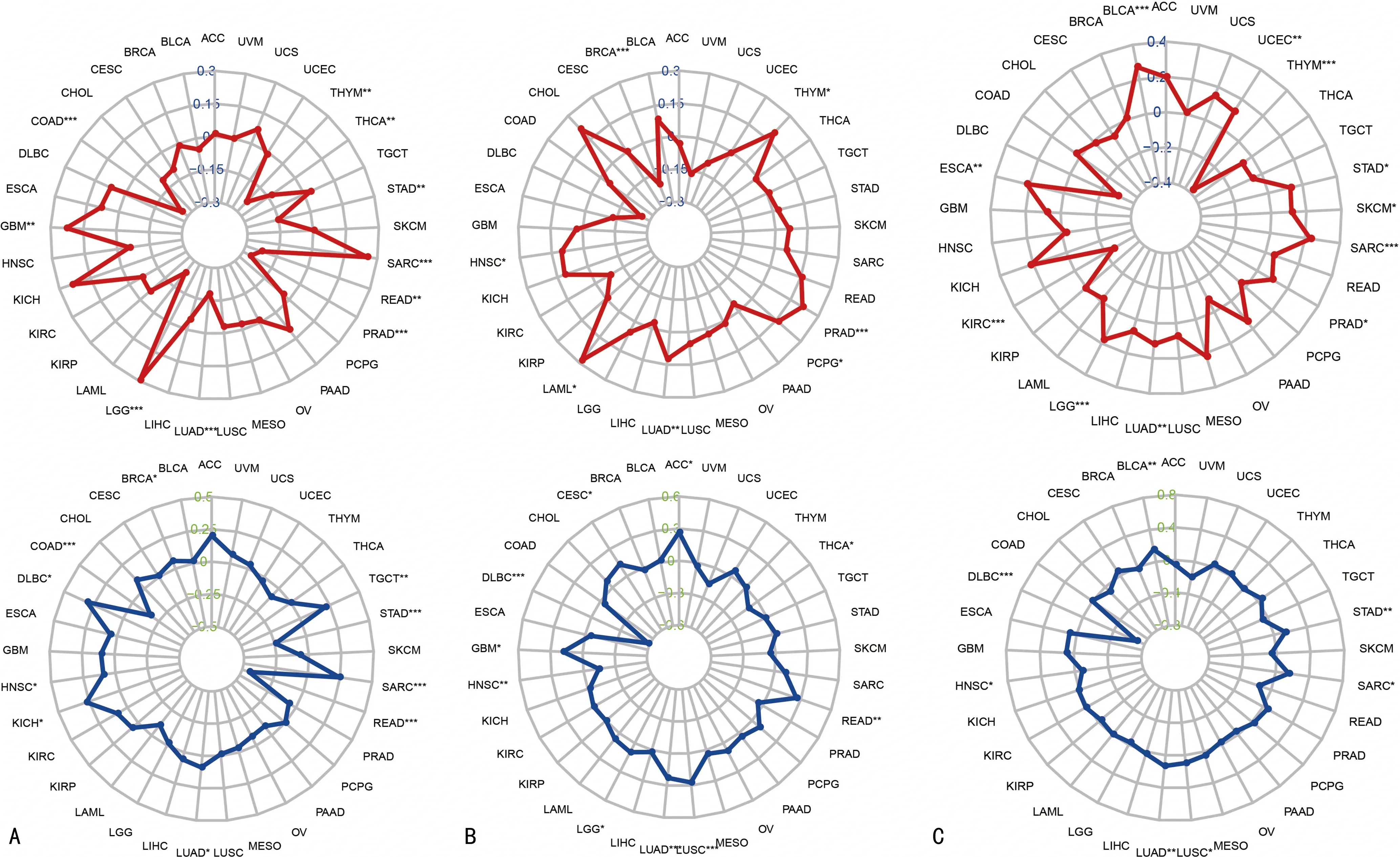
A:A-Raf的表达与TMB和MSI的关系;B:B-Raf的表达与TMB和MSI的关系;C:C-Raf的表达与TMB和MSI的关系。
2.5 Raf激酶家族成员药物敏感性分析
通过使用CellMinerTM数据库,笔者分析了Raf激酶家族成员在不同人类癌细胞系的基因表达水平与药物敏感性的潜在相关性(图6)。结果表明A-Raf表达与XL-147的药物敏感性呈正相关。B-Raf表达与别嘌呤醇和辛伐他汀的药物敏感性有关。 Raf-1的表达与曲美替尼、考比替尼以及司美替尼等药物的药物敏感性呈显著相关。

3 讨 论
自20世纪80年代以来,Raf激酶家族(A-Raf、B-Raf和C-Raf)被确定为逆转录病毒致癌基因[9],一直被深入研究,其通过MAPK通路将信号转导到RAS下游[1],进而调控细胞增殖、存活和转化等生物学功能[10]。三者中,A-Raf具有最低的激酶活性,其最大活性仅为C-Raf的20%,B-Raf的激酶活性最强。Raf激酶家族3个成员的功能既互相交叉又具有独特性,不同的上游信号分子可激活不同的Raf蛋白,同时其下游信号也转导不同的过程。
本研究使用TCGA数据库中33种不同肿瘤的转录组数据,研究了Raf激酶家族 (A-Raf、B-Raf、Raf-1)基因在癌组织与正常组织中的表达差异。对于3个Raf激酶家族成员,其表达水平在肿瘤内和肿瘤间均存在显著的异质性。在部分肿瘤中表达水平非常高的成员,在另一些肿瘤中基因表达水平可忽略不计,如A-Raf在LIHC中高表达,印证之前的报道,肝细胞癌中A-Raf的表达升高与癌症进展有关[10],然而在COAD中A-Raf表达相对较低。这些发现表明了在不同肿瘤之间及在同种肿瘤中不同Raf激酶家族成员的表达存在差异,进而促进或抑制肿瘤的发生,需要将Raf激酶家族成员作为个体进行研究。除此之外,本研究在消化系统肿瘤COAD、LIHC、STAD中,检测不同细胞系Raf激酶家族成员mRNA的表达及不同组织蛋白水平的表达,结果显示Raf激酶家族成员的表达差异均与TCGA数据库检索结果相符。
本研究通过单变量COX风险比例回归模型结合KM曲线分析泛癌中Raf激酶家族成员的表达对患者总生存期的影响,如A-Raf基于两种分析方法,均在LGG患者中与预后不良显著相关,在MESO和KIRC中与预后较好有关,表明A-Raf可能影响LGG、MESO和KIRC患者的肿瘤进展过程及预后特征。因此,本研究可能会为Raf激酶家族成为肿瘤预后标志物及在肿瘤学中更进一步应用提供见解,从而有助于肿瘤患者通过结合检测Raf激酶家族基因的表达有效地预测患者预后。
肿瘤微环境在刺激肿瘤细胞的异质性、多药耐药和导致癌症进展和转移中起着至关重要的作用[11-12]。在TME相关分析中,本研究应用ESTIMATE算法计算泛癌患者的基质和免疫评分,进行相关分析。结果发现,泛癌中Raf激酶家族基因表达在部分肿瘤中与基质和免疫评分呈显著正相关或负相关,表明Raf激酶家族与肿瘤细胞和免疫细胞之间存在相互作用,这为开发更有效的治疗方案提供了新的视角。在癌症进展过程中,肿瘤细胞会逐渐失去分化的表型,并获得祖细胞和干细胞样特征,干细胞指数与癌症干细胞活跃的生物学过程和肿瘤去分化有关[13]。本研究的另一个重要发现是,泛癌中Raf激酶家族基因表达也与RNAss和DNAss呈显著正相关或负相关,尤其是在THYM和TGCT中。值得注意的是,在TGCT中,A-Raf和B-Raf与RNAss呈显著负相关,但Raf-1与之呈正相关,A-Raf与DNAss呈显著负相关,B-Raf和Raf-1呈显著正相关。这些结果表明,结合RNAss和DNAss可以鉴定出不同肿瘤的特征。
TMB和MSI是多种肿瘤有效的预后生物标志物和免疫治疗反应指标[14]。在一些癌症类型中,本研究也发现了Raf激酶家族表达与TMB和MSI之间的联系。以往的研究[15]已经将TMB和MSI与患者的药物反应联系起来,特别是针对免疫检查点抑制剂的药物,如PD-1抑制剂。因此,笔者建议Raf激酶家族表达水平可以作为癌症患者用药后免疫治疗评估的额外指标。此外,本课题组还从CellMinerTM数据库中探究了不同人类癌细胞株中Raf激酶家族基因表达与药物敏感性之间的潜在相关性,发现肿瘤细胞中Raf激酶家族基因的表达水平与某些药物的敏感性有关,因此肿瘤患者中检测Raf激酶家族基因的表达对临床药物的选择具有特殊的指导意义。
虽然本研究为Raf激酶家族成员的表达对肿瘤患者的预后、肿瘤微环境及药物靶点等研究方向提供了有用证据,但这项研究仍有一些需要解决的局限性,仍需要更多的实验室研究和大规模的临床试验进行验证。

