丹参酮IIA-丹酚酸B共载脂质体水凝胶制备及性能考察
罗 玺,许小琪,刘冬榕,王 纠,韩 兵,时 军
·药剂与工艺·
丹参酮IIA-丹酚酸B共载脂质体水凝胶制备及性能考察
罗 玺1,许小琪2,刘冬榕1,王 纠1,韩 兵3,时 军1, 4*
1.广东药科大学中药学院,广东 广州 510006 2.汕头市科学技术协会,广东 汕头 515031 3.中国医学科学院整形外科医院,北京 100144 4.广东省局部精准递药制剂工程技术研究中心,广东 广州 510006
制备丹参酮IIA-丹酚酸B共载脂质体水凝胶(Lip-Gel@TSA/SAB),并进行离体皮肤渗透动力学研究。采用薄膜分散-pH梯度法制备丹参酮IIA-丹酚酸B共载脂质体,再进一步负载于氧化透明质酸/琥珀酰壳聚糖,制得水凝胶Lip-Gel@TSA/SAB,进行扫描电子显微镜(SEM)表征;HE染色法研究Lip-Gel@TSA/SAB皮肤刺激性;动态透析法研究Lip-Gel@TSA/SAB的体外释药规律;改良Franz扩散池法研究Lip-Gel@TSA/SAB体外透皮渗透和真皮层滞留性能,计算并拟合药物释放模型。脂质体在透射电子显微镜(TEM)下呈球状或类球状层状囊泡结构,平均粒径为(189.50±1.57)nm,粒度多分散系数(polydispersity index,PDI)为0.246±0.030,平均ζ电位为(−18.73±1.41)mV。Lip-Gel@TSA/SAB呈橘红色,质地均匀,内部为三维多孔网状结构。体外透皮试验表明,TSA-SAB Lips/Gel中TSA、SAB在48 h内单位面积累积透过量分别为(17.55±1.01)、(918.99±50.83)μg/cm2,真皮滞留量分别为(10.07±0.75)、(36.12±2.06)μg/cm2,符合Hixon-crowell方程和一级动力学模型。Lip-Gel@TSA/SAB处方工艺合理,具有良好的透皮吸收性能和药物真皮滞留性能。
脂质体;水凝胶;皮肤渗透动力学;丹参酮IIA;丹酚酸B;薄膜分散-pH梯度法;透明质酸;琥珀酰壳聚糖;动态透析法;透皮吸收
增生性瘢痕(hypertrophic scar,HS)是皮肤深度创伤愈合的病理性结局,成纤维细胞过度增殖或细胞外基质过度沉积形成隆起状皮肤病变。现多采用手术、激光、药物注射等治疗方式,但存在高复发率、皮肤萎缩、毛细血管扩张、局部坏死等不良反应[1-2]。明代《证治准绳疡医》记载,瘢痕又称蟹足肿、黄瓜痈,病机为瘀血阻滞。丹参能“破积聚症坚,散瘿赘恶疮”,具有活血化瘀、凉血消痈的功效,以丹参酮IIA(tanshinone IIA,TSA)和丹酚酸B(salvianolic acid B,SAB)为代表性成分[3]。现代药理研究证明,丹参具有改善微循环、抗血栓、抗凝血、调节免疫等作用,以及显著的抗炎、抗纤维化的效果,能够有效防治增生性瘢痕[4],临床有丹参注射液、丹参川芎嗪注射液、丹参涂膜剂等运用于HS的防治[5]。中医药防治HS具有安全有效的优势,为降低毒副作用、提高患者依从性、避免口服给药的肝脏首过效应,研制防治HS的经皮给药制剂具有重大意义。
TSA具有明显的抗肝、肾、心肌纤维化作用,SAB能够有效抑制成纤维细胞增殖及胶原合成,在防治HS方面具有广阔的应用前景。Chen等[6]研究发现,TSA能阻断细胞周期,诱导细胞早期凋亡,降低凋亡抑制基因(survivin)蛋白的表达,从而治疗皮肤纤维化疾病。Liu等[4]发现,SAB能够减轻博莱霉素诱导的小鼠皮肤纤维化程度,其机制可能与抑制转化生长因子-β1(transforming factor-β1,TGF-β1)/SMAD、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路有关。Peng等[7]通过建立结肠炎小鼠模型观察到丹参茎叶总酚酸与丹参酮联用时对结肠炎具有协同治疗作用,联合给药药效优于单独给药。因此,本研究拟构建丹参酮IIA-丹酚酸B共载脂质体水凝胶(Lip-Gel@TSA/SAB),为活血化瘀中药的纳米透皮制剂提供新的研究思路。
1 仪器与材料
1.1 仪器
UltiMate 3000高效液相色谱仪系统,赛默飞世尔科技公司;LF-50型脂质体挤出仪,加拿大Avestin公司;NK200-1B型可视孔氮吹仪,杭州米欧仪器有限公司;JY 96-IIN型超声波细胞破碎机,宁波新芝生物科技股份有限公司;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;SHA-B水浴恒温振荡器,上海力辰邦西仪器科技有限公司;Olympus CKX41型倒置式生物显微镜,北京中仪光科科技发展有限公司;TP-6型透皮扩散仪,天津市精拓仪器科技有限公司;FD-1-50型真空干燥机,北京博医康实验仪器有限公司;MS-H-Pro+型磁力搅拌器,美国赛洛捷克公司;3-30K型低温离心机,美国Sigma-Aldrich公司;TGL-16型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;JEM-2100F型透射电子显微镜(TEM)、JEM-1200EX型扫描电子显微镜(SEM),日本电子株式会社;Zetasizer Nano ZS90型马尔文激光粒度仪,英国Malvern Panalytical仪器有限公司;IR Prestige-21型岛津傅立叶变换红外光谱仪,日本Shimadzu岛津公司。
1.2 材料
TSA对照品,中国食品药品检定研究院,批号111562-2020012,质量分数≥99%;TSA原料药(批号Y14M10C82864,质量分数≥95%)、SAB对照品(批号H16O10Y100218,质量分数≥98%),上海源叶生物科技有限公司;大豆卵磷脂,德国Lipoid公司,批号579010-1150055-13;胆固醇,上海艾伟特医药科技有限公司,批号B01221;寡聚透明质酸,华熙生物科技股份有限公司,相对分子质量7294,批号20070121;-琥珀酰壳聚糖(-succinyl chitosan,NSC),江苏金壳生物医药科技有限公司,取代度81.3%,黏度62 mPa·s,批号201201;其余试剂均为分析纯。
1.3 动物
SPF级健康SD大鼠,雌雄各半,体质量200~250 g,合格证号为SCXK(粤)2019-0041;普通级健康新西兰兔,雌雄各半,体质量1.5~2.2 kg,合格证号为SCXK(粤)2019-0015。所有动物实验遵循广东药科大学试验动物伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 Lip-Gel@TSA/SAB的制备
2.1.1 TSA-SAB脂质体的制备 精密称取处方量的磷脂、胆固醇、TSA(物质的量比100∶46∶3)共溶于10 mL二氯甲烷,37 ℃真空旋转蒸发30 min,氮气吹干,加7 mL去离子水后常压孵育30 min,冰浴条件下用探头超声(100 W、超声1 s,间隔1 s)5 min;将12 mg SAB溶于3 mL 1%甘氨酸-盐酸缓冲溶液,加入上述溶液中,继续孵育30 min,过0.8 μm微孔滤膜,400 nm脂质体挤出仪来回挤出20次整粒,得TSA-SAB脂质体(TSA-SAB Lips)。再加入9.0%蔗糖混合均匀,冷冻干燥24 h,得TSA-SAB脂质体冻干粉。
2.1.2 Lip-Gel@TSA/SAB的制备 制备氧化透明质酸(oxidized hyaluronic acid,OHA)[8]并用盐酸羟胺滴定法测定OHA样品中的氧化程度(OD)。精密称取0.1 g OHA于25 mL 0.25 mol/mL的盐酸羟胺-0.05%甲基橙溶液中,用0.1 mol/mL的NaOH溶液作为滴定液,当体系溶液由红色变为黄色时即到达滴定终点,记录NaOH的消耗量。按公式(1)计算OD分别为(42.39±2.22)%、(49.18±1.62)%、(61.42±1.36)%,记为OHA40、OHA50、OHA60;将20 mg/mL的OHA溶液缓慢加入于150 mg/mL的NSC溶液中,两者质量比为1∶1,搅拌均匀,即得空白水凝胶(OHA/NSC)。将TSA-SAB脂质体冻干粉(质量分数为30%)复溶于20 mg/mL OHA溶液中,加至150 mg/mL NSC,搅拌均匀,即得Lip-Gel@TSA/ SAB,如图1所示。

图1 Lip-Gel@TSA/SAB的制备
OD=NaOHHA/2HA(1)
NaOH为NaOH浓度,为NaOH的消耗量,HA为透明质酸相对分子质量,HA为透明质酸质量
2.2 Lip-Gel@TSA/SAB的基础性能表征
2.2.1 脂质体表征 采用低速离心法测定脂质体中TSA的包封率[9],将TSA-SAB Lips 2000 r/min(离心半径6.3 cm)离心5 min,取上清,甲醇稀释10倍并超声破乳,HPLC法测定TSA质量浓度为1;另取TSA-SAB Lips甲醇稀释10倍并超声破乳,HPLC法测定TSA质量浓度为2。根据公式(2),计算得TSA的包封率为(87.93±0.97)%。
TSA包封率=1/2(2)
采用高速离心-超滤法测定脂质体中SAB的包封率[10],将TSA-SAB Lips 15 000 r/min(离心半径9.98 cm)离心30 min,取上清,截留相对分子质量100 000超滤管10 000 r/min(离心半径9.98 cm)离心15 min,收集滤过液,HPLC法测定游离SAB质量浓度为3;取TSA-SAB Lips甲醇稀释10倍并超声破乳,HPLC法测定稀释前SAB质量浓度为4。根据公式(3),计算得SAB的包封率为(91.20±0.47)%。
SAB包封率=(4-3)/4(3)
用去离子水复溶TSA-SAB Lips冻干粉,观察脂质体复溶液;将脂质体复溶液滴至铜网上,滴加2%磷钨酸溶液进行负染,自然干燥后,利用透射电子显微镜(transmission electron microscope,TEM)观察其形貌特征;利用马尔文激光粒度仪测定其平均粒径、粒度多分散系数(polydispersity index,PDI)和ζ电位。如图2所示,TSA-SAB Lips呈浅肉橘色,稀释后可观察到明显的淡蓝色乳光,TEM下呈球状或类球状层状囊泡结构;平均粒径为(189.50±1.57)nm(=3),PDI为0.246±0.030(=3),平均ζ电位为(−18.73±1.41)mV(=3)。
2.2.2 傅里叶变换红外光谱(FTIR)分析 采用溴化钾压片法制备不同氧化程度的OHA、NSC和OHA/NSC样品。扫描范围为500~4000 cm−1,扫描速度为0.2 cm/s,分辨率为4 cm−1。如图3所示,与HA相比,OHA在1739 cm−1处出现醛基伸缩振动吸收峰(-C=O),且强度随着氧化程度增加而增大,表明OHA制备成功。与OHA和NSC相比,OHA/ NSC在1645 cm−1处出现亚胺键伸缩振动吸收峰 (-C=N-),且未见明显的醛基吸收峰,表明OHA的醛基与NSC的氨基之间发生席夫碱反应,OHA/ NSC制备成功。
2.2.3 SEM分析 将OHA/NSC经液氮骤冷后真空冷冻干燥,切开,对断面进行喷金处理,利用SEM观察内部微观形貌。如图4所示,OHA/NSC内部为疏松海绵状多孔材料,随着OHA氧化程度增大,交联度变高,孔径变小,形成的网络结构致密。
2.2.4 基础性能特征 系列OHA/NSC pH值分别为6.28±0.04、6.59±0.12、6.89±0.23。将OHA/NSC 0.4 g倒置倾斜30 s不流动,记录成胶时间,为(77±5)s;将0.2 g冻干OHA/NSC浸没于蒸馏水中,定时取出称定质量,直至样品质量不再增加,按公式(4)计算平衡溶胀率;将2 g OHA/NSC放入温度(30.0±0.5)℃、相对湿度(50±5)%的药品稳定性试验箱中,定时取出称定质量,至质量不再减少,按公式(5)计算保湿率;将不同颜色的OHA/NSC切开,并重新拼接[11],自愈合能力良好;将OHA/ NSC置于不同材料(玻璃板、丁腈手套、人体皮肤)表面均能良好黏附;将OHA/NSC通过26 G针头注射,通针性良好,结果如表1和图5所示。

A-复溶前后整体外观 B-TEM C-丁达尔效应 D-粒径 E-ζ电位

a-HA b-OHA40 c-OHA50 d-OHA60 e-NSC f-OHA40/NSC g-OHA50/NSC h-OHA60/NSC
平衡溶胀率=(2-1)/1(4)
保湿率=1-(4-3)/3(5)
1为冻干水凝胶质量,2为溶胀过程中水凝胶质量,3为初始水凝胶质量,4为试验过程中水凝胶质量

图4 OHA/NSC的SEM表征(×200)
表1 OHA/NSC的性能特征 (, n = 3)
Table 1 Properties of OHA/NSC (, n = 3)

表1 OHA/NSC的性能特征 (, n = 3)
OHA/NSC成胶时间/s平衡溶胀率/%保湿率/% OHA40/NSC91.00±7.35836.70±15.6885.99±3.62 OHA50/NSC74.33±4.08781.57±12.3783.44±6.01 OHA60/NSC49.83±2.99710.85±16.6486.31±3.91
2.2.5 Lip-Gel@TSA/SAB的表征 称取适量Lip-Gel@TSA/SAB,甲醇溶解,超声20 min,过0.22 μm微孔滤膜,HPLC法测得TSA质量分数为(0.98±0.27)mg/g(=3),SAB质量分数为(8.37±0.70)mg/g(=3),平均总载药量为(8.80±0.52)%(=3);将处方量扩大5倍后,测得TSA的包封率为(86.60±2.39)%(=3),SAB的包封率为(90.61±1.01)%(=3),平均总载药量为(8.74±0.91)%(=3)。

图5 OHA/NSC水凝胶的性能表征
观察Lip-Gel@TSA/SAB整体形状并进行SEM分析,结果如图6所示,Lip-Gel@TSA/SAB呈橘红色,质地均匀,内部为三维多孔网状结构,断面可见散在脂质体球状颗粒;将Lip-Gel@TSA/SAB置于不同材料(玻璃板、丁腈手套、人体皮肤)表面,具有良好黏附性。
2.3 体外透皮吸收实验
取SD大鼠进行脱毛处理,处死后剥取腹部皮肤并去除皮下脂肪等其他组织,将皮肤固定于Franz扩散池的供给室和接收室之间,角质层朝向供给室,接收介质溶液为无水乙醇-PEG400-生理盐水(5∶2∶3),37 ℃、350 r/min进行试验;将TSA和SAB溶于20 mg/mL OHA溶液中,加至150 mg/mL NSC,搅拌均匀,得TSA-SAB水凝胶(TSA-SAB Gel);分别在供给室中加入0.5 g TSA-SAB Gel、Lip-Gel@ TSA/SAB,于0、1、2、4、6、8、10、12、24、30、36、48 h分别取样5 mL,并补加等量接收介质,氮气吹干,甲醇复溶,HPLC法测定SAB、TSA的质量浓度,按公式(6)计算单位面积累积透过量(Q)。
Q=(CV+CV)/(6)
Q为时间点单位面积累积透过量;C为第个取样点所取样品中药物的质量浓度;C为第(=-1)个时间点所取样品中药物的质量浓度;为接收池体积体积(15 mL);V为取样体积;为扩散池有效接触面积(1.766 cm2);0为供给室初始浓度;为模拟方程直线部分的斜率
以为横坐标,Q为纵坐标,绘制-曲线并进行模型拟合。如图7所示,Lip-Gel@TSA/SAB中TSA在48 h内的Q为(17.55±1.01)μg/cm2(=3),为0.200 μg/(cm2·h),=−1.044+0.941-0.0192+0.000 23(2=0.966 5);SAB在48 h内的Q为(918.99±50.83)μg/cm2(=3),为0.214 μg/(cm2·h),=−49.444+74.392-2.2532+0.0233(2=0.979 3),透皮释放过程均符合Hixson-Crowell方程,为溶蚀与一级动力学释药的作用过程。
2.3.1 皮肤刺激性 取新西兰兔背部皮肤进行脱毛处理,随机分为对照组(生理盐水)、阳性对照组(15 mg/mL甲醛水溶液)、free TSA-SAB组(TSA-SAB物理混合)、TSA-SAB Lips组和Lip-Gel@TSA/SAB组,每组3只,24 h后给药,每天1次,连续7 d,记录受试部位皮肤情况;7 d后处死并取受试部位皮肤进行HE染色,显微镜下观察皮肤情况。甲醛水溶液组皮肤红肿并伴有红斑,其余给药组均未出现异常症状。

A-整体性状 B-SEM(×200),红点为脂质体颗粒 C-黏附性
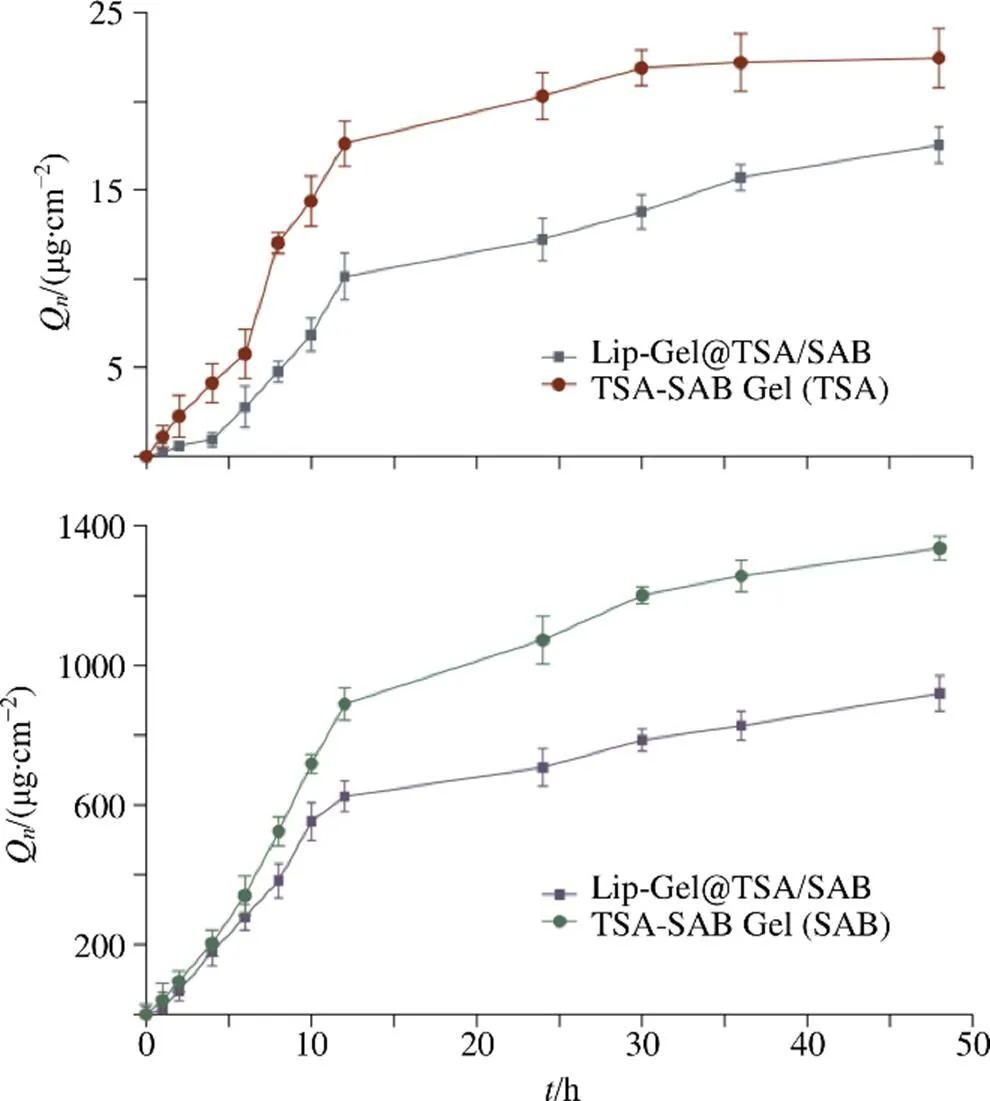
图7 Lip-Gel@TSA/SAB透皮吸收曲线(, n = 3)
如图8所示,甲醛水溶液组皮肤结构表皮受损,真皮组织处可见大量炎性细胞浸润,胶原纤维排列紊乱,皮下组织轻中度水肿;对照组和free TSA/SAB组的兔子皮肤结构完整,角质层无破损,基底膜内侧细胞排列整齐紧密;TSA-SAB Lips组和Lip-Gel@ TSA/SAB组均可见皮肤组织结构表皮细胞无序排列,真皮组织处无炎性细胞浸润,皮下组织棘层细胞和表皮形成细胞小水肿,细胞间隙增大,提示脂质体凝胶可增加角质层细胞间隙,改变角质层结构或加强角质层水合作用从而影响角质层屏障,增强皮肤渗透性。其中,皮下组织棘层细胞和表皮形成细胞小水肿如图TSA-SAB Lips组、Lip-Gel@TSA/ SAB组所示,皮肤结构表皮受损、炎性细胞浸润如图阳性对照组所示。
2.3.2 体外释药试验 将Lip-Gel@TSA/SAB 0.5 mL置于透析袋(截留相对分子质量14 000)内,加入1 mL释放介质(含1%十二烷基硫酸钠的0.9% NaCl溶液),再放入50 mL释放介质中,37 ℃、100 r/min水浴振摇,于0、0.5、1、2、4、6、8、10、12、24、30、36 h分别取样1 mL,并补加等量释放介质,HPLC法测定TSA的质量浓度。另取质量浓度相等的TSA溶液、TSA-SAB Lips和TSA-SAB Gel,同上述实验步骤进行测定。
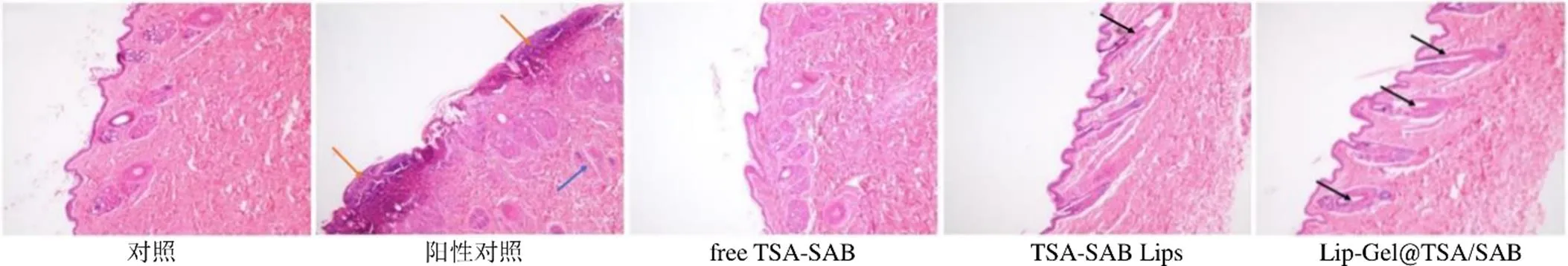
图8 皮肤组织HE染色切片(×400)
SAB体外释药试验的释放介质为0.9% NaCl溶液,操作同上,测定相同质量浓度的SAB溶液、TSA-SAB Lips、TSA-SAB/Gel和Lip-Gel@TSA/SAB中SAB的质量浓度。按公式(7)计算体外释药累积释放率,以取样时间点()为横坐标,累积释放率(Q)为纵坐标,绘制-曲线并进行模型拟合。如图9所示,Lip-Gel@TSA/SAB中TSA 36 h累积释放率48.63%,=3.992+6.072-0.2362+0.0033,2=0.988 1;Lip-Gel@TSA/SAB中SAB 24 h累积释放率61.65%,=−0.402+8.943-0.4002+0.0063,2=0.989 1,体外释药模型均符合Hixon-Crowell和一级动力学模型,即其释放行为遵循溶蚀、扩散和动力学过程。
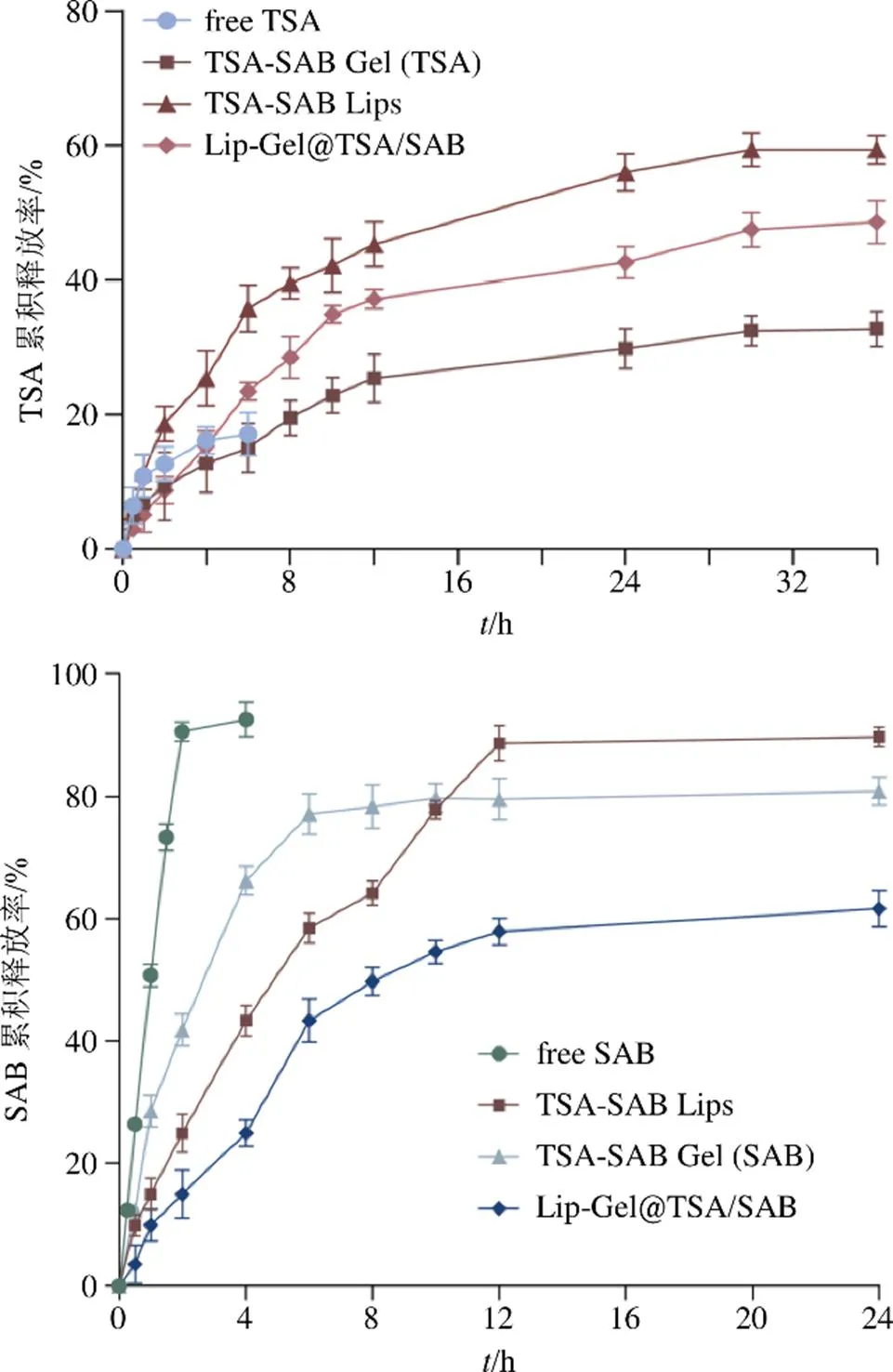
图9 Lip-Gel@TSA/SAB体外释药曲线(, n = 3)
Q=(CV+CV)/(7)
C为第个取样点所取样品中药物的质量浓度;为释放介质总体积;C为第个时间点所取样品中药物的浓度;V为取样体积;为初始加入透析袋内样品所含药物总量;Q为时间点的体外释药累积释放率
2.3.3 真皮滞留量 透皮试验结束后,用生理盐水洗净离体皮肤,研磨成浆,甲醇溶解,超声20 min,3500 r/min(离心半径6.3 cm)离心10 min,取上清液,滤过,HPLC法测定TSA、SAB含量,计算真皮皮肤滞留量。TSA-SAB/Gel中TSA和SAB的真皮滞留量分别为(5.15±0.22)、(23.84±3.85)μg/cm2(=3);Lip-Gel@TSA/SAB中为(10.07±0.75)、(36.12±2.06)μg/cm2(=3)。Lip-Gel@TSA/SAB中真皮滞留量均高于TSA-SAB/Gel,表明Lip-Gel@ TSA/SAB在皮肤真皮组织蓄积,形成药物贮库,缓慢持续释放药物。
3 讨论
TSA具有显著的抗纤维化、抗炎、促进血液循环、改善机体免疫力等作用,SAB能够抑制成纤维细胞增殖、抗内皮细胞过度分化、减少炎症反应[4],在防治HS方面具有广阔的应用前景。然而,TSA透皮性能较差,阻碍了其在皮肤制剂领域中的应用。脂质体为双分子层结构,具有高度组织相容性和细胞亲和力,利用其结构特性同时搭载TSA、SAB 2种不同极性的药物。
脂质体溶液皮肤附着性能较差,采用水凝胶支架,可以延长给药时间,在真皮层形成药物贮库,提高生物利用度[12]。实验通过对不同氧化程度OHA的考察确定最佳OHA/NSC。OHA上醛基能与NSC上的氨基发生席夫碱反应形成水凝胶,当HA的氧化程度过低,醛基含量过少不利于形成均一的水凝胶;而当氧化程度过高,则醛基含量过大易导致细胞毒性过大[13]。综合考虑均一性和细胞毒性,确定OHA50为试验条件。
Dai等[14]研究发现,TSA、SAB、丹酚酸A联合使用可抑制槟榔提取物诱导的口腔黏膜纤维化,可显著抑制小鼠口腔黏膜成纤维细胞的异常增殖和胶原沉积,抑制I型胶原(collagen type 1,COL1A1)和III型胶原(collagen type 3,COL3A1)的转录,通过增加基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9的活性,降低组织金属蛋白酶抑制因子-1(tissue specific inhibitor-1,TIMP-1)和TIMP-2的表达,改善胶原生成和代谢的平衡,抑制结缔组织生长因子(connective tissue growth factor,CTGF)、TGF-β1、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因 子-α(tumor necrosis factor-α,TNF-α)等促炎、促纤维化因子的转录和释放,其抗纤维化作用机制可能与抑制槟榔提取物诱导的蛋白激酶B(protein kinase B,Akt)/ERK和TGF-β1/Smads通路有关[15]。TSA和SAB联用可能通过调控相关MMPs和TIMPs的表达与活性,发挥抗HS作用[15-16]。
本实验结果表明,Lip-Gel@TSA/SAB质量稳定,具有良好的缓释性能,且药物真皮滞留性能良好,有助于降低给药频率,提高患者顺应性[13],后续试验将深入研究Lip-Gel@TSA/SAB抗瘢痕增生效果及作用机制,为制剂开发及应用提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 许小琪, 韩兵, 赖建辉, 等.丹参酮IIA对TGF-β1诱导的人皮肤成纤维细胞增殖的影响及作用机制 [J].中草药, 2020, 51(18): 4685-4690.
[2] 孙子荔, 柳思宇, 邹鸣立, 等.中药防治病理性瘢痕的作用及机制研究进展 [J].中国实验方剂学杂志, 2020, 26(17): 225-234.
[3] Chen X, Guo J, Bao J,.The anticancer properties ofBunge (Danshen): A systematic review [J]., 2014, 34(4): 768-794.
[4] Liu Q, Lu J, Lin J,.Salvianolic acid B attenuates experimental skin fibrosis of systemic sclerosis [J]., 2019, 110(2): 546-553.
[5] 赖建辉, 许小琪, 时军, 等.增生性瘢痕的形成机制及丹参治疗的研究进展 [J].广东药科大学学报, 2019, 35(5): 707-713.
[6] Chen G, Liang Y, Liang X,.Tanshinone IIAinhibits proliferation and induces apoptosis through the downregulation of survivin in keloid fibroblasts [J]., 2016, 76(2): 180-186.
[7] Peng K Y, Gu J F, Su S L,.stems and leaves total phenolic acids combination with tanshinone protect against DSS-induced ulcerative colitis through inhibiting TLR4/PI3K/AKT/mTOR signaling pathway in mice [J]., 2021, 264(10): 113052-113061.
[8] Li L, Wang N, Jin X,.Biodegradable and injectablecross-linking chitosan-hyaluronic acid based hydrogels for postoperative adhesion prevention [J]., 2014, 35(12): 3903-3917.
[9] 邵红霞, 奉建芳, 龙晓英.脂质体包封率的测定方法 [J].中南药学, 2009, 7(3): 212-215.
[10] 闫丹, 江敏瑜, 王云红, 等.积雪草总苷脂质体的制备及体外透皮研究 [J].中草药, 2018, 49(9): 2041-2048.
[11] 王超燃.一种含酰肼基团的水凝胶的制备及应用 [D].长春: 长春工业大学, 2020.
[12] Akhtar N, Khan R A.Liposomal systems as viable drug delivery technology for skin cancer sites with an outlook on lipid-based delivery vehicles and diagnostic imaging inputs for skin conditions’ [J]., 2016, 64: 192-230.
[13] 翁洪娟.基于琥珀酰壳聚糖-氧化透明质酸的新型水凝胶制备及性能研究 [D].济南: 山东大学, 2020.
[14] Dai J P, Zhu D X, Sheng J T,.Inhibition of tanshinone IIA, salvianolic acid A and salvianolic acid B on areca nut extract-induced oral submucous fibrosis[J]., 2015, 20(4): 6794-6807.
[15] Zhang H S, Wang S Q.Salvianolic acid B frominhibits tumor necrosis factor-alpha (TNF-alpha)-induced MMP-2 upregulation in human aortic smooth muscle cells via suppression of NAD(P)H oxidase-derived reactive oxygen species [J]..2006, 41(1): 138-148.
[16] Mao S, Wang Y, Zhang M,Phytoestrogen, tanshinone IIAdiminishes collagen deposition and stimulates new elastogenesis in cultures of human cardiac fibroblasts [J].2014, 323(1): 189-197.
Preparation and properties of tanshinone ⅡA-salvianolic acid B co-loaded liposomes hydrogel
LUO Xi1, XU Xiao-qi2, LIU Dong-rong1, WANG Jiu1, HAN Bing3, SHI Jun1, 4
1.School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2.Shantou Science and Technology Association, Shantou 515031, China 3.Plastic Surgery Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100000, China 4.Guangdong Engineering & Technology Research Center of Topical Precise Drug Delivery System, Guangzhou 510006, China
To prepare tanshinone IIA-salvianolic acid B co-loaded liposomes hydrogel (Lip-Gel@TSA/SAB) and investigate permeation kinetics of skin.Tanshinone IIA-salvianolic acid B co-loaded liposomes were prepared by thin film dispersion-pH gradient method, and then loaded on oxidized hyaluronic acid/-succinyl chitosan hydrogel to obtain Lip-Gel@TSA/SAB.SEM was used to characterize Lip-Gel@TSA/SAB.HE staining was used to study the skin irritation of Lip-Gel@TSA/SAB.Dynamic dialysis was used to study the drug release of Lip-Gel@TSA/SAB.Modified Franz diffusion cell method was used to study the transdermal penetration and dermal retention of Lip-Gel@TSA/SAB, and the drug release model was calculated and fitted.Liposomes showed a spherical or sphere-like laminar vesiclestructure under TEM with an average particle size of (189.50 ± 1.57) nm, a PDI of 0.246 ± 0.030, and an average ζ potential of (−18.73 ± 1.41) mV.Lip-Gel@TSA/SAB was orange-red with homogeneous texture and a three-dimensional porous network structure inside.The transdermal testshowed that the cumulative penetration amounts of TSA and SAB per unit area of TSA-SAB Lips/Gel within 48 h were (17.55 ± 1.01) and (918.99 ± 50.83) μg/cm2, respectively, and the dermal retention of TSA was (10.07 ± 0.75) μg/cm2while SAB was (36.12 ± 2.06) μg/cm2, which accorded with Hixon-crowell equation and first-order kinetic model.Lip-Gel@TSA/SAB preparation process is reasonable, it has good transdermal absorption, drug dermal retention and high bioavailability.
liposome; hydrogel; skin permeation kinetics;tanshinone IIA; salvianolic acid B; thin film dispersion-pH gradient method; hyaluronic acid;-succinyl chitosan; dynamic dialysis; transdermal absorption
R283.6
A
0253 - 2670(2022)10 - 2977 - 08
10.7501/j.issn.0253-2670.2022.10.006
2021-11-23
国家自然科学基金资助项目(82173982);广东省自然科学基金资助项目(2022A1515011382)
罗 玺(1995—),女,在读硕士研究生,研究方向为中药制剂研究与开发。Tel: 13322910501 E-mail: 528990196@qq.com
通信作者:时 军(1980—),男,博士,副教授,主要从事中药经皮给药技术与增生性瘢痕防治研究。Tel: 13580334598 E-mail: shijun8008@163.com
[责任编辑 郑礼胜]

