多功能型明胶黏合剂的制备及应用研究进展
李良 吴瑀婕 杨静 马晶晶 杨彪 邹烨 王道营 徐为民
:明胶是由胶原蛋白水解得到的一类聚合物。作为一种具有良好生物相容性和生物降解性等生物学性能的天然高分子材料,因其具有良好的发泡性、乳化性和成膜性等特点,在产品包装、增稠、充当递送载体等方面被广泛应用。本文就明胶凝胶强度、黏度、颜色、产量、等电点等理化性质及其影响因素,以及明胶不同类型的改性、交联方式和制备各种功能性明胶基水凝胶进行综述。通过设计使用不同材料,引入不同官能团来合成不同功能特性的明胶复合水凝胶黏合剂,以丰富其在日常生活的应用,为明胶的提取及综合利用提供一些新的思路。
:明胶;交联;改性;水凝胶;黏合剂
Recent Progress in Preparation and Application of Multifunctional Gelatin Adhesives
LI Liang WU Yujie YANG Jing MA Jingjing YANG Biao ZOU Ye WANG Daoying XU Weimin
Gelatin is a polymer derived from the hydrolysis of collagen. As a natural polymer material with good biocompatibility and biodegradability, gelatin has been widely used in product packaging and thickening and as a delivery carrier due to its good foaming, emulsifying and film-forming properties. In this paper, the physicochemical properties of gelatin such as gel strength, viscosity, color, yield and isoelectric point and the factors influencing them are reviewed, as well as the modification of different types of gelatin, the types and ways of cross-linking of gelatin and the preparation of various functional gelatin-based hydrogels. Gelatin composite hydrogel adhesives with different functional properties can be synthesized by introducing different functional groups into different artificially designed materials, which can enrich the application of gelatin in daily life and provide some new ideas for the extraction and comprehensive utilization of gelatin.
gelatin; crosslinking; modification; hydrogels; adhesive
DOI:10.7506/rlyj1001-8123-20211227-242
中圖分类号:TQ431.3 文献标志码:A 文章编号:
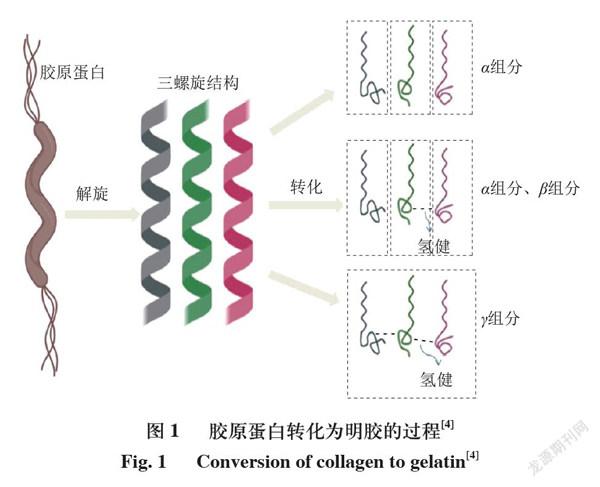
明胶不是天然存在的蛋白质,而是由胶原蛋白水解产生的一种无味、无色的固体物质,它与胶原蛋白具有同源性。胶原蛋白是一种结构蛋白,具有3 个相互交织的肽链,三重螺旋结构的稳定性由链间的氢键提供。胶原蛋白有多种类型,迄今为止,已发现29 种胶原蛋白,按发现时间顺序分别称为Ⅰ型到XXIX型。胶原蛋白向明胶的转化目前认为是由胶原蛋白的螺旋结构分解为无规则卷曲,冷却后,无规则卷曲形态会经历再次向螺旋结构的转变,在此期间它们会改变原始结构(图1)。
水凝胶由水和聚合物网络组成,兼具吸水溶胀又不溶解的性能,在黏合剂方面具有较大优势。明胶分子链中含有大量的活性官能团,具有水溶性和可逆凝胶化的优点,使其成为构筑水凝胶黏合剂的优良生物材料。制备具有高强度和多功能的明胶黏合剂有利于提高明胶的高附加值并拓展其应用领域,有助于明胶行业的可持续发展。目前,明胶黏合剂在工业中的应用包括伤口敷料、生物活性材料、口服递送载体及食品的封装等方面。本文通过对明胶的提取、改性、交联等方法和机理进行总结,同时指出改性和交联可能对明胶黏合剂产生的负面影响,以期为明胶黏合剂的深入研究提供新的研究思路。
根据获取来源不同,明胶可分为哺乳动物(如牛、猪)明胶、鱼类(如冷水鱼和温水鱼)明胶、畜禽(鸡、鸭)明胶、昆虫明胶等。过去,明胶是从猪的皮肤和软骨(46%)、牛皮(29.4%)、各种动物的骨头(23.1%)和其他来源(1.5%)提取的。如今,由于牛海绵状脑病(bovine spongiform encephalopathy,BSE)和口蹄疫(foot and mouth disease,FMD)的担忧,以及犹太教和伊斯兰教认为食用猪明胶违法,用其他更安全的来源提取明胶成为了学者新的研究方向,例如,从鱼类和家禽中提取明胶受到了更多的关注。
明胶通过其不同获取方法分为A型明胶(等电点为pH 6.5~9.0)、B型明胶(等电点为pH 4.8~5.2)及酶法明胶。其中A型明胶是指将原材料经酸性介质前处理后获得的明胶,故又称为酸法明胶。B型明胶是指将原材料经碱性介质前处理后获得的明胶,故又称为碱法明胶。研究表明,酸性处理对鱼皮和猪皮中共价交联较少的胶原蛋白更有效,而碱性处理对牛皮中结构更复杂的胶原蛋白有效。酶法明胶则是指将原材料经酶处理后获得的明胶。酶处理提高了明胶产量,缩短了加工时间,产生的废物更少。但是酶法会使明胶的链和链一起降解,降低了凝胶强度,从而影响明胶质量。
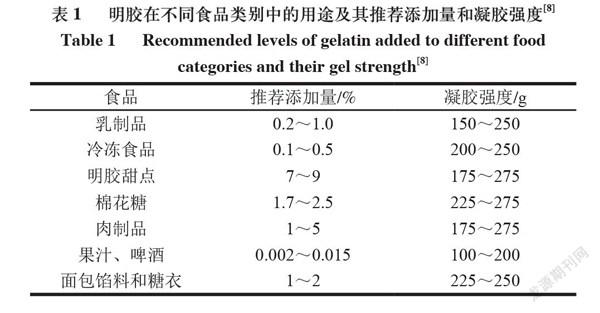
明胶具有良好的生物相容性和生物降解性,且具有优良的功能特性,如水结合能力、成膜性、发泡和乳化能力,使其成为多功能食品(表1)的重要成分。
明胶是从各类动物皮中提取出来的胶原蛋白的变性产物,具有蛋白质的理化性质,同时因其自身分子结构的特殊性又具有其自身的独特性质。
1.1 胶凝特性
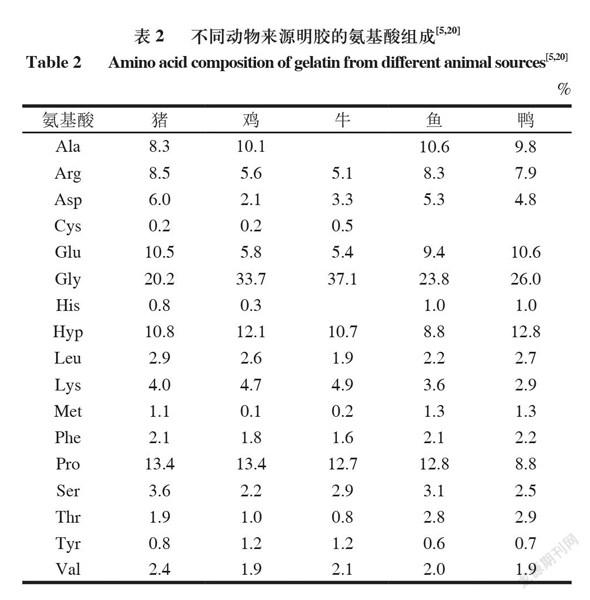
明胶的临界胶凝温度取决于其原料,然而,鱼皮明胶的脯氨酸和羟脯氨酸含量显著低于哺乳动物明胶(表2),导致其凝胶强度、凝胶温度与哺乳动物相比较低。凝胶强度的大小则体现了明胶的胶凝能力。食用明胶的凝胶强度通常为50~300 g(表1),而200~250 g是最优良的。明胶的凝胶强度与链和链的总和成正比。分子质量分布和氨基酸组成的差异导致凝胶强度的差异,通常具有高分子质量多肽的明胶表现出高凝胶强度。
1.2 分子质量
分子质量主要取决于提取工艺及所使用的原材料,所用动物的年龄也有影响。提取温度的升高会增加明胶主蛋白链(、、链)的降解,从而降低所得明胶的分子质量。其分子质量主要取决于链(80~125 kDa)、链(160~250 kDa)、链(240~375 kDa)和其他低分子质量物质。链和链大致分别为单体链的二聚体和三聚体(图1)。与在高pH值下提取的明胶相比,低pH值下提取的明胶具有更宽的分子质量分布和更小的分子质量,而且随着提取时间的延长也会导致高分子质量明胶消失。
1.3 氨基酸组成
氨基酸组成取决于明胶的来源,不同种类的明胶来源,其氨基酸种类也不尽相同(表2)。甘氨酸(Gly)(27%~35%)、脯氨酸(Pro)和羟脯氨酸(Hyp)(20%~24%)是最主要的氨基酸。与哺乳动物明胶相比,鱼明胶的特点是Pro和Hyp含量较低,所以鱼明胶的凝胶强度比哺乳动物明胶凝胶强度偏低。
不同种类来源的明胶都有一些共同的结构,即Gly-XY-序列的连续重复,其中X主要是Pro,Y主要是Hyp。Pro和Hyp的含量越高,明胶的融化温度和胶凝温度就越高,热稳定性越好,其主要是通过游离水分子与明胶中Hyp的羟基之间形成的氢键来维持胶原结构三螺旋的稳定性。
1.4 等电点
等电点是明胶的一个重要物性指标,当pH值为等电点时,明胶分子中的净电荷数等于零,分子链之间卷曲程度最大,其溶液的黏度、渗透压、浊度等物性指标均最低。Gudmundsson等发现,在pH 6.0条件下制备的鱼明胶比在pH 2.5~3.0条件下制备的鱼明胶具有更高的凝胶强度。这是因为在pH 2.5~3.0条件下下制备的明胶聚合物带正电荷,排斥力占优势,使聚合物彼此远离;而在pH 6.0条件下制备的凝胶更接近明胶的等电点,此时明胶聚合物几乎带中性电荷,明胶趋向聚集,形成更紧密的凝胶网络。Hattrem等发现,鱼明胶的等电点随提取温度的升高而降低。这可能是由于随着提取温度的升高,谷氨酰胺和天冬酰胺分别脱酰胺变为谷氨酸和天冬氨酸导致的。
1.5 其他性质
明胶的黏度与其成膜性密不可分,黏度的大小取决于明胶中多肽链的长短及其分子质量。明胶中多肽链的长度越短,则明胶的网状结构越容易形成,其黏度也就越低。同时明胶的黏度会影响其溶解速率和凝固速率,黏度越低,其溶解、凝固速率越小。
明胶的颜色特性取决于所使用的原材料和生产方法。在提取步骤中,蛋白质和微量脂质之间会发生美拉德反应,使明胶变黑。明胶的深色通常是由其制造过程中引入或未去除的无机物、蛋白质和黏膜物质污染物引起的。
明胶因其成膜能力、生物降解性和良好的气体阻隔性而被广泛研究,但其机械强度较差,且由于其吸湿性强,与水分含量高的食品接触时容易溶胀溶解,限制了其在食品包装中的直接应用。明膠分子链上含有大量的活性官能团,这为明胶的改性奠定了基础。常见的明胶改性方法分为物理改性、化学改性及酶法改性。
2.1 物理改性
物理改性是指通过超声、高压、紫外线照射或γ照射等方法进行交联改性,物理改性过程中最大的优势是不会引入其他毒性物质,具有极高的生物相容性。Tu Zongcai等用超声显著提高了鳙鱼明胶的产率和游离氨基含量。然而,较长的超声时间会削弱凝胶网络结构,从而降低凝胶强度和熔点,并伴随产生更多的表面空隙。张宇昊等用高压处理也提高了鱼明胶的凝胶强度,当压力为300 MPa时,处理得到的巴沙鱼皮明胶凝胶强度显著高于200 MPa提取得到的明胶,这可能是由于高压引起了蛋白质聚集效应。辐照作为一种物理的、具有成本效益的非热技术受到越来越多的关注。明胶在辐照作用下发生交联、聚集和降解,是由于明胶中酪氨酸、苯丙氨酸等特定残基处形成自由基,导致明胶分子交联断裂。而与紫外线照射相比,γ照射很容易降低鱼胶的凝胶强度和黏度,可能是因为γ辐照具有较高的量子能量,容易引起明胶分子变化甚至碎裂,导致明胶水凝胶的凝胶强度和黏度降低。物理改性虽有以上优点,但是物理改性对力学性能改善程度较小,而且物理改性大多具有可逆性。
2.2 化学改性
化学改性通常是利用明胶链上的活性基团来发生化学反应,促使分子间形成网络结构,实现对明胶的改性。如磷酸化修饰、醛类改性、酚类改性、琥珀酰胺修饰和糖基化修饰等。Kaewruang等将三聚磷酸钠的磷酸盐引入明胶分子中,增强了明胶链中磷酸基团与氨基酸—NH之间的离子相互作用,提高了明胶的凝胶强度。戊二醛可与氨基酸的侧向残基快速反应,特别是与赖氨酸和羟赖氨酸的-NH官能团反应,以通过席夫碱形成亚胺来稳定明胶网络。酚类化合物的羟基可通过氢键与明胶的羧基相互作用,酚类的芳环与明胶的疏水侧链之间可能发生疏水相互作用,从而改善鱼明胶的功能特性。Zhang Ting等用辛烯基琥珀酸酐改性牛皮和鱼皮明胶,增加了鱼油乳液的液滴稳定性、相变时间和奶油化指数。周伟等用糖基化处理联合添加杨梅素协同提高鱼鳞明胶可食膜的机械性能和光阻隔性能,而不影響鱼鳞明胶可食膜的阻水性。
2.3 酶法改性
酶法改性是用酶来催化蛋白质分子内或分子间交联,以改变其功能特性。与化学修饰相比,酶法改性有几个显著的优点:1)更高的选择性和底物特异性,使所得产物具有精心设计和立体有序的结构;2)较温和的反应条件;3)可持续。微生物转谷氨酰胺酶(microbial transglutaminase,MTGase)通过催化蛋白质的-氨基之间形成交联肽键,从而诱导蛋白质中-(-谷氨酰)-赖氨酸交联的形成。Wangtueai等发现,随着MTGase浓度的增加,MTGase显著改变了鱼明胶的结构,形成了高分子质量聚合物。由于形成了具有非常小空隙的致密、均匀凝胶网络,这些改性大大提高了鱼明胶的熔点和凝胶强度。但是,Wangtueai等也发现,过量的酶会导致鱼明胶凝胶强度和硬度降低,因为过量的交联会抑制均匀蛋白质网络的发展,甚至在高浓度下显示出非热可逆性。
水凝胶是许多食物的重要成分,包括酸乳、甜点、酱料和一些肉制品,它提供了理想的外观、质地、风味和稳定性特征。
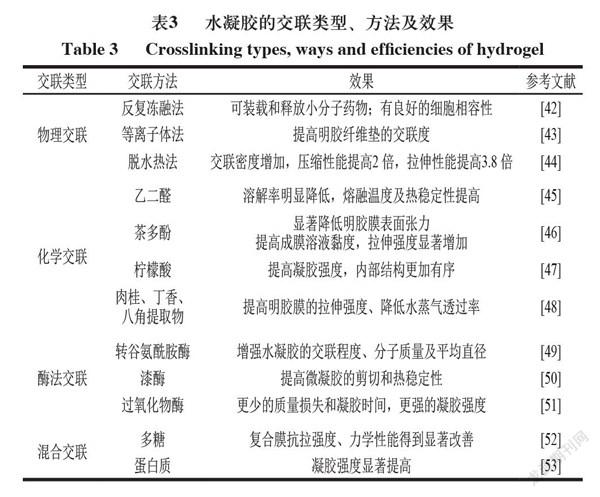
目前水凝胶交联类型主要分为物理交联、化学交联、酶法交联和混合交联(表3)。
3.1 物理交联
物理交联是通过物理相互作用,如静电吸附、氢键、范德华力等形成明胶分子链间的缠绕。目前,明胶基水凝胶的物理交联方法主要包括反复冻融法、等离子体法和脱水热法等。Mauricio等用超声物理交联纤维素纳米晶须和淀粉,制备微水凝胶复合材料,在药物递送方面,交联纤维素纳米晶须的药物释放速率降低约2.9 倍。物理交联因为没有引入化学类交联剂,所以细胞毒性相对较低、生物降解性、生物相容性较好。但是通过物理法制备的明胶基水凝胶存在性质不稳定、力学强度低等缺点。
3.2 化学交联
明胶的化学交联可在蛋白质片段之间形成持久的共价键。用于明胶的化学交联剂包括戊二醛、甘油醛、甲醛、京尼平、乙二醛、二醛淀粉和羰基二咪唑。然而,大多数化学交联剂通常会引起毒性、环境污染以及导致其他不良影响,所以天然交联剂是首选。目前多酚化合物(包括绿茶多酚、迷迭香、咖啡酸和没食子酸)、有机酸(乙酸、苹果酸、草酸和柠檬酸)、草本提取物(肉桂、丁香和八角)等具有用作生物聚合物的天然交联剂的潜在应用。
3.3 酶法交联
明胶分子链可在生物酶的催化作用下发生生化反应,从而产生内部交联,酶法交联常用的酶主要有谷氨酰胺转氨酶、漆酶、过氧化物酶等。由于没有化学交联剂的引入,酶法交联具有细胞毒性低、生物相容性好、自然条件下易被降解等优点。
3.4 混合交联
目前研究的通常思路是将可逆物理交联和不可逆共价交联混合在一种聚合物结构中,以获得坚韧的水凝胶。基于这个思路,发现了拓扑凝胶、滑环凝胶、双网络凝胶和双交联凝胶的制备方法。然而,这些水凝胶的主要支架通常是合成聚合物(如聚丙烯酰胺),這使得它们不具有生物相容性和生物降解性。在食品行业用于制备水凝胶的成分中,蛋白质和多糖因其可生物降解性、生物相容性和无毒性等特点受到广泛关注。
添加多糖可加速和强化不同分子内和分子间水平的结构形成过程。由蛋白质和多糖形成的两亲共轭物可通过蛋白质的疏水区域牢固锚定在食品乳液系统的油水界面上,从而形成黏弹性层,同时,非吸附性多糖区域提供了空间稳定性,可导致胶凝的形成。蛋白质和多糖之间的相互作用主要是通过美拉德反应的共价键,即起始于还原糖与氨基酸或蛋白质赖氨酸残基的-氨基的缩合,以及静电相互作用、疏水相互作用、氢键和范德华相互作用的非共价键。
蛋白质与明胶可以形成更强和更坚固的凝胶。Badii等发现,鱼明胶与蛋清蛋白形成的凝胶结构显示出协同相互作用,从而导致更高的凝胶强度。蛋清-明胶相互作用机制为:加热时,一部分明胶(其可逆性未恢复)与蛋清蛋白非共价结合,然后蛋清蛋白采用一种构象,将其与其他蛋清蛋白的聚集降至最低,最后与对照凝胶相比形成了均匀的强凝胶结构。
明胶基水凝胶是以明胶为基础通过化学交联、物理交联、酶法交联以及与其他材料复合等方式而得到的水凝胶。目前明胶黏合剂主要分为高强度凝胶黏合剂和多功能凝胶黏合剂。
4.1 高强度凝胶黏合剂
水凝胶黏合剂易脆,力学性能差是限制其应用的主要原因。近些年,学者把研究重点放在如何提高水凝胶黏合剂的力学性能上。如Hyunwoo等在固体表面修饰甲基丙烯酸基团,该基团可以和水凝胶界面进行化学键合,形成高韧性的水凝胶,界面的黏合强度可达到1 000 J/m,使得高水分含量(超过90%)的水凝胶可以和许多固体材料(玻璃、陶瓷、铝制品等)进行界面黏合;Yuk等在黏合之前对弹性体和水凝胶进行预成型,其次,用二苯甲酮对固化的弹性体表面进行改性,与水凝胶进行化学键合,利用坚韧水凝胶的耗散特性来实现坚固的界面;Liu Qihan等则是通过将硅烷偶联剂加入到水凝胶和弹性体的体系中,通过硅烷偶联剂产生的硅氧烷键使得水凝胶和弹性体形成化学键合,增强水凝胶的力学性能。但以上研究的问题是因弹性体和一些偶联剂的引入,人体会产生一定的排斥性。
4.2 多功能凝胶黏合剂
水凝胶与不同材料的复合使得水凝胶具有不同的功能性质,在生活中应用于不同的领域。
在医学领域中,Katas等分别以花蘑菇基质和壳聚糖为还原剂和稳定剂,成功合成了具有一定抗菌作用的银纳米颗粒(argentum nanoparticles,AgNPs),然后将AgNPs加入到明胶基水凝胶中用作伤口敷料,表现出良好的抗菌性和生物膜活性。Zhang Min等利用明胶、壳聚糖及水性聚氨酯为原料,制备出一种兼具高机械强度、抗菌及可生物降解的多功能水凝胶膜,该研究主要是利用明胶的成胶性能及良好的生物相容性、壳聚糖优异的抗菌性能及水性聚氨酯优异的力学性能,将三者通过乳液聚合的方法进行化学结合,构建出一种具有抗菌性能的高强度水凝胶膜敷料。Barros等以明胶和海藻酸为原料制备了可生物降解的输尿管支架,对人体无害,可短期自然降解,成功克服了第1代输尿管支架的缺陷。况光仪等利用缓降解骨基质明胶修复喉框架缺损,以达到恢复喉的外形和功能的目的,是目前最为理想的新喉再造的生物活性材料。
在食品领域中,Zhang Jing等发现多糖-蛋白质双网络(double network,DN)水凝胶系统可作为生物活性化合物的口服递送载体,DN水凝胶表现出高机械强度,因为它的第1个网络有效耗散了能量,而第2个网络在变形过程中保持了水凝胶的完整性。与以蛋白质为唯一成分的水凝胶相比,DN水凝胶在肠道中运输营养物质的效率更高,因为凝胶中的多糖网络保护蛋白质免受胃蛋白酶降解和胃中酸性环境的影响。Ding Mengzhen等用丙酮、戊二醛交联明胶纳米颗粒,制备负载鱼油的皮克林(Pickering)乳液,可有效保护鱼油中的活性成分,增加水溶性,隔离鱼腥味。Wang Xiaoyan等用壳聚糖/明胶复合颗粒作为一种新型的Pickering乳化剂,显示出更小的液滴尺寸和更好的长期稳定性,用于生产食品和非食品应用的无表面活性剂和生物基O/W乳液。Ge Liming等通过1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺/-羟基琥珀酰亚胺将迷迭香酸(rosemary acid,RosA)化学偶联到明胶骨架上,制备出明胶-G-RosA偶联物,然后将其用甘油增塑并用二醛黄原胶交联,以制备活性明胶基可食用薄膜。结果表明,RosA-明胶可食用薄膜具有良好的耐水性、较强的机械性能和优异的紫外线阻隔能力、有效的抗氧化和长期抗菌活性,在食品和药品包装领域具有广阔的应用前景。
在其他领域中,Hou Jiliang等以丙烯酸丁酯为主要成分,丙烯酸二环戊酯为交联剂进行乳液聚合,形成大分子微球,使其作為疏水缔合的交联中心,制备快速可恢复、抗疲劳、超韧的双网络水凝胶。该方法可以有效阻止水凝胶裂纹扩展趋势,所制备的双网络水凝胶拉伸应变高达2 100%,拉伸应力也达到1.48 MPa,在保护套、保护涂层、防尘罩等领域有潜在应用前景。Ren Kai等用海藻酸钠胺化明胶,与聚吡咯通过低温制备了自愈合导电水凝胶,海藻酸盐和明胶网络中存在大量可逆的席夫碱单元,可作为动态交联剂修复水凝胶。这在可修复电路、柔性传感器设备方面具有潜在的应用。
明胶因其独特的理化特性而被广泛应用于食品、医药、化妆品等诸多领域。为了满足全球大多数消费者对明胶日益增长的需求,有必要进一步研究和探索鱼明胶和家禽类明胶作为哺乳动物明胶的替代品。目前,从鱼和家禽的皮肤和骨头中开发明胶来源的进展很快,还有骆驼明胶、鳄鱼明胶、鸭明胶等。这些未来均可能会作为重要的商业明胶来源,但更重要的是其可能具有新颖、独特的功能特性。
明胶作为常用的凝胶,因其稳定性与凝胶特性方面还存在缺陷,研究开发改性明胶的功能特性与改性程度之间的关系,将直接有利于更高品质明胶的产业化。基于改性明胶的水凝胶在医学及食品领域有广泛用途,如支架、伤口敷料、可食性薄膜及口服递送载体等。但在改性交联前仍有许多重要问题急需解决,因此还需大量科学研究来解释改性明胶交联后如何影响食品的质地、结构和加工特性,并结合其他分析方法进行研究,如感官、流变学和摩擦学分析。明胶基水凝胶在未来会和各种功能材料相结合,衍生出各种功能,在生产生活方面会有更广阔的应用。
[1] 王雨生, 张楠, 陈海华. 高G型海藻酸钠-明胶pH敏感型复合水凝胶的制备与性质[J]. 中国食品学报, 2017, 17(8): 132-139. DOI:10.16429/j.1009-7848.2017.08.018.
[2] LIN Kaili, ZHANG Dawei, MACEDO M H, et al. Advanced collagen-based biomaterials for regenerative biomedicine[J]. Advanced Functional Materials, 2019, 29(3): 1804943. DOI:10.1002/adfm.201804943.
[3] MAKI Y, ANNAKA M. Gelation of fish gelatin studied by multi-particle tracking method[J]. Food Hydrocolloids, 2020, 101: 105525. DOI:10.1016/j.foodhyd.2019.105525.
[4] ZHANG Ting, XU Jiamin, ZHANG Yangyi, et al. Gelatins as emulsifiers for oil-in-water emulsions: extraction, chemical composition, molecular structure, and molecular modification[J]. Trends in Food Science and Technology, 2020, 106: 113-131. DOI:10.1016/j.tifs.2020.10.005.
[5] ABEDINIA A, MOHAMMADI NAFCHI A, SHARIFI M, et al. Poultry gelatin: characteristics, developments, challenges, and future outlooks as a sustainable alternative for mammalian gelatin[J]. Trends in Food Science and Technology, 2020, 104: 14-26. DOI:10.1016/j.tifs.2020.08.001.
[6] KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576. DOI:10.1016/j.foodhyd.2008.07.002.
[7] LÜ Linchen, HUANG Qingyun, DING Wen, et al. Fish gelatin: the novel potential applications[J]. Journal of Functional Foods, 2019, 63: 103581. DOI:10.1016/j.jff.2019.103581.
[8] AHMAD T, ISMAIL A, AHMAD S A, et al. Recent advances on the role of process variables affecting gelatin yield and characteristics with special reference to enzymatic extraction: a review[J]. Food Hydrocolloids, 2017, 63: 85-96. DOI:10.1016/j.foodhyd.2016.08.007.
[9] CAO Y, MEZZENGA R. Design principles of food gels[J]. Nature Food, 2020, 1(2): 106-118. DOI:10.1038/s43016-019-0009-x.
[10] TAVAFOGHI M, SHEIKHI A, TUTAR R, et al. Engineering tough, injectable, naturally derived, bioadhesive composite hydrogels[J]. Advanced Healthcare Materials, 2020, 9(10): e1901722. DOI:10.1002/adhm.201901722.
[11] ABDELMALEK B E, GÓMEZ-ESTACA J, SILA A, et al. Characteristics and functional properties of gelatin extracted from squid () skin[J]. LWT-Food Science and Technology, 2016, 65: 924-931. DOI:10.1016/j.lwt.2015.09.024.
[12] AHMAD T, ISMAIL A, AHMAD S A, et al. Characterization of gelatin from bovine skin extracted using ultrasound subsequent to bromelain pretreatment[J]. Food Hydrocolloids, 2018, 80: 264-273. DOI:10.1016/j.foodhyd.2018.01.036.
[13] NAGARAJAN M, BENJAKUL S, PRODPRAN T, et al. Characteristics and functional properties of gelatin from splendid squid () skin as affected by extraction temperatures[J]. Food Hydrocolloids, 2012, 29(2): 389-397. DOI:10.1016/j.foodhyd.2012.04.001.
[14] TAN C C, KARIM A A, UTHUMPORN U, et al. Effect extraction temperature on the emulsifying properties of gelatin from black tilapia () skin[J]. Food Hydrocolloids, 2020, 108: 106024. DOI:10.1016/j.foodhyd.2020.106024.
[15] GUDIPATI V. Fish gelatin: a versatile ingredient for the food and pharmaceutical industries[M]//KIM S K. Marine proteins and peptides: biological activities and applications. Wiley, 2013: 271-295. DOI:10.1002/9781118375082.ch13.
[16] GÓMEZ-GUILLÉN M C, GIMÉNEZ B, LÓPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: a review[J]. Food Hydrocolloids, 2011, 25(8): 1813-1827. DOI:10.1016/j.foodhyd.2011.02.007.
[17] DÍAZ-CALDERÓN P, FLORES E, GONZÁLEZ-MUÑOZ A, et al. Influence of extraction variables on the structure and physical properties of salmon gelatin[J]. Food Hydrocolloids, 2017, 71: 118-128. DOI:10.1016/j.foodhyd.2017.05.004.
[18] KWAK H W, SHIN M, LEE J Y, et al. Fabrication of an ultrafine fish gelatin nanofibrous web from an aqueous solution by electrospinning[J]. International Journal of Biological Macromolecules, 2017, 102: 1092-1103. DOI:10.1016/j.ijbiomac.2017.04.087.
[19] WANG Lin, AN Xinxin, YANG Fangmei, et al. Isolation and characterisation of collagens from the skin, scale and bone of deep-sea redfish ()[J]. Food Chemistry, 2008, 108(2): 616-623. DOI:10.1016/j.foodchem.2007.11.017.
[20] AYKIN-DINCER E, KOC A, ERBAS M. Extraction and physicochemical characterization of broiler () skin gelatin compared to commercial bovine gelatin[J]. Poultry Science, 2017, 96(11): 4124-4131. DOI:10.3382/ps/pex237.
[21] GUDMUNDSSON M, HAFSTEINSSON H. Gelatin from cod skins as affected by chemical treatments[J]. Journal of Food Science, 1997, 62(1): 37-39. DOI:10.1111/j.1365-2621.1997.tb04363.x.
[22] HATTREM M N, MOLNES S, HAUG I J, et al. Interfacial and rheological properties of gelatin based solid emulsions prepared with acid or alkali pretreated gelatins[J]. Food Hydrocolloids, 2015, 43: 700-707. DOI:10.1016/j.foodhyd.2014.07.026.
[23] SILVA R S G, BANDEIRA S F, PINTO L A A. Characteristics and chemical composition of skins gelatin from cobia ()[J]. LWT-Food Science and Technology, 2014, 57(2): 580-585. DOI:10.1016/j.lwt.2014.02.026.
[24] DUCONSEILLE A, ANDUEZA D, PICARD F, et al. Variability in pig skin gelatin properties related to production site: a near infrared and fluorescence spectroscopy study[J]. Food Hydrocolloids, 2017, 63: 108-119. DOI:10.1016/j.foodhyd.2016.08.001.
[25] AVENA-BUSTILLOS R J, OLSEN C W, OLSON D A, et al. Water vapor permeability of mammalian and fish gelatin films[J]. Journal of Food Science, 2006, 71(4): E202-E207. DOI:10.1111/j.1750-3841.2006.00016.x.
[26] LIU bo, HUANG Wei, YANG Guixia, et al. Preparation of gelatin/poly (gamma-glutamic acid) hydrogels with stimulated response by hot-pressing preassembly and radiation crosslinking[J]. Materials Science and Engineering: C, 2020, 116: 111259. DOI:10.1016/j.msec.2020.111259.
[27] TU Zongcai, HUANG Tao, WANG Hui, et al. Physico-chemical properties of gelatin from bighead carp () scales by ultrasound-assisted extraction[J]. Journal of Food Science and Technology, 2015, 52(4): 2166-2174. DOI:10.1007/s13197-013-1239-9.
[28] 張宇昊, 马良, 师萱. 鱼皮明胶的超高压辅助提取工艺[J]. 食品科学, 2011, 32(6): 99-103.
[29] BENBETTAÏEB N, CHAMBIN O, KARBOWIAK T, et al. Release behavior of quercetin from chitosan-fish gelatin edible films influenced by electron beam irradiation[J]. Food Control, 2016, 66: 315-319. DOI:10.1016/j.foodcont.2016.02.027.
[30] WU C K, TSAI J S, SUNG W C. Impact of ultraviolet treatment on improving gel strength of tilapia skin gelatin[J]. International Journal of Food Properties, 2015, 18(8): 1702-1706. DOI:10.1080/10942912.2014.933439.
[31] SUNG W C, CHEN Z Y. UV treatment and γ irradiation processing on improving porcine and fish gelatin and qualities of their premix mousse[J]. Radiation Physics and Chemistry, 2014, 97: 208-211. DOI:10.1016/j.radphyschem.2013.11.038.
[32] KAEWRUANG P, BENJAKUL S, PRODPRAN T. Characteristics and gelling property of phosphorylated gelatin from the skin of unicorn leatherjacket[J]. Food Chemistry, 2014, 146: 591-596. DOI:10.1016/j.foodchem.2013.09.111.
[33] BISCARAT J, GALEA B, SANCHEZ J, et al. Effect of chemical cross-linking on gelatin membrane solubility with a non-toxic and non-volatile agent: terephthalaldehyde[J]. International Journal of Biological Macromolecules, 2015, 74: 5-11. DOI:10.1016/j.ijbiomac.2014.11.022.
[34] KAEWDANG O, BENJAKUL S. Effect of ethanolic extract of coconut husk on gel properties of gelatin from swim bladder of yellowfin tuna[J]. LWT-Food Science and Technology, 2015, 62(2): 955-961. DOI:10.1016/j.lwt.2015.02.006.
[35] ZHANG Ting, DING Mingzhen, TAO Lina, et al. Octenyl succinic anhydride modification of bovine bone and fish skin gelatins and their application for fish oil-loaded emulsions[J]. Food Hydrocolloids, 2020, 108: 106041. DOI:10.1016/j.foodhyd.2020.106041.
[36] 周偉, 胡熠, 张进杰, 等. 杨梅素和糖基化协同改性鱼鳞明胶可食膜[J]. 食品与发酵工业, 2018, 44(6): 58-66. DOI:10.13995/j.cnki.11-1802/ts.015875.
[37] KARAKI N, ALJAWISH A, HUMEAU C, et al. Enzymatic modification of polysaccharides: mechanisms, properties, and potential applications: a review[J]. Enzyme and Microbial Technology, 2016, 90: 1-18. DOI:10.1016/j.enzmictec.2016.04.004.
[38] GASPAR A L, DE GOES-FAVONI S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins: a review[J]. Food Chemistry, 2015, 171: 315-322. DOI:10.1016/j.foodchem.2014.09.019.
[39] WANGTUEAI S, NOOMHORM A, REGENSTEIN J M. Effect of microbial transglutaminase on gel properties and film characteristics of gelatin from lizardfish ( spp.) scales[J]. Journal of Food Science, 2010, 75(9): C731-9. DOI:10.1111/j.1750-3841.2010.01835.x.
[40] HUANG Tao, TU Zongcai, WANG Hui, et al. Comparison of rheological behaviors and nanostructure of bighead carp scales gelatin modified by different modification methods[J]. Journal of Food Science and Technology, 2017, 54(5): 1256-1265. DOI:10.1007/s13197-017-2511-1.
[41] KOMAIKO J, MCCLEMENTS D J. Food-grade nanoemulsion filled hydrogels formed by spontaneous emulsification and gelation: optical properties, rheology, and stability[J]. Food Hydrocolloids, 2015, 46: 67-75. DOI:10.1016/j.foodhyd.2014.12.031.
[42] TAO Gang, WANG Yejing, CAI Rui, et al. Design and performance of sericin/poly(vinyl alcohol) hydrogel as a drug delivery carrier for potential wound dressing application[J]. Materials Science and Engineering: C, 2019, 101: 341-351. DOI:10.1016/j.msec.2019.03.111.
[43] RATANAVARAPORN J, RANGKUPAN R, JEERATAWATCHAI H, et al. Influences of physical and chemical crosslinking techniques on electrospun type A and B gelatin fiber mats[J]. International Journal of Biological Macromolecules, 2010, 47(4): 431-438. DOI:10.1016/j.ijbiomac.2010.06.008.
[44] HAUGH M G, JAASMA M J, O’BRIEN F J. The effect of dehydrothermal treatment on the mechanical and structural properties of collagen-GAG scaffolds[J]. Journal of Biomedical Materials Research: Part A, 2009, 89(2): 363-369. DOI:10.1002/jbm.a.31955.
[45] 高喜平, 刘翠云, 汤克勇, 等. 乙二醛交联对明胶/PVA可生物降解复合膜性能的影响[J]. 材料研究学报, 2013, 27(2): 173-177.
[46] CHEN M, LIU F, CHIOU B S, et al. Characterization of film-forming solutions and films incorporating free and nanoencapsulated tea polyphenol prepared by gelatins with different Bloom values[J]. Food Hydrocolloids, 2017, 72: 381-388. DOI:10.1016/j.foodhyd.2017.05.001.
[47] 郭華, 史泽毅, 张海霞, 等. 明胶-柠檬酸-硬脂酸复合凝胶的制备及性能[J]. 现代食品科技, 2021, 37(10): 171-179; 307. DOI:10.13982/j.mfst.1673-9078.2021.10.0183.
[48] HOQUE M S, BENJAKUL S, PRODPRAN T. Properties of film from cuttlefish () skin gelatin incorporated with cinnamon, clove and star anise extracts[J]. Food Hydrocolloids, 2011, 25(5): 1085-1097. DOI:10.1016/j.foodhyd.2010.10.005.
[49] LIU Yexue, WENG Ruru, WANG Wenhang, et al. Tunable physical and mechanical properties of gelatin hydrogel after transglutaminase crosslinking on two gelatin types[J]. International Journal of Biological Macromolecules, 2020, 162: 405-413. DOI:10.1016/j.ijbiomac.2020.06.185.
[50] AZARIKIA F, WU B C, ABBASI S, et al. Stabilization of biopolymer microgels formed by electrostatic complexation: Influence of enzyme (laccase) cross-linking on pH, thermal, and mechanical stability[J]. Food Research International, 2015, 78: 18-26. DOI:10.1016/j.foodres.2015.11.013.
[51] HAN Yanping, ZHAO Xinhuai. Properties of bovine gelatin cross-linked by a mixture of two oxidases (horseradish peroxidase and glucose oxidase) and glucose[J]. CyTA-Journal of Food, 2016, 14(3): 457-464. DOI:10.1080/19476337.2015.1134671.
[52]郭开红, 张蕾蕾, 吴晓翠, 等. 鲢鱼皮明胶-海藻酸钠复合膜的制备与性能[J]. 食品科学, 2018, 39(7): 243-248. DOI:10.7506/spkx1002-6630-201807036.
[53] PANG Z, DEETH H, SOPADE P, et al. Rheology, texture and microstructure of gelatin gels with and without milk proteins[J]. Food Hydrocolloids, 2014, 35: 484-493. DOI:10.1016/j.foodhyd.2013.07.007.
[54] ORYAN A, KAMALI A, MOSHIRI A, et al. Chemical crosslinking of biopolymeric scaffolds: current knowledge and future directions of crosslinked engineered bone scaffolds[J]. International Journal of Biological Macromolecules, 2018, 107(Pt A): 678-688. DOI:10.1016/j.ijbiomac.2017.08.184.
[55] EHRMANN A. Non-toxic crosslinking of electrospun gelatin nanofibers for tissue engineering and biomedicine: a review[J]. Polymers, 2021, 13(12): 1973. DOI:10.3390/polym13121973.
[56] MAURICIO M R, DA COSTA P G, HARAGUCHI S K, et al. Synthesis of a microhydrogel composite from cellulose nanowhiskers and starch for drug delivery[J]. Carbohydrate Polymers, 2015, 115: 715-722. DOI:10.1016/j.carbpol.2014.07.063.
[57] ABAEE A, MOHAMMADIAN M, JAFARI S M. Whey and soy protein-based hydrogels and nano-hydrogels as bioactive delivery systems[J]. Trends in Food Science and Technology, 2017, 70: 69-81. DOI:10.1016/j.tifs.2017.10.011.
[58] GE Haiyan, WU Yan, WOSHNAK L L, et al. Effects of hydrocolloids, acids and nutrients on gelatin network in gummies[J]. Food Hydrocolloids, 2021, 113: 106549. DOI:10.1016/j.foodhyd.2020.106549.
[59] KEILLOR J W, CLOUTHIER C M, APPERLEY K Y P, et al. Acyl transfer mechanisms of tissue transglutaminase[J]. Bioorganic Chemistry, 2014, 57: 186-197. DOI:10.1016/j.bioorg.2014.06.003.
[60] HE Qingyan, HUANG Yan, WANG Shaoyun. Hofmeister effect-assisted one step fabrication of ductile and strong gelatin hydrogels[J]. Advanced Functional Materials, 2018, 28(5): 1705069. DOI:10.1002/adfm.201705069.
[61] CHEN Hongrui, WU Di, MA Wuchao, et al. Strong fish gelatin hydrogels enhanced by carrageenan and potassium sulfate[J]. Food Hydrocolloids, 2021, 119: 106841. DOI:10.1016/j.foodhyd.2021.106841.
[62] 彭湘紅, 王敏娟, 陆茜, 等. 氧氟沙星-壳聚糖-明胶共混膜的制备及表征[J]. 精细化工, 2000(6): 325-327. DOI:10.13550/j.jxhg.2000.06.005.
[63] SHI Xiaodan, HUANG Jingjing, WU Jiulin, et al. Fabrication, interaction mechanism, functional properties, and applications of fish gelatin-polysaccharide composites: a review[J]. Food Hydrocolloids, 2022, 122: 107106. DOI:10.1016/j.foodhyd.2021.107106.
[64] LEIVA G E, NARANJO G B, MALEC L S. A study of different indicators of Maillard reaction with whey proteins and different carbohydrates under adverse storage conditions[J]. Food Chemistry, 2017, 215: 410-416. DOI:10.1016/j.foodchem.2016.08.003.
[65] HUANG Tao, TU Zongcai, SHANGGUAN X, et al. Characteristics of fish gelatin-anionic polysaccharide complexes and their applications in yoghurt: rheology and tribology[J]. Food Chemistry, 2021, 343: 128413. DOI:10.1016/j.foodchem.2020.128413.
[66] BADII F, HOWELL N. Fish gelatin: structure, gelling properties and interaction with egg albumen proteins[J]. Food Hydrocolloids, 2006, 20(5): 630-640. DOI:10.1016/j.foodhyd.2005.06.006.
[67] LIN Lin, REGENSTEIN J M, LÜ Shun, et al. An overview of gelatin derived from aquatic animals: properties and modification[J]. Trends in Food Science and Technology, 2017, 68: 102-112. DOI:10.1016/j.tifs.2017.08.012.
[68] YUK H, ZHANG T, LIN S, et al. Tough bonding of hydrogels to diverse non-porous surfaces[J]. Nature Materials, 2016, 15(2): 190-196. DOI:10.1038/nmat4463.
[69] YUK H, ZHANG T, PARADA G A, et al. Skin-inspired hydrogel-elastomer hybrids with robust interfaces and functional microstructures[J]. Nature Communications, 2016, 7: 12028. DOI:10.1038/ncomms12028.
[70] LIU Qihan, NIAN Guodong, YANG Canhui, et al. Bonding dissimilar polymer networks in various manufacturing processes[J]. Nature Communications, 2018, 9(1): 846. DOI:10.1038/s41467-018-03269-x.
[71] KATAS H, AKHMAR M A M, ABDALLA S. Biosynthesized silver nanoparticles loaded in gelatine hydrogel for a natural antibacterial and anti-biofilm wound dressing[J]. Journal of Bioactive and Compatible Polymers, 2021, 36(2): 111-123. DOI:10.1177/0883911520988303.
[72] ZHANG Min, YANG Mao, WOO M W, et al. High-mechanical strength carboxymethyl chitosan-based hydrogel film for antibacterial wound dressing[J]. Carbohydrate Polymers, 2021, 256: 117590. DOI:10.1016/j.carbpol.2020.117590.
[73] BARROS A A, OLIVEIRA C, LIMA E, et al. Gelatin-based biodegradable ureteral stents with enhanced mechanical properties[J]. Applied Materials Today, 2016, 5: 9-18. DOI:10.1016/j.apmt.2016.07.006.
[74] 況光仪, 陈剑飞, 易惠明. 缓降解骨基质明胶在喉成形术中的临床研究[J]. 临床耳鼻咽喉科杂志, 2005(18): 836-837; 841. DOI:10.3969/j.issn.1001-1781.2005.18.009.
[75] ZHANG Jing, QIAN Sunxiang, CHEN Lingdong, et al. Highly antifouling double network hydrogel based on poly(sulfobetaine methacrylate) and sodium alginate with great toughness[J]. Journal of Materials Science and Technology, 2021, 85: 235-244. DOI:10.1016/j.jmst.2021.01.012.
[76] SUN T L, KUROKAWA T, KURODA S, et al. Physical hydrogels composed of polyampholytes demonstrate high toughness and viscoelasticity[J]. Nature Materials, 2013, 12(10): 932-937. DOI:10.1038/nmat3713.
[77] ALAVI F, EMAM-DJOMEH Z, YARMAND M S, et al. Cold gelation of curcumin loaded whey protein aggregates mixed with -carrageenan: impact of gel microstructure on the gastrointestinal fate of curcumin[J]. Food Hydrocolloids, 2018, 85: 267-280. DOI:10.1016/j.foodhyd.2018.07.012.
[78] DING Mengzhen, ZHANG Ting, ZHANG Huan, et al. Effect of preparation factors and storage temperature on fish oil-loaded crosslinked gelatin nanoparticle Pickering emulsions in liquid forms[J]. Food Hydrocolloids, 2019, 95: 326-335. DOI:10.1016/j.foodhyd.2019.04.052.
[79] WANG X Y, HEUZEY M C. Pickering emulsion gels based on insoluble chitosan/gelatin electrostatic complexes[J]. RSC Advances, 2016, 6(92): 89776-89784. DOI:10.1039/c6ra10378b.
[80] GE Liming, ZHU Mingjin, LI Xinying, et al. Development of active rosmarinic acid-gelatin biodegradable films with antioxidant and long-term antibacterial activities[J]. Food Hydrocolloids, 2018, 83: 308-316. DOI:10.1016/j.foodhyd.2018.04.052.
[81] HOU Jiliang, REN Xiuyan, GUAN Shuang, et al. Rapidly recoverable, anti-fatigue, super-tough double-network hydrogels reinforced by macromolecular microspheres[J]. Soft Matter, 2017, 13(7): 1357-1363. DOI:10.1039/c6sm02739c.
[82] REN Kai, CHENG Yu, HUANG Chao, et al. Self-healing conductive hydrogels based on alginate, gelatin and polypyrrole serve as a repairable circuit and a mechanical sensor[J]. Journal of Materials Chemistry B, 2019, 7(37): 5704-5712. DOI:10.1039/c9tb01214a.

