氯胺酮与七氟醚诱导老龄小鼠POCD的病理机制比较*
黄钰媛 韦雪梅 郑育秀 刘丽丽
(海南医学院第二附属医院麻醉科,海南 海口 570311)
外科手术中全身麻醉起效快,可迅速引起患者意识、感觉和反射可逆性消失,骨骼肌松弛[1]。然而,老年患者因常伴有心、脑、肺等多个脏器的生理性功能衰退,全身麻醉会带来一系列不良反应[2]。氯胺酮与七氟醚分别用于全身麻醉中吸入型和静脉注射型麻醉,常在髋关节置换术[3]、肿瘤切除等手术中应用[4]。全身麻醉会增加老年患者术后认知功能障碍(Postoperative cognitive dysfunction,POCD)的风险[5],这严重限制了其在老年人手术中的应用。但是多数手术无法避免全麻,因此需要一项针对氯胺酮与七氟醚诱导认知功能障碍的比较研究,为临床中麻醉方式、药物的选择甚至进一步的联合应用提供一些理论基础。Aβ属于细胞毒性多肽,可促进胶质细胞活化,加剧氧化应激反应,促进Tau蛋白过度磷酸化形成神经纤维缠结,进而引起神经元死亡与树突棘的萎缩[6]。而老龄患者海马神经元树突棘萎缩会阻滞神经信号传递,最终导致记忆的存储与记忆的障碍[7]。基于Aβ沉积与树突棘萎缩都是小鼠认知功能损伤的原因,本研究拟构建氯胺酮静脉注射型与七氟醚吸入型全麻模型,比较两种麻醉方式对脑组织中Aβ斑块沉积和神经元树突棘状态的影响,分析小鼠POCD的严重程度,为临床上全麻的选择提供一些指导。
1 材料与方法
1.1 实验动物 36只C57BL/6小鼠,12月龄,体质量35~40 g,由海南医学院动物实验中心提供。小鼠饲养环境为12 h昼夜循环,(22±2)℃恒温空间,充足食物、水源。所有涉及动物的实验方案均按照《实验动物的护理和使用指南》进行,且本实验研究方案已获得海南医学院第二附属医院伦理委员会的批准。
1.2 实验方案 将小鼠随机分为对照组,七氟醚组与氯胺酮组,每组12只,开始水迷宫测试。小鼠禁食12 h后,静脉注射氯胺酮(浙江九旭药业有限公司)或者吸入七氟醚(上海恒瑞医药有限公司)麻醉,麻醉时间维持在6 h以上。参考预实验与文献中报道[8-9],七氟醚麻醉方案:3%七氟醚持续通入麻醉盒中,维持180 min。氯胺酮麻醉方案:0 min时注射80 mg/kg,30 min时注射40mg/kg,90 min时注射40 mg/kg,180 min时注射40 mg/kg,总剂量200 mg/kg。麻醉完成后2周,开始水迷宫测试,随后CO2处死,取脑组织用于长时程电位测试,高尔基染色,免疫组化染色,Western blot。
1.3 Morris水迷宫测试 水迷宫装置(江苏赛昂斯生物技术公司,型号:SA201)是直径1.2 m,深50 cm的圆形水池,分为4个象限。第Ⅰ象限中央设置一个低于水面1 cm的圆形平台,直径12 cm。四周贴有不同图形帮助小鼠定位。麻醉后14 d开始,每天将小鼠自各个象限依次投入水中,记录90 s内寻找到平台的时间,取平均时间记为当日逃避潜伏期。训练4天后,撤去平台,将小鼠自第Ⅲ象限投入水中,记录90 s内小鼠运行轨迹,计算机分析小鼠平均游泳速率、首次到达平台时间、穿越平台次数、第Ⅰ象限停留时间。
1.4 长时程电位测试 小鼠以CO2处死后,用氧饱和高糖切片液心脏灌流,取完整脑组织,修块后固定于切片机上切片。转移脑组织切片至32℃的氧饱和人工脑脊液(ACSF,北京酷来搏科技有限公司)中。取出海马切片,自内侧穿通路(The medial perforant path,MPP)插入刺激电极,在海马 DG区插入记录电极,充灌 ACSF作为记录电极内液。电极连接MultiClamp 700B放大器,记录兴奋性突触后电位(Excitatory postsynaptic potential,EPSP);不断调整调整刺激强度和记录电极的位置和深度,用 0.033 Hz的刺激频率诱发场电位(Filed EPSP,fEPSP)直到记录典型的场电位波形,然后固定刺激强度与记录电极。在基线稳定记录20 min后,以高频刺激诱发长时程增强(Long term potentiation,LTP),连续20串高频脉冲,每串包含200个脉冲,频率为200 Hz,波宽200 μs,串间隔30 s,高频刺激连续记录60 min。
1.5 高尔基染色及计数 小鼠以CO2处死后,取完整脑组织浸泡于溶液1、溶液2混合液中(溶液1、2及下面提到的溶液3、4、5均来自于美国Hitobiotec公司生产的Hito Golgi-Cox Optimstain Kit高尔基染色试剂盒),4℃避光孵育14天。取出脑组织浸入5倍体积的溶液3中,4℃避光孵育12 h后更换等量溶液3,4℃下继续孵育48 h。将脑组织放入预冷的异戊烷中冷冻,冰冻切片机将组织切成10 μm切片,转移至滴有溶液3的载玻片中贴片,放入溶液4、5混合溶液中反应30 min。将玻片以梯度酒精脱水,经二甲苯透化后封片。使用显微镜(日本奥林巴斯科技公司,型号:BX53)捕获图像。
1.6 免疫组化染色 小鼠以CO2处死后,生理盐水心脏灌流,取脑组织放入4%多聚甲醛溶液中固定,再经梯度酒精脱水,以二甲苯透化,石蜡包埋后切片,厚度约10 μm。取切片,高温烘烤15 min修复抗原,将切片置于4%胎牛血清封闭液中封闭2 h,加入Anti-Aβ抗体稀释液[1:100,艾博抗(上海)贸易有限公司],4℃孵育过夜。次日,取出切片,PBST清洗并加入HRP标记的山羊抗兔IgG(H+L)抗体稀释液[1:2000,艾博抗(上海)贸易有限公司],4℃条件下避光孵育2 h。PBST洗涤切片,DAB显色30 s,再次使用苏木精复染20 s,蒸馏水分化,在不同梯度酒精中脱水,二甲苯透化后封片,显微镜下观察拍片。
1.7 Western blot 小鼠以CO2处死后,取海马组织,加入RIPA裂解液(上海碧云天生物技术有限公司),研磨成细胞悬液,12000 rpm离心20 min,加入上样缓冲液。取出凝胶上样梳,每孔加入约10 μg样品。设置电泳条件:60 V/30 min,120 V/60 min,以上样缓冲液到达凝胶底部为电泳终点。截取目标蛋白条带,湿法转膜法将凝胶上蛋白转移至PVDF膜上,设置转膜条件:2 mA/60 min,整个过程冰水浴。取出PVDF膜,4%胎牛血清封闭,以目的蛋白一抗稀释液孵育PVDF膜,4℃过夜,包括Anti-NMDAR1,Anti-NMDAR2A,Anti-NMDAR2B,Anti-Caspase-3,Anti-bcl-2,Anti-bax(1:1000,武汉三鹰生物技术有限公司)。次日,取出PVDF膜,HRP标记IgG(H+L)二抗稀释液(1:5000,武汉三鹰生物技术有限公司)孵育2 h。将发光液滴加的PVDF膜上,显影仪(上海天能科技有限公司,型号:1600/1600R)下显影获得蛋白条带。

2 结果
2.1 氯胺酮与七氟醚对老龄小鼠Morris水迷宫指标的影响 Morris水迷宫结果显示,训练期间,随着时间的推移,各组小鼠逃避潜伏期都出现了一定程度降低。麻醉前,各组小鼠之间逃避潜伏期没有差异;麻醉后,自第3天起,与对照组相比,氯胺酮组与七氟醚组小鼠逃避潜伏期明显增加(P<0.05),且氯胺酮组小鼠逃避潜伏期低于七氟醚组。测试中,麻醉前各组小鼠各项指标均没有差异;麻醉后,各组小鼠虽然游泳速率没有差异,但与对照组相比,氯胺酮组与七氟醚组小鼠首次到达平台时间明显增加(P<0.05),第Ⅰ象限停留时间与穿越平台次数明显减少(P<0.05)。与此同时,测试中氯胺酮组小鼠各项指标,虽然没有明显性差异,但全部都优于七氟醚组。见图1~3。

图1 各组小鼠训练期间逃避潜伏期的变化(n=12)Figure 1 Changes in escape latency of mice in each group during training

图2 各组小鼠测试期间Morris水迷宫轨迹图(n=12)Figure 2 Morris water maze trajectory of mice in each group during test
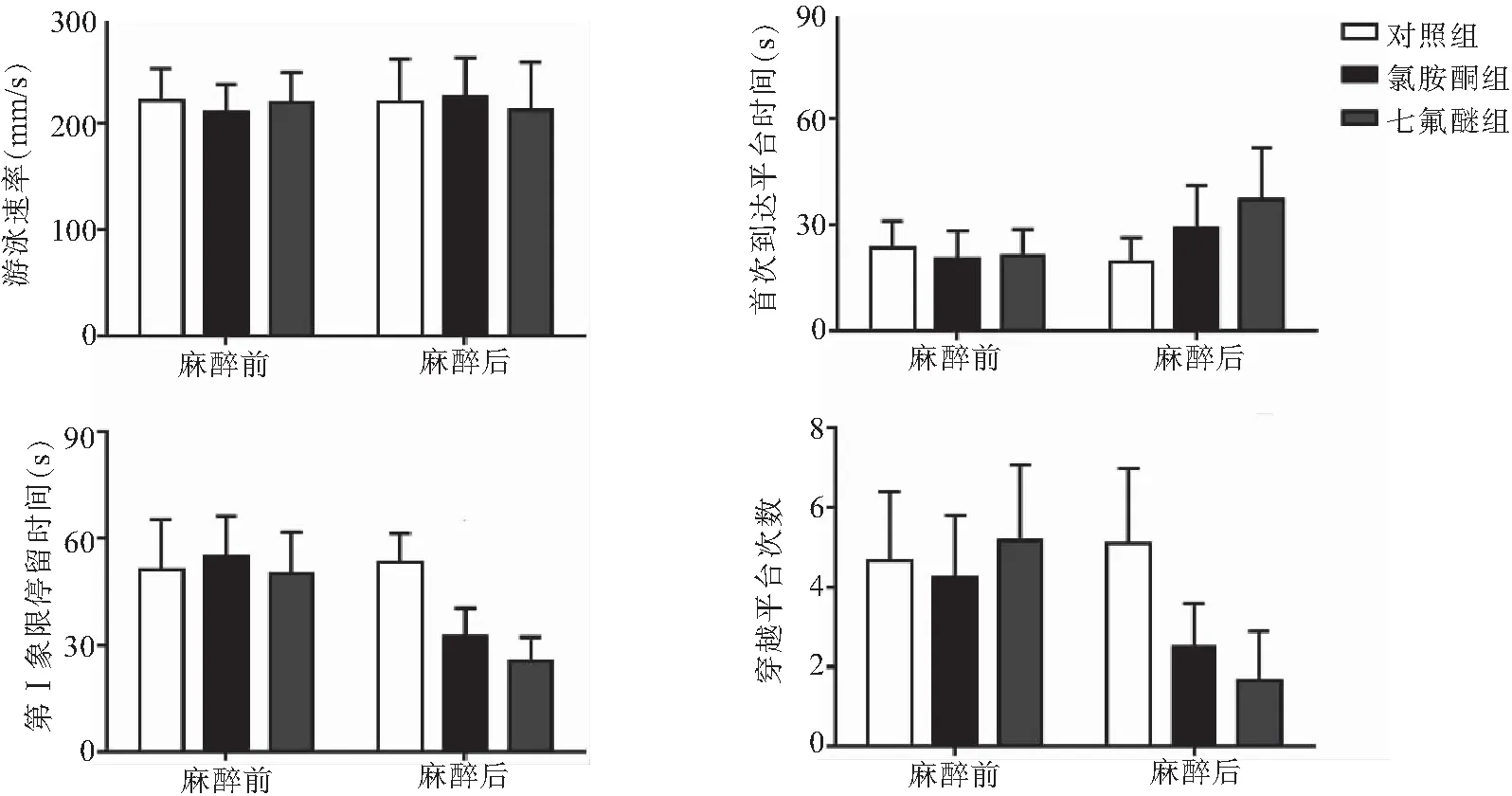
图3 各组小鼠测试期间Morris水迷宫指标的变化(n=12)Figure 3 Changes in Morris water maze indexes of mice in each group during test
2.2 氯胺酮与七氟醚对老龄小鼠神经元突触状态的影响 高尔基染色显示,对照组小鼠神经元突触丰富且树突棘密集。与对照组相比,氯胺酮与七氟醚都造成了小鼠神经元中树突棘密度和树突棘长度降低(P<0.05);与氯胺酮组相比,七氟醚造成树突棘密度降低,且树突棘长度明显减少(P<0.05)。见图4。
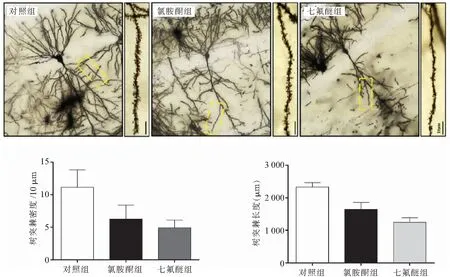
图4 各组小鼠神经元树突棘状态(高尔基染色,1000×,n=3)Figure 4 Dendritic spines of mice in each group
2.3 氯胺酮与七氟醚对老龄小鼠长时程电位的影响 长时程电位测试显示,与对照组相比,氯胺酮与七氟醚都造成了小鼠MPP-DG回路的fEPSP斜率降低(P<0.05);与氯胺酮组相比,七氟醚组小鼠MPP-DG回路中fEPSP斜率更低(P<0.05)。见图5。

图5 各组小鼠长时程电位的变化(n=3)Figure 5 Changes in long-term potential of mice in each group
2.4 氯胺酮与七氟醚对老龄小鼠Aβ沉淀的影响 免疫组化染色显示,对照组小鼠脑组织中几乎没有Aβ沉淀。氯胺酮与七氟醚诱导小鼠,无论是皮层还是海马区,都造成了Aβ沉积明显增加(P<0.05);与氯胺酮组相比,七氟醚造成皮层和海马区Aβ沉积增加,且海马区Aβ沉积具有明显差异(P<0.05)。见图6。

图6 各组小鼠脑组织中Aβ沉积(免疫组化染色,10×,40×,n=3)Figure 6 Aβ deposition in brain of mice in each group
2.5 氯胺酮与七氟醚对老龄小鼠NMDA受体的影响 Western blot结果显示,与对照组相比,氯胺酮与七氟醚造成了NMDAR表达降低(P<0.05);与七氟醚组相比,氯胺酮对NMDAR表达的降低作用更明显(P<0.05)。见图7。

图7 各组小鼠海马中NMDAR表达(n=3)Figure 7 NMDAR expression in hippocampus of mice in each group
2.6 氯胺酮与七氟醚对老龄小鼠Caspase-3凋亡信号的影响 Western blot结果显示,与对照组相比,氯胺酮与七氟醚造成了Caspase-3表达升高,bcl-2表达降低,bax表达升高(均P<0.05);与七氟醚组相比,氯胺酮组bcl-2表达更高(P<0.05)。见图8。

图8 各组小鼠海马中Caspase-3凋亡信号蛋白的表达(n=3)Figure 8 The expression of Caspase-3 apoptotic signal protein in hippocampus of mice in each group
3 讨论
氯胺酮与七氟醚是临床常用全麻药物。七氟醚是一种无色透明,无刺激性易挥发的液体,患者戴上面罩吸入浓度为3%~6%七氟醚2 min,即会出现意识消失的情况[10]。氯胺酮一种无色透明液体,具有强效的阵痛作用,且安全性较高,麻醉过程易管理[11]。已有较多研究比较了两者在髋关节置换术,疝囊高位结扎术等手术中的麻醉效果[12-13]。与氯胺酮相比,七氟醚具有多方面优势,如术前诱导期较为平静、术中血液动力学较为稳定,肌松药使用较少,术后苏醒较快[14-15]。然而,两种麻醉药物在POCD的研究中却鲜有比较。
POCD是以学习记忆能力损伤为特征的并发症。Morris水迷宫中,小鼠以空间四周标记作为参照物,经反复训练,在其脑中形成空间参考记忆,能够借助参照物来辨别方位,登上逃生平台[16]。本研究中,麻醉前各组小鼠学习认知功能相似,但经历了七氟醚或氯胺酮麻醉后的小鼠各项指标都明显劣于对照组小鼠,提示本研究小鼠认知功能障碍模型构建成功。与七氟醚组相比,虽然没有明显性差异,但氯胺酮麻醉小鼠Morris水迷宫各项指标中都优于七氟醚组。
突触是神经元之间功能联系的接触点,是信息传递的关键结构。突触通过树突棘的增加和萎缩使信息传递效率发生变化,因此,树突棘数量、密度、长度的变化可反应突触可塑性变化[17]。突触可塑性指突触基于树突棘结构产生的不断变化的传递效能,与个体的学习和记忆能力相关[18]。以往探索中,POCD患者脑组织中都有发现树突棘萎缩[19],而新生幼鼠中,树突棘密度往往随着脑组织结构的发育而增加[20]。宏观上,海马区LTP效应也反映了突触可塑性,与认知行为有明显相关性[21]。Sakusic等[22]分析显示提高学习和记忆的因素往往能诱发LTP;反之,抑制LTP的因素也能影响学习和记忆过程。本研究中,氯胺酮与七氟醚组中可见明显的树突棘密度与长度降低,且LTP水平明显降低,反映了氯胺酮与七氟醚组小鼠的学习与记忆能力的损伤,七氟醚对树突棘密度和LTP水平的影响都要明显高于氯胺酮组,也反映了七氟醚造成的学习与记忆能力损伤要高于氯胺酮。
Aβ是β和γ分泌酶对淀粉样前体蛋白连续水解和切割的产物,是阿尔兹海默病认知功能障碍进展的病理基础[23]。氯胺酮与七氟醚组小鼠脑组织中可见明显的Aβ斑块沉积。在海马组织中,与氯胺酮组相比,七氟醚造成海马区Aβ沉积明显增加。有研究证实,老龄患者早期轻度认知功能损伤是由于寡聚态Aβ的聚集引起的突触功能障碍所致,并且这种寡聚体Aβ的沉积现象的出现是早于广泛的突触丧失和神经变性之前[24]。由于海马区是影响动物学习与记忆能力的生理区域,因此海马区Aβ增加是造成神经元树突棘萎缩,LTP强度降低的主要原因,也是导致七氟醚组小鼠学习与记忆功能劣于氯胺酮组的生理因素之一。
回顾氯胺酮与七氟醚组对小鼠造成的学习与记忆能力损伤,其涉及的信号终点主要是Caspase-3凋亡途径激活以造成的海马神经元凋亡[25]。Bax与Bcl-2分别是促凋亡蛋白与抗凋亡蛋白,协同调控线粒体外膜的透化。在七氟醚或氯胺酮诱导过程中,Bax表达增加而Bcl-2表达减少会导致线粒体外膜破坏,释放细胞色素C,促进Apaf-1的寡聚化,致使下游Caspase-3的凋亡途径的激活[26]。然而,氯胺酮与七氟醚介导的学习与记忆损伤的差异性,可能是由NMDA-NO信号通路介导的。NMDA受体广泛表达于海马神经突触后膜,氯胺酮是NMDA特异性拮抗剂[27]。NMDA受体组成亚基中NMDAR2B是一种被认可的“聪明基团”,针对此基团已有设计并上市了用于抑郁治疗的药物[28-29]。无论是抑郁症研究,还是POCD的研究中,都有显示较低剂量的氯胺酮被发现是通过减少NMDA受体蛋白的表达,抑制下游炎性细胞因子,从而发挥神经保护作用。本研究中使用的氯胺酮介导的Caspase-3凋亡途径激活的效应高于NMDA信号通路的抗炎作用,最终导致了老龄小鼠突触损伤、Aβ沉积增加。此外,我们也发现,与七氟醚组相比,氯胺酮组NMDA表达减少,且Bcl-2表达增加,因此对于细胞凋亡认知功能的影响较小。
4 结论
七氟醚与氯胺酮都会造成老龄小鼠出现学习与记忆能力损伤。其生理机制涉及Caspase-3信号通路的激活造成神经元树突棘损伤与Aβ沉积,然而氯胺酮基于NMDA信号的抑制,可能在一定程度上减轻了小鼠认知功能的损伤。因此,在临床上应用中,氯胺酮诱导患者出现认知功能损伤的几率较低,在可能造成患者认知功能损伤的手术中应将氯胺酮使用的优先级提高。

