初诊2 型糖尿病患者心脏舒张功能障碍预测模型的建立与验证
张霄旦,邓小怡,肖绮文,李晏丽,黄咏榆,林日金,叶芊芃,罗子睿,易敏*
(1.广州医科大学附属第二医院内分泌科,广东 广州 510260;2.广州医科大学附属第二医院检验科,广东 广州 510260;3.广州医科大学第二临床医学院,广东 广州 511436)
心功能不全是糖尿病患者常见的并发症。在排除了高血压等因素的影响后,糖尿病患者的心血管疾病发病率和死亡率仍显著高于非糖尿病患者。糖尿病是心力衰竭进展的独立预测因素[1]。左心室舒张功能障碍(left ventricular diastolic dysfunction,LVDD)是在收缩功能改变之前的糖尿病性心肌病的第一阶段,被认为是心力衰竭的早期临床前表现[2-3]。糖尿病患者舒张功能障碍的发生率高达30%~75%[4-7]。因此,早期发现糖尿病心肌病对于预防远期的严重心力衰竭,有着重要意义。
此前的研究表明,在年轻的糖尿病患者或新诊断的糖尿病患者中,即有一部分人出现无症状的心脏舒张功能障碍,由此提出了糖尿病早发性心肌病的概念[8-10]。LVDD 在首次确诊为2 型糖尿病(type 2 diabetes mellitus,T2DM)的患者中很常见,即使在血压正常的患者中也是如此[11]。LVDD 的早期诊断通常是基于多普勒超声心动图,这依赖于操作员与专业技术人员的解释,且需要一定的技术条件。本研究旨在调查新诊断的T2DM 患者LVDD 的患病率,并探究与无症状LVDD 相关的简单临床影响因素。以此构建LVDD 的预测模型,并对模型的准确性进行验证。以便于对LVDD 进行早期的识别和干预。
1 资料与方法
1.1 研究对象
筛选2014 年1 月至2021 年10 月在广州医科大学附属第二医院内分泌科住院的T2DM 患者。纳入标准为:根据中国糖尿病协会推荐的诊断标准,首次确诊为T2DM 且接受了静息标准超声心动图检查的成人患者。排除标准包括:(1)射血分数(ejection fraction,EF)<50%;(2)既往或当前有冠心病(包括急性心肌梗死);(3)有其他确诊的心脏病病史,包括扩张型心肌病、先天性心脏病或心脏手术等;(4)有恶性肿瘤病史;(5)有糖尿病急性并发症,包括糖尿病酮症酸中毒和高渗高血糖昏迷;(6)严重肾功能不全(eGFR<30 mL/min/1.73m2)或肝功能不全(转氨酶>三倍参考值上限)。最终,共纳入692 名新诊断的T2DM 患者(年龄为18 至85 岁)。该研究经广州大学第二附属医院伦理委员会审核批准(批准号2021-hg-ks-02)。
1.2 数据收集
回顾性收集患者相关临床资料,包括性别、年龄、身高、体重、家族史、吸烟史、既往史、合并疾病、入院时血压等各项指标。采用常规实验室方法测量常规生化参数。估计的肾小球滤过率(eGFR)根据改良MDRD 公式计算:eGFR(mL/min/1.73 m2)=186×(SCr(mg/dL)/88.4)-1.154×(年龄)-0.203× 0.742(女性)[12]。白蛋白尿被定义为尿白蛋白肌酐比(UACR)>30 mg/g 或白蛋白排泄率(AER)>30 mg/24 h。HOMA-IR 和HOMA-β 采用以下公式进行计算:HOMA-IR=1.5+空腹血糖(mmol/L)×空腹C 肽(pmol/L)/ 2800,HOMA-β=0.27×空 腹C 肽(pmol/L)/(空腹血糖(mmol/L)-3.5)[13]。
对所有患者均进行二维和多普勒超声心动图检查(日本APLIO ARTIDA、TOSHIBA)。通过早期(E)和晚期(A)二尖瓣速度峰值来评估心室整体舒张功能。以早期二尖瓣流速峰值与晚期二尖瓣流速峰值的比值(E/A)<1.0 为LVDD 的诊断标准。在舒张功能障碍晚期,如果存在“假正常”的E/A 比,则通过组织多普勒E’/A’<1.0 来确认LVDD[14-16]。
对所有患者均进行颈动脉彩超检查,以测量颈动脉内中膜厚度(cIMT)、评估颈动脉斑块情况。以cIMT<1.0 为正常标准,≥1.0 mm 判断为cIMT 增厚。颈动脉粥样硬化定义为cIMT ≥1.0 mm 和/或存在颈动脉斑块[17]。对所有患者均进行肝超声检查。根据超声特征诊断脂肪肝。
1.3 统计学方法
采用SPSS 19.0 和R 软件进行统计学分析。计量资料表示为平均值±标准差或中位数(四分位数),计数资料表示为数量(百分率)。符合正态分布的计量变量采用t检验,偏态分布的计量资料采用Mann-Whitney U 检验。计数资料的组间比较采用卡方检验。将单因素分析P<0.05 或具有临床意义的变量采用logistic 多因素逐步回归分析构建LVDD 的预测模型。建立受试者工作特征(receiver operating characteristic,ROC)曲线,并进行拟合优度检验,以评价该预测模型的区分度和校准度。绘制该模型的列线图。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本资料
在692 名新诊断的T2DM 患者中,有460 位合并LVDD(66.5%)。与心脏舒张功能正常的患者相比,合并LVDD 的T2DM 患者年龄更大,SBP、TC 和LDL-C 水平较高,eGFR 水平较低。在LVDD 患者中,女性和高血压患者的比例较高。颈动脉超声检查显示,LVDD 患者的cIMT 水平较高,cIMT 增加和颈动脉粥样硬化的发生率较高。除E/A 比值之外,两组间心脏彩超的其余参数均差异无统计学意义(P>0.05),见表1。
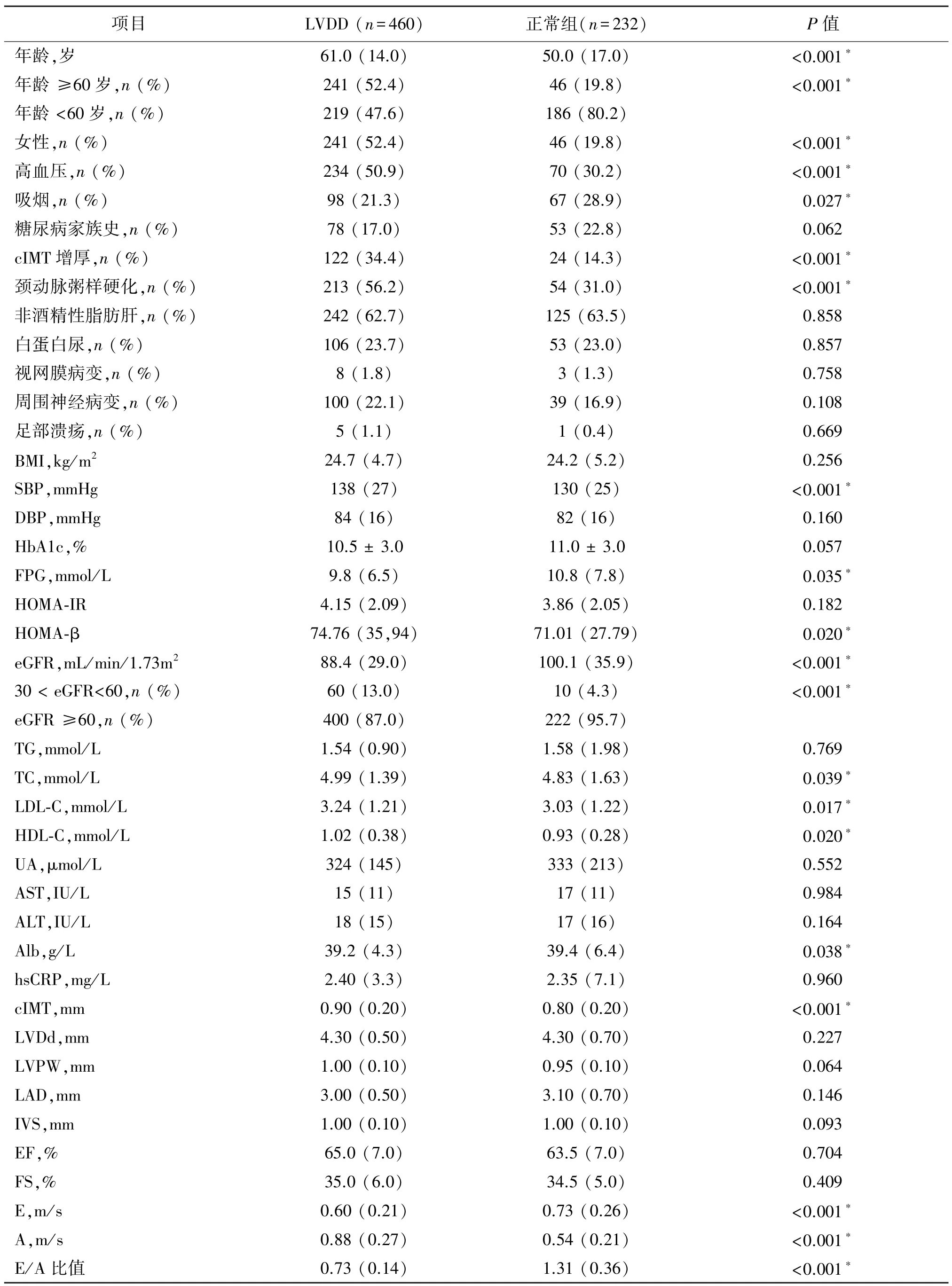
表1 LVDD 患者与无LVDD 患者的临床特征比较
2.2 LVDD 的多因素Logistic 回归分析及预测模型的
多因素Logistic 回归分析显示,年龄≥60 岁(OR=2.834,P<0.001)、女性(OR=1.627,P=0.030)、合并高血压(OR=1.645,P=0.027)、eGFR(OR=0.987,P=0.002)和cIMT ≥1.0 mm(OR=2.060,P=0.008)与LVDD 的发生显著相关,且独立于LDL-C 的影响,见表2。根据Logistic 回归分析的结果,构建初诊T2DM 患者LVDD 的预测模型为:Logit(P)=0.527+1.042 × 年龄(<60 岁=0,>60 岁=1)+0.487×性别(男性=0,女性=1)+0.498×合并高血压(无=0,有=1)-0.014×eGFR(mL/min/1.73m2)+0.723×cIMT 增厚>1 mm(无=0,有=1)。

表2 LVDD 的多因素logistic 回归分析
采用ROC 曲线检验预测模型的区分能力。结果显示,该模型预测概率P值的ROC 曲线下面积为0.752(95%CI:0.708-0.797),标准误为0.023,提示该预测模型有较好的区分度根据Youden index 计算公式,该预测模型的概率P值的截断值为0.43,此时ROC 曲线的敏感性和特异性分别为0.681 和0.749。该预测模型拟合优度检验(Hosmer-Lemeshow)显示χ2=4.782,P=0.781(P>0.05),见图1。根据其实际观测值和模型预测值绘制线图,从该线图可见,实际观测曲线与模型预测曲线较接近,说明模型的准确性较好,该模型能较好地预测LVDD 的发生概率,见图2。

图1 模型ROC 曲线

图2 模型校准图
2.3 Nomogram 分析
以是否发生LVDD 为因变量,以多因素logistic回归分析筛选出的变量作为预测变量,为5 个危险因素不同取值水平进行赋分,应用R 软件进行Nomogram 分析。计算各因素评分的总分。总分越高,发生LVDD 的风险越大。如1 例年龄为50 岁(0 分)、女性(19 分)、合并高血压(20 分)、eGFR 为80 mL/min/1.73 m2(66 分)、cIMT ≥1.0 mm(29 分)的初诊T2DM 患者,她的总分为134 分,LVDD 的预测概率为0.85,见图3。

图3 初诊T2DM 患者LVDD 发生风险的列线图
3 讨论
本研究显示,在新诊断的T2DM 患者,即存在较高的LVDD 患病率(66.5%),这与之前的研究结果一致[8-11]。患者的中位年龄为56.3 岁,平均BMI 为25.1,近一半的患者合并有高血压。这些人口学特征和临床特点与中国T2DM 的流行病学报告一致[18]。
既往的研究显示,年龄、女性、高血压和BMI 都是与心脏舒张功能障碍正相关的影响因素[19]。我们的研究也有类似的发现。与其他因素相比,年龄对LVDD 的影响更大[20]。随着年龄的增大,老年人的左心室舒张功能通常会逐步减退。在一般人群中,LVDD 常在老年人中发现,且与糖尿病、高血压等危险因素有关[21]。在新诊断的T2DM 患者中,年龄和HbA1c 是LVDD 的强预测指标[22]。
在本研究中,女性也是LVDD 的一个独立危险因素。近年来,性别差异正成为一个热门话题。近期的一篇综述指出,相较于男性,在女性群体中,糖尿病是患心血管疾病的更强烈的危险因素[23]。心脏功能存在一定的性别差异,尤其是在老年人群。舒张性心力衰竭或射血分数保留的心力衰竭,在女性,特别是绝经后妇女中的发生率更高[24-25]。有研究表明糖尿病患者发生心力衰竭的风险增加:与年龄匹配的非糖尿病患者相比,男性的发病率高出2 倍,而女性的发病率则高出5 倍[26]。一项研究显示,T2DM 患者的LVDD 在男性和女性中的患病率同样高,而射血分数保留的心力衰竭,女性的患病率似乎比男性更高[7]。研究人员推测了潜在的机制,包括遗传和激素因素以及疾病管理中的差异等。绝经后心脏保护性雌激素的丧失、被诊断为T2DM 前的长期胰岛素抵抗状态和代谢功能障碍以及较低的体力活动水平都被认为是可能的影响因素[23,27]。
高血压是一个公认的导致心脏功能障碍的重要因素。而在本研究中,很大一部分糖尿病患者都合并高血压,且高血压与LVDD 之间存在显著的相关性。cIMT,既被认为是动脉粥样硬化发展的早期生物标志物,也是一种血管重塑和老化的生物标志物。cIMT 和LVDD 之间的联系在一般人群中得到了广泛的认可,特别是在老年人中[28-29]。这种关联的原因可能是,cIMT 增加的患者心血管疾病的发病率较高。而对于年轻的患者来说,这方面的证据相对较少。一项针对儿科腹膜透析患者的研究表明,cIMT是舒张期功能障碍的独立预测因子[30],这与我们的发现一致。cIMT 值的增加与糖尿病患者LVDD 的存在显著相关。
本研究表明,eGFR 的早期下降与LVDD 的发生显著相关。在肾脏损伤的早期阶段,肾脏和心脏就已存在一定的相互作用。此前的研究表明,在普通人群和T2DM 患者中,轻到中度的eGFR 下降与早期的LVDD 之间均存在显著的相关性[31-32]。微量白蛋白尿是糖尿病肾损伤的一个特征性表现,通常早于eGFR 的下降。在本研究中,我们没有发现白蛋白尿与LVDD 的相关性,这可能与本研究未对尿白蛋白进行定量分析有关。之前的研究显示了不同的结果。对高血压、冠心病或血压正常患者的研究显示,微量白蛋白尿和LVDD 之间存在显著关联[33-36]。但在另一项针对T2DM 患者的研究中,eGFR 与亚临床动脉粥样硬化相关,而与蛋白尿无关[37]。未来还需要进一步的量化分析来明确心脏和肾损伤早期变化之间的关系。
高BMI 值和肥胖症与心脏舒张功能障碍相关。一项针对日本普通人群的研究表明,BMI 与超声心动图左心室舒张功能的参数相关,即使是在BMI 值相对较低(22.6 ± 3.3)的患者中也是如此[38]。BMI的增加会随着年龄加速左心室舒张功能的减退[39]。从生理学的角度来看,BMI 的升高会增加总血容量,进而增加左心室每搏量。这将导致左心室肥厚,并最终导致LVDD。此外,研究表明,肥胖通过分泌各种促炎细胞因子来诱导全身性炎症,这可能导致心肌细胞肥大和间质纤维化[40]。但这些有阳性结果的研究都是在一般人群中进行的[38-41]。在特定的患者群体中,特别是对于有心血管危险因素的患者,BMI 的影响可能不太显著。一项对T2DM 患者(BMI 26.3 ± 3.9)的研究表明,BMI 并不是心脏舒张功能障碍的危险因素[20]。另一项在疑似患冠心病的中国患者(BMI 25.2 ± 2.9)的研究也报告了类似的阴性结果[42]。这些结果与我们的研究相一致。在本研究中,LVDD 组患者的BMI 值24.7(4.7)略高于正常组24.2(5.2),但差异无统计学意义。
血脂失调在糖尿病患者中很常见。糖尿病状态下,脂质的数量和功能都会发生改变。有多种脂类生物标记物,包括LDL-C、甘油三酯和HDL-C 等,均被认为是糖尿病患者舒张功能障碍的预测因子,尤其是在那些血糖控制较差的患者中[43]。HDL-C 的异常可能参与了糖尿病的病理生理过程,并增加患者的心血管风险[44]。血清氧化LDL 水平的升高与肾病末期患者的收缩期心功能障碍显著相关[45]。除了LDL-C、非HDL-C 或HDL-C 外,脂谱组合如TC/HDL-C 比值也与左心室结构的异常显著相关。与单个血脂参数相比,脂谱组合可能为预测心血管事件的发生提供更多的预后信息[46-47]。在本研究中,合并LVDD 的T2DM 患者TC 与LDL-C 水平较心功能正常组更高,但多因素分析未提示血脂与LVDD 之间的显著相关性。此前的研究还提出了其他的LVDD 相关因素,如非酒精性脂肪肝和高敏C反应蛋白(hsCRP)[48-50]。但在本研究中,没有类似的发现。
综上所述,本研究表明,新诊断的T2DM 患者的LVDD 患病率很高。高龄、女性、合并高血压、eGFR的早期下降和cIMT 水平的增加都与LVDD 的存在密切相关。本研究构建的预测模型有助于甄别心血管疾病高风险的初诊T2DM 患者。对于高风险的患者,LVDD 的早期筛查和检测应在初次确诊为T2DM时即开始。本研究为横断面观察性研究,且样本量有限,存在一定的局限性。研究结论还需要大规模的前瞻性临床研究进一步探讨与证实。

