基于非接触电导检测和在线富集技术快速灵敏检测土壤中速效磷
齐培杉,朱蓬生,谢天尧
(中山大学 化学学院,广东 广州 510275)
磷是植物生长过程中的重要元素之一。若缺磷,植被则难以生长,而磷含量过多也会造成磷污染。土壤含磷量(包括有机磷和无机磷)的多少及其存在形态常与生长在该区域的植物生长发育状况有着重要联系[1-3]。通常有机磷因以高分子形态存在,难以直接被植物吸收作为养分;而无机磷则包括了与钙、铁、铝等络合的难溶性磷酸盐以及能够为植物吸收利用的水溶性无机磷酸盐。由于水溶性无机磷可为植物直接吸收利用(称之为速效磷),因此其含量是反映土壤中速效磷的重要指标[4-5]。通过研究速效磷在土壤中的分布及含量,能够深入了解土壤中磷的供应状况,这对于农业中的精准施肥有直接的指导意义[6-8]。但在土壤中速效磷的研究过程中,由于其含量很低且土壤中大量共存组分的干扰严重,因此建立灵敏快速、抗干扰能力强的土壤中速效磷含量的检测新方法具有十分重要的现实意义。
土壤中速效磷的常规检测方法是采用浸提剂浸出土壤中的可溶性磷,再用比色法进行检测[4-5]。其它有关磷的分析方法主要有:离子色谱法、毛细管电泳法、电化学分析法和光学分析法等[9-14]。其中,比色法的步骤较繁琐,检测时间长,检测灵敏度低。此外,因土壤中含有一定量的有机质,浸出液通常呈深浅不一的黄褐色(须用活性炭脱色后再测定),一定程度上对比色分析造成了干扰。浸出液的颜色也会不同程度地影响到其它光学分析方法。离子色谱法是较广应用于土壤和水体中无机阴离子测定的分析方法,但存在前处理复杂,色谱柱较昂贵且易污染,分析成本高和不适于现场快速检测的缺点。根据已有研究,建立操作简单且快速灵敏的分离检测土壤中速效磷新方法,尚属一个具有挑战性的研究课题。毛细管电泳法(CE)具有高效、分离速度快,样品和试剂消耗少,易于小型化和便携化等特点。电容耦合非接触电导检测法(C4D)作为一种优良的CE 通用检测技术,对被检测组分具有普适性,尤其在极弱光活性和电活性组分检测中更显优势。C4D 中溶液与电极之间因毛细管壁的间隔而不接触,因而具备良好的重现性和稳定性[15]。场放大进样(FASI)在众多CE在线富集方法中操作最为简单,且富集因子高,极具实际可操作性,进而很好地解决了常规CE在微量、痕量分析中灵敏度不足导致应用受限的问题[16]。FASI通常以超纯水作为进样介质(即样品直接溶于超纯水),通过电动进样实现高效的在线富集效果[16-18]。因此,采用FASI-CE-C4D 测定土壤中速效磷含量,是极具应用潜力的检测新技术。
本文采用FASI-CE-C4D 对土壤中速效磷的含量进行测定,通过优化实验条件使得土壤中共存的常见无机阴离子(如Cl-、SO24-、NO-3)和有机基质不干扰速效磷的测定;样品无需进一步处理即可直接进样分析,从而为土壤中速效磷的快速检测提供了一种操作简单、灵敏和成本低的检测新方法。
1 实验部分
1.1 仪器与试剂
CES2018 型毛细管电泳仪、C4D 检测器、C4D 检测池体(广州涵天科仪公司);石英毛细管柱(邯郸永年锐沛色谱器件公司);TG16-WS型台式高速离心机(湖南湘仪公司)。
乙酸(HAc)、乙酸铵、NaOH、HNO3、氯化钠、硝酸钠、硫酸钠;十六烷基溴化铵(CTAB)、三羟甲基氨基甲烷(Tris,广州化学试剂厂);磷酸二氢钾标准品(北京国家标准试剂公司);土壤标准样品(GBW07461,由广东土壤研究所提供),所用试剂除注明外均为分析纯。实验用水为超纯水,由超纯水机制备。
用水、乙酸和乙酸铵直接配制电泳运行液,现用现配。用水和经105 ℃干燥2 h 的KH2PO4配制质量浓度为100 mg/L 的磷标准储备液(若以PO3-4计,则为306.6 mg/L),保存在4 ℃冰箱;实验时,取适量的上述标准品储备液用水配成不同质量浓度的标准工作溶液。
1.2 实际样品的处理
参照文献方法[1-2],土壤样品经烘干、研磨后称取0.500 0 g 加入10 mL 水浸泡。震荡5 min 后超声浸提5 min,经6 000 r/min 离心5 min 后静置5 min。取适量上清液于进样瓶中(如有必要,可经过滤处理),视实际样品中磷含量用水稀释至适当倍数,使其质量浓度处于线性检测范围之内,上机进行FASI-CE-C4D测定。
1.3 实验方法
毛细管在使用前的处理参照文献[17]:每2 次进样分析之间,用运行液冲洗毛细管3 min,走基线8 min。电泳分析过程运行5 h后,电泳仪两端的储液瓶中需换新鲜电泳运行液。石英毛细管柱:45 cm×50 μm id,Leff=40 cm。35 mmol/L 乙酸+2 mmol/L 乙酸铵溶液为电泳运行液。CE 仪器的参数为:负高压分离:-14 kV,电动进样:-11 kV×10 s。C4D 检测器的输出信号由数据工作站实时采集到上位微机中进行CE-C4D电泳图谱的记录和分析。仪器运行条件为室温,相对湿度≤70%。
2 结果与讨论
2.1 CE分离条件的选择
磷酸根离子在水溶液中以阴离子形式存在,采用负高压的分离模式可获得良好的分离效果[15]。电泳运行液对分离度、灵敏度、信噪比有着重要影响,通过选择合适的运行液,能够获得最佳的分离度、灵敏度、信噪比和平稳基线。土壤样品中共存的氯离子、硫酸根离子、硝酸根离子是磷酸根离子检测中最主要的干扰离子。因此,在电泳运行液的选择方面主要考察Cl-、SO24-、NO-3、PO34-的分离情况。经对多种电泳运行液体系(HAc - NH4Ac、HAc-Tris、HAc-Tris-CTAB、HAc-NaOH、HAc-NaOH-CTAB)进行测试,结果表明:采用35 mmol/L 乙酸-2 mmol/L 乙酸铵溶液(pH 3.0)作为电泳运行液时,可以很好地满足土壤样品中磷酸根离子的分离检测要求,其主要具有以下优点:①此时该电泳运行液的pH 3.0 左右,石英毛细管壁上的硅羟基电离几乎完全抑制,导致电渗流很小[19],无需添加电渗流抑制剂,且基线平稳。②在pH 3.0 的酸性介质中,磷酸根离子主要以磷酸二氢根离子形式存在[20],是毛细管中电迁移的主体,因此进样组分PO34-、HPO24-、H2PO-4均表现为具有相同电迁移时间的单峰,且峰形尖锐单一,磷酸根离子的检测灵敏度高。③土壤中共存的常见无机阴离子(Cl-、SO24-、NO-3)不干扰磷的测定(见图1)。因此本实验选择35 mmol/L 乙酸-2 mmol/L 乙酸铵溶液(pH 3.0)作为最佳电泳运行液。
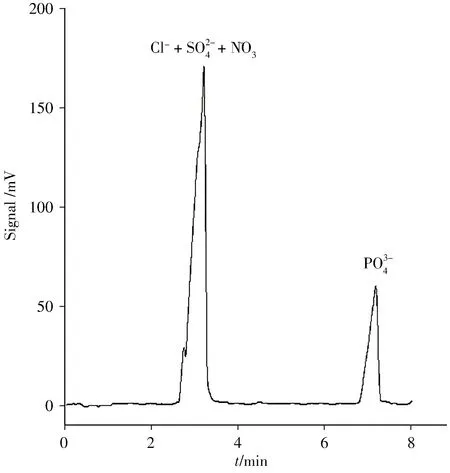
图1 Cl-、SO24 -、NO-3、PO34 -混合离子的FASICE-C4D 电泳谱图Fig.1 FASI-CE-C4D electropherogram of the mixed Cl-,SO24 -,NO-3 and PO34 -ions running buffer:35 mmol/L acetic acid+2 mmol/L ammonium acetate(pH 3.0);separation voltage:-14 kV,electrokinetic injection:-11 kV×10 s
2.2 分离电压的选择
考察了分离电压的影响,实验结果表明:随着分离电压由-8 kV 升至-18 kV,目标离子的出峰时间不断缩短,有利于提高分析速度。但当分离电压达到-16 kV以后,目标电泳峰与土壤中的干扰离子峰发生部分重叠,且电泳电流引起的焦耳热也随之增加,使得检测结果的信噪比降低。综合考虑分析时间、共存组分干扰情况以及基线稳定性的影响,本文选择-14 kV为最佳分离电压。
2.3 场放大进样条件的选择
在FASI 中,需对进样电压和进样时间进行优化。实验考察了目标电泳峰强度与进样电压间的关系。结果表明:当进样电压由-3 kV 调至-11 kV 时,目标峰的峰高随之线性增加,而半峰宽变化不明显;当进样电压超过-11 kV 后,峰高增加趋缓,而半峰宽则明显增加。因此,从分离度方面考虑,本实验采用进样电压为-11 kV。
考察了进样时间由3 s增至15 s时,磷酸根离子的电泳峰峰高和半峰宽的变化情况。结果表明:进样时间由2 s增至10 s时,峰高随时间的增加而线性增加,当进样时间超过10 s时,峰高随时间变化趋缓,而峰宽则明显增加。因此,选择最佳进样时间为10 s。
电动进样前,通过重力进样方式进5 s左右的水(称之为水塞)可进一步提升磷酸根离子的检测灵敏度(约提高50%)。但需指出水塞为非必要步骤,在灵敏度满足实际样品的检测要求时可省略。本实验省略了该步骤。
在上述实验条件下,测定了FASI法对磷酸根离子的富集因子,结果表明:通过FASI,磷酸根离子的检测灵敏度相比于常规进样方法得到显著提高,富集前后的谱图对比如图2 所示。图2a 采用常规的重力进样,磷酸根离子的进样浓度为5.0 mg/L(样品介质为水);图2b采用FASI进样,磷酸根离子的进样浓度为0.10 mg/L。通过计算得出富集因子为580。
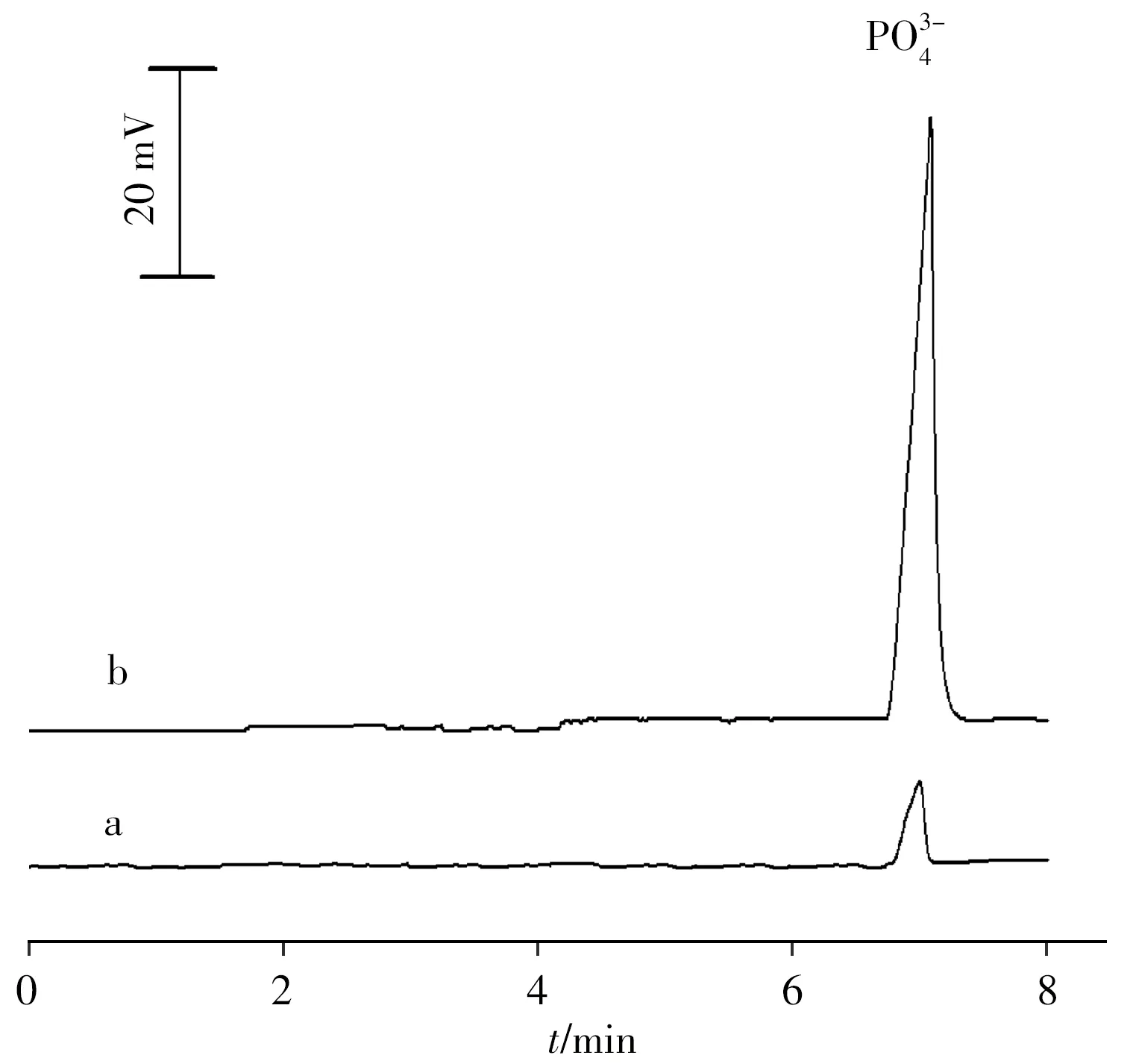
图2 PO34 -经常规重力进样(a)和FASI进样(b)的CE-C4D电泳谱图Fig.2 CE-C4D electropherograms of PO34 -by normal hydrodynamic injection(5.0 mg/L)(a)and FASI(0.10 mg/L)(b)
2.4 干扰情况考察
土壤浸出液的基体相对较复杂,与磷酸根离子共存的组分主要有:无机阴离子Cl-、NO-3、SO2-4以及有机酸(如:草酸、甲酸、乙酸等)。但基于以下原因,这些基体物质不干扰测定结果(见图3):①选择了合适的电泳运行液,使得主要的干扰组分Cl-、NO-3、SO2-4的电泳峰远在磷酸根离子电泳峰之前,不影响土壤中速效磷的测定;②负高压分离模式下,仅有阴离子组分迁移到检测器被检出,而阳离子因迁移方向相逆未检出;③由于采用了乙酸电泳运行液,对于电离常数值接近或小于乙酸的有机弱酸,因电离几乎被抑制而不能迁移至检测器端被检出[15-16];④草酸、甲酸的电泳峰位于磷酸根离子电泳峰之前,且与目标峰完全分离,不干扰测定。稍大于乙酸电离常数值的有机酸因出峰时间较长(10 min以上)而落在检测窗口之外。另外,土壤浸出液基体颜色不影响测定结果。在实际样品分析中,为了解决土壤样品溶液基质引起的校正曲线基体匹配问题,可采用标准加入法,或其他定量方法[16]。本文采用标准加入法。
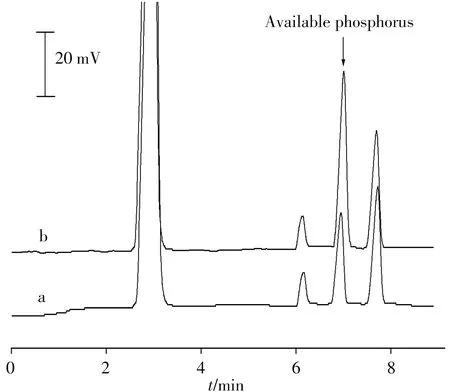
图3 土壤样品(a)及加标土壤样品(b)的FASI-CE-C4D 电泳谱图Fig.3 FASI-CE-C4D electropherograms for detection of available phosphorus in the soil sample(a)and spiked soil sample(b)
2.5 方法学评价
在优化实验条件下,对不同浓度的磷酸根离子标准液进行FASI-CE-C4D 测定。结果表明:磷酸根离子质量浓度在16~800 μg/L 范围内,其峰面积(y)与质量浓度(x,μg/L)间呈良好的线性关系:y= 8.36x-2.12,线性相关系数为0.998 1。以目标物峰高与背景噪声的3 倍信噪比(S/N)计算得到磷酸根离子的检出限为5 μg/L。表明本方法的检出限可满足痕量磷酸根离子的检测要求。
对0.10 mg/L 磷酸根离子溶液平行测定5 次,测得其日内和日间相对标准偏差(RSD)分别为4.0%和4.7%。表明该方法具有较好的重现性,可以满足土壤中速效磷的定量分析要求。
2.6 实际样品测定
将建立的方法应用于5 个土壤样品(采集于中山大学南校区的不同区域)及1 个土壤标准样(GBW07461,速效磷的标注值为11.2±1.6 mg/kg)中速效磷含量的测定。按“1.2”样品制备方法获得土壤浸出溶液。由于土壤含有一定量的有机质,浸提液呈浅深不一的黄褐色。采用FASI-CE-C4D 对其速效磷含量进行检测,经定量分析和单位换算后,结果见表1。土壤样品中均检出不同含量的速效磷,范围为4.91~19.9 mg/kg。其中Sample#5是土壤标准样,实验测得值与其标注值基本一致。对实际样品进行加标回收实验,每个加标水平进行日内6 次平行试验,测得加标回收率为92.5%~107%,相对标准偏差(RSD)均小于5.0%。图3为土壤及加标土壤样品的FASI-CE-C4D谱图。
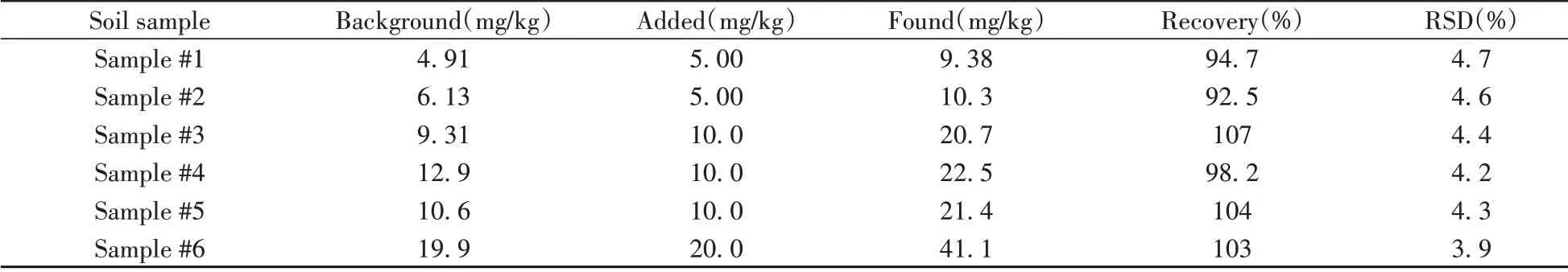
表1 6个土壤样品中速效磷的含量及加标回收率(n=6)*Table 1 Contents and spiked recoveries of available phosphorus in six soil samples(n=6)*
3 结 论
本研究采用非接触式电导检测和FASI在线富集技术,结合毛细管电泳对土壤中的速效磷进行了分离检测。土壤样品经水浸取后,无需复杂前处理即可上机检测。方法操作简单、灵敏快速,是一种经济实用、分析成本低的优良分析方法,可为土壤中速效磷的快速灵敏检测提供新途径。

