固相萃取/液相色谱-串联质谱法测定水果蔬菜中双胍辛胺的残留量
秦 富,汪文龙,司露露,蔡翔宇,梁 宇,苏 华,韦 涛
(南宁海关技术中心,广西 南宁 530201)
双胍辛胺是由日本Dainippon Ink and Chemical 公司于1986 年开发的一种具有触杀与预防性作用的广谱杀菌剂,双胍三辛烷基苯磺酸盐和双胍辛胺醋酸盐是双胍辛胺最常见的2种盐类杀菌剂,其有效成分和水解产物均为双胍辛胺。双胍辛胺及其盐剂对大多数由子囊菌和半知菌引起的真菌病害有良好的效果[1],广泛应用于柑橘、苹果、番茄、生菜等水果蔬菜的病害防治和防腐保鲜[2-3]。尽管双胍辛胺属于低毒性农药,但对家蚕等生物有较高毒性[4],若大量使用而释放至环境中可能对环境和人体产生不良影响[5]。因此,各国均制定了双胍辛胺的残留限量标准,其中欧盟规定双胍辛胺在水果蔬菜等植物源性食品中的残留量均不能超过0.05 mg/kg[6],日本规定水中的双胍辛胺醋酸盐不能超过6 μg/L[7]。中国规定双胍三辛烷基苯磺酸盐(以双胍辛胺表示)在各种水果和蔬菜中的最大残留限量为0.2~3 mg/kg[8],但缺少相关的检测标准,导致难以对植物源性食品中双胍辛胺实施有效的监督管理和风险评价,也不利于水果蔬菜的进出口贸易。因此,研究快速、准确测定水果蔬菜中双胍辛胺残留量的检测方法显得尤为重要。
目前,国内外对双胍辛胺检测方法的研究报道较少,其中针对植物源性食品常采用液相色谱法,但需要添加离子对试剂[9]或进行柱后衍生[10],操作繁琐,衍生效率难以控制,且灵敏度较低,难以满足现行相关限量标准的要求。任海涛[11]和李云飞等[12]分别开发了液相色谱-串联质谱法和高分辨质谱法,但2种方法采集的母离子均为灵敏度和稳定性较差的单电荷加合离子[M+H]+,导致方法的灵敏度低和重现性较差,难以满足植物源性食品中双胍辛胺的痕量检测和定量要求。为此,本研究以沃柑、菠萝蜜、苹果、葡萄、生菜、黄瓜、西红柿、芦笋为样本,成功建立了灵敏度、准确度和精密度更好的固相萃取/液相色谱-串联质谱法,为水果蔬菜中双胍辛胺残留的监督检测以及相关标准制定提供了技术参考。
1 实验部分
1.1 仪器、材料与试剂
1290 Infinity Ⅱ液相色谱仪、Eclipse Plus C18色谱柱(2.1 mm × 100 mm,1.8 μm)(美国Agilent 公司); Qtrap 4500 质谱仪(美国AB SCIEX 公司);BEH Hilic 色谱柱(2.1 mm × 100 mm,1.7 μm)、OASIS WCX 固相萃取柱(3 mL/60 mg)(美国Waters 公司); XS204 电子天平(瑞士Mettler Toledo 公司);飞鸽DL-5-B 离心机(上海安亭科学仪器厂);KL512J 氮气浓缩装置(北京康林科技有限公司);VOTEX GENIE2 涡旋混合器(美国Scientific Industries 公司);GM 200 刀式混合研磨仪(德国Retsch 公司);1.5 mL 聚丙烯短颈螺口瓶(PP 进样瓶,美国Thermo 公司);0.22 μm 疏水性聚四氟乙烯(PTFE)针式滤器、0.22 μm 亲水PTFE 针式滤器(上海安谱实验科技公司);0.2 μm 再生纤维针式滤器(美国Agilent公司);100 mL聚丙烯容量瓶、250 mL聚丙烯试剂瓶(德国Vitlab公司)。
双胍辛胺醋酸盐标准品(CAS:57520-17-9,纯度≥90.1%,德国Dr.Ehrenstorfer 公司),使用甲醇溶解配制标准溶液,浓度以双胍辛胺计,使用聚丙烯材质的容量瓶和试剂瓶定容和储存。乙腈、甲醇、二氯甲烷、甲酸为色谱纯,购自美国Tedia公司。
1.2 样品前处理
提取:将水果、蔬菜样品切碎后,用刀式混合研磨仪制成细碎均匀的试样。称取5.00 g 试样置于50 mL聚丙烯离心管中,加入10 mL 0.2%乙酸水和10 mL二氯甲烷,振荡提取30 min,于4 000 r/min离心5 min。
净化:分别用3 mL 甲醇和3 mL 水活化平衡WCX 固相萃取柱,取3 mL 上清液以1 滴/s 通过小柱;依次加入2 mL 水和2 mL 甲醇淋洗小柱;再用3 mL 10%甲酸乙腈洗脱并收集至15 mL聚丙烯离心管中;于45 ℃水浴氮吹至近干,加入0.2%甲酸水并定容至1 mL,涡旋混匀,过0.22 μm 疏水性PTFE 针式滤器装入PP进样瓶,供仪器分析。
1.3 分析条件
1.3.1 液相色谱条件色谱柱:Eclipse Plus C18(2.1 mm×100 mm,1.8 μm);柱温:40 ℃;进样量:5 μL;流动相:A 为0.2%甲酸水,B 为甲醇;以0.35 mL/min 进行梯度洗脱。洗脱程序:0~2.0 min,保持95% A;2.0~3.0 min,95%~15% A;3.0~5.8 min,15%~5% A;5.8~6.0 min,5%~95% A;6.0~8.0 min,保持95%A。
1.3.2 质谱条件离子源:电喷雾离子源,正离子模式(ESI+);扫描方式:多反应监测(MRM);气帘气(CUR):1.4×105Pa;碰撞气(CAD):Medium;离子源电压(IS):4 500 V;离子源温度(TEM):500 ℃;雾化气(GS1):3.8×105Pa;辅助加热气(GS2):3.8×105Pa;双胍辛胺的离子对参数:母离子为m/z178.8,定量和定性子离子分别为m/z100.0和187.0,碰撞能(CE)分别为19、19.5 V,去簇电压(DP)均为80 V。
1.4 定量方法
采用空白基质加标曲线定量。选择与试样一致的空白基质,添加系列双胍辛胺标准溶液,与样品一同处理后进样,采用MultiQuant 3.0.2软件绘制标准曲线并进行定量分析。
2 结果与讨论
2.1 质谱条件优化
分别采集双胍辛胺的[M+H]+和[M+2H]2+加合离子进行质谱参数优化,结果显示双胍辛胺的最佳母离子为带双电荷的m/z178.8,而单电荷母离子m/z356.6 的响应较差且极其不稳定。可能是由于双胍辛胺的化学结构两端均含有C===== N 双键,在离子化过程中易获得2 个H+形成双电荷离子加合模式[M+2H]2+。母离子碎裂后形成的响应丰度较好的子离子为m/z69.0、100.0、157.7、187.0(如图1),经实际样品检测验证,最终选择响应较好、干扰峰较少的m/z100.0 和187.0 为子离子,该离子参数与文献[13]基本一致。
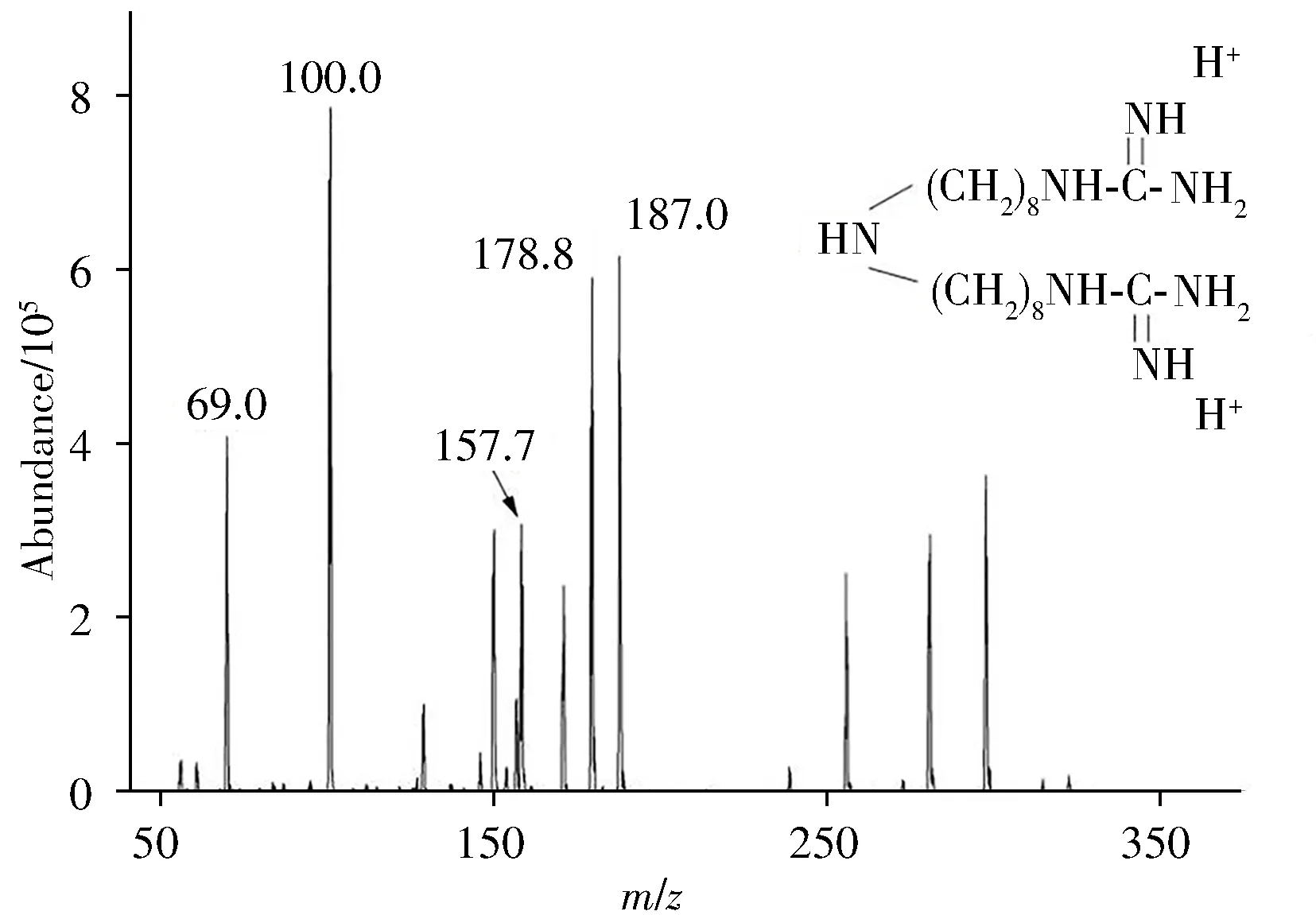
图1 双胍辛胺的质谱图Fig.1 Mass spectrum of iminoctadine
2.2 色谱条件优化
双胍辛胺的极性较强,实验首选BEH Hilic 色谱柱(2.1 mm × 100 mm,1.7 μm)进行分离,结果双胍辛胺的色谱峰有较严重的拖尾,且难以通过调整洗脱程序得到改善。改用C18色谱柱(2.1 mm ×100 mm,1.8 μm)进行分离,结果显示双胍辛胺的色谱峰也存在拖尾,但通过优化流动相洗脱程序后可以获得尖锐、对称的色谱峰形,所以选用C18色谱柱。进一步考察了0.2%甲酸水-甲醇和0.2% 甲酸水-乙腈作为流动相时双胍辛胺标准溶液的出峰效果,发现前者的峰形、峰宽和丰度均优于后者。可能是由于双胍辛胺在甲醇中的溶解性较乙腈好,甲醇的洗脱效果和离子化效果更优,所以选择0.2%甲酸水-甲醇为流动相。在最佳色谱条件下获得双胍辛胺的MRM 色谱峰如图2所示。使用双胍三辛烷基苯磺酸盐和双胍辛胺醋酸盐作为标准溶液进行实验,在相同条件下获得的色谱峰及响应值一致。
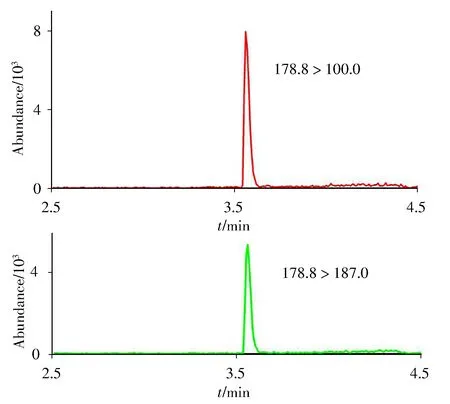
图2 双胍辛胺的MRM色谱图Fig.2 The MRM chromatograms of iminoctadine
由于双胍辛胺容易吸附在质谱系统的管路、喷针、离子源等部件上造成污染,引起保留时间变动、不规则拖尾等色谱现象,从而影响色谱条件的优化。通过多次连续进样或对管路、喷针、锥孔等进行冲洗后可以消除该影响。
2.3 前处理方法的优化
2.3.1 提取、净化条件的优化由于双胍辛胺的极性较强、易溶于水,使用甲醇、乙腈等有机试剂为提取溶剂时效果较差,因此选择使用水相进行提取,并加入二氯甲烷萃取弱极性物质从而获得较好的净化和分层效果。双胍辛胺呈碱性,容易与羧基结合,因此选择经羧基修饰的混合型弱阳离子交换柱WCX进行萃取净化,可获得较好的回收率。
采用标准溶液过柱法对净化条件进行优化。首先,分别使用0.01%氨水、纯水和0.1%、0.2%、0.4%、0.8%、1.6%乙酸水配制标准溶液,过WCX 柱,接收流出液上机测定。结果表明,0.01%氨水和纯水组检出低信号,而各乙酸水组均未检出,表明酸性条件有利于双胍辛胺在WCX柱上的保留,且水溶液的酸性强弱(pH 3.0~6.5)对其保留效果影响不大。因此,实验选择0.2%乙酸水作为提取溶剂。然后,分别使用0.1%氨水乙腈、乙腈和1%、2%、5%、10%、15%甲酸乙腈洗脱上述WCX 柱,收集洗脱液并氮吹复溶后上机测定。结果显示,使用0.1%氨水乙腈和乙腈作为洗脱液时双胍辛胺的回收率为0;使用含甲酸的乙腈为洗脱液时,双胍辛胺的回收率随着甲酸含量的增加而增加,甲酸含量增至10%后双胍辛胺的回收率基本达到最优。因此选择10%甲酸乙腈溶液作为洗脱液。
2.3.2 实验器具的选择由于双胍辛胺易被玻璃吸附,使用玻璃材料的器具或进样瓶时会导致方法的稳定性和重现性较差。文献方法[10-11]通过在前处理过程中添加三乙胺溶液减少玻璃器具对双胍辛胺的吸附。而本方法未使用玻璃器具,容量瓶、试剂瓶、离心管、进样瓶等均为聚丙烯(PP)材料,因此可有效避免玻璃材料对双胍辛胺的吸附。
比较了不同过滤器对双胍辛胺的影响,发现亲水PTFE针式滤器和再生纤维素滤器均会明显吸附双胍辛胺,而疏水性PTFE针式滤器有较少吸附,但对定量结果无影响。
2.3.3 定容溶液的选择比较了0.01%氨水、纯水和0.1%、0.2%、0.4%、0.8%甲酸水为定容溶液时双胍辛胺的响应丰度,结果显示各甲酸水组的响应值无明显差异,均明显高于0.01%氨水和纯水组。这是因为酸性条件既可促使双胍三辛烷基苯磺酸盐水解为双胍辛胺,促进其在电喷雾离子源的离子化,还可减少管路、喷针等仪器材料的吸附和干扰[7]。因此本研究选择0.2%甲酸水作为定容溶液。
2.4 方法学考察
2.4.1 基质效应和定量方法选择具有代表性的沃柑、菠萝蜜、苹果、葡萄、生菜、黄瓜、西红柿、芦笋8种样品基质进行方法验证,发现采用溶剂标准曲线进行定量时,双胍辛胺的加标回收率均较低,未能满足定量要求。引起方法回收率偏低主要有两方面的原因:一是样品前处理过程造成损失,二是产生了较强的基质抑制效应。参照文献方法[14]对8 种水果蔬菜样品进行基质效应(ME)评价。结果显示,上述水果蔬菜的基质效应分别为5.6%、12.0%、11.2%、10.7%、-9.1%、4.5%、-5.6%、-31.2%,其中生菜、西红柿和芦笋为基质抑制效应,其它5 种样品为基质增强效应。可见,引起双胍辛胺回收率偏低的原因除了与基质抑制效应有关,还与前处理过程有关。在前处理过程中,双胍辛胺由于受植物成分和实验器具的吸附干扰导致其绝对回收率偏低[7,10-11]。目前主要通过添加盐酸胍降低干扰。而本实验发现添加盐酸胍反而降低了双胍辛胺的回收率。原因在于,上述文献方法均选择700 mg[10]或1 000 mg[11]大容量的固相萃取柱,而本研究选择60 mg 的小容量柱。在柱容量较小的情况下,由于盐酸胍与双胍辛胺在与WCX柱进行离子交换过程中发生竞争关系,从而导致双胍辛胺的保留和回收率降低。因此本研究不添加盐酸胍,选择采用空白基质加标曲线定量法来校正双胍辛胺的回收率。
2.4.2 检出限与定量下限双胍辛胺采用双电荷离子化模式在液相色谱-串联质谱仪上干扰较小,基线噪音很低,灵敏度很高,其仪器检出限(S/N≥3)可低至0.000 5 mg/L。但在实际检测中,由于双胍辛胺易被植物成分、实验耗材和进样系统等吸附干扰,低浓度时回收率较低。另外,当进样浓度过高时,后续进溶剂空白会出现高于3 倍信噪比的目标信号,因而双胍辛胺的方法检出限(LOD)和定量下限(LOQ)不仅要符合S/N≥3 和S/N≥10 的要求,且其响应值要远高于该残余信号值。通过在仪器检出限的基础上逐渐增加样品的加标浓度进行分析,同时对不同浓度双胍辛胺进样后造成的系统残余信号值进行评估,最终确定双胍辛胺的方法检出限和定量下限分别为0.005 mg/kg 和0.010 mg/kg。对沃柑、菠萝蜜、苹果、葡萄、生菜、黄瓜、西红柿、芦笋阴性样品进行LOD和LOQ水平的加标实验,结果均满足以上两个要求。同时,该方法的LOQ远低于国家标准规定的最大残留限量(0.2~3.0 mg/kg)[8],也低于欧盟的最大残留限量(0.05 mg/kg)[6],满足结果判定要求。
2.4.3 线性关系、回收率与相对标准偏差分别以沃柑、菠萝蜜、苹果、葡萄、生菜、黄瓜、西红柿、芦笋为样品基质,添加0、0.005、0.010、0.020、0.040、0.080、0.160 mg/kg 双胍辛胺进行实验,以加标浓度为横坐标(x,mg/kg),峰面积为纵坐标(y)拟合线性方程。按照LOQ、2LOQ 和欧盟限量值3 个浓度水平(0.010、0.020、0.050 mg/kg)添加双胍辛胺,进行低浓度加标实验,每个浓度设置6 个平行,考察回收率和相对标准偏差(RSD)。结果如表1所示,各样品基质在0.005~0.160 mg/kg范围内的线性关系良好,相关系数r≥0.995;平均加标回收率为88.5%~109%,RSD(n=6)为2.1%~8.8%。
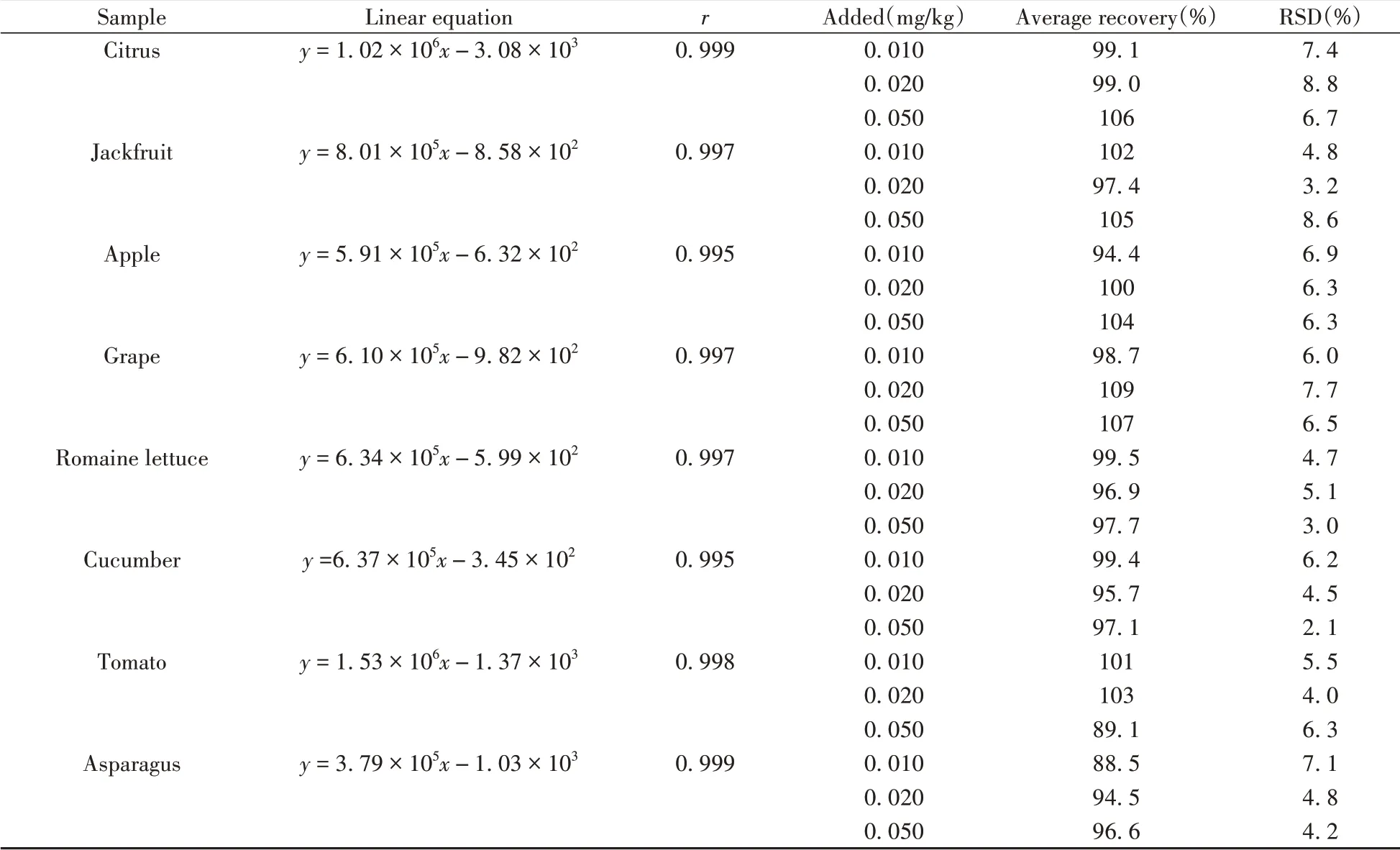
表1 低浓度加标实验的线性、回收率和相对标准偏差Table 1 Linearity,recoveries and relative standard deviations of standard addition test at low concentrations
为使方法的适用性更强,本研究增加了国家限量标准中双胍辛胺的常见限量值1 mg/kg 和3 mg/kg的加标实验。首先尝试按照0.5、1、2、4、8 mg/kg进行加标曲线分析,结果由于加标浓度过高,导致加标曲线线性较差,不能满足定量要求。因此当样品中双胍辛胺的浓度过高时,需将过柱体积降低至WCX 柱的净化容量以下。将过柱体积降至0.3 mL,然后对8 种水果蔬菜进行了1 mg/kg 和3 mg/kg 的加标实验。结果如表2所示,各样品基质在0.5~8.0 mg/kg 范围内的线性关系良好,相关系数r≥0.996;1 mg/kg和3 mg/kg水平的平均加标回收率为88.1%~109%,RSD(n=6)为2.8%~10%。
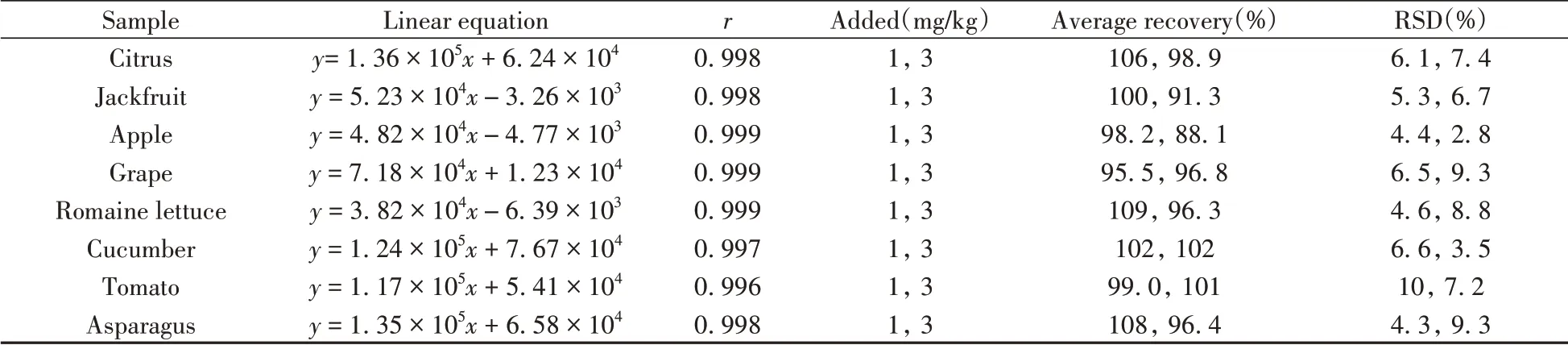
表2 高浓度加标实验的线性、回收率和相对标准偏差Table 2 Linearity,recoveries and relative standard deviations of standard addition test at high concentration
以上结果表明,本方法在各样品基质中不同浓度水平的加标回收率和RSD 均满足“欧盟食品和饲料中农药残留及分析的质量控制和方法验证程序指南”[15]的相关要求,适用于水果蔬菜中不同浓度双胍辛胺残留量的筛查和定量分析。
2.5 方法应用
采用本方法对161 批市售水果蔬菜样品中的双胍辛胺进行检测,其中沃柑31 批,菠萝蜜6 批,苹果29批,葡萄24批,生菜16批,黄瓜21批,西红柿24批,芦笋10批。结果有7批沃柑样品检出双胍辛胺,其余样品均未检出。沃柑的检出率为22.6%,检出量为0.011~0.066 mg/kg,均远低于国家最大残留限量(3 mg/kg)[8],若按照欧盟的限量标准(0.05 mg/kg)[6],则有1批次不合格。
3 结 论
本研究以沃柑、菠萝蜜、苹果、葡萄、生菜、黄瓜、西红柿、芦笋为试样,建立了固相萃取/液相色谱-串联质谱检测水果蔬菜中双胍辛胺的方法。与现有检测方法[8-12]相比,该方法选择聚丙烯材料的容量瓶、离心管、进样瓶等器具,有效避免了双胍辛胺受玻璃器具吸附的影响,同时选择小容量的WCX固相萃取柱使操作更简单、试剂用量更少,且灵敏度和重现性均较好,适用于各种蔬菜水果中双胍辛胺残留量的检测。

