100例肝移植术患儿术后早期感染的病原菌分布及耐药情况
李斯婕,覃金爱,杨志勇
1 广西医科大学第一附属医院PICU,南宁 530021;2 广西医科大学第一附属医院医院感染科
肝移植术后患儿因存在肝脏基础疾病、术后使用免疫抑制剂抗排异、侵入性诊疗操作多等因素,具有很大的感染风险,影响患儿预后。能否有效控制感染是肝移植成功的关键,因此监测肝移植术后感染特点及病原菌变迁有利于提高肝移植患儿的存活率。本研究对我院儿童重症监护室(PICU)收治的肝移植术后患儿3个月内的送检标本培养结果进行回顾性分析,了解我院肝移植术患儿术后早期感染的病原菌分布特点,并对常见病原菌进行耐药性分析,旨在为肝移植患儿术后抗感染方案的选择提供参考。
1 资料与方法
1.1 临床资料 收集2017 年7 月—2020 年6 月入住我院PICU 的100 例肝移植术后患儿,其中男52例、女48 例,年龄0.33~8.33 岁、中位年龄0.71 岁,体质量4.2~47.0 kg、中位体质量7.3 kg。供者来源包括:死亡供体15例(脑死亡供体14例、心脏死亡供体1 例),活体供体85 例(亲体供者84 例、自体供者1例),其中1例患儿行二次肝移植(第一次供者为亲体移植,二次供者为死亡供体)。原发病包括:胆管闭锁76 例,肝硬化失代偿9 例,肝母细胞瘤2 例,Caroli 病2 例,布加综合征2 例,Alagille 综合征2 例,其他(如肝功能衰竭、肝脏肿瘤等)7例。
1.2 病原菌来源标本的采集方法 患儿肝移植术后使用呼吸机辅助通气,转入PICU。于入住PICU当天,常规采集深部痰标本、腹腔引流液标本、血标本及尿液送检。患儿术后3个月内出现肺部、腹腔、血流、尿路及手术部位等感染,符合临床感染诊断标准,同时感染部位标本送检有病原学阳性,其病原学结果与临床感染特点一致,排除污染菌及定植菌者,可确诊为术后感染。不包括入院前已开始或入院时已处于潜伏期的感染。根据患儿感染情况采集标本送检,病情稳定后拔除气管插管、深静脉置管、尿管及术中留置引流管,如考虑有血流感染或腹腔感染则留取深静脉置管尖端及腹腔引流管尖端,气管插管尖端及尿管均不留培养。所有痰、血液、尿液、中心静脉置管尖端、引流液、创面分泌物等标本的采集与送检参照中华人民共和国卫生行业标准颁布的微生物标本采集及送检操作规范。
1.3 病原菌鉴定方法 采用法国生物梅里埃公司VITEK 2-Compact 系统,血琼脂平板、麦康凯琼脂平板及水解酪蛋白琼脂平板均为郑州安图生物工程有限公司产品。
1.4 药敏检测方法 药敏试验参照美国CLSI M100-S23(2013 年)推荐的标准。药敏质控菌株为金黄色葡萄菌 ATCC52923,大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853,肺炎克雷伯杆菌ATCC700603。β 内酰胺酶检测采用双纸片协同法和双纸片增效法确定菌株,采用改良Hodge试验确认碳青霉烯类耐药菌株。同一患者、同一部位7 d 内相同药敏菌株视为同一菌株,不重复统计。多重耐药菌定义为病原菌对临床使用的三类或三类以上抗菌药物同时呈现耐药。广泛耐药菌定义为病原菌对除了黏菌素和替加环素外的其他抗菌药物全部耐药者。耐碳青霉烯类肠杆菌(CRE)定义为对亚胺培南、美罗培南或厄他培南任一药物耐药者。
1.5 统计学方法 采用WHONET5.6 和EXCEL 软件进行数据录入和统计。
2 结果
2.1 肝移植患儿术后感染发生情况 术后3 个月内,57 例(57.0%)患儿发生1 次或1 次以上感染,合并2个及2个以上部位感染22例。其中肝移植术后肺炎44 例,腹腔感染18 例,脓毒症或脓毒性休克15例,尿路感染6例,手术伤口感染5例,导管相关血流感染4例,胃肠道感染2例,皮肤软组织感染1例,中枢神经系统感染1 例。在不同原发病患儿中,胆管闭锁患儿术后感染发生率最高,为77.6%,见表1。

表1 不同原发病肝移植患儿术后感染分布情况[例(%)]
2.2 肝移植患儿术后早期感染病原菌的分布特点
2.2.1 病原菌检出情况及分布 送检标本共培养分离出114 株病原菌,其中细菌94 株(包括革兰阳性菌41 株、革兰阴性菌53 株),真菌20 株。分离前5 位细菌分别为屎肠球菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、肺炎克雷伯菌、表皮葡萄球菌。革兰阳性菌中,最常见为屎肠球菌,其次为表皮葡萄球菌和肺炎链球菌,见表2;革兰阴性菌中,最常见为鲍曼不动杆菌,其次为嗜麦芽窄食单胞菌和肺炎克雷伯菌,见表3;20 株真菌中,最常见为白色念珠菌,见表4。
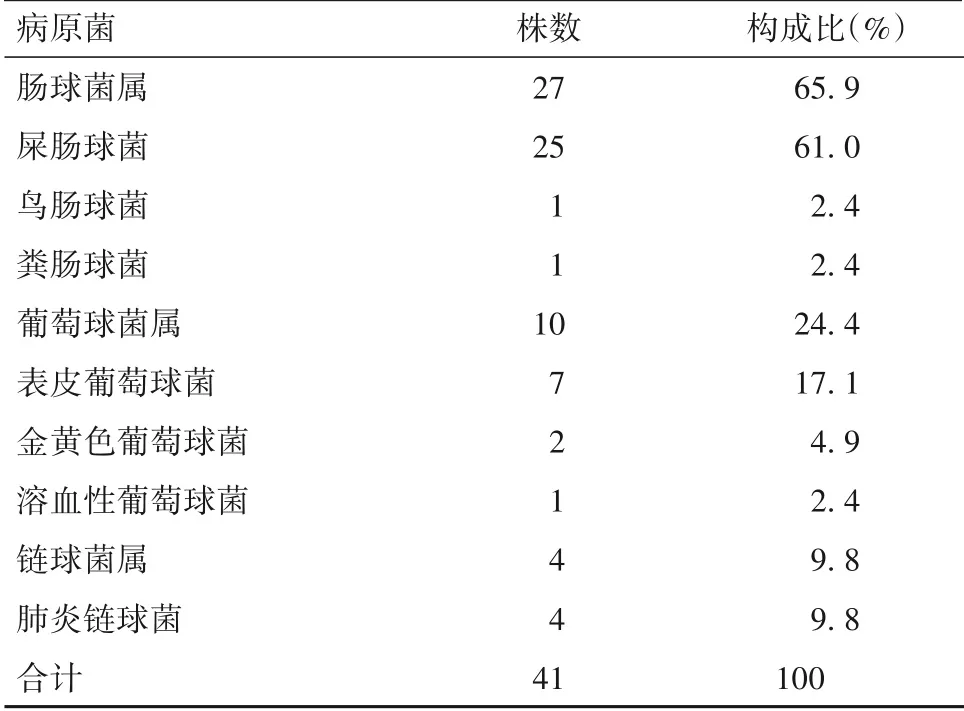
表2 100例肝移植术后患儿革兰阳性菌感染分布

表3 100例肝移植术后患儿革兰阴性菌感染分布
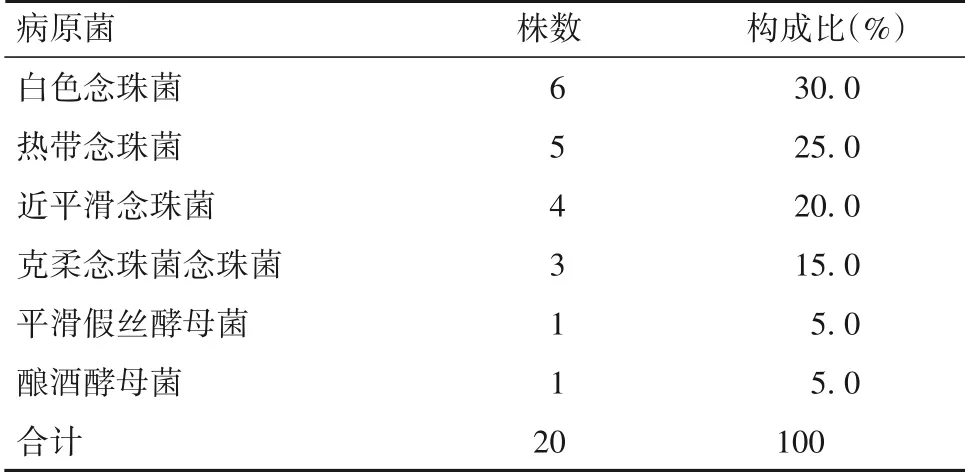
表4 100例肝移植术后患儿真菌感染分布
2.2.2 细菌培养阳性标本来源分布情况 94 株细菌培养阳性标本中,痰标本29例、血液标本25例(包括外周血培养21例及中心静脉置管尖端培养4例),腹腔引流液标本13例,穿刺性腹水标本9例,尿液标本6例(均留置导尿管>48 h),其他13例(包括胆汁、创面分泌物、胃液及粪便等)。
2.3 常见病原菌耐药分析结果
2.3.1 常见革兰阳性菌耐药分析结果 屎肠球菌对氨苄西林、苄青霉素耐药率为100%,对庆大霉素、左氧氟沙星及呋喃妥因耐药率均超过30%,对环丙沙星、四环素部分敏感;表皮葡萄球菌对苄青霉素、苯唑西林及四环素耐药率为100%,对红霉素、克林霉素及左氧氟沙星耐药率超过50%。两者均未发现对利奈唑胺、替加环素及万古霉素耐药菌株。见表5。
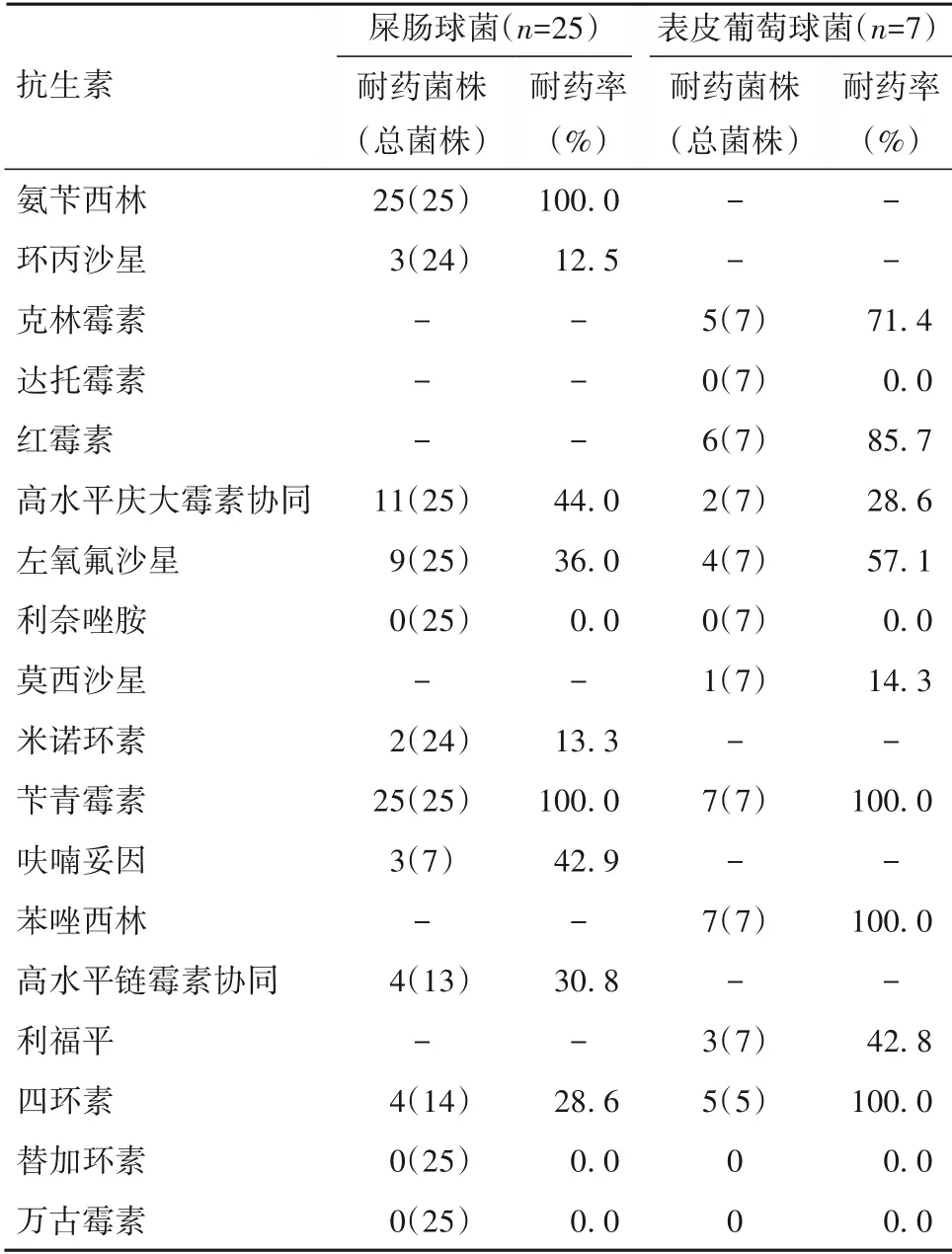
表5 常见革兰阳性菌耐药性分析结果
2.3.2 常见革兰阴性菌耐药分析结果 鲍曼不动杆菌对哌拉西林、复方新诺明耐药率100%,对大多数抗生素耐药均在70%以上,未发现对替加环素及多黏菌素E 耐药菌;嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药,对左氧氟沙星、米诺环素及复方新诺明仍较敏感,对头孢他啶部分耐药,耐药率为14.3%;肺炎克雷伯菌对头孢曲松及哌拉西林耐药率为100%,对头孢他啶、头孢哌酮/舒巴坦、头孢吡肟、庆大霉素、复方新诺明耐药率均在50%以上,其中1株为耐碳青霉烯类抗生素。见表6。
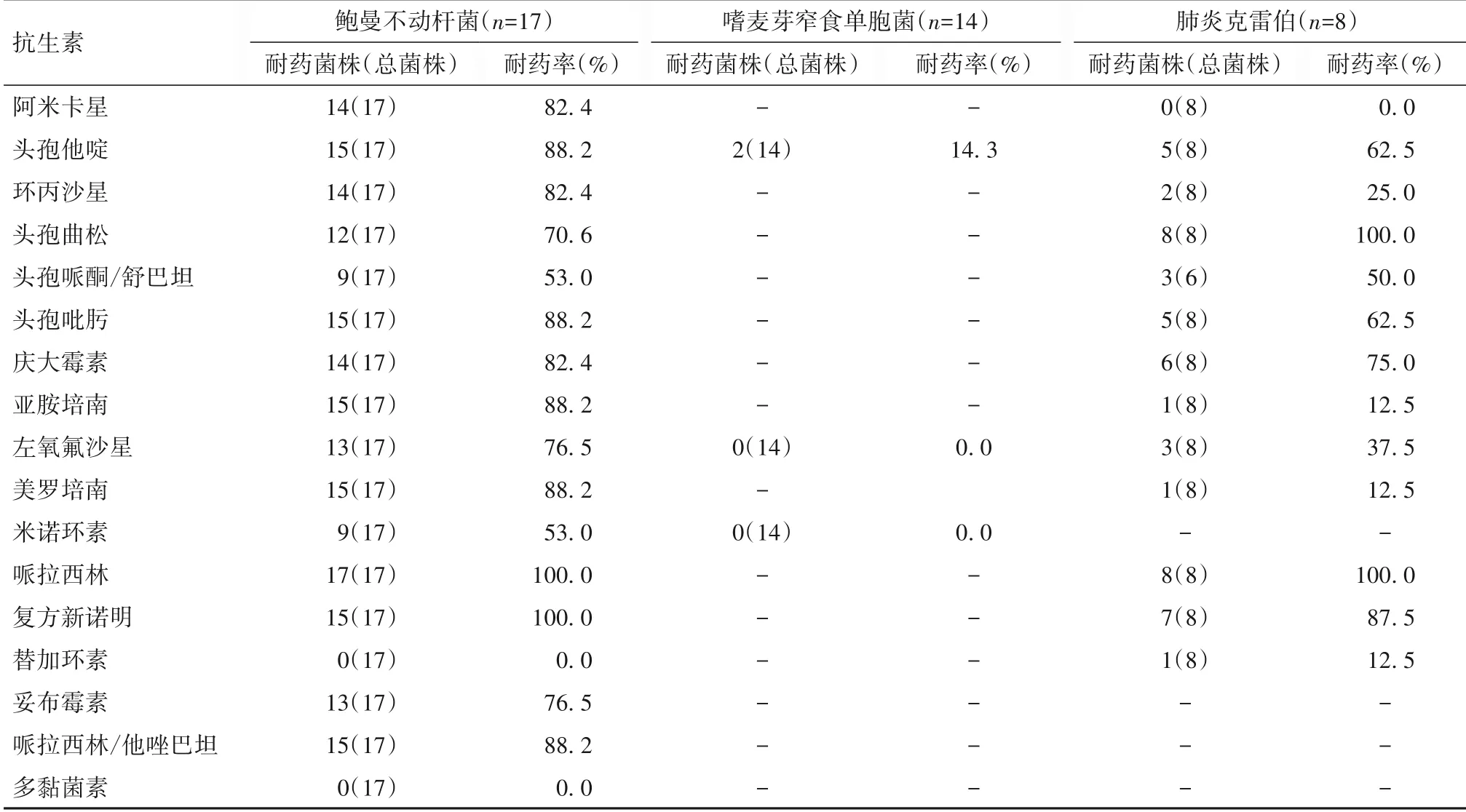
表6 常见革兰阴性菌耐药性分析结果
2.3.3 多重耐药菌、广泛耐药菌和CRE 检出结果 共检出多重耐药菌14 株,均为鲍曼不动杆菌,其中广泛耐药菌12株,药敏结果提示仅对多黏菌素及替加环素敏感,其余对常用抗生素均耐药。检出CRE 4 株,其中产气克雷伯菌2 株、肺炎克雷伯菌1株、大肠埃希菌1 株,药敏结果提示对厄他培南、美罗培南及亚胺培南均耐药。对4例CRE感染患儿给予美罗培南或亚胺培南联合替加环素治疗,其中3例感染控制,1例因感染加重死亡。
3 讨论
儿童肝移植是治疗儿童各种急慢性终末期肝病和肝脏遗传代谢性疾病的有效手段。国外相关统计数据显示,儿童肝移植术后1年、5年、10年生存率为94%、91%和88%[1],10 年以上生存率约为70%[2-3]。国内报道显示,在有经验的肝移植中心,术后5年生存率为90%[4]。术后感染是影响早期预后的重要危险因素之一[5-7]。本研究中,100 例肝移植术后患儿感染发生率为57.0%,与MUKADDER 等[8]报道的儿童肝移植术后细菌感染率55.7%(93/167)相近,明显高于孟稼祥等[9]报道的儿童肝移植术后细菌或真菌感染率37.2%(122/328),低于毛壬萍[10]报道的儿童肝移植术后细菌感染率80.5%(33/41)。儿童肝移植术后感染的高危因素包括年龄小、营养不良、腹水、门脉高压、术后各种侵入性操作、免疫抑制剂使用、术后二次手术等[8-12]。本研究100 例肝移植患儿中,76.0%的原发病为胆管闭锁,多数为月龄小的婴儿,伴有营养不良、腹水、门脉高压等,术后常规使用呼吸机辅助通气、留置腹腔引流管、中心静脉置管及尿管,免疫抑制剂抗排斥反应等,成为肝移植术后感染的危险因素。
儿童肝移植术后感染率高,感染发生时间早,有多部位、多菌种混合感染倾向。细菌是术后早期最常见的病原体,常见感染部位包括下呼吸道、腹腔、胆管等,常见致病细菌为铜绿假单胞菌、屎肠球菌、大肠埃希菌等[8-10]。本研究100 例肝移植术患儿中,术后3 个月内有57 例患儿发生1 次或1 次以上病原菌感染,其中最常见的是肝移植术后肺炎44 例,其次为腹腔感染18 例,脓毒症或脓毒性休克15 例,其他包括导尿管相关尿路感染、血管导管相关血流感染及手术部位感染等,2个及2个以上部位感染有22例,部分病例呈现出多部位、多菌种感染特点。但感染病原菌分布与上述报道的不同,常见为屎肠球菌、肺炎克雷伯菌、鲍曼不动杆菌及嗜麦芽窄食单胞菌。CHRISTIAN 等[13]报道,345 例儿童肝移植术后细菌感染中127 例出现脓毒症,占54%,常见于手术部位感染、血流感染、呼吸道感染及尿路感染,多重耐药菌占20%。本研究中有15 例患儿出现脓毒症或脓毒性休克,均为多部位混合感染。
本研究对常见细菌进行耐药分析发现,屎肠球菌对氨苄西林、苄青霉素耐药率为100%,对庆大霉素耐药率超过60%,表皮葡萄球菌对红霉素、苄青霉素、四环素100%耐药,均对利奈唑胺、替加环素及万古霉素保持敏感,未发现对以上三种抗生素耐药者。鲍曼不动杆菌对大多数抗生素耐药均在70%以上,对复方新诺明耐药率达100%,嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药,对头孢他啶、左氧氟沙星、复方新诺明仍较敏感。本研究中12株多重耐药鲍曼不动杆菌,药敏提示仅对多黏菌素及替加环素敏感,其余常用抗生素均耐药。多重耐药菌的出现加大了抗菌药物选择的难度,使得部分患儿呼吸使用时间延长、PICU 住院时间延长,增加治疗费用。本研究共检出CRE 4 株,其中产气克雷伯菌2 株、肺炎克雷伯菌1 株、大肠埃希菌1 株,药敏结果提示对厄他培南、美罗培南及亚胺培南均耐药。研究显示,儿童肝移植术后感染多重耐药菌及CRE 是影响预后的重要因素[14]。孙雁等[15]报道,286 例儿童肝移植术后CRE 感染率为7.3%,腹腔是肝移植术后感染的好发部位,占95.2%。CRE 感染的独立影响因素包括术前CRE 感染、入ICU 前CRE 定植、术后ICU 治疗时间[12,16]。针对多重耐药菌及CRE 的治疗,相关文献推荐根据药敏选择抗生素,同时予大剂量、联合用药[17-18],取得一定的疗效,同时指出新型酶抑制剂复合制剂CAZ-AVI在控制CRKP 感染方面疗效显著。本研究中4例CRE感染患儿给予美罗培南或亚胺培南联合替加环素治疗,其中3 例感染控制,1 例因感染加重死亡。儿童肝移植术后有很高的感染风险,高感染率增加死亡风险,特别是出现脓毒症、严重脓毒症及脓毒症休克患儿。应及时制定有效的防治策略,例如制定有效的围手术期抗生素预防、术后感染早期诊断和有效的治疗细菌及真菌感染,从而遏制感染的进一步发展。
本研究对我院肝移植术患儿术后早期细菌感染的分布和耐药情况进行分析,结果表明儿童肝移植术后早期易出现感染,病原菌以细菌为主,革兰阳性菌及革兰阴性菌比例相近,感染来源多见于呼吸道感染、腹腔感染及导管相关性感染。这也为今后肝移植术后抗菌药物选择提供一些的参考资料。但是,由于研究周期短,试验条件有限,对于感染高风险人群,是否进行预防性治疗,预防性治疗与确诊后治疗的效果比较,儿童细菌感染的治疗方案选择等方面的研究,仍需要扩大样本量,长期随访、进一步的随机对照研究来实现。

