个体化减重干预对肥胖合并T2DM患者体质量指数、糖脂代谢的影响
谭琼琼,杨丽,朱玲棣,张小青,王晓桂
(连云港第一人民医院,江苏连云港 222000)
2 型糖尿病(type 2 diabetes mellitus, T2DM)是三大基础疾病之一,目前估计全球已有超过4 亿患者,我国占比最高,且有研究估计超过50%的糖尿病患者未确诊[1-2]。我国流行病学调查资料显示,成人T2DM 的患病率已达10.4%,并仍在增加[3]。肥胖是T2DM 患者常见的危险因素,肥胖合并T2DM患者常伴有胰岛素抵抗、糖耐量下降、高胰岛素血症等表现,体质量指数(BMI)居高不下,且糖脂代谢严重紊乱[4]。临床上针对肥胖合并T2DM 患者常采用饮食、运动干预配合药物治疗,虽有一定降糖作用,但对糖脂代谢的控制效果不甚理想[5]。个体化减重干预是根据患者的病情特点和基本情况实施的具有较强针对性的、个体化特征的减重管理,目的在于控制患者的体重、增强体质、改善糖脂代谢状态。但个体化减重干预的实施和实践效果仍需进一步探讨。本研究重点探讨个体化减重干预的操作方法和实践效果,以期为此类患者提供一种临床可行的操作方案。
1 资料与方法
1.1 一般资料
选取2019年1月—2019年12月连云港第一人民医院收治的肥胖合并T2DM 患者90 例,采用随机数字表法分为对照组和观察组,每组45 例。对照组男性21 例,女性24 例;年龄35~65 岁,平均(50.52±5.61)岁; BMI 25.6~33.7 kg/m2, 平均(28.75±2.02)kg/m2;Ⅰ度肥胖(25 kg/m2<BMI<30 kg/m2)29 例,Ⅱ度肥胖(BMI ≥30 kg/m2)16 例;T2DM 家族史12 例。观察组男性19 例,女性26 例;年龄32~63 岁,平均(49.89±6.05)岁;BMI 25.4~33.9 kg/m2,平均(28.68±2.11)kg/m2;其中,Ⅰ度肥胖27 例,Ⅱ度肥胖18 例;T2DM 家族史14 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①BMI ≥25 kg/m2,确诊为T2DM[6];②初诊患者;③年龄≤65 岁,有运动能力。排除标准:①伴有其他类型基础疾病,如高血压、高脂血症等;②伴有心脑血管病;③妊娠期或哺乳期;④长期服用激素或其他可能影响代谢的药物;⑤有运动障碍、消化吸收障碍;⑥伴有T2DM 相关并发症;⑦存在其他急慢性疾病,如恶性肿瘤、血液系统、神经系统、生殖系统等疾病。本研究经医院医学伦理委员会审核批准,患者及家属均知情并签署知情同意书。
1.2 治疗方法
两组均给予常规降糖药物治疗,即二甲双胍(山东健康药业有限公司,国药准字H10983056,规格:0.25 g)口服,250 mg/次,3 次/d;每晚10 点皮下注射利拉鲁肽[诺和诺德(中国)制药有限公司,国药准字J20160037,规格:3 mL∶18 mg],初始剂量0.6 mg/d,1 周后可增加至1.2~1.8 mg,1 次/d;血糖控制目标值:空腹血糖(FBG)为4.5~7.0 mmol/L,餐后2 小时血糖(2 hPG)<10.0 mmol/L,可视情况停止使用利拉鲁肽或减量。持续治疗3个月。
对照组给予基础饮食和运动干预,提醒患者注意禁止食用高热量、高糖分、高脂肪含量的食物,如油炸食品、糖块、蜜饯、冰淇淋、地瓜、土豆、肥肉等,鼓励食用膳食纤维含量高、升糖指数低的蔬菜和水果等,如玉米面、荞麦面、西红柿、黄瓜、芹菜、柚子、猕猴桃等;提醒患者加强运动锻炼,包括快速行走、慢跑、打太极拳等,5 次/周,60 min/次,建议在饭后1~1.5 h 进行锻炼。持续干预3 个月。
观察组给予个体化减重干预。①饮食和营养干预。请专业的营养师为每位患者制作个体化的膳食食谱,大致为:早餐稀豆浆150 mL+煮鸡蛋1 个+膳食纤维冲剂5 g,午餐营养棒1 根(56 g,饭前食用,碳水化合物26 g)+蔬菜(130±20)g+瘦肉(120±30)g+营养素补充剂15 g(包含各种维生素及其他所需营养素);晚餐营养棒1 根(56 g,饭前食用,碳水化合物26 g)+蔬菜(130±20)g+瘦肉(120±30)g+膳食纤维冲剂5 g+营养素补充剂15 g(包含各种维生素及其他所需营养素),每天摄入食物的热量控制在5 442~6 697 kJ,若出现饥饿感可少量食用水煮青菜、营养棒等。持续干预3 个月。②运动干预。根据患者的肥胖程度予以干预。其中,Ⅰ度肥胖患者选择中等强度运动,如慢跑,5 次/周,60 min/次,运动时最大耗氧量为40%~60%,运动中脉率=基础脉搏+(运动中最大脉率-基础脉搏)×(40%~60%),最大脉率=210-年龄,佩戴运动手环,自测桡动脉脉搏,达到该强度后坚持20~30 min;Ⅱ度肥胖患者选择中等强度+高强度运动,如慢跑+跳绳方式,最初1 个月慢跑45 min+跳绳15 min,此后慢跑30 min+跳绳30 min,慢跑要求达到上述强度,跳绳要求达到运动中脉率=170-年龄,相当于最大耗氧量的60%,佩戴运动手环自测运动强度,5 次/周,60 min/次,运动过程中患者可视情况每20 min 休息5 min。持续干预3 个月。③生活作息干预:对患者实施个体化的心理和情绪疏导,每个月1 次,鼓励其保持积极乐观的态度面对自身病情和生活,多参加户外活动,培养生活爱好,适当转移注意力,拥有健康的心理状态;引导患者制订个体化的生活计划表,要求养成规律的生活和作息习惯,早睡早起,每晚睡眠时间8~8.5 h,中午午休0.5~1 h,多饮用温开水,多关注和学习健康养生知识。
1.3 检测糖、脂代谢指标
抽取两组患者治疗前、治疗1个月后、治疗2 个月后、治疗3 个月后的空腹静脉血5 mL,3 000 r/min离心10 min,取上清液待测。采用日本ARKRAY 公司生产的HA8180 型全自动血糖仪,FBG、2 hPG、糖化血红蛋白(HbA1c)分别用葡萄糖氧化酶法和微注法进行检测,空腹胰岛素采用免疫检测方法进行检测,试剂盒均购自上海生工生物工程有限公司;胰岛素抵抗指数(HOMA-IR)采用稳态模型评估法(HOMA)计算,HOMA-IR=空腹胰岛素(FINS)×FBG/22.5。抽取两组患者治疗前、治疗1 个月后、治疗2 个月后、治疗3 个月后时空腹静脉血5 mL,3 000 r/min 离心10 min,取上清液待测。采用美国PTS 公司Cardio Chek PA 型全自动血脂检测仪,采用酶比色法定量测定甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平,试剂盒购自安诺伦(北京)生物科技有限公司。
1.4 观察指标
利拉鲁肽用药剂量,治疗前、治疗1 个月后、治疗2 个月后、治疗3 个月后患者的BMI,糖、脂代谢指标,治疗期间不良事件(包括低血糖、酮症酸中毒等)发生率。
1.5 质量控制
为保证本研究质量,特采取以下质量控制措施:①每天均要求参与本研究的患者通过微信平台或者电话沟通上报个人情况,若未按照方法操作则视为自动退出本研究;②天气剧变或不适宜户外运动的情况下采用同等强度的室内运动替代方案;③每个月复诊1 次,以便医务人员全面了解患者病情的动态变化和基本情况;④佩戴运动手环的患者要求每天运动后拍照或拍短视频通过微信平台发送给医务人员确保达到规定的运动强度,未佩戴运动手环的患者则由家属监督,确保按照治疗方法操作;⑤提醒患者明确本研究的重要性,使患者能够诚实、守信、上报实况。
1.6 统计学方法
数据分析采用SPSS 22.0 统计学软件。计量资料以均数±标准差(±s)表示,比较采用t检验或重复测量设计的方差分析;计数资料构成比或率(%)表示,比较采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
观察组有3 例未坚持完成运动干预、2 例未坚持完成饮食和营养干预;对照组有4 例未坚持完成运动干预、2 例未坚持完成饮食和营养干预、2 例出现T2DM 相关并发症(1 例肾损害、1 例酮症酸中毒)。均退出本研究。
2.1 两组利拉鲁肽用药剂量比较
观察组利拉鲁肽用药剂量为(55.50±10.25)mg,对照组利拉鲁肽用药剂量为(56.75±9.63)mg,两组比较,差异无统计学意义(t=0.550,P=0.584)。
2.2 两组BMI比较
观察组与对照组治疗前、治疗1 个月后、治疗2 个月后、治疗3 个月后的BMI 比较,采用重复测量设计的方差分析,结果:①不同时间点的BMI 有差异(F=6.827,P=0.014);②两组的BMI 有差异(F=5.146,P=0.021),观察组低于对照组;③两组的BMI变化趋势有差异(F=6.144,P=0.018)。见表1和图1。
表1 两组治疗前、治疗1个月后、治疗2个月后、治疗3个月后BMI比较 (kg/m2,±s)

表1 两组治疗前、治疗1个月后、治疗2个月后、治疗3个月后BMI比较 (kg/m2,±s)
注:①与对照组比较,P <0.05;②与治疗前比较,P <0.05;③与治疗1个月后比较,P <0.05;④与治疗2个月后比较,P <0.05。
组别观察组对照组治疗3个月后22.05±1.43①②③④24.09±1.52②③④n 40 37治疗前28.52±2.07 28.40±2.05治疗1个月后26.04±1.69①②27.10±1.85②治疗2个月后24.01±1.58①②③25.97±1.64②③
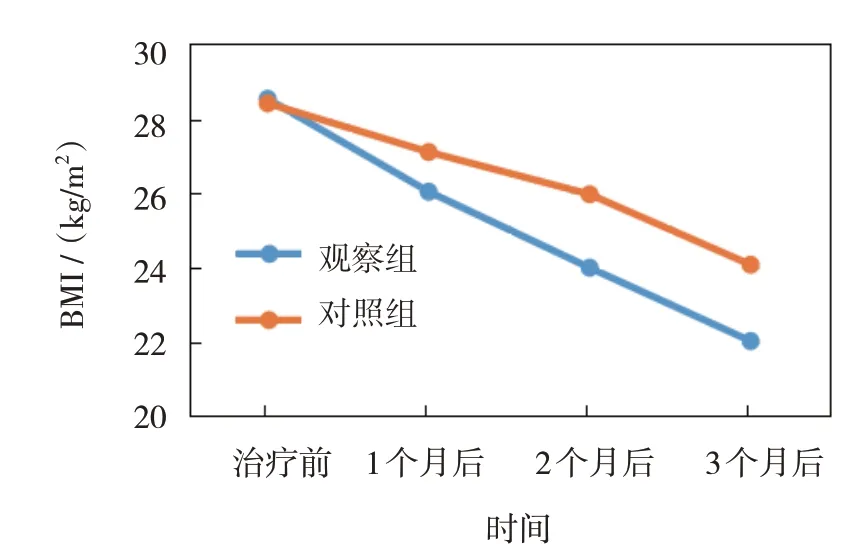
图1 两组不同时间点的BMI变化趋势
2.3 两组糖代谢指标比较
观察组与对照组治疗前、治疗1 个月后、治疗2 个月后、治疗3 个月后的FBG、2 hPG、HbA1c、HOMA-IR 比较,采用重复测量设计的方差分析,结果:①不同时间点的FBG、2 hPG、HbA1c、HOMA-IR 有差异(F=7.103、 6.178、 8.905 和11.382,P=0.007、0.012、0.004 和0.001);②两组的FBG、2 hPG、HbA1c、HOMA-IR 有差异(F=4.862、 3.169、 5.179 和7.305,P=0.025、 0.043、0.022 和0.009),观察组均低于对照组;③两组的FBG、2 hPG、HbA1c、HOMA-IR 变化趋势有差异(F=5.061、 5.140、 6.771 和10.097,P=0.018、0.028、0.011 和0.003)。见表2和图2~5。
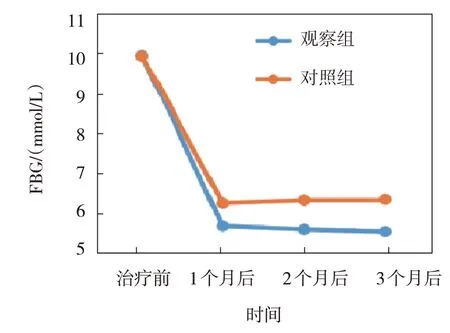
图2 两组FBG不同时间点的变化趋势
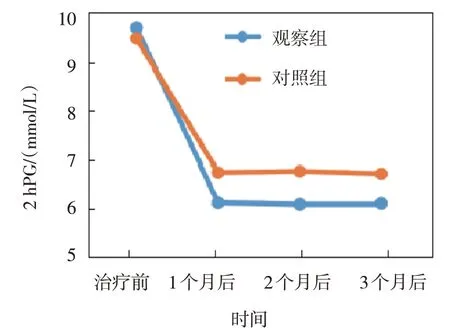
图3 两组2 hPG不同时间点的变化趋势
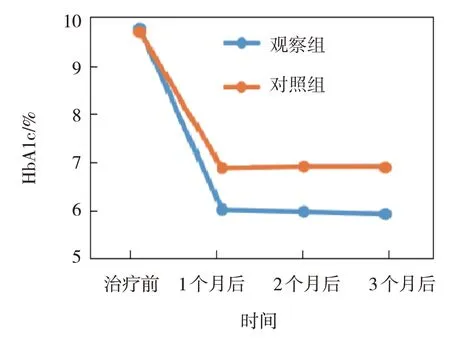
图4 两组HbA1c不同时间点的变化趋势
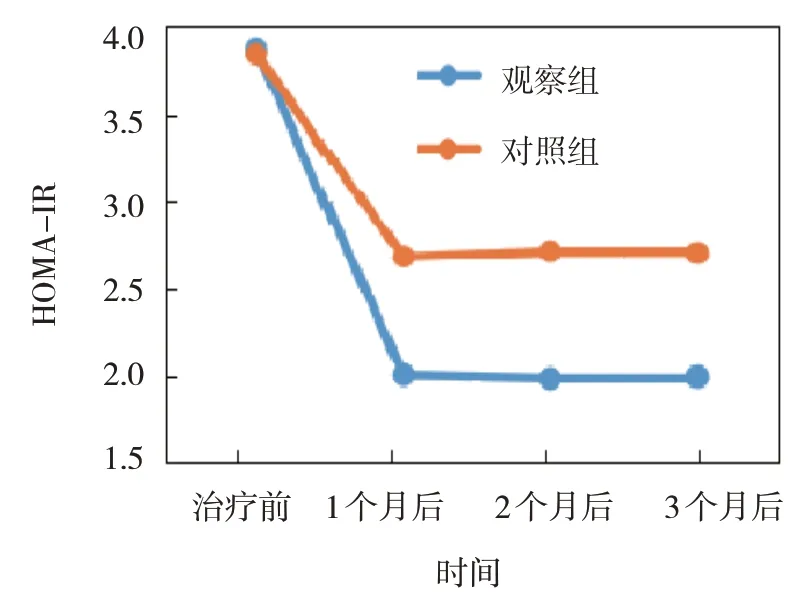
图5 两组HOMA-IR不同时间点的变化趋势
表2 两组治疗前、治疗1个月后、治疗2个月后、治疗3个月后的糖代谢指标比较 (±s)
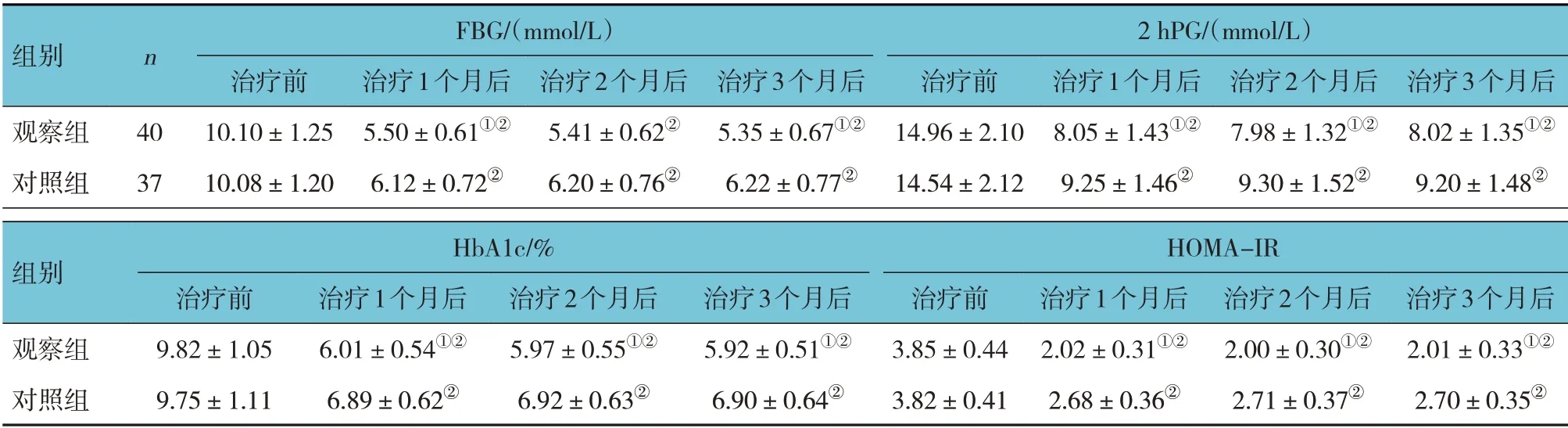
表2 两组治疗前、治疗1个月后、治疗2个月后、治疗3个月后的糖代谢指标比较 (±s)
注:①与对照组比较,P <0.05;②与治疗前比较,P <0.05。
FBG/(mmol/L)2 hPG/(mmol/L)组别n观察组对照组40 37治疗前10.10±1.25 10.08±1.20治疗1个月后5.50±0.61①②6.12±0.72②治疗2个月后5.41±0.62②6.20±0.76②治疗3个月后5.35±0.67①②6.22±0.77②治疗前14.96±2.10 14.54±2.12治疗1个月后8.05±1.43①②9.25±1.46②治疗2个月后7.98±1.32①②9.30±1.52②治疗3个月后8.02±1.35①②9.20±1.48②组别HbA1c/%HOMA-IR观察组对照组治疗3个月后2.01±0.33①②2.70±0.35②治疗前9.82±1.05 9.75±1.11治疗1个月后6.01±0.54①②6.89±0.62②治疗2个月后5.97±0.55①②6.92±0.63②治疗3个月后5.92±0.51①②6.90±0.64②治疗前3.85±0.44 3.82±0.41治疗1个月后2.02±0.31①②2.68±0.36②治疗2个月后2.00±0.30①②2.71±0.37②
2.4 两组脂代谢指标比较
观察组与对照组治疗前、治疗1 个月后、治疗2 个月后、治疗3 个月后的TC、TG、LDL-C、HDL-C 比较,采用重复测量设计的方差分析,结果:①不同时间点的TC、TG、LDL-C、HDL-C 有差异(F=5.106、5.283、7.591 和7.026,P=0.002、0.020、0.008 和0.010);②两组的TC、TG、LDL-C、HDL-C有差异(F=3.894、3.046、4.697 和4.782,P=0.043、0.045、0.020 和0.019),观察组的TC、TG、LDL-C 均低于对照组,HDL-C 高于对照组;③两组的TC、TG、LDL-C、HDL-C 变化趋势有差异(F=4.325、 4.606、 6.402 和6.838,P=0.030、 0.029、0.012 和0.011)。见表3和图6~9。
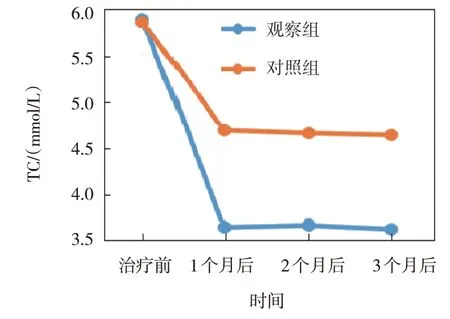
图6 两组TC不同时间点的变化趋势
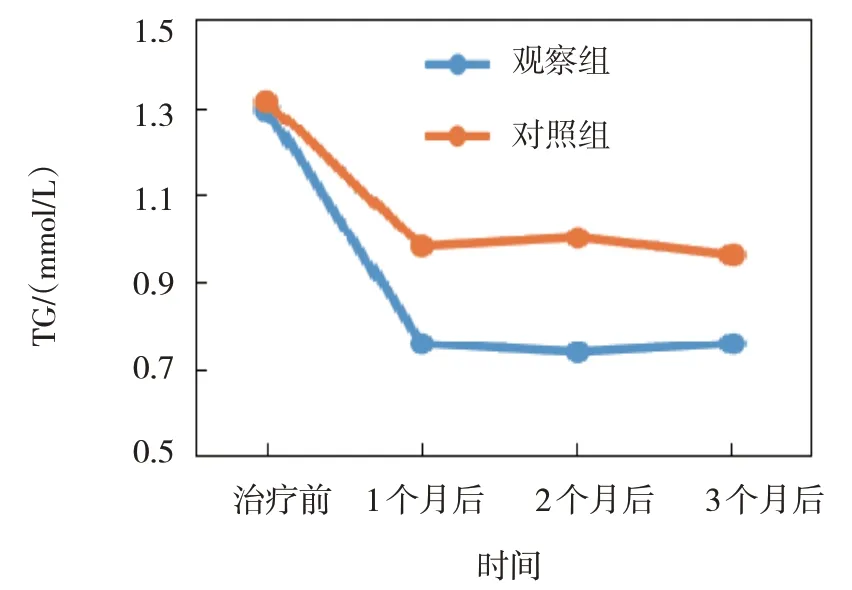
图7 两组TG不同时间点的变化趋势
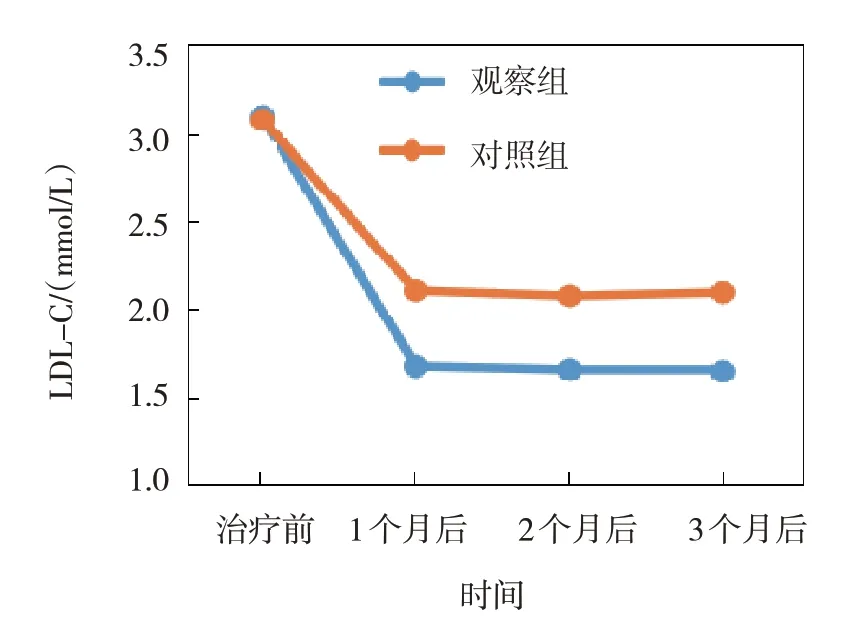
图8 两组LDL-C不同时间点的变化趋势

图9 两组HDL-C不同时间点的变化趋势
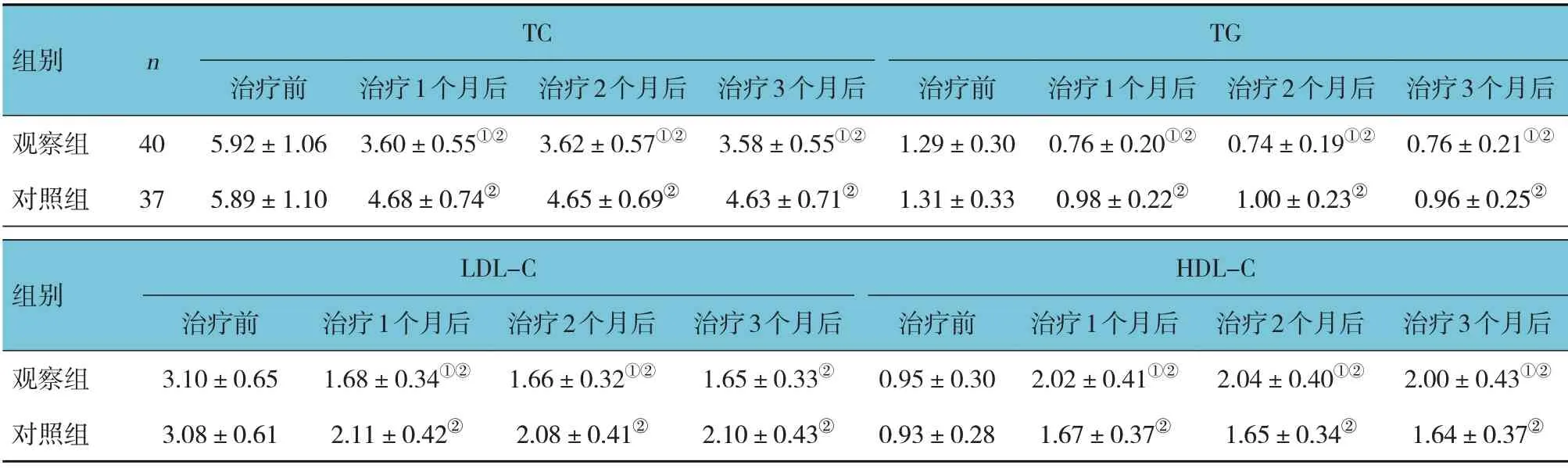
表3 两组治疗前、治疗1个月后、治疗2个月后、治疗3个月后的脂代谢指标比较 (x±s,mmol/L)
2.5 两组不良事件发生率比较
观察组有2 例低血糖经临时加餐、进水果糖处理后好转,未发生昏迷或酮症酸中毒等严重不良事件,不良事件发生率为5.00%(2/40);对照组无不良事件,不良事件发生率为0.00%(0/37)。两组不良事件发生率比较,采用Fisher′s 精确概率法,差异无统计学意义(P=0.458)。
3 讨论
随着人们生活条件的提高和生活压力的增大,肥胖、T2DM 等基础疾病的发病率也越来越高,不仅影响患者的形体美观和身体健康,还对其身体健康产生极大的威胁。研究指出[7],机体BMI 与糖脂代谢有密切关系,而肥胖合并T2DM 患者不仅BMI 偏高、糖代谢紊乱,也有部分患者存在脂代谢紊乱的情况,因此需采取有效的措施控制患者的BMI,调节其糖脂代谢。近年来随着医疗技术的发展,各种减肥药物层出不穷,但许多肥胖患者收效甚微[8-9]。因而探讨高效、安全,符合肥胖合并T2DM 患者个体化减重需求的干预策略至关重要。
节食和运动是目前公认的减重手段[10]。本研究发现,两组患者利拉鲁肽用药剂量相近,提示可比性强。两组BMI 和糖、脂代谢指标比较结果显示,BMI 随着时间的延长逐渐降低,且治疗1 个月后、2 个月后和3 个月后观察组BMI 均低于对照组,提示对肥胖合并T2DM 患者采用常规干预方法可控制BMI,但采用个体化减重干预策略的效果更佳;治疗1 个月后、2 个月后和3 个月后两组各项指标均较治疗前改善,且观察组均优于对照组,提示对肥胖合并T2DM 患者采用个体化减重干预还可调节糖脂代谢,且其作用明显优于常规干预方案。个体化减重干预包括饮食和营养干预、运动干预、生活作息干预,饮食和营养干预既可达到节食减重的目的,又兼顾患者对营养物质的需求,确保营养全面、充足,为正常的代谢和生理活动提供必需的营养,避免营养过剩,减少糖分向脂肪的转化;运动干预主要是根据患者的肥胖程度制订的具有个体化特征的运动处方,确保每位患者均能够达到理想的运动强度,增强体质,加速燃脂,加快新陈代谢,减轻机体负荷,从而降低BMI,改善糖脂代谢状态;生活作息干预可帮助患者保持健康的情绪状态,积极乐观面对生活和病情,更好地依从和配合医务人员的工作,还可促使其养成良好的、健康的、有规律的生活习惯,促使机体向全面健康的状态发展。既往报道指出[11],个体化营养干预对肥胖合并T2DM 患者作用重大,是控制BMI、改善糖脂代谢的重要措施;也有报道肯定了运动处方在肥胖合并T2DM 患者中的积极作用[12]。
本研究根据患者的病情特点制订并实施个体化减重干预,充分利用饮食和营养干预、运动干预和生活作息干预的优势,三者相互结合,共同发挥作用,因而患者的BMI、糖脂代谢指标均可得到显著改善。
与常规饮食、运动干预方法相比,个体化减重干预内容更为细致,更具科学性,并且也全面考虑到了肥胖合并T2DM 患者的病情特点和干预需求,是一种健康、科学、合理的干预策略。该方法具有针对性和个体化特征,能够确保每位患者均得到符合自身状况的干预指导和管理,并且在干预过程中要求患者按时上报自身状况,佩戴运动手环以监测自身的运动强度,定期予以心理支持和健康指导,也能够确保患者依从和配合,因而该方案的实施可达到理想的成效。但是近年来有研究指出[13],肥胖有多种分类,肥胖合并T2DM的发病机制和临床特征也较为复杂,如何对不同分类、不同发病机制和临床特征的患者予以个体化减重干预仍需要进一步探讨。
本研究中两组不良事件发生率接近,提示个体化减重干预并不会增加肥胖合并T2DM 患者不良事件的发生风险,有一定的安全性。
综上所述,与常规干预方法相比,个体化减重干预有助于持续控制肥胖合并T2DM 患者的BMI,还可调节糖脂代谢并将其水平维持在理想范围,效果更佳,值得推广。但本研究仍存在明显不足:应进一步探讨不同肥胖类型、不同发病机制和临床特征的肥胖合并T2DM 患者的个体化减重干预策略,更好提升干预效果。

