乳腺发育与乳腺干细胞的分子调控
张领衔,蔡车国
(武汉大学医学研究院,湖北 武汉 430071)
乳腺作为哺乳动物特有的器官,其主要功能是分泌乳汁滋养后代.与其他器官相比,乳腺的独特之处在于它是一个出生后发育的腺体器官.乳腺出生后发育的特点使得研究乳腺发育比研究其他器官发育更加便利和有效,也使得乳腺成为研究成体干细胞功能和行为的优良模型.小鼠乳腺的发育有3个主要阶段:胚胎期、青春期和生殖周期.发育期间,乳腺细胞的增殖、分化与凋亡导致乳腺结构发生重塑.成体乳腺由多种细胞组成,包括上皮细胞、脂肪细胞、成纤维细胞、免疫细胞、淋巴细胞和血管细胞等,它们以一种动态相互作用的方式共同调节乳腺的发育,塑造和维持乳腺的功能.
乳腺导管周期性的变化显示乳腺上皮细胞具有强大的再生潜力,乳腺导管能够经历许多生长和退化的周期,暗示乳腺上皮中存在着乳腺干细胞(MaSC).科学家们先后通过体内移植和谱系追踪实验等发现了一些MaSC特异的分子标记(如Lgr5、Axin2、Procr、Bcl11b、Dll1等[1-5]),并对这些分子标记与单潜能或多潜能干细胞的关系进行了探讨.乳腺发育和MaSC的干性维持是一个复杂的、受到精准调控的过程,其中Wnt、Notch、Hedgehog、Hippo等关键信号通路及其交叉作用共同决定了MaSC的特性.
目前乳腺癌是妇女中发病率最高的癌症,也是对人类健康造成巨大威胁的癌症之一[6].有研究认为乳腺癌是一种干细胞相关疾病,即癌细胞拥有的类似干细胞特征导致了肿瘤的发生[7].乳腺癌干细胞(BCSC)来自MaSC的观点也逐渐被研究者认可[8].因此,了解MaSC的分子调控机制对乳腺发育的研究和乳腺癌的研究都具有重要意义.
1 乳腺的发育
1.1 胚胎期
小鼠的乳腺形态发生始于胚胎期E10.5 d,外胚层向外扩张先在两侧形成外胚层来源的乳腺线,细胞从前端向后端延伸[9].到胚胎期E11.5 d,外胚层细胞沿着乳腺线向特定位置的迁移和聚集逐渐产生5对被称为基板的多层结构[10].基板随后内陷于下方的间充质中,形成乳腺上皮芽结构,上皮芽继续下沉并形成连接乳腺芽和表皮的柄.随后上皮芽周围的间充质细胞浓缩并分化形成一层由致密的成纤维细胞组成的乳腺间充质.间充质分泌的各种因子对乳腺线上的细胞有着非常重要的影响,可刺激这些细胞向乳腺上皮细胞谱系分化.在胚胎期E15.5 d时,上皮芽开始增殖并延伸到由脂肪细胞前体组成的脂肪垫前体中.此时,导管分枝形态发生过程起始,形成由主导管和10~15个次级分枝组成的初级导管树,该结构从出生时就存在,直到青春期前基本保持静息状态[9].
1.2 青春期
青春期起始时,在激素和生长因子的作用下,导管开始大量延伸并形成分枝,并在整个脂肪垫形成复杂的上皮导管树.乳腺末端芽结构(TEB)是乳腺导管在青春期特有的棒状结构,其位于乳腺导管尖端,是乳腺细胞增殖的主要场所.TEB由两种不同类型的细胞组成:复合型内层由中央体细胞构成,最终分化为管腔上皮细胞;外层由单层的帽细胞构成,最终分化为肌上皮细胞.帽细胞在形态上并未分化,暗示帽细胞中可能包含能产生肌上皮细胞和管腔细胞的祖细胞[11].高度增殖的TEB结构引领着乳腺导管在脂肪垫中向前延伸,TEB的分叉产生初级导管,TEB内的中央体细胞则走向凋亡而形成管腔结构;这一过程需要细胞在增殖和凋亡之间实现动态平衡,一旦导管延伸到乳腺脂肪垫的边界,TEB结构就会消失[12].一个完全发育的上皮导管树包括初级导管、次级分枝以及填充导管间隙的侧向三级分枝.
1.3 生殖周期
在成体乳腺保持稳态期间,导管形态在每个生殖周期时又会发生变化.周期性的增殖和分化会产生侧枝(三级分枝)以及在生殖周期中不断产生和消退的腺泡结构[13].该腺泡结构会在妊娠的刺激下进一步发育和分化:乳腺结构在孕期时会发生明显改变,最终会在孕晚期形成泌乳细胞,其主要功能是合成和分泌乳汁.乳腺在孕期的形态变化主要是由孕激素和催乳素(prolactin,Prl)引起的[14-15].孕初期,在孕激素诱导下乳腺细胞大量增殖,导管树形成大量次级分枝和三级分枝.孕中期,孕激素和Prl协同调控腺泡的发育,腺泡细胞的增殖能力减弱,逐渐向泌乳的细胞谱系分化;同时,血管发生时形成的毛细血管网络将腺泡结构包围起来[16].在此期间也会发生大量的间质重塑,因此,由于腺泡结构的扩大,到妊娠后期脂肪组织会被高度挤压[17].脂肪细胞在生殖周期中不会再生,而是通过现有脂肪细胞的肥大进行扩张[18].在孕晚期的泌乳阶段,乳清酸性蛋白和α-乳清蛋白的表达显著上升,脂滴开始形成[19].断奶后乳腺会经历另一个剧烈重塑期,在退化期腺泡结构会大量凋亡,上皮导管树会恢复到与未受孕小鼠乳腺相似但不相同的状态.在一系列严格的调控下,80%小鼠乳腺上皮细胞会在3 d内消失.在小鼠中,退化期的第一阶段主要受局部信号的调节,而退化期的第二阶段受全身激素的调节[20].图1显示了小鼠出生后乳腺上皮的发育过程.总体而言,乳腺发育过程是组织重塑的典型例子,这些动态变化使得乳腺上皮细胞在整个生命周期中不断调整以满足生理需求.

出生(newborn)后3周,乳腺导管在雌激素(estrogen,E)作用下开始形态发生;青春期(puberty)到成年期(adult),小鼠乳腺导管侧分枝的形成主要受孕酮(progesterone,Pg)的调节;孕期(pregnancy),E、Pg和Prl共同作用促进腺泡细胞的扩增;孕晚期及泌乳期(lactation),Prl主要促进乳汁的分泌;泌乳期结束,小鼠乳腺进入退化期(involution),导管恢复未受孕时的静息状态.
2 乳腺导管微环境
2.1 上皮细胞
乳腺中有多种类型的上皮细胞.小鼠乳腺导管是一个双层结构,由管腔上皮细胞层和与基底膜接触的基底细胞层组成.管腔细胞表达角蛋白8(K8)和K18,而基底细胞表达K5、K14以及调节其收缩功能的平滑肌肌动蛋白.在青春期和孕期,一些独特的细胞类型与乳腺的功能密切相关.例如在青春期,构成TEB的帽细胞和体细胞都是特化的上皮细胞.帽细胞排列在芽末端,形成一个帽状结构的薄基底层,与周围的基质接触,随后帽细胞会分化为肌上皮细胞并形成一个更厚的基底层[21];体细胞则填充满TEB的内部,中央的体细胞随后会凋亡形成管腔,剩余的体细胞则分化为管腔上皮细胞[22].在孕期,管腔细胞会迅速扩增并分化形成腺泡结构,以备泌乳.
2.2 脂肪细胞
成体脂肪垫和非哺乳期脂肪垫基质中很大一部分由脂肪细胞构成.在胚胎期E14 d时出现致密的脂肪垫前体,随着胚胎的发育,形成在出生后2~3 d可以观察到的白色脂肪组织.在孕期和哺乳期,脂肪细胞的油脂含量下降,这表明脂肪参与了泌乳的代谢过程[17,23].脂肪细胞还在乳腺中发挥内分泌功能,可以调控乳腺上皮细胞的发育和功能,并能够与乳腺中其他类型细胞进行联系[17,24].例如,脂肪细胞可以分泌血管内皮生长因子(VEGF)来调控乳腺中的血管生成[25].
2.3 成纤维细胞
成纤维细胞嵌入脂肪垫中,与上皮导管树的基底侧非常接近[26].成纤维细胞行使多种功能,其中之一是在分枝形态发生过程中与上皮细胞进行双向交流,为乳腺上皮细胞提供生长因子、蛋白酶和其他元素[27].体内和体外研究表明,成纤维细胞对于脂肪垫中乳腺上皮细胞的存活和形态发生都非常重要[28-30].此外,成纤维细胞参与合成许多细胞外基质成分,如胶原蛋白、蛋白多糖和纤维连接蛋白;成纤维细胞还可以合成许多酶,如基质金属蛋白酶(MMP),MMP不仅能够降解细胞外基质,还能够释放出包被在细胞外基质中的生长因子和细胞因子,从而影响细胞和组织的功能[31-32].因此,成纤维细胞可以通过改变细胞外基质的组成成分或致密程度来调控上皮细胞特征和上皮癌表型[33].
2.4 血管和免疫细胞
乳腺导管同大量的血管网和淋巴网一起嵌入脂肪垫中.在青春期乳腺形态发生期间,淋巴网络、乳腺上皮树和血管系统有着密切联系.乳腺的淋巴管生成是由肌上皮来源的血管上皮生长因子VEGF-C和/或VEGF-D驱动的[34].免疫细胞,如巨噬细胞和嗜酸性粒细胞,对于分枝形态的发生也非常重要.这些免疫细胞会被招募到上皮的分枝尖端,调控乳腺导管对脂肪垫的入侵[35].巨噬细胞对于退化期上皮细胞的凋亡和脂肪细胞的重建非常重要[36].肥大细胞通过丝氨酸蛋白酶的活化和去颗粒作用,参与青春期乳腺的分枝形成;在退化期,肥大细胞会积累并活化血浆激肽释放酶来激活纤溶酶原级联反应[37-38].
3 MaSC的发现
3.1 乳腺基底细胞群的谱系追踪
体内、体外的试验证据表明,乳腺的分化是一个层级递进的过程,起始于一群具有自我更新潜能的干细胞.单个多潜能干细胞分化形成的后代足以重塑功能性乳腺,且再生乳腺中干细胞的自我更新能力并不会衰减[39].此前的研究发现利用特异的细胞表面分子标记Lineage(包括CD31、CD45和TER119)、热稳定抗原(CD24)和β1-整合素(CD29)能够区分小鼠乳腺上皮细胞的不同类群.通过流式细胞仪分选,先将表达CD31的内皮细胞和表达CD45、TER119的造血细胞这些非谱系细胞去除,再根据CD24和CD29表达的高低区分开乳腺上皮细胞的基底层细胞(Lin-CD24+CD29high)和管腔细胞(Lin-CD24+CD29low);并通过移植实验发现乳腺上皮的基底层细胞中存在多潜能MaSC,能够在体内再生成为完整的乳腺,包含所有乳腺分化细胞类型[40-41].
既然翻译是完成人与人之间的交际,那么人际性和社会性也是翻译必不可少的性质。一般翻译理论认为翻译涉及三方面的参与者:原文作者、译者、译文接收者(读者或听众)。功能派还加入了翻译过程的发起者,译文使用者和收受者等其他参与方(仲伟合等,1999)。在翻译这个互动系统中,各方面互相联系、影响。例如:
然而,乳腺的基底细胞包括干细胞、祖细胞和终末分化的肌上皮细胞等多种细胞类型,存在很强的异质性,导致乳腺重建成功率较低;且体外移植实验模拟的是一种再生状态,在特定而非正常生理环境下考察MaSC的分化潜能.因此,科学家们随后通过细胞谱系追踪的方法在乳腺的正常发育过程中鉴定多潜能干细胞的类群,考察是否由多潜能干细胞负责乳腺上皮的发育及成体乳腺上皮层级的维持.2011年,Blanpain团队利用诱导型谱系追踪小鼠K14-rtTA/TetO-Cre/Rosa-YFP来考察K14标记的基底细胞中是否存在多潜能干细胞,发现基底细胞形成的后代细胞只有基底细胞而没有管腔细胞;同样利用K8-CreER/Rosa-YFP小鼠发现K8标记的管腔细胞中含有管腔干细胞,其后代仍为管腔细胞,因而认为小鼠出生后的乳腺中并不存在多潜能干细胞,只存在单潜能干细胞[1].而在2014年,Visvader团队利用随机多色Cre报告系统K5-rtTA/TetO-Cre/R26R-Confetti谱系追踪小鼠,证明K5标记的基底细胞能形成两种乳腺上皮细胞谱系,利用K14-CreERT2/R26R-Confetti小鼠也得到相同的结论,因而证明了多潜能MaSC的存在[42].
除对K14或K5标记的所有基底细胞进行谱系追踪外,也有研究对Lgr5+或Axin2+的基底细胞亚群进行谱系追踪.在2011年,Blanpain团队利用Lgr5-GFP-CreER/Rosa-Tomato小鼠对Lgr5标记的一小群基底细胞进行谱系追踪,发现其后代只存在于基底细胞中[1].在2012年,Nusse团队利用Axin2CreERT2/+R26RlacZ/+以及Axin2CreERT2/+R26RmTmG/+小鼠,证明对Wnt/β-连环蛋白(β-catenin)信号响应的干细胞所形成的后代也仅限于基底细胞谱系[2].以上研究证明Lgr5+或Axin2+细胞是单潜能干细胞,而乳腺上皮细胞谱系最前端是否存在多潜能干细胞这一疑问亟待解答.
3.2 MaSC分子标记的发现
Wnt信号通路在乳腺发育的各个阶段发挥重要作用.Nusse团队的研究工作表明,在体外3D培养体系中添加Wnt3A蛋白可以促进MaSC的克隆形成,实现克隆的传代扩增和干性维持,从而建立了MaSC体外培养体系[43].基于Wnt信号通路对MaSC干性维持的关键作用以及MaSC体外培养系统,通过筛选MaSC中Wnt信号通路的靶基因中发挥干性维持作用的基因,中国科学院生化细胞所曾艺团队在2014年找到蛋白C受体(Procr),并证明Procr标记的是一群多潜能小鼠MaSC[3].
Procr是一个单次跨膜蛋白,最初在抗凝、炎症和造血等方面发挥作用[44-47].曾艺团队通过流式细胞分析技术发现约3%的基底细胞表达Procr,而管腔细胞中不存在Procr+细胞;免疫荧光染色也证明基底细胞的一个亚群表达Procr.借助体外3D培养体系,进一步发现只有Procr+基底细胞能够在体外3D培养条件下形成克隆, 而Procr-基底细胞没有克隆形成能力.他们通过体内移植实验进一步验证了Procr+基底细胞的再生能力,结果显示Procr+基底细胞能够更有效地再生出乳腺.与所有的基底细胞(CD24+CD29high)相比,Procr+基底细胞(Procr+CD24+CD29high)的乳腺重建能力提高了约6倍,表明Procr可以作为特异的分子标记进一步在基底细胞中富集MaSC.
为了进一步探究Procr+细胞在正常乳腺发育中是否作为多潜能干细胞发挥作用,曾艺团队构建了ProcrCreERT-IRES-tdTomato基因敲入小鼠,流式细胞分析和免疫荧光染色表明该小鼠可成功再现内源性Procr的表达模式;追踪Procr+细胞的后代,通过遗传实验获得了ProcrCreERT2/+R26mTmG/+小鼠,在注射Tamoxifen后,未发生同源重组的细胞依然表达mTomato,Procr+细胞则产生有活性的重组酶而开始表达mGFP[48].上述结果表明,小鼠正常发育状态下乳腺中的Procr+细胞被成功标记.进一步追踪这群被标记细胞的后代并分析其细胞类型,发现这群被标记的Procr+细胞能够分化为所有类型的乳腺上皮细胞,该发现为MaSC中存在多潜能干细胞这一观点提供了有力证据,解答了该领域存在的争议.综上,曾艺团队证明了Procr+细胞是位于乳腺细胞谱系最顶端的多潜能干细胞,在移植实验中具有最高的再生能力,在谱系追踪实验中能够分化为所有类型的乳腺上皮细胞[3].
Bcl11b是一种C2H2锌指转录因子,也是各种染色质重塑复合物(如SWI/SNF、NURD)的成员[49-50].2017年,Clarke团队鉴定出一群Bcl11b标记的静息状态的MaSC,对乳腺再生发挥重要作用[4].许多组织中的干细胞通过进入静息状态来维持干细胞特性,以避免基因组损伤及过度增殖造成的衰竭,MaSC也是如此.他们发现Bcl11b在CD49fhighCD24medLin-细胞中高表达,并特异定位于乳腺导管的基底层中.当使用K14-Cre小鼠条件性在乳腺上皮中敲除Bcl11b基因后,乳腺发育和乳腺再生能力受到抑制.高表达Bcl11b的细胞在二次移植中也能够再生乳腺,说明Bcl11b可调节乳腺细胞的长期再生能力,而不是通过细胞的外在机制间接影响乳腺的发育.他们还发现ProcrhighCD49fhighCD24medLin-细胞是处于活跃状态的干细胞,而Bcl11bhighCD49fhighCD24medLin-细胞处于细胞周期的G0期,在体内和体外都有着较低的增殖活性,是处于静息状态的干细胞.此外,Clarke团队证明Bcl11b通过细胞周期蛋白依赖性激酶4抑制剂1a(Cdkn1a)/p21和Cdkn2a/p16来调控乳腺上皮干细胞在静息和活跃两种状态间的转换,从而维持乳腺细胞的长期稳态[4].
随后在2018年,康毅滨团队鉴定出一群Dll1标记的多潜能MaSC[5].干细胞所处的微环境影响着干细胞在正常发育及稳态中的行为.在MaSC富集的基底细胞中Notch配体Dll1高表达,当使用K14-Cre小鼠条件性在乳腺上皮中敲除Dll1基因后,乳腺导管的延伸和侧分枝的形成受到抑制,MaSC所在的乳腺基底细胞群数量明显下降.当使用Dll1-GFP-IRES-Cre-ERT2 ROSA-tdTomato转基因小鼠对Dll1GFP+细胞进行追踪发现,Dll1+MaSC产生的后代中既有基底细胞也有管腔细胞.他们进而证明了这一调控作用由乳腺微环境中表达Notch受体的巨噬细胞与Dll1+MaSC的直接接触所介导.进一步对野生型和Dll1cKO的 F4/80+标记巨噬细胞进行全转录组分析发现,它们的Wnt配体(Wnt10A、Wnt16和Wnt3)呈现差异性表达,并通过体外共培养实验证明巨噬细胞对MaSC的调控是由巨噬细胞响应Dll1-Notch信号后增加Wnt配体分泌所介导的.
本文通信作者曾作为曾艺团队的一员,参与了Procr作为MaSC标记的发现过程.本团队随后对该群细胞进行深入研究,发现免疫检查点PD-L1在Procr标记的MaSC中富集表达.长期及孕期的细胞谱系追踪实验也显示PD-L1标记的乳腺基底细胞可以产生基底细胞、管腔细胞及腺泡细胞.图2为PD-L1标记的MaSC分化谱系示意图.类似于Dll1+MaSC与巨噬细胞之间的相互作用,推测PD-L1可能介导MaSC与胸腺依赖性淋巴细胞(T细胞)之间的相互作用.此外,本团队最新研究发现PD-L1的高表达可显著提高MaSC在移植试验中的重建效率,为PD-L1作为免疫检查点和癌症治疗之外的作用提供了新视角[51].
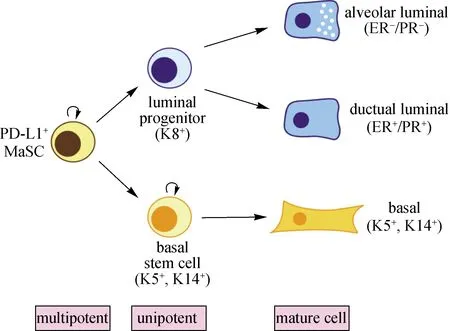
图2 PD-L1+ MaSC分化谱系示意图
综上,研究者们在探究乳腺上皮细胞之间的谱系关系上开展了大量工作.图3所示为乳腺导管截面示意图,总结了不同分子(包括Lgr5、Axin2、Procr、Bcl11b、Dll1和PD-L1)标记的MaSC以及它们与乳腺导管微环境中不同细胞相互作用的特点.Procr在乳腺上皮的基底细胞和基质细胞中表达,在管腔细胞中不表达,标记的是一群多潜能的活跃状态的MaSC,这群细胞具有明显的上皮间充质相互转化(EMT)的特性;Dll1只在乳腺上皮基底细胞中表达,标记的是一群双潜能MaSC,介导MaSC与巨噬细胞的相互作用;Bcl11b在基底细胞中特异表达,标记的是一群位于基底与管腔界面之间静息状态的MaSC;PD-L1在Procr标记的MaSC中富集表达,可能介导MaSC与T细胞的相互作用.

图3 MaSC与乳腺导管微环境
4 MaSC的分子调控
4.1 Wnt信号通路
Wnt信号通路几乎参与了乳腺发育的所有阶段,并在调节MaSC中发挥重要作用[52-54].Wnt信号通路的很多组分,包括Wnt配体、受体、下游效应因子和DNA结合蛋白,都参与了乳腺形态发生的不同阶段.
胚胎期Wnt6与Wnt10b的表达标志乳腺线的形成[55].淋巴增强因子1(Lef1)是早期乳腺形态发生所需的关键Wnt组分,Lef1缺失的小鼠基板内陷过程不能正常进行[56-58],上皮芽进入脂肪垫及分枝过程也会受到影响[59].青春期一些Wnt配体(如Wnt5a和Wnt7b)的表达出现峰值,且一般出现在高度增殖的TEB中[60-61].本团队在之前的研究中发现管腔细胞分泌的激素调节因子Wnt4和特异性顶部盘状底板反应蛋白(Rspo1)存在协同作用,当同时敲低Wnt4和Rspo1基因表达,MaSC会完全失去重建能力[62].Wnt信号的增强对于干/祖细胞在有丝分裂过程中特性的维持至关重要.本团队之前的研究发现,帽细胞在分裂过程中Wnt信号通路水平会升高,这一过程是依赖于细胞周期蛋白(Ccny)和细胞周期蛋白样1(Ccnyl1)实现的.Ccny、Ccnyl1的表达和低密度脂蛋白受体相关蛋白6(Lrp6)的磷酸化水平在有丝分裂的乳腺细胞中升高,Ccnyl1在帽细胞中高表达,并与Axin2共定位.在体内移植和谱系追踪试验中,Ccny的缺失降低了基底细胞的乳腺再生能力[63].有研究表明:转化相关蛋白63(p63)的N末端截短异构体ΔNp63作为p63的重要亚型,通过调节卷曲蛋白受体7(Fzd7)的表达来调控Wnt信号,在决定基底细胞命运中发挥重要作用;ΔNp63主要在基底细胞中表达,抑制ΔNp63的表达导致MaSC的再生能力下降以及乳腺发育的延迟,并且ΔNp63的过表达可以使管腔细胞在移植试验中再生出乳腺,这表明ΔNp63可以诱导管腔细胞获得MaSC的特性;Fzd7作为ΔNp63的靶基因,是ΔNp63在基底细胞中重要的下游效应因子,在ΔNp63缺失的乳腺细胞中过表达Fzd7基因可部分挽救MaSC在体外培养和再生试验中的表型[64].也有研究发现肢体和心脏发育(Lbh)基因作为Wnt信号的靶基因,仅在基底细胞和基质细胞群中表达,且Lbh蛋白的失活会导致乳腺发育的延迟和谱系向管腔分化的增加;并证明了Lbh通过诱导ΔNp63的表达来维持MaSC的特性,并抑制其向管腔细胞分化[65].总体而言,Wnt信号通路的激活决定并维持了乳腺上皮细胞的基底细胞走向,使MaSC的干性得到维持.
4.2 Notch信号通路
Notch信号通路与MaSC的命运决定有着紧密的联系.在胚胎期小鼠乳腺中,有一群表达Notch1的单潜能干细胞,Notch1的激活使基底细胞获得E受体阴性的管腔细胞特征,促进这些细胞逐渐向管腔移动[66].通过敲低重组信号结合蛋白JK(Rbpj)基因表达来抑制Notch信号通路,可诱导管腔细胞向基底细胞分化,造成p63的上调以及MaSC的异位增殖;相反地,持续性表达活化形式的Notch1则会使MaSC向管腔细胞分化[67].有研究发现Notch信号抑制因子Numb/Numbl在基底层细胞中富集,其表达在孕期达到峰值.Numb/Numbl基因缺失型小鼠乳腺基底细胞层受到破坏,且管腔细胞层出现扩增,并使上皮细胞发生EMT,从而导致乳腺在孕期无法形成正常的腺泡结构[68].
Notch信号通路也可以调控管腔祖细胞的行为.Notch3在管腔祖细胞中高表达,谱系追踪试验表明,Notch3信号抑制管腔祖细胞的分裂和增殖,并使其维持在静息状态[69].此外,过表达活化形式的Notch1或Notch3也会抑制青春期导管细胞和孕早期腺泡结构细胞的增殖,使乳腺的β-酪蛋白产量减少而无法正常喂养幼鼠[70].转录因子E74样因子5(Elf5)在细胞命运决定和调节乳腺上皮的干/祖细胞功能方面也发挥着关键作用.Elf5在乳腺中的缺失会导致具有双重管腔/基底特性(K8和K14共表达)细胞的累积以及孕期CD61+管腔祖细胞的增加[71].总体而言,Notch通路的激活促进了乳腺上皮向管腔的分化,而低水平的Notch信号则有助于MaSC的干性维持.
4.3 Hedgehog信号通路
生殖细胞中Hedgehog转录因子Gli-Kruppel家族成员2(Gli2)和Gli3的缺失严重影响了胚胎期乳腺的发育并导致胎儿在围产期的死亡[72-73].补丁蛋白1(Ptch1)是Hedgehog信号通路的负调控因子,Ptch1位点单倍体缺失的杂合小鼠乳腺导管结构会出现严重缺陷[74].对Ptch1位点单倍体缺失的杂合小鼠进行长期标记保留,研究表明Hedgehog通路参与调控MaSC在静息或活跃状态的转变[75].持续性过表达活化形式的平滑卷曲家族受体(Smo)小鼠的乳腺细胞表现出较低的乳腺再生能力,伴随着MaSC向祖细胞过早分化的现象,这表明Hedgehog通路起到维持干细胞特性的作用[76-77].基质细胞与上皮细胞的相互作用对乳腺发育也十分重要.尽管只有20%成纤维细胞表达Gli2,但成纤维细胞中Gli2的缺失会严重削弱MaSC的活性[73].总体而言,Hedgehog通路的激活使静息状态的MaSC转变为活跃状态,促进MaSC的不对称分裂以及向管腔细胞的分化.
4.4 Hippo信号通路
Hippo信号通路与细胞命运决定有着很大的联系.在一项功能性筛选研究中,转录因子Tafazzin(Taz)被鉴定出参与调控MaSC,可以将人乳腺管腔上皮细胞转变成干细胞样[78].有研究表明,瞬时表达外源的Yes相关蛋白1(Yap)或与其密切相关的同源物Taz,可以将小鼠乳腺管腔细胞转化成干/祖细胞状态,并且在体内有再生能力[79].也有研究通过RNA干扰筛选鉴定出大肿瘤抑制基因子1/2(Lats1/2)为MaSC干性维持的调节因子和分化的抑制因子[80].Yap或Taz单独缺失时对乳腺发育没有影响,这可能是因为Yap和Taz之间存在功能上的互补;而Yap和Taz同时缺失则会显著地削弱基底细胞在传代时的自我更新能力[79].
4.5 EMT相关的转录因子
许多间充质相关基因如Snail、Twist和Zeb1也在基底细胞中高表达[81-82].转录因子Snail2/Slug与Sox9共同作用来决定MaSC的状态,抑制Snail2/Slug或Sox9会削弱MaSC的活性;Slug缺失的小鼠乳腺上皮细胞在移植后呈现延迟发育的现象,而外源性共表达Snail2/Slug和Sox9可以将分化的管腔细胞转化为具有长期乳腺重建能力的MaSC[81,83].另有研究报道,人乳腺上皮细胞中CD44high/CD24low标记的干细胞样群体和小鼠中CD49fhighCD24med标记的干细胞样群体都高表达EMT相关分子标记,包括N-cadherin、Snail和Twist等[84].以上研究表明间充质相关基因对乳腺上皮有一定的干性维持作用.
4.6 表观遗传相关调控因子
胚胎期和成体的MaSC染色质开放程度检测表明,它们有着相似的表观遗传模式[85].B细胞特异性莫罗尼鼠科白血病病毒集成位点1(Bmi1)作为抑制性多梳蛋白复合体1(PRC1)的核心组件参与调控人MaSC的自我更新[86].Bmi1缺失的小鼠乳腺上皮细胞在移植试验中没有再生能力[87].ZESTE同源物增强子1(Ezh1)与Ezh2作为PRC2的组分,两者同时缺失时会导致乳腺发育受损;而缺失PRC2另一个核心组分Suz12,乳腺细胞会丢失H3K27me3组蛋白甲基化标记,导致乳腺发育受阻[88].组蛋白甲基化识别子Pygo2可抑制MaSC分化,Pygo2缺失的MaSC移植后有着较低的乳腺重建效率,并且展现出一部分管腔细胞的分子特性及Notch信号的上调;在MaSC中,Pygo2促进β-catenin结合到Notch3位点上,抑制其染色质状态从而抑制其表达;Pygo2介导的染色质调控将Wnt信号和Notch信号联系在一起,限制了MaSC向管腔分化[89].有研究通过整合ATAC-seq、DNA甲基化、基因表达,以及成体基底细胞和管腔细胞的蛋白质组学数据表明,乳腺细胞的DNA甲基化受DNA甲基转移酶(Dnmt1和Dnmt3a/3b)和甲基胞嘧啶双加氧酶(Tet)的共同调节[90].其中Dnmt1的缺失会导致乳腺导管生长明显缺陷,因此Dnmt1对维持干/祖细胞是必不可少的.
图4中展示了乳腺上皮基底层的MaSC、管腔祖细胞及管腔细胞中的主要分子调控机制.在复杂机制的调控下,MaSC实现自身干性维持或向管腔分化的命运;而在一些特定条件下,分化的乳腺上皮管腔细胞也可以重新获得干细胞样特性.这些分子的共同作用维持了乳腺上皮的细胞谱系,实现了乳腺的正常发育与乳腺上皮的稳态.

RANK.核因子κB(NFκB)受体活化因子;RANKL.NFκB受体活化因子配体;AREG.双调蛋白;EGFR.表皮生长因子受体;Cbf1.C启动子结合因子1;ERα.雌激素受体α;TAp63.p53家族蛋白63亚型.
5 MaSC与乳腺癌
起源细胞是获得突变而大量扩增并最终导致肿瘤发生的初始细胞.BCSC来源的假说之一:BCSC来自于MaSC目前已被广泛接受,MaSC因具有复制潜能和较长的寿命而易受累积突变的影响[91-92].BCSC与MaSC具有相似的表型特征及干细胞标记也支持这一假说.利用乙醛脱氢酶(ALDH1)活性的升高可以分离出BCSC群体,BCSC群体也可以呈现出与MaSC相似的CD44+/CD24-/low分子特征[93].BCSC群体具有自我更新、增殖与分化的能力,可以在体外形成克隆球等表型,与MaSC或部分分化的乳腺祖细胞类似[94].
目前已经发现调控自我更新的干性相关关键信号通路,如Notch、Wnt/β-catenin和Hedgehog通路的失调会促使MaSC向BCSC转变.干性相关基因的异常激活或突变与癌症的侵略和复发有很强的关联性[95].之前一些对自发性乳腺癌小鼠模型的研究证明Wnt通路在调控恶性MaSC中发挥作用.在乳腺肿瘤病毒(MMTV)-Wnt1自发性乳腺癌模型小鼠的乳腺肿瘤中,干细胞所在的基底细胞群占有很大比例[96].Zhang等[97]通过慢病毒介导的TOP-eGFP报告系统,发现在p53缺失的小鼠乳腺肿瘤中有一群Wnt通路响应的BCSC.另有研究发现,ΔNp63通过Wnt通路调控MMTV-Wnt1和MMTV-cMyc肿瘤细胞的肿瘤起始活性;而ΔNp63的缺失削弱了癌变前增生乳腺中MaSC富集的基底细胞群扩增,并导致MMTV-Wnt1肿瘤中Thy1+标记的BCSC群体减少[64].在人乳腺癌中,β-catenin的表达与乳腺癌患者预后呈负相关[98-99],且相较于乳腺癌其他类型,三阴性乳腺癌(TNBC)中β-catenin的核定位信号比较常见.在TNBC中,靶向Lrp6使细胞的自我更新能力变弱,CD44与cMyc的表达下降,CD24的表达上升[100-102].在Frizzled蛋白受体中,Fzd7主要在TNBC中表达,并驱动T细胞因子(TCF)依赖的下游基因转录[103].有研究表明,Wnt靶基因PROCR在50%的TNBC患者中高表达,标记了一群BCSC[104].Wnt通路在雌激素受体阳性乳腺癌的CD44+CD24-/low干细胞中被激活[105],Wnt拮抗剂Dkk1通过抑制Wnt通路降低MCF-7细胞的克隆形成能力[106],说明Wnt通路在非TNBC类型乳腺癌中也发挥重要作用.
Notch通路在调控乳腺癌发展和BCSC活力中也发挥重要作用.在基底样乳腺癌中,Notch配体Jagged1蛋白的表达促进了表达Notch受体的BCSC群体的扩增[107].表达Notch配体Dll1的BCSC有着化疗耐药性,而通过药物阻断Dll1可以重新激活肿瘤细胞对化疗的敏感性[108].Notch1或Dll4可以通过Sirt2介导的Aldh1a1(K353)去乙酰化来激活Aldh1a1,从而促进BCSC的自我更新[109].抑制γ-secretase从而抑制活化形式Notch片段的形成,也可以阻碍异种移植中肿瘤的发展,降低CD44+CD24-/low和ALDH+乳腺癌细胞的比例,可增强化疗效果[110-111].Numb作为Notch通路的重要抑制因子,在约50%的原发性乳腺癌中表达下调[112],说明Notch通路与乳腺癌有一定相关性.
BCSC中也存在Hedgehog信号通路高度活化的现象[113].Gli1在多种癌症(包括乳腺癌)中的高表达都与病人较差的预后相关[114].有研究发现在MMTV-Wnt1小鼠乳腺肿瘤的基质细胞中,Hedgehog信号通路也比较活跃,BCSC通过Hedgehog信号诱导癌症相关成纤维细胞(CAF)分泌细胞因子和生长因子来维持适合自己生存的微环境[115].另外,酪氨酸激酶受体(EGFR、PDGFR、VEGFR和AXL等)以及它们参与调控的有丝分裂原活化蛋白激酶(MAPK)、磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)及Janus激酶(JAK)信号转导,及转录激活蛋白(STAT)等信号通路,对MaSC的富集和维持也十分重要[116].总体而言,单个信号通路的异常调节可能是导致乳腺癌发生发展的原因,但这些信号通路并非单独发挥功能,而是它们之间的相互作用以及外部刺激共同维持BCSC的特性.
6 展 望
小鼠MaSC在维持乳腺上皮细胞谱系、乳腺正常发育及乳腺行使正常功能中的重要作用,提示MaSC在乳腺再生医学中有着重要的应用和发展前景,如MaSC在人体中可以用于细胞治疗,以替代受损细胞或进行乳腺再生.目前,再生医学在乳腺组织治疗方面已经取得一定进展,如考虑到乳腺微环境中脂肪细胞对乳腺细胞的重要影响,已经开发了3种利用细胞辅助脂肪移植技术的设备[117].另外,在乳腺癌中,干细胞是实体肿瘤的一小部分细胞群,以不依赖于锚定的方式生长,从而扩散到身体的不同部位,形成继发性肿瘤.BCSC还会表达多种耐药基因和药物外排转运体,使患者对各种常规化疗药物产生耐药性.以上由BCSC引起的耐药性和肿瘤复发,使得乳腺癌仍然是死亡率居高的疾病.因此,靶向BCSC的自我更新途径以及肿瘤与基质的相互作用,设计针对BCSC的治疗干预措施,将有助于清除BCSC群.可通过单一或联合用药进行分子靶向治疗,从而靶向对BCSC的维持和存活有重要作用的Wnt、Notch、Hedgehog、Hippo等信号通路,如:Notch信号通路抑制剂MK-0752与多西紫杉醇进行联合用药,在治疗局部晚期或转移性乳腺癌上展现出很好的效果[118];临床试验表明Hedgehog信号通路抑制剂sonidegib与紫杉醇进行联合用药,在治疗晚期乳腺癌上有一定效果;通过萝卜硫素靶向Wnt通路可显著抑制BCSC的肿瘤发生能力等[119].由于细胞中的信号通路不是单独发挥功能而是形成复杂网络来调控BCSC的行为,所以合理的靶向治疗、个性化治疗在乳腺癌治疗中非常重要.
近年来,乳腺癌类器官技术的发展为分析病人样本提供了新的机会,患者来源的乳腺癌类器官能够很好地遗传原始肿瘤的特性并维持自身的异质性.利用乳腺癌类器官进行体外药敏试验以指导临床用药,对乳腺癌的精准治疗更是有着重要的意义.未来,基因组分析和乳腺癌类器官模型的结合能够让人们更加了解乳腺癌发生发展的机制研究,从而更彻底地预防和治疗乳腺癌.

