‘翠香’猕猴桃黑头病常温贮藏期间生理特性研究
陈丽娟,杨亚明,戚英伟,杜 薇,殷伟杰,任小林,丁毓端
(1.西北农林科技大学 园艺学院,陕西杨凌 712100;2.广东省农业科学院 蚕桑食品研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610)
陕西省是中国栽培面积和产量最大的省份,2016年分别占全国种植面积和产量的32.07%和54.91%[1]。‘翠香’猕猴桃是一种品质优良的中早熟品种。然而,‘翠香’黑头病(又称黑斑、黑霉、霉病)日趋严重,影响果实品质,造成经济损失。该病发病初期,幼果底部出现小黑点,后期逐渐增加并形成片状,但斑点下果肉不发病。有研究表明钙与黑头病有关[2]。果实中约80%的总钙含量是在坐果后的前几周积累的,这表明坐果时钙营养不良可能导致收获时果实钙含量较低[3]。也有研究表明钙可以防治黑头病[4-5]。
付博等[6]通过对陕西‘翠香’猕猴桃黑斑病病原的分离、形态学观察、致病性测定和分子鉴定,认为病原为间座壳属真菌Diaportheeres。Phomopsis(有性态为Diaporthe)分布广泛,常发生在植物生长后期或因营养不良和虫害而衰弱的植物中[7]。另外,王西锐等[8]从患病猕猴桃中分离病原菌并进行测序,发现其与枝孢属(Cladosporium)有99%的同源性。目前对该病的认识有所欠缺,不能有效地解决该病田间防治和贮藏管理问题。采后贮藏过程中,该病导致‘翠香’猕猴桃不耐贮藏,严重者在树上就已经软化,造成严重的经济损失。由于该病对采后贮藏的影响较大,极易腐烂,造成严重的经济损失。所以,黑头病对‘翠香’果实的生理特性影响研究对该果业的持续发展显得极为重要。本研究通过测定采后‘翠香’黑头病果实常温贮藏下的的生理指标,掌握黑头病对‘翠香’果实的生理特性影响,可以为其贮藏管理提供一定依据。
1 材料与方法
1.1 材 料
2019年9月,在陕西杨凌‘翠香’果园采收可溶性固形物含量约为7.5%的果实。挑选出果形适中、无机械损伤的果实用于后续试验,感病果则根据果实表面黑头病面积大小,将果实分为健康(无黑头)、轻病(病斑0~50%)、重病(病斑≥50%)3类。每25个果实采用PE保鲜袋包装,开口放置在浅框内,置于室温(22±1) ℃,相对湿度为(65±5)%下贮藏。
1.2 测定指标及方法
硬度参考Ge等[9]方法,每重复选取9个果,用GY-15型硬度计测定,柱形探头直径11 mm,测定深度8 mm,测量速度为5 mm·s-1,探头下降/上升速度为10 mm·s-1,在果实的赤道处去皮测定2次,2次测定位置保持相互垂直,单位:N。
果实色差的测定:参考张伟[10]的方法。
可溶性固形物(SSC)和可滴定酸的测定:取每个果果柄处和花萼处果肉榨汁,采用糖酸仪一体机测定SSC,将200 μL纯果汁稀释50倍测定含酸量(单位:%);干物质含量的测定为取一定量的鲜果切成薄片放在锡箔纸上,105 ℃杀青30 min,50 ℃烘干至恒量,2次质量之差后计算即为干物质含量(单位:%)。
呼吸速率的测定:参考刘悬烁[11]的方法略作改进;乙烯释放速率根据Choi等[12]方法,每12个果实分别放入玻璃缸并密封,60 min后,抽吸5 mL气体于小瓶中以水密封保存。用气相色谱仪测定乙烯含量。载气为氮气(99.999%),柱温 70 ℃,入口温度100 ℃,测试室温150 ℃。
抗氧化代谢相关酶活性的测定:参考曹建康等[13]、李圆圆[14]的方法略作改进。
酸溶性钙、镁、钾含量的测定根据Shahkoomahally等[15]和Da等[16]方法修改。果肉样品在105 ℃脱水30 min,在70 ℃烘干至恒量。称取0.1 g干燥样品,放入灭菌管中,加入6 mL硝酸和2 mL双氧水。微波消解仪(MA165-001 multipre -41 FC2,意大利)消煮后的剩余液体最后定容至50 mL,测试时稀释。由原子吸收光谱仪(ZA3000,日立,日本)测定。不同果实组织的酸溶性矿质元素的测定选择的是常温贮藏3 d的样品。水溶性矿质元素的测定样品为加水溶解鲜样1 g,离心过滤后上机。
上述试验重复3次,最终数据采用均值。
2 结果与分析
2.1 ‘翠香’黑头病对果实贮藏期硬度的影响
图1为不同发病程度的‘翠香’果实,随着贮藏时间的增加,‘翠香’果实硬度逐渐降低(图2)。贮藏第0天时,重病果实硬度已经和轻病、健康果实的硬度出现显著性差异,贮藏第3天,重病果实的硬度迅速下降至7 N,轻病果实的硬度下降至72 N,而此时健康果实的硬度维持在90 N,3种不同的果实间硬度继续表现出显著性差异(P<0.05),贮藏第5天时,重病果实硬度已经降至2 N左右,错过最佳食用时间,失去商业价值。而此时健康果实还保持较高硬度水平,为46 N。

图1 不同发病程度的‘翠香’黑头病果
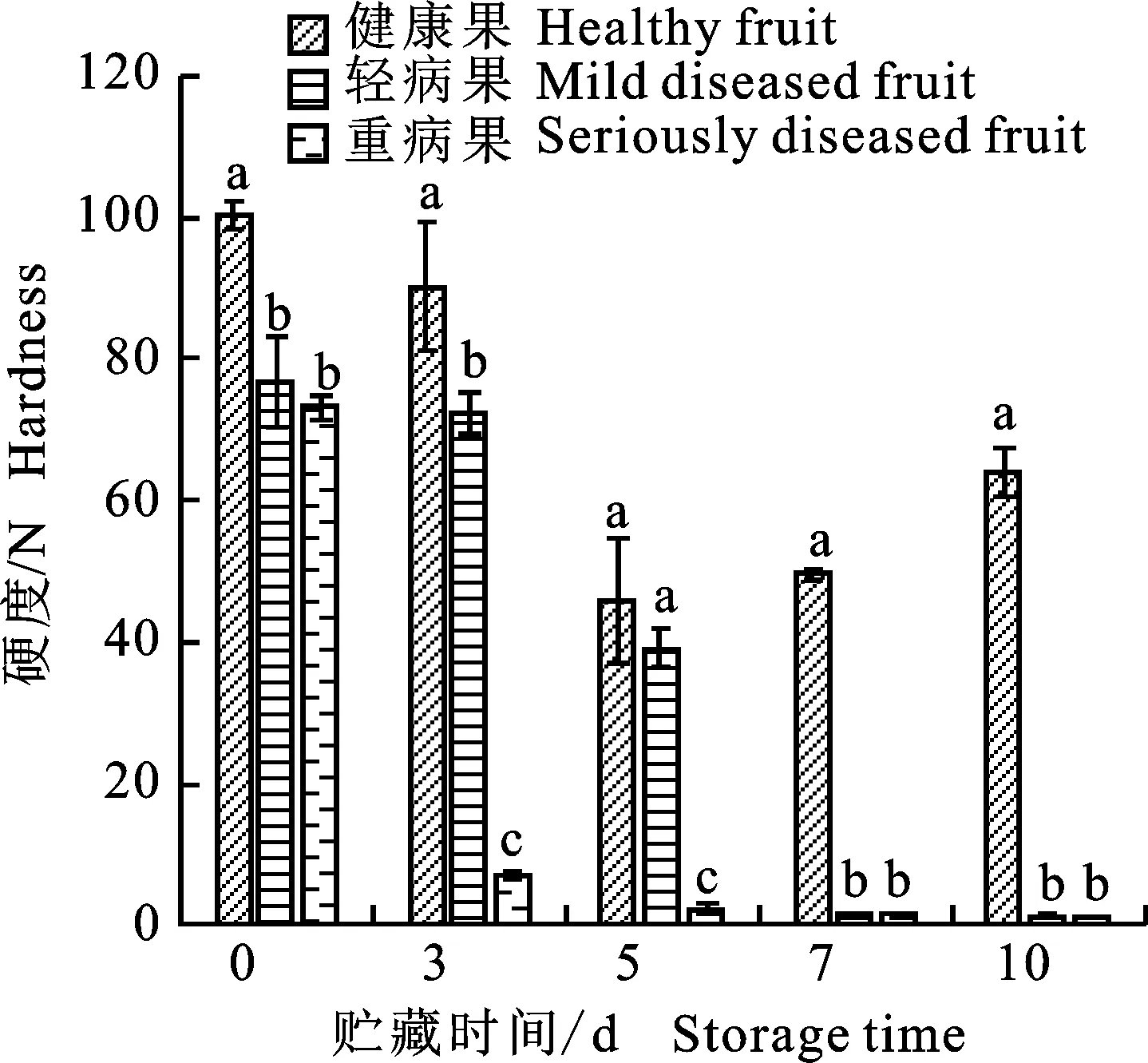
图中不同小写字母分别表示差异显著性(P<0.05),下同
2.2 ‘翠香’黑头病对果实贮藏期乙烯释放速率和呼吸速率的影响
由图3可知,在贮藏期间,重病、轻病、健康果实呼吸和乙烯释放速率均有高峰出现。图3-A显示,本次试验测到的重病果实呼吸速率峰值达92.14 mg·kg-1·h-1,实际上重病果实呼吸高峰出现在贮藏一开始甚至更早,轻病果实呼吸高峰出现在贮藏第10天,峰值为85.63 mg·kg-1·h-1,健康果实呼吸高峰出现在贮藏第5天,峰值为71.29 mg·kg-1·h-1,三者相比,重病果实的呼吸速率一直保持在较高的水平。重病、轻病、健康果实的乙烯释放速率的高峰分别是第5天、第7天、第7天(图3-B)。整个贮藏期间,病果的乙烯释放速率均高于健康果实,且乙烯释放高峰提前2 d。贮藏第13天时,重病、轻病果实的乙烯释放速率达到50 μL·kg-1·h-1以上,而健康果实此时仅为13 μL·kg-1·h-1。

图3 呼吸速率和乙烯释放速率的变化
2.3 ‘翠香’黑头病对果实贮藏期可溶性固形物含量、可滴定酸含量和干物质含量的影响
由图4可知,在贮藏期间,重病、轻病、健康果实的可溶性固形物随着贮藏时间的延长而升高,可滴定酸表现出相反的趋势。重病果实的可溶性固形物在第3天迅速上升,达到17%,已经接近完全成熟的‘翠香’猕猴桃的最高甜度。此时轻病和健康果的可溶性固形物还在较低水平,分别是8.4%,9.3%。随着贮藏时间的延长,轻病果实的可溶性固形物含量也快速上升。健康果的可溶性固形物在贮藏期间都处于病果水平以下。可滴定酸含量和干物质含量变化类似,病果的干物质含量在整个贮藏期间都高于健康果。

图4 可溶性固形物含量、可滴定酸含量和干物质含量的变化
2.4 ‘翠香’黑头病对果实贮藏期色差值的影响
随着果实成熟,果肉的颜色也随之变化。以色差L*、a*、b*值来描述颜色转变。其中,L*值表示亮或者暗,a*值表示红或者绿,而 b*值则表示黄或者蓝。由图5可知,在贮藏期间,重病、轻病、健康果实的色差值L*、a*、b*三者差异不明显,在贮藏第3天,重病果的L*值显著低于轻病和健康果,到第7天,病果与健康果的色差值有显著性差异,健康果的L*显著高于病果,a*值和b*值显著低于病果。整个贮藏中,重病果的L*值一直低于轻病和健康果。
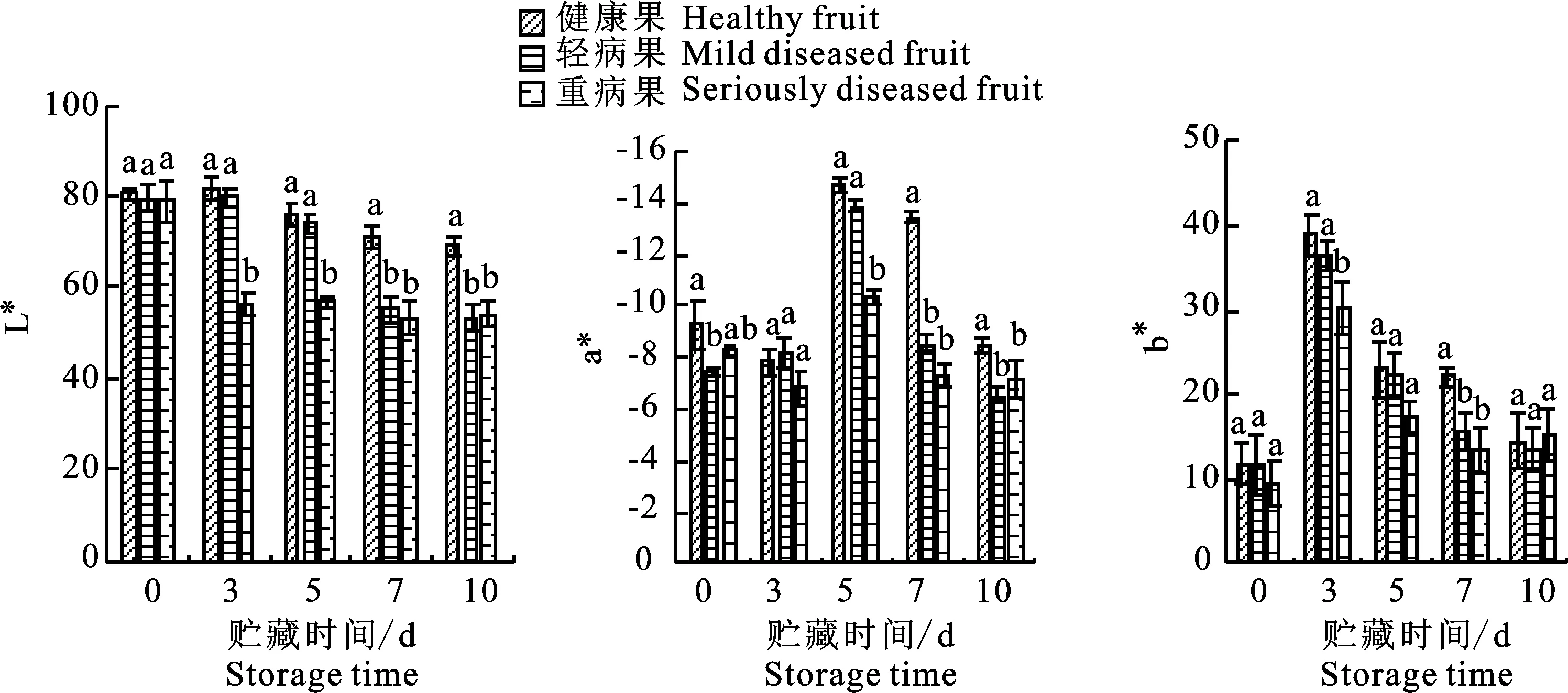
图5 色差L*、a*和b*值的变化
2.5 ‘翠香’黑头病对果实贮藏期抗氧化相关酶活的影响
由图6可知,在贮藏初期,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性在健康果和病果间没有显著差异,健康果的多酚氧化酶(PPO)活性显著低于病果。随着贮藏时间的延长,相关的抗氧化物酶活性也发生变化。PPO活性在贮藏第3天时活性上升,此后健康果的PPO活性高于病果。CAT活性在健康果中也高于病果。

图6 抗氧化相关酶活性的变化
2.6 ‘翠香’黑头病对果实贮藏期矿质元素含量的影响
由图7可知,在贮藏初期,酸溶性钙的含量在3种果实之间没有显著性差异,而水溶性钙在健康果中的含量显著高于病果。贮藏第5天时,健康果的酸溶性钙显著高于病果,达到0.5 mg·g-1。此后酸溶性钙的水平也相对高于病果,轻病果的酸溶性钙高于重病果。贮藏第5天以后,健康果和轻病果的水溶性钙含量也相对高于重病果。酸溶性钾的含量在贮藏一开始就表现出显著性差异,可以看到轻病果的酸溶性钾含量达到28 mg·g-1,水溶性钾为1.8 mg·g-1,显著高于病果。而对于镁的含量变化,在贮藏前3 d,病果和健康果中酸溶性镁的含量无明显差异。
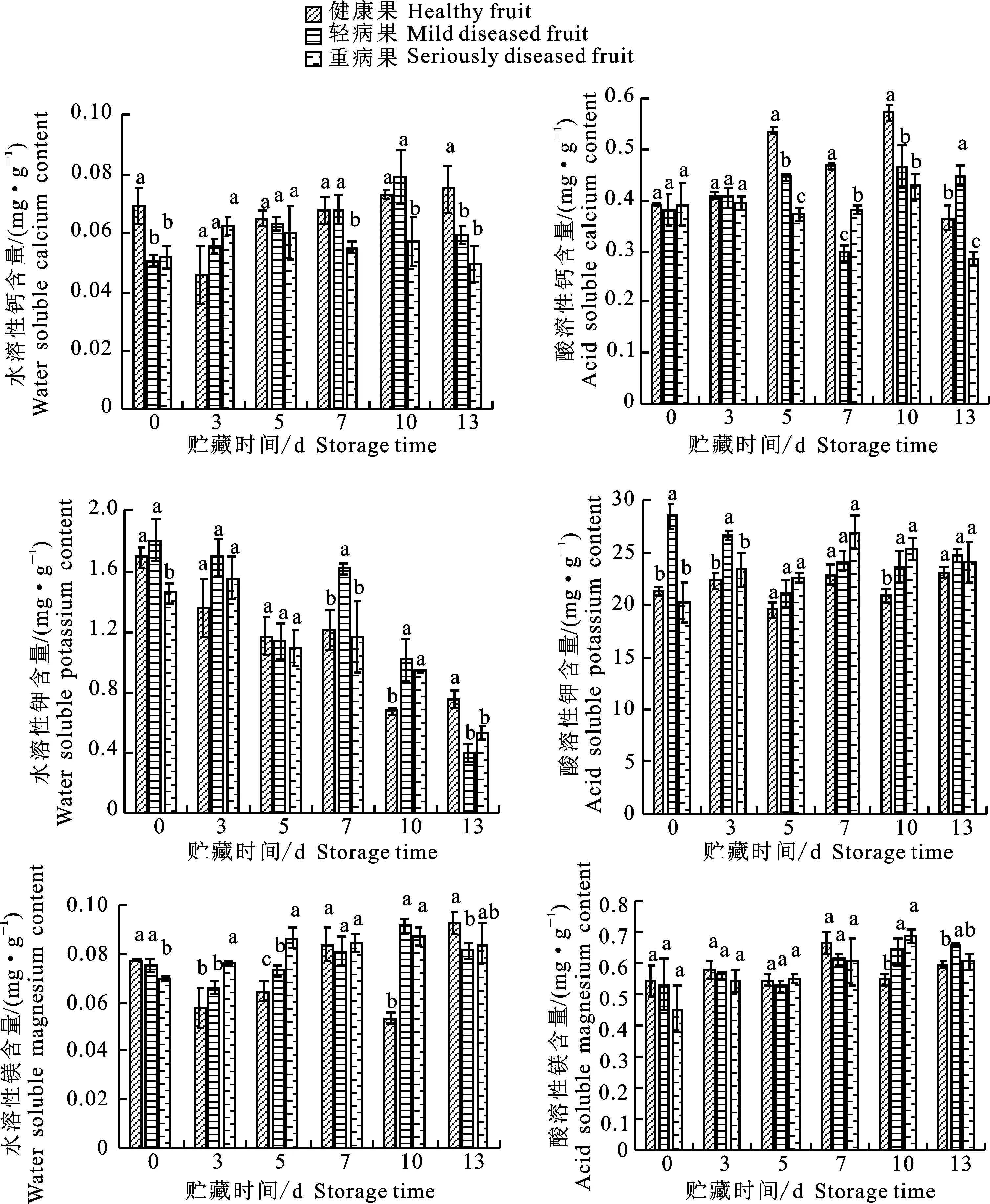
图7 果肉矿质元素含量的变化
由图8可知,贮藏3 d的‘翠香’果实钾的含量在果肉中高于果皮,而钙和镁的含量在果皮中比较高。贮藏3 d时,钙、镁、钾在果肉中并无显著性差异,在果皮中可以明显看到健康果的钾、钙显著高于病果,不同发病程度的病果间无差异,镁的含量在健康果和轻病果中显著高于重病果。从比值来看,钾/钙、(钾+镁)/钙的比值在果肉中高于果皮,轻病果的钾/钙、(钾+镁)/钙的比值显著高于健康果。

图8 ‘翠香’黑头病果实不同组织的矿质元素含量(贮藏3 d后)
由表1可知,矿质元素含量及其比值与果实品质存在相关性,健康果中可滴定酸与钾/钙、镁/钙、(钾+镁)/钙存在显著正相关性,相关系数分别为0.955、0.909和0.955。重病果中硬度与镁/钙存在显著负相关,相关系数为-0.894。
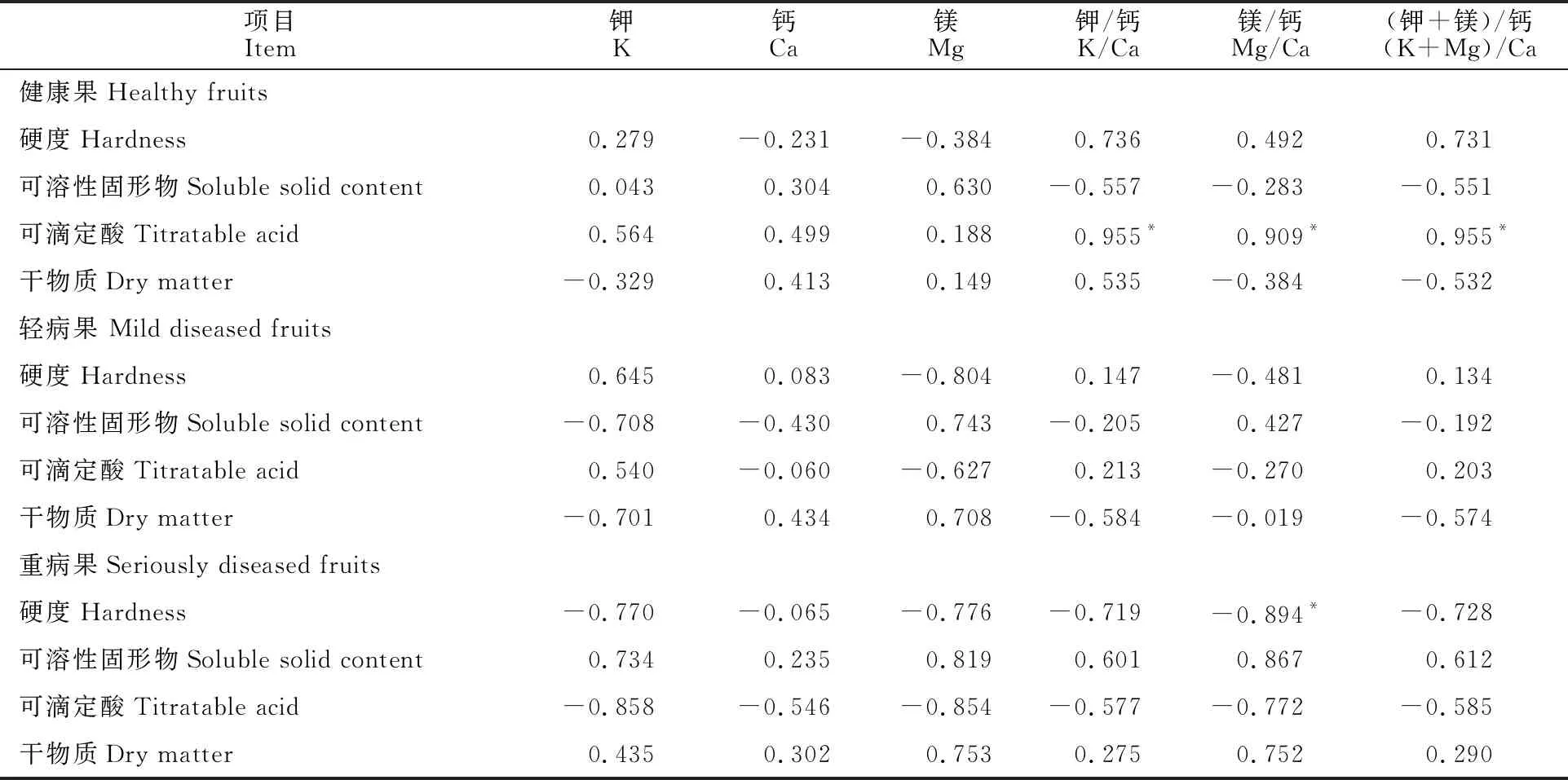
表1 ‘翠香’贮藏过程中果肉矿质元素及其比值与果实品质相关指标的相关性
3 讨论与结论
猕猴桃属于呼吸跃变型果实,有明显的生理后熟过程,采后常温不耐贮藏。研究表明在20 ℃左右的室温贮藏温度下,猕猴桃果实采后呼吸跃变一般发生于采后1~2周内[17]。本试验中,健康果实的呼吸高峰出现在第5天,而重病果在一开始贮藏时呼吸速率就比较高,此后一直保持较高水平,且再没有高峰出现,所以重病果实的呼吸高峰可能在更早出现,这与许多果农表示黑头病果实在树上就已经变软的说法相一致。乙烯释放速率也在短时间迅速上升,健康果、轻病果、重病果分别在第7天,第7天,第5天达到乙烯释放高峰。重病果的乙烯释放高峰比健康果提前2 d。已有研究表明猕猴桃果实在常温下的硬度曲线大致遵循S型曲线,分为缓慢的软化启动阶段、快速下降的阶段、更加缓慢趋于渐近线水平的结束阶段[17],这一定程度上解释了健康果实的硬度在第5 d后又回升,但也有可能是取样不均匀的问题。从可溶性固形物和干物质的含量可以看出,在整个贮藏期病果一直保持较高的可溶性固形物和干物质含量,可滴定酸则相反。另外,‘翠香’重病果实L*值一直低于健康果实,而L*代表亮度,值越低则亮度越低,代表褐变越严重[18]。说明重病果实已经可能发生严重的褐变,但是由于果肉颜色较深不易被观察。
果蔬体内活性氧的产生和清除是一个动态平衡的过程,其中承担清除活性氧的酶主要有SOD、POD和CAT等,这些酶对延缓果蔬衰老有着重要作用[19]。SOD在贮藏初期没有显著差异,贮藏第3天时,健康果和轻病果中SOD酶活显著高于重病果,贮藏第5天时,病果显著高于健康果,此后三者之间无显著性差异。CAT酶活在贮藏期健康果中活性一直高于病果,CAT能维持植物体内过氧化氢平衡,在植物应对生物和非生物胁迫过程中发挥着重要作用,过氧化氢作为信号分子参与植物各种胁迫的信号途径,但是过量会造成植物细胞不可逆的损伤,所以,平衡过氧化氢的浓度至关重要[20]。POD在植物受到外界刺激,病原菌侵染等作用时会相应的变化。在贮藏的前5 d,三者之间都无明显差异,到贮藏第7天及以后,病果的该酶活显著高于健康果。PPO与果蔬组织的褐变有关[21]。本试验在贮藏的前5 d,三者之间都无明显差异,到贮藏第7天及以后,病果的该酶活显著高于健康果。
果实的矿质元素与果实的抗性、品质、贮藏等有关,研究表明,采前补钙能减少黑头病的发生[22]。不同矿质元素本身及其比值都可能与果实的品质形成有关[23-24],巩峻豪等[25]研究表明健康苹果的果皮果肉Ca含量均高于苦痘病果实果皮和果肉,且苦痘病苹果果实具有较高的K、Mg含量,果实发病部位的K/Ca、Mg/Ca、[K+Mg]/Ca比值均显著高于正常果实相对应元素的比值[25]。本实验中健康果果皮组织中钾元素含量较高,达到13.69 mg·g-1,显著高于病果。而钙、镁元素在健康果、病果果皮间无显著性差异。健康果果肉组织中钙元素含量较高,达到0.65 mg·g-1,显著高于病果。而钾、镁元素无显著性差异。从比值的结果来看,果皮中Mg/Ca、[K+Mg]/Ca的比值在轻病果中较高。结果表明,钙、镁、钾含量与其相关比值与‘翠香’黑头病有一定的相关性,还需要进一步研究。
黑头病造成采后‘翠香’果实后熟过程加快,提高果实可溶性固形物和干物质含量。感病果果肉中钙含量显著低于健康果,钙、镁、钾含量与其相关比值与‘翠香’黑头病有一定的相关性,还需要进一步研究。

