中国南方茶棍蓟马地理种群遗传分化分析
罗林丽, 孟泽洪, 李 帅, 赵兴丽, 周罗娜, 贺圣凌,魏茹蕙, 张 欣, 周玉锋,*
(1.贵州省农业科学院生物技术研究所, 贵阳 550006; 2.贵州省农业生物技术重点实验室, 贵阳 550006;3.贵州省农业科学院茶叶研究所, 贵阳 550006)
随着茶园种植面积不断增大,以及化学农药的施用,在茶园昆虫区系演替过程中,体型大、繁殖力弱的害虫逐渐减少,而体型小、多化性的害虫逐步上升为主要害虫,虫体微小、生活隐蔽的蓟马类昆虫就是其中之一,茶棍蓟马Dendrothripsminowai是贵州最早暴发的蓟马类害虫的优势种之一(王国华等, 2010; 吕召云等, 2015)。茶棍蓟马是一类以锉吸式口器吸食茶树叶片汁液为食的小型昆虫,属缨翅目(Thysanoptera)蓟马科(Thripidae)(唐美君和肖强, 2018),为害山茶科的多种经济作物,尤以茶树最为严重。据报道茶棍蓟马主要分布在朝鲜、日本和中国南部地区(Lyuetal., 2017)。近年来,茶棍蓟马是我国南部和西南部地区茶园的一种毁灭性害虫,贵州省作为我国茶叶种植面积最大的省份,茶棍蓟马为害严重(Lyuetal., 2016; Wangetal., 2019; Zhangetal., 2021)。
目前关于茶棍蓟马的研究主要集中在生物学(赵志清, 1997; 吕召云等, 2015)、生态学(赵志清和陈流光, 1997; 张莉等, 2019)以及防治方法(赵志清, 1997; 李慧玲等, 2014; 董照锋和张小平, 2018; Lietal., 2020)几个方面,而关于种群遗传多样性方面的研究较少。Lyu等(2016)利用线粒体COⅠ基因分析贵州茶棍蓟马的遗传分化和起源,发现贵州省茶棍蓟马种群在近期发生了种群的扩张,推测茶棍蓟马可能是由东部茶区扩散至西部茶区的,即茶棍蓟马是由湄潭暴发并扩散到贵州其他茶区的。Lyu等(2017)利用微卫星标记技术对贵州24个茶棍蓟马种群进行系统的遗传分析发现,贵州茶棍蓟马的种群遗传结构和地理距离无显著相关性,大部分的种群在近期没有经历种群遗传的“瓶颈效应”,根据基因流推测贵州茶棍蓟马的暴发起源地可能有多个。罗林丽等(2020)利用线粒体COⅠ和COⅡ基因综合分析了贵州省茶棍蓟马11个种群的遗传多样性,发现种群遗传多样性较丰富,种群或已处于扩张状态,提出在农业生产中应及时掌握该虫种群动态,以防止其在全国各大茶区扩张和暴发。以上研究均局限于对贵州省茶棍蓟马遗传多样性的相关分析,而就茶棍蓟马在我国南部和西南部地区茶园为害严重的现状,这些地区茶棍蓟马的遗传多样性与遗传结构如何,其在这些地区是否已经处于种群扩张的状态,目前尚不明确。
因此,本研究联合线粒体DNA(mitochondrial DNA, mtDNA)的COⅠ和COⅡ两个基因序列,以中国南方主产茶区6省8个不同地区的茶棍蓟马种群作为研究对象,分析不同地理种群的遗传分化程度、基因交流、扩散趋势以及历史动态等,探究茶棍蓟马各地理种群的内在遗传变异与遗传进化关系,以期为茶棍蓟马区域性发生规律和综合防治措施的研究提供一定的理论基础。
1 材料与方法
1.1 供试材料
本研究采用的茶棍蓟马样本是采自中国南方地区的8个不同地理种群,共计93头成虫。 采用扫网法在野外采集样本,采集的样本立即放入盛有无水乙醇的冻存管中,并记录采样相关信息,带回实验室进行形态鉴定后于-20℃长期保存,样本信息见表1。
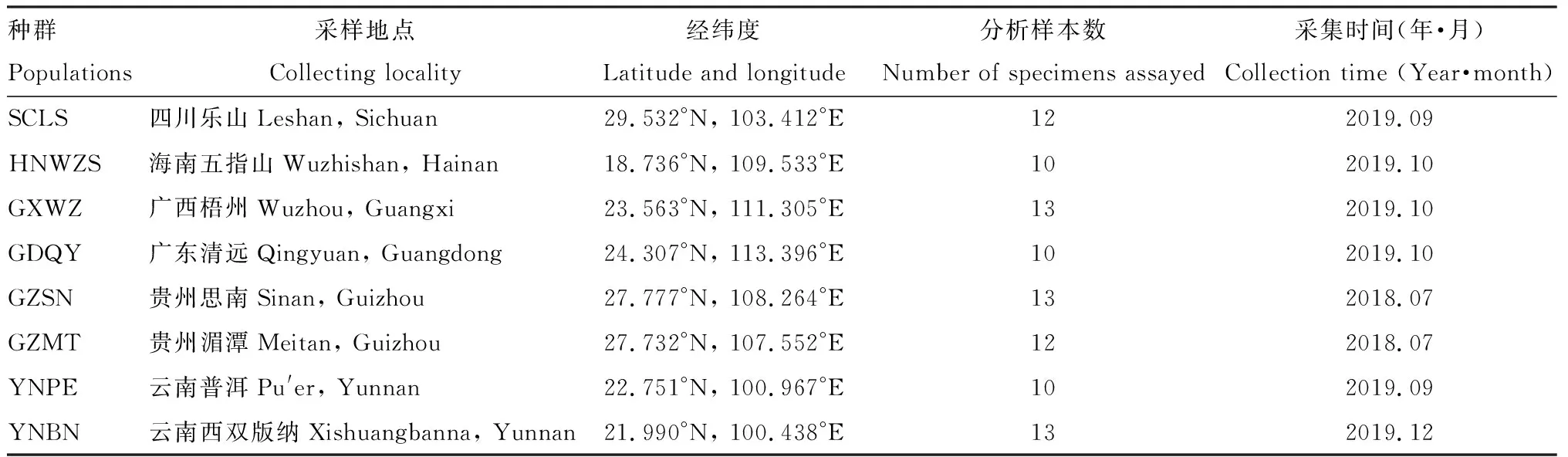
表1 中国南方茶棍蓟马采样信息Table 1 Sampling information of Dendrothrips minowai in South China
1.2 基因扩增与测序
利用盐析法提取单头茶棍蓟马的基因组DNA(张利娟等, 2011),分别使用mtDNACOⅠ的通用引物LCO1490/HCO2198(Folmeretal., 1994)和茶棍蓟马mtDNACOⅡ的特异性引物DmCOⅡ_F/DmCO Ⅱ_R(罗林丽等, 2020)对茶棍蓟马的mtDNACOⅠ和mtDNACOⅡ基因序列进行PCR扩增,引物由北京擎科新业生物技术有限公司合成(表2)。

表2 引物信息Table 2 Primer information
采用TaKaRa高保真PCR酶PrimeSTAR®HS DNA Polymerase进行PCR扩增,反应体系(50 μL): Taq酶0.5 μL, 5×Buffer 10.0 μL, dNTPs(各2.5 mmol/L) 4.0 μL, 正反向引物(10 μmol/L)各2.0 μL, 模板3.0 μL, ddH2O 28.5 μL。扩增程序: 94℃预变性5 min; 94℃变性1 min, 53℃退火1 min (mtDNACOⅠ)或55℃ 30 s (mtDNACOⅡ), 72℃延伸1 min 20 s,循环30次;72℃延伸10 min, 4℃保存。PCR产物电泳检测确认后送北京擎科新业生物技术有限公司进行双向测序。
1.3 序列整理与分析
利用Chromas 2.23(http:∥technelysium.com.au/)对测序所得序列进行峰图质量验证,在DNASTAR Lasergene 7.1软件包的SeqMan模块中(Larkinetal., 2007)将正/反向序列进行拼接,对序列进行人工读取和反复校验后得到完整的序列片段,在NCBI数据库中进行同源比对,以确定序列是否为所需的目的基因。
利用MEGA 6.0(Tamuraetal., 2013)分析序列的碱基组成与多态性位点、转换/颠换偏倚率(R),以及基于Kimura-Parameter(K2P)模型计算不同单倍型组群间遗传距离等;通过DnaSP 5.10(Librado and Rozas, 2009)计算核苷酸多样性(π)、单倍型多样性(Hd)、核苷酸平均差异数(K)及种群间遗传分化系数(FST)和基因流(Nm)等遗传学参数,并进行错配分布分析。 利用SAMOVA 2.0(Dupanloupetal., 2002)对不同地理种群间的分子空间变异进行分析。根据SAMOVA分组结果,应用Arlequin 3.5.2.2(Excoffier and Lischer, 2010)进行分子遗传变异分子方差分析(AMOVA)和中性检验,并进行Taijima’sD(Tajima, 1989)和Fu’sFs中性检验(Fu, 1997)。在Arlequin 3.5.2.2计算各种群的FST值并线性化(Slatkin linearized FSTs)(Smouse and Long, 1992),应用Google Earth Pro 7.3.3软件的标尺工具根据采样点的经纬度测量种群间的地理距离并取自然对数值,最后利用GenAlEx 6.502(Peakall and Smouse, 2012)进行茶棍蓟马种群间遗传距离与地理距离的相关性检验(Smouseetal., 1986),相关性的绘图在IBM SPSS Statistics 22中完成。以茶黄蓟马ScirtothripsdorsalismtDNACOⅠ和COⅡ的联合序列(GenBank登录号: NC_025241.1)为外群,利用MEGA 6.0基于Kimura-Parameter(K2P)模型的邻接法(neighbor-joining, NJ)构建茶棍蓟马地理种群不同单倍型的系统发育树。利用Network 10.2(Bandeltetal., 1999)绘制基于median-joining的单倍型中介网络图。在Migrate 4.4.3(Beerli, 2006)软件中运用贝叶斯法(Bayesian)计算茶棍蓟马各种群的有效有效种群大小(Θ)及种群间有效迁移率(M) (迁出和迁入迁移率)。
2 结果
2.1 线粒体基因序列分析
序列经NCBI比对后并进行翻译,确定中国南方茶棍蓟马6省8个地理种群mtDNACOⅠ和COⅡ片段各93条,均为蛋白编码序列,且序列中无终止密码子、无插入/缺失现象,排除假基因干扰。mtDNACOⅠ序列长度为655 bp,共有11个单倍型(GenBank登录号: MW965602-MW965612),单倍型多样性(Hd)为0.777,核苷酸平均差异数(K)为3.086,核苷酸多样性(π)为0.00471。mtDNACOⅡ序列长度为494 bp,共有10个单倍型(GenBank登录号: MZ151872-MZ151881),单倍型多样性(Hd)为0.836,核苷酸平均差异数(K)为3.806,核苷酸多样性(π)为0.00770。
本研究联合mtDNACOⅠ和COⅡ两个基因序列(COⅠ: 655 bp和COⅡ: 494 bp)进行综合分析。联合序列(1 146 bp)共检测到29个突变位点(转换数25个,颠换数4个),其中自裔位点6个,简约信息位点23个,整体的转换/颠换偏倚率R=23.202,碱基组成为33.36%(A),37.46%(T),15.94%(C)和13.24%(G),70.82%(A+T),具有明显的AT偏好性。
2.2 种群遗传多样性
从COⅠ和COⅡ联合的分析结果(表3)可以看出,中国南方8个不同地理种群的茶棍蓟马共有单倍型数(h)为22,总体的单倍型多样性(Hd)为0.924,总体的核苷酸平均差异数(K)为6.879,核苷酸多样性(π)为0.00600。8个地理种群间存在一定的差异:各种群联合序列的h为2~5,Hd为0.282~0.782,K为0.282~1.744,π为0.00025~0.00152。贵州思南种群(GZSN)和云南西双版纳种群(YNBN)的遗传多样性相对较高,h均为5,Hd分别为0.782和0.731。云南普洱种群(YNPE)联合序列的变异位点数(S)最多,共7个,分别为150, 273, 301, 468, 633, 639和644。广西梧州种群(GXWZ)的Hd和K最低。
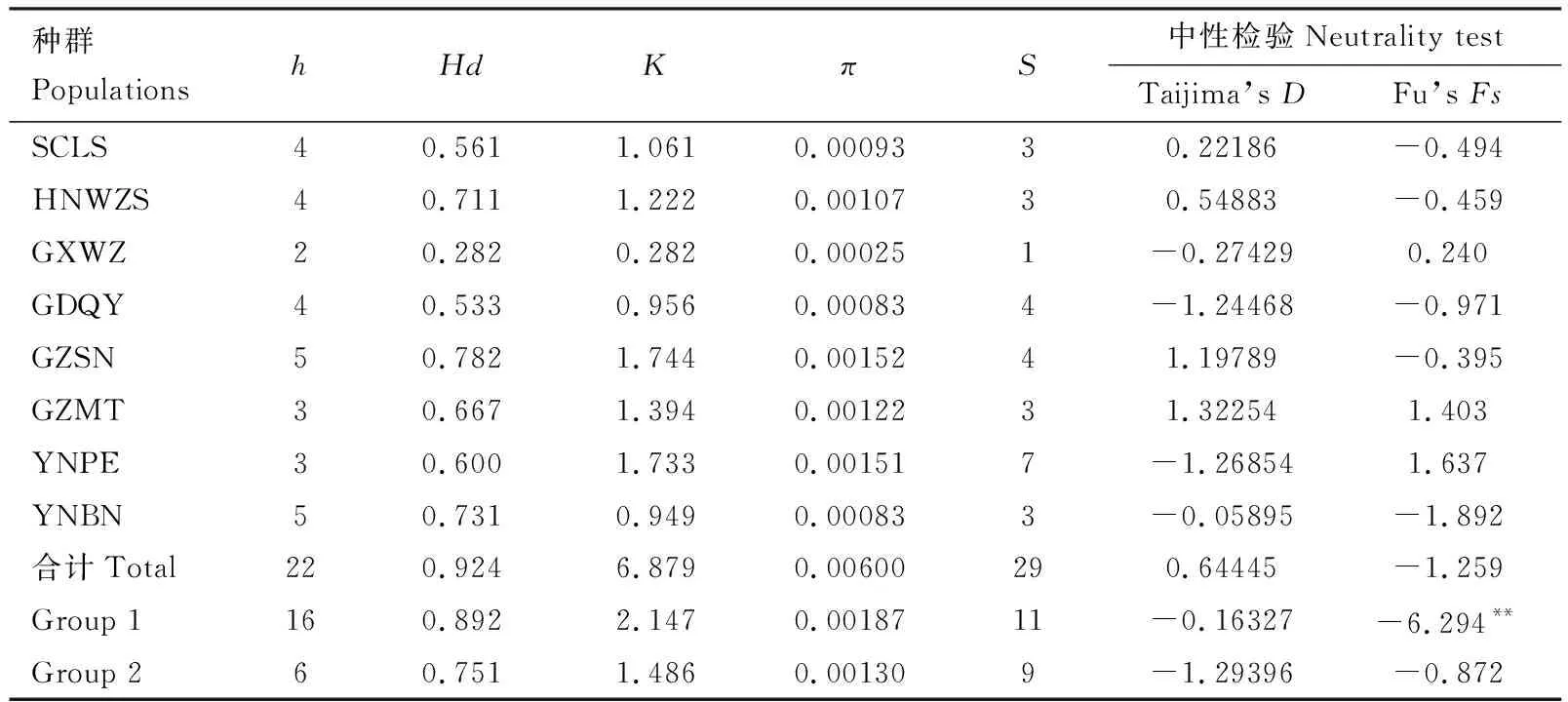
表3 基于mtDNA COⅠ和COⅡ联合序列的中国南方茶棍蓟马地理种群遗传多样性与中性检验Table 3 Genetic diversity and neutrality test of geographical populations of Dendrothrips minowai in South China based on the combined sequence of mtDNA COⅠ and COⅡ
2.3 种群间遗传分化与基因交流
基于mtDNACOⅠ和COⅡ联合序列分析,中国南方8个茶棍蓟马地理种群两两之间的FST范围为-0.00413~0.95812(表4);其中,贵州湄潭种群(GZMT)与四川乐山种群(SCLS)之间的遗传分化水平最低(FST=-0.00413);YNBN与GXWZ之间的遗传分化水平最高(FST=0.95812) (P<0.01);GZMT与GZSN之间种群间分化较小(FST=0.07899);GZMT与SCLS之间没有发生遗传分化(FST=-0.00413);GZSN与SCLS之间可能发生了中度分化(FST=0.16888)(P<0.05),除上述种群外的其他种群两两之间均发生了显著性分化(FST>0.25;P<0.01)。8个种群两两之间的Nm范围为0.511~1.004(表4),SCLS与GZMT的Nm=1.004,基因交流水平较高;除SCLS与GZMT外,其他种群两两之间的Nm均小于1,表明各种群之间基因交流水平低,种群间可能由于遗传漂变而发生了分化。8个种群总的遗传分化系数高(FST=0.84830>0.25),表明各种群之间可能出现明显的遗传分化;总群体的基因流低(Nm=0.040<1),表明各种群之间基因交流水平低,种群间可能因为遗传漂变而发生了遗传分化。
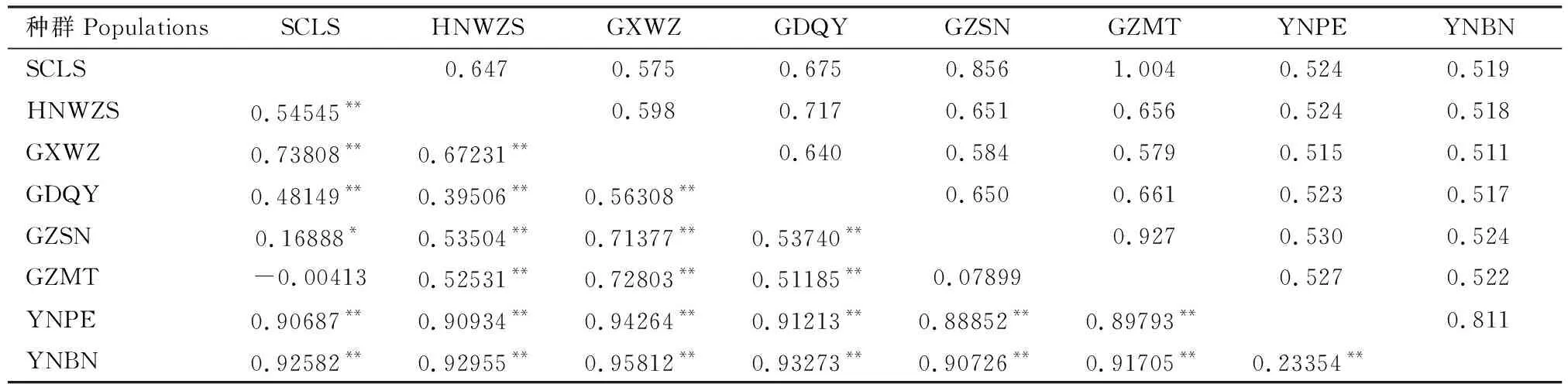
表4 基于mtDNA COⅠ和COⅡ联合序列的中国南方茶棍蓟马地理种群的遗传分化系数FST(下三角)和基因流Nm(上三角)值Table 4 Pairwise FST (below the diagonal) and gene flow Nm (above the diagonal) values of geographical populationsof Dendrothrips minowai in South China based on the combined sequence of mtDNA COⅠ and COⅡ
2.4 种群间的分子变异
基于mtDNACOⅠ和COⅡ联合序列分析,8个茶棍蓟马地理种群间的分子空间变异结果见表5,K=2作为最佳分组数,group 1包括SCLS、海南五指山种群(HNWZS)、GXWZ、广东清远种群(GDQY)、GZSN和GZMT 6个种群,group 2包括YNPE和YNBN 2个种群。进一步AMOVA分析结果显示(表6),各组间种群的遗传分化系数FCT=0.84922(P<0.05),
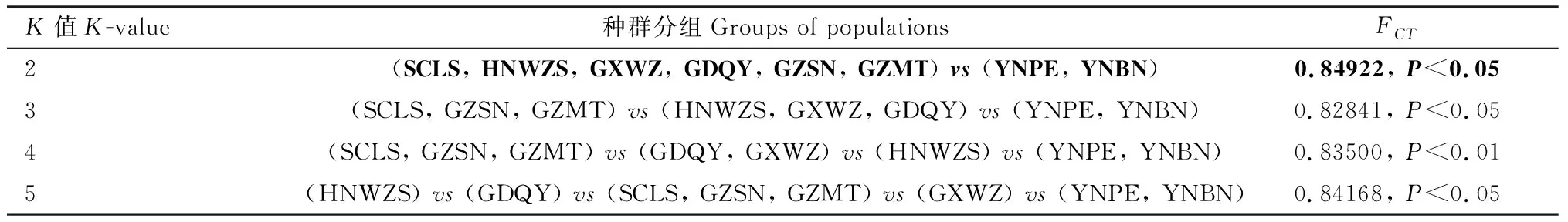
表5 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群的SAMOVA分析Table 5 SMOVA analysis of geographical populations of Dendrothrips minowai in South Chinabased on the combined sequence of mtDNA COⅠ and COⅡ

表6 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群分子方差分析(AMOVA)Table 6 Analysis of molecular variance (AMOVA) of geographical populations of Dendrothrips minowai in South Chinabased on the combined sequence of mtDNA COⅠ and COⅡ
组内不同种群间的遗传分化指数FSC=0.48725(P<0.01),种群内遗传分化系数FST=0.92269(P<0.01)。方差组分分析显示,组间的变异率占总体变异率的84.92%,组内种群间的变异占7.35%,种群内的变异占7.73%,说明群体总变异主要来源是组间变异。
基于mtDNACOⅠ和COⅡ联合序列,Mantel检测结果显示,中国南方茶棍蓟马地理种群的遗传距离FST/(1+FST)与种群间地理距离的对数值的相关系数r=0.5029(P<0.01)(图1: A),存在显著的正相关,说明8个茶棍蓟马不同地理种群之间存在显著的地理隔离现象。进一步分析茶棍蓟马的扩散趋势表明,8个茶棍蓟马地理种群采样地点的经度与单倍型多样性存在不显著的负相关(r=-0.3718;P>0.05)(图1: B)。
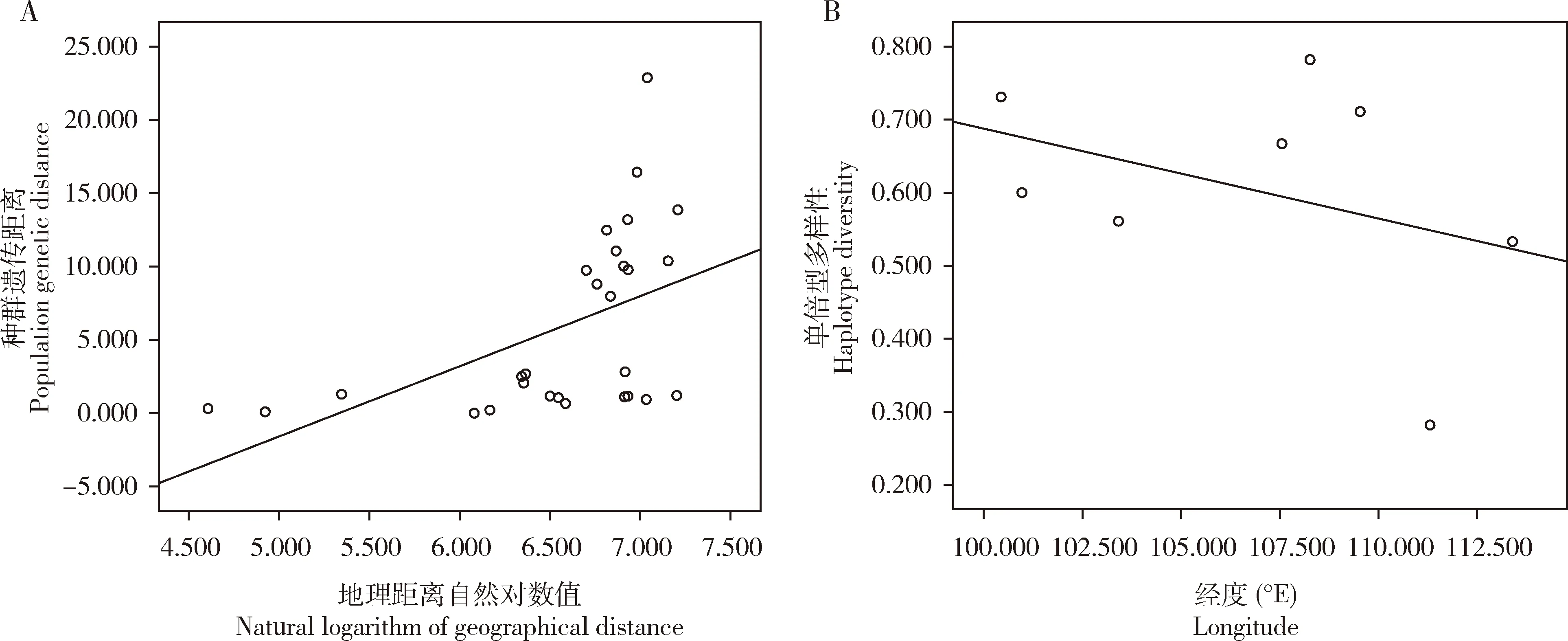
图1 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群地理距离自然对数值与遗传距离的相关性(A)和采样经度与单倍型多样性的相关性(B)Fig.1 Correlation between the natural logarithm of geographical distance and the genetic distance (A), and between longitudeand haplotype diversity (B) of geographical populations of Dendrothrips minowai in South Chinabased on the combined sequence of mtDNA COⅠ and COⅡ
2.5 茶棍蓟马地理种群单倍型系统发育
基于茶棍蓟马mtDNACOⅠ和COⅡ联合序列构建的不同单倍型系统发育树(图2)显示,所有单倍型与外群具有明显的区分,系统发育树在整体上可分为明显的2支,其中第1支包含Hap1-Hap16共计16种单倍型,第2支包含Hap17-Hap22共计6种单倍型。两个分支间的K2P遗传距离为0.014。单倍型中介网络图(图3)的聚类结果与系统发育树结果一致,茶棍蓟马的8个地理种群个体在整体上聚为2支,其中YNPE和YNBN种群(单倍型Hap17-Hap22)单独聚为一支。此外,以上聚类结果与SAMOVA分子空间变异分析的分组结果(表5)一致。

图2 邻接法构建的基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群22个单倍型的系统进化树Fig.2 Phylogenetic tree of 22 haplotypes of geographical populations of Dendrothrips minowai in South China constructedby neighbor-joining method based on the combined sequence of mtDNA COⅠ and COⅡScritothrips dorsalis (NC_025241.1): 茶黄蓟马mtDNA COⅠ和COⅡ的联合序列(GenBank登录号: NC_025241.1) (外群) Combined sequence of mtDNA COⅠ and COⅡ of Scirtothrips dorsalis (GenBank accession no.: NC_025241.1) (outgroup).Hap1-Hap22: 22个单倍型22 haplotypes.下同The same below.

图3 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群的单倍型中介网络图Fig.3 Median-joining haplotype network of geographical populations of Dendrothrips minowai in South Chinabased on the combined sequence of mtDNA COⅠ and COⅡ圆面积代表单倍型出现频率,彩色扇形面积代表各种群在同一单倍型中所占的比例。Circle area is proportional to haplotype frequency, while colored portions represent the proportion of the same haplotype that occurs in each region.
2.6 种群迁移动态与历史动态
基于mtDNACOⅠ和COⅡ联合序列的中国南方茶棍蓟马地理种群间有效迁移率(M)结果显示(表7),各种群间的迁移率范围为4.000(MSCLS→GXWZ)~999.333(MGZMT→SCLS)。 另外,各地理种群之间存在迁移率不对称的现象,如GDQY迁移到GXWZ的迁移率较高(MGDQY→GXWZ=816.667),而GXWZ迁移到GDQY的迁移率较低(MGXWZ→GDQY=126.667);GZSN迁移到SCLS的迁移率高(MGZSN→SCLS=999.333),而SCLS迁移到GZSN的迁移率较低(MSCLS→GZSN=117.333)。 云南两个种群之间发生的迁移率相对较高(MYNPE→YNBN=736.000,MYNBN→YNPE=807.333),而这两个种群与其他种群之间的迁移率相对较低。有效迁移率的结果整体上与FST、Nm(表4)及单倍型网络图(图3)的结果基本保持一致。
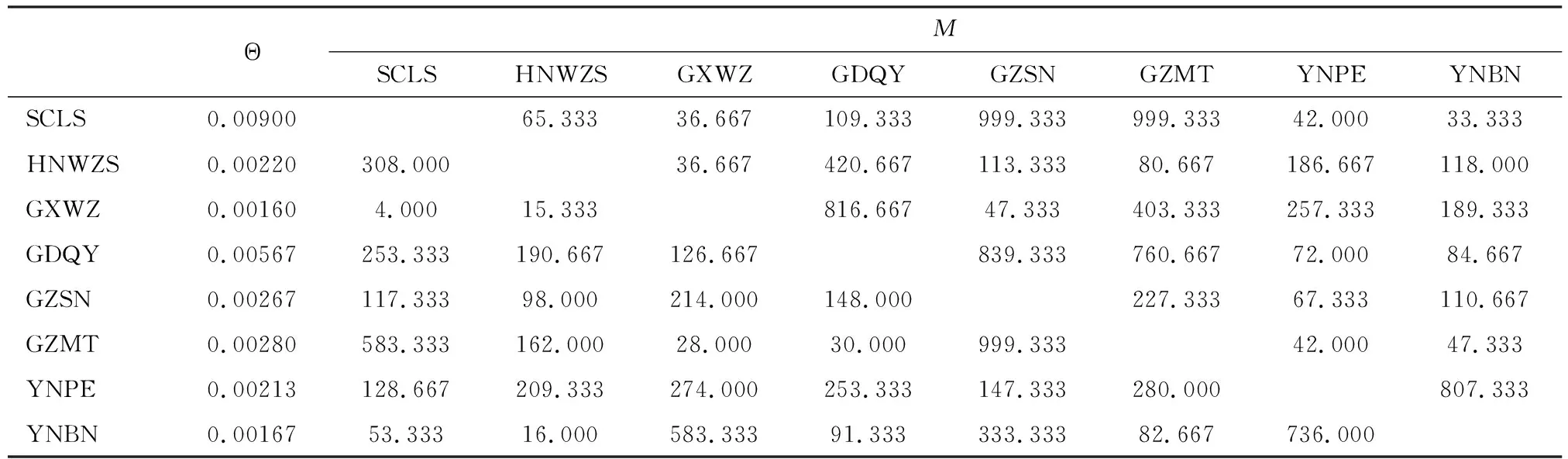
表7 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马有效种群大小(Θ)及种群间有效迁移率(M)Table 7 Effective population size (Θ)and effective immigration rate (M) among populations of Dendrothrips minowaiin South China based on the combined sequence of mtDNA COⅠ and COⅡ
中性检验结果表明,基于mtDNACOⅠ和COⅡ联合序列将8个种群作为一个整体进行分析时,Taijima’sD和Fu’sFs均未达到显著性水平(表3),以组为单位进行分析时,group 1的Taijima’sD为负值,Fu’sFs为显著负值(P<0.01),group 2的Taijima’sD和Fu’sFs均负值,但未达到显著性水平。整体种群和group 2的错配分布曲线呈多峰(图4: A, C),group 1的错配分布曲线呈单峰(图4: B),表明group 1种群(除云南2个种群YNPE和YNBN以外)近期可能发生了扩张。
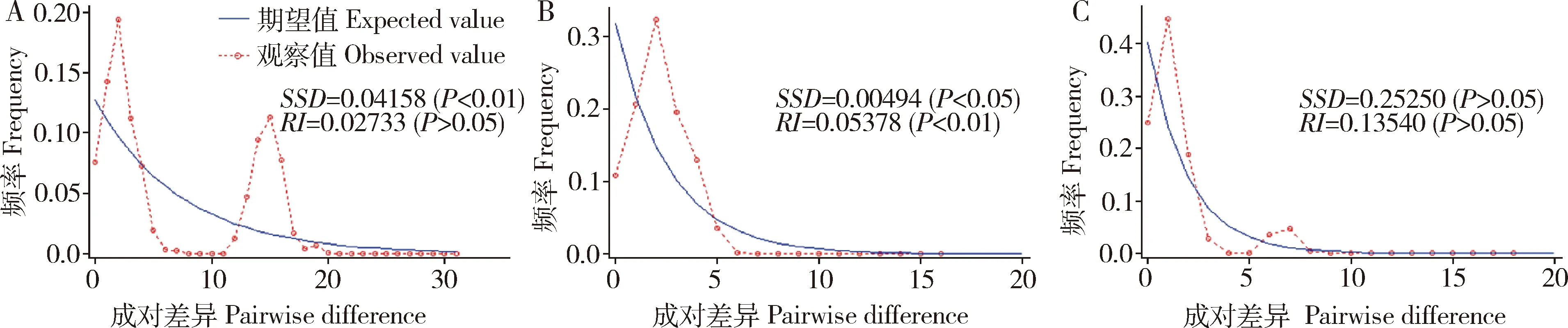
图4 基于mtDNA COⅠ和COⅡ联合序列中国南方茶棍蓟马地理种群的错配分布曲线Fig.4 Mismatch distribution curve of geographical populations of Dendrothrips minowai in South Chinabased on the combined sequence of mtDNA COⅠ and COⅡA: 总群体Total population; B: Group 1; C: Group 2.
3 讨论
线粒体基因是评价昆虫种群遗传多样性和遗传分化的有效分子标记手段(Ariasetal., 2005; Ball and Armstrong, 2008; Puillandreetal., 2008),被广泛用于研究包括蓟马在内多种昆虫的遗传多样性与遗传结构研究(Brunneretal., 2004; Brunner and Frey, 2010; Hondelmannetal., 2017; 田虎等, 2018; 高勇富, 2019; 谢艳兰等, 2019; 王梦琦等, 2020)。本研究中茶棍蓟马mtDNACOⅠ和COⅡ基因序列的碱基组成具有明显的A/T偏好性,符合昆虫线粒体基因的特点(Simonetal., 1994)。两个基因的转换位点数量均大于颠换位点数量,与近源物种间的线粒体基因碱基差异多为转换造成的观点相符(Simonetal., 1994),同时也表明茶棍蓟马COⅠ和COⅡ基因序列均未达到饱和状态,可用于种群遗传多样性分析。基于mtDNACOⅠ和COⅡ基因分析分别检测到茶棍蓟马的单倍型数量分别为11种和10种,其中mtDNACOⅠ基因的单倍型数量与贵州茶棍蓟马种群基本保持一致,而mtDNACOⅡ基因的单倍型数量略高于贵州茶棍蓟马种群(Lyuetal., 2016; 罗林丽等, 2020),说明我国南方茶棍蓟马的遗传多样性较高,在不同的地理环境下茶棍蓟马种群的遗传变异保持相对稳定,同时也适应环境产生了特定的遗传变异。Brunner和Frey(2010)利用COI基因分析北美洲西花蓟马Frankliniellaoccidentalis遗传多样性,检测到30种单倍型;田虎(2017)利用COⅠ和COⅡ基因对西花蓟马不同地理种群进行分析时,均检测到13种单倍型;谢艳兰等(2019)利用COⅠ基因对中国西南地区木领针蓟马Helionothripsmube不同地理种群进行分析时,获得16种单倍型,本研究中茶棍蓟马种群的单倍型数目明显少于其他蓟马种群,说明与其他蓟马种群相比,我国茶棍蓟马的遗传多样性相对偏低,种群可能在某个阶段经历过“瓶颈效应”, 或者种群可能正处于产生适应性进化的时滞阶段。
单倍型多样性 (Hd) 和核苷酸多样性 (π) 是衡量种群mtDNA遗传多样性的两个重要指标(Grant and Bowen, 1998),Grant和Bowen根据以上两个指标将种群的遗传多样性分为Hd和π均低、高Hd低π、 低Hd高π、Hd和π均高4种类型。本研究中,除GXWZ外, 其他地理种群均呈现高Hd值和低π值,总群体也呈现高Hd值和低π值(表3),可以推测除GXWZ外中国南方几省的茶棍蓟马种群可能在近期呈现快速扩张模式,种群数量快速增长导致新突变的积累,但核苷酸突变积累时间尚不足。总群体的单倍型多样性指数较高(Hd=0.924),表明茶棍蓟马具有较高的多态性,同时也在一定程度上说明了茶棍蓟马较强的适应能力和遗传变异潜力。GXWZ的Hd值和π值均较低(Hd=0.282,π=0.00025),从单倍型数量来看,GXWZ单倍型数目仅有两种,且Hap9仅为GXWZ独有(图3),这种独有的单倍型可能是茶棍蓟马迁移到广西梧州的时间较短,或者是其对当地环境适应能力较差引起的,因此可以推测该地的茶棍蓟马种群遗传多样性是仅由单一或较少数量的群体所产生和形成的“建立者效应”,或者当地种群在近期种群发展经历了“瓶颈效应”。AMOVA分析表明中国南方8个茶棍蓟马地理种群的遗传变异主要源于组间(组间变异率占总体的84.92%),且两个组间存在显著的遗传结构(FCT=0.84922,P<0.05)(表6)。种群历史动态分析显示,group 1的中性检验Fu’sFs为显著负值(P<0.01)(表3),错配分布曲线呈单峰(图4: B),说明group 1种群(除云南两个种群以外的其他种群)可能近期发生了扩张,这与近几年观察到的茶棍蓟马在几个省份危害日益严重的情况保持一致。从单倍型系统发育树(图2)和中介网络图(图3)可以看出,云南省YNBN和YNPE两个种群形成了明显的地理族群,而其他种群则呈现相对散布的格局,云南省YNBN和YNPE两个种群表现出的差异性可能是种群为适应当地的特殊地理、气候而发生了适应性分化。
物种在迁移、扩散的过程中往往会受到各种限制,从而导致遗传多样性发生变化,例如,由于不同地理环境的异质性,同一物种在不同环境中生存和繁衍往往会受到各种选择压力,不同地理种群间可能因距离而缺乏充分的基因交流,从而导致种群的遗传多样性和遗传结构表现出差异,因此,地理距离隔离被认为是影响种群遗传结构与遗传多样性的重要因素之一(Bickhametal., 2000; Zhengetal., 2013)。张利娟等(2012)利用线粒体COⅠ基因对云南省榕母管蓟马Gynaikothripsficorum不同地理种群的遗传分化进行分析,发现各地理种群间缺乏明显的地理分布格局;而谢艳兰等(2019)利用线粒体COⅠ基因对中国西南地区木领针蓟马不同地理种群进行分析,表明地理隔离可能是造成不同地理种群产生较大遗传分化的主要因素。本研究中,Mantel检验结果显示,中国南方茶棍蓟马8个种群存在显著的距离隔离现象(r= 0.5029,P<0.01)(图1: A),单倍型系统进化树和中介网络图也显示云南YNBN和YNPE两个茶棍蓟马种群与其他种群具有明显的差异。地理隔离的主要特征是种群的遗传分化程度会随着种群地理距离的的增大而增大(Kimura and Wesis, 1964),根据迁移率的分析结果(表7)可以看出,若以最早暴发茶棍蓟马的贵州湄潭为起点,在一定程度上距离该地区越远,种群的遗传分化就越大,因此,云南种群YNBN和YNPE的分化程度较大。但值得注意的是,HNWZS与GZMT的地理距离明显大于云南种群YNBN和YNPE,但YNBN和YNPE两个种群与GZMT的遗传分化却明显高于HNWZS与GZMT的遗传分化。自然界中茶棍蓟马的迁飞能力较弱,无法自身完成远距离迁移,因此我们推测茶棍蓟马的扩散传播除受距离因素影响外,还受人类活动、气候等因素的综合影响。
本研究所用茶棍蓟马样本的采集地局限于中国南部的贵州、四川、广西、广东、海南和云南6个省份,且其中4个省份的样本仅限于一个采集地,在遗传多样性和遗传分化上的解释可能会出现偏差。关于中国南方乃至全国范围内茶棍蓟马种群的遗传变异和地理种群分化格局的深度解析,可能需要扩大样本采集的范围,同时结合更多的分子标记进行系统深入研究。另外,不同宿主植物(茶树品种)对茶棍蓟马遗传分化的影响也值得进一步研究。

