H2S对盐碱混合胁迫下裸燕麦叶片脂肪酸组成的影响
刘建新,刘瑞瑞,贾海燕,刘秀丽,卜 婷,李 娜
(甘肃省陇东生物资源保护利用与生态修复重点实验室/陇东学院生命科学与技术学院,甘肃庆阳 745000)
土壤盐碱化是限制农业发展的全球性生态问题[1]。脂肪酸是生物膜的重要组成成分,植物体内的脂肪酸通常不带支链且多为偶数碳,其中以16和18碳脂肪酸居多[2]。研究表明,盐胁迫下,植物脂肪酸含量和组成会发生改变[3],并且不同植物通过膜脂比例及不饱和脂肪酸调控膜的通透性,从而赋予其不同的耐盐能力[4]。Zhang等[5]指出,盐胁迫下质膜的流动性与脂肪酸不饱和度呈正相关。Wu等[6]发现,膜脂饱和度的增加使生物膜更易形成凝胶态而降低膜流动性,从而减少Na+和Cl-的通透率。可见,植物脂肪酸组成对于植物的盐碱适应性尤为关键,探究盐碱胁迫下植物脂肪酸组成对深入了解植物耐盐碱机制具有重要意义。
硫化氢(hydrogen sulfide,H2S)是在生物体内发现的第3种气体信号分子,它参与调控植物多种生理过程[7],并能缓解干旱[8]、低温[9]和重金属[10]等逆境对植物的伤害。研究表明,内源H2S通过耦合氧化还原平衡和抑制K+外流能够提高紫花苜蓿(Medicagosativa)耐盐性[11];外源H2S可维持盐胁迫下黄瓜(Cucumissativus)Na+/K+平衡和提高氧化应激反应能力[12];通过Na+/H+逆向转运蛋白和H+-ATP酶基因表达调控维持大麦(Hordeumvulgare)Na+/K+平衡[13];增强盐胁迫茶树(Camelliasinensis)抗氧化能力[14];提高盐胁迫小麦(Triticumaestivum)光合效能[15]。H2S是否参与盐碱混合胁迫下植物脂肪酸组成的调控,迄今尚未见报道。裸燕麦(Avenanuda)是禾本科燕麦属具有营养保健功能的西北优势特色作物[16],耐受盐碱和土壤贫瘠的能力强[17],其籽粒富含黄酮和膳食纤维,具有降低血清胆固醇和血糖的作用[18]。盐碱混合胁迫是我国西部盐碱化土地裸燕麦生长发育的重要限制因素。因此,本试验模拟甘肃省中部裸燕麦种植地盐碱环境,采用盆栽方式,通过叶面喷施H2S供体硫氢化钠(NaHS),研究外源H2S对盐碱混合胁迫下裸燕麦脂肪酸组成的影响,旨在为揭示H2S增强植物耐盐碱机制提供理论依据。
1 材料与方法
1.1 试验材料
试验于2020年4-8月在甘肃省陇东生物资源保护利用与生态修复重点实验室科技园进行。供试材料为裸燕麦品种定莜9号,为2019年甘肃省定西市通渭县什川镇阳坡村试验基地收获的种子。NaCl、Na2SO4、Na2CO3、NaHCO3、NaHS和H2S合成抑制剂羟胺(hydroxylamine,HA)购自上海生物工程有限公司。模拟甘肃省中部裸燕麦种植地盐碱含量和组成,按摩尔比为NaCl∶Na2SO4∶Na2CO3∶NaHCO3=12∶8∶1∶9配制50 mmol·L-1盐碱混合溶液(浓度由预试验确定,pH=8.73)[19]。
1.2 试验设计
挑选饱满一致的定莜9号健康种子,用 2.0%(V/V)NaClO表面消毒10 min,自来水冲洗干净后播种在配有底盘的塑料盆(口径23 cm,高26 mm)中;以珍珠岩作基质,每盆播约50粒,浇水后露天培养;苗齐后定苗,每盆保留整齐壮苗20株。幼苗二叶期后用Hoagland营养液培养,培养至抽穗期进行试验处理。
试验设置7个处理:(1)对照(CK):根部浇灌Hoagland营养液+叶面喷施蒸馏水;(2)盐碱混合胁迫(salt-alkali mixed stress,SA):根部浇灌含50 mmol·L-1盐碱混合溶液的Hoagland营养液+叶面喷施蒸馏水;(3)SA+NaHS:根部浇灌含50 mmol·L-1盐碱混合溶液的Hoagland营养液+叶面喷施50 μmol·L-1NaHS;(4)SA+HA:根部浇灌含1 mmol·L-1HA和50 mmol·L-1盐碱混合溶液的Hoagland营养液+叶面喷施蒸馏水;(5)SA+NaHS+HA:根部浇灌含1 mmol·L-1HA和50 mmol·L-1盐碱混合溶液的Hoagland营养液+叶面喷施50 μmol·L-1NaHS;(6)NaHS:根部浇灌Hoagland营养液+叶面喷施50 μmol·L-1NaHS;(7)HA:根部浇灌含1 mmol·L-1HA的Hoagland营养液+叶面喷施蒸馏水。
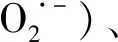
1.3 植株干重测定
采用烘干法测定植株干重[20]。
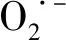
1.5 脂肪酸组分测定
1.5.1 样品前处理
称取样本50 mg于2 mL离心管中,加1 mL氯仿-甲醇(2∶1)溶液,加入3颗钢珠,放入高通量组织研磨仪中60 Hz震荡1 min,重复2次;室温超声30 min,12 000 r·min-14 ℃离心5 min,取全部上清液于15 mL离心管中;加入2 mL 1%硫酸甲醇溶液,充分混匀震荡1 min;80 ℃水浴锅中酯化30 min;取出后冷却,加入1 mL正己烷萃取;再加入5 mL ddH2O(4 ℃)洗涤,12 000 r·min-14 ℃离心10 min;吸取700 μL上清液于2 mL离心管中,再加入100 mg无水硫酸钠粉末除去多余水分,振荡混匀30 s,12 000 r·min-1离心5 min;精确吸取300 μL上清液于2 mL离心管中,加入15 μL 500×10-6g·mL-1水杨酸甲酯作内标,振荡混匀10 s,精准吸取250 μL上清液加入到检测瓶中。
1.5.2 气相色谱-质谱(GC-MS)联用检测
用Trace 1310-ISQ 7000气-质联用仪(Thermo,美国)采集数据。色谱条件:色谱柱Thermo TG-FAME毛细管柱(50 m×0.25 mm ID×0.20 μm);进样量1 μL,分流比8∶1。进样口温度 250 ℃,离子源温度230 ℃,传输线温度250 ℃,四极杆温度150 ℃。程序升温起始温度80 ℃,保持1 min;以20 ℃·min-1升至160 ℃,保持1.5 min;以3 ℃·min-1升至196 ℃,保持8.5 min;最后以20 ℃·min-1升至250 ℃,保持3 min。载气为氦气,载气流速0.63 mL·min-1。MS条件:电子轰击电离(EI)源,SIM扫描模式,电子能量70 eV。
1.5.3 定性定量分析
52种脂肪酸甲酯混标溶液用正己烷配置成0.5、1、5、10、25、50、100、250、500、1 000、2 000 μg·mL-1混合标准浓度梯度。母液保存于 -80 ℃,工作标准溶液现配现用。对脂肪酸标准液的系列浓度分别进行GC-MS检测,以标准品的浓度为横坐标,标准品与内标的峰面积比值为纵坐标得到各物质的线性回归方程。根据建立的样品前处理及仪器分析方法,对所有样品进行定量分析,得到各脂肪酸含量,并计算脂肪酸不饱和度(UFA/SFA)和双键指数(double bond index,DBI),计算公式:UFA/SFA=不饱和脂肪酸(UFA)总量/饱和脂肪酸(SFA)总量;DBI=[Σ(UFA含量×双键数)]/SFA总含量。
1.6 数据分析
运用Excel 2007整理数据,用SPSS 20.0和Duncan进行方差分析和多重比较,结果以平均值±标准差表示。
2 结果与分析
2.1 H2S对盐碱混合胁迫下定莜9号叶片和MDA含量及植株干重的影响
表1 不同处理下裸燕麦叶片和MDA含量及植株干重Table 1 Contents of H2O2 and MDA in leaves and plant dry weight of Dingyou 9 under different treatments
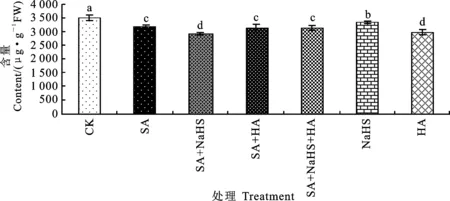
图柱上不同字母表示处理间差异显著(P<0.05)。下同。Different letters above columns mean significant difference among treatments(P<0.05).The same below.图1 不同处理下裸燕麦叶片总脂肪酸含量Fig.1 Total fatty acid content in naked oat leaves under different treatments
2.2 H2S对盐碱混合胁迫下定莜9号叶片总脂肪酸含量的影响
如图1所示,CK处理叶片中脂肪酸含量为 3 523.16 μg·g-1FW;SA处理的脂肪酸含量为 3 177.01 μg·g-1FW,与CK相比显著降低;与SA处理相比,SA+NaHS处理下脂肪酸含量显著下降(7.71%)。SA+HA处理的脂肪酸含量与SA处理相比无显著差异。与SA+NaHS处理相比,SA+NaHS+HA处理的脂肪酸含量显著提高(7.26%)。单独NaHS或HA处理与CK相比,脂肪酸含量均显著降低。
2.3 H2S对盐碱混合胁迫下定莜9号叶片脂肪酸组分含量的影响
由表2可知,CK处理叶片中共检测到50种脂肪酸组分,其中含量大于50.00 μg·g-1FW的组分有7种,表现为C16∶0(棕榈酸)>C18∶3N3(α-亚麻酸)>C18∶0(硬脂酸)>C20∶1(顺-11-二十碳烯酸)>C18∶2N6(亚油酸)>C15∶1T(反-10-十五烯酸)>C14∶1T(反-9-肉豆蔻烯酸)。其中C16∶0的含量占总脂肪酸含量的33.77%,C18∶3N3和C18∶0分别占总脂肪酸含量的 22.91%和19.87%;C20∶1和C18∶2N6的含量占比分别是6.01%和 4.06%;C15∶1T和 C14∶1T的含量占比分别为2.14%和1.62%。C10∶0(癸酸)、C11∶0(十一烷酸)、C21∶0(二十一烷酸)和C23∶0(二十三烷酸)4种脂肪酸的含量小于1.00 μg·g-1FW,均低于总脂肪酸含量的0.02%。另外,有39种脂肪酸的含量在 1.00~50.00 μg·g-1FW,占总脂肪酸含量的 9.58%。
不同处理引起定莜9号叶片脂肪酸组分含量发生明显变化(表2)。与CK相比,SA处理的C12∶0和C23∶0两种脂肪酸含量显著升高;C13∶0、C14∶1T等20种脂肪酸含量显著下降,其中5种脂肪酸(C14∶1T、C16∶0、C18∶0、C18∶2N6和C18∶3N3)含量大于50.00 μg·g-1FW,其他15种脂肪酸含量均在1.00~ 50.00 μg·g-1FW之间;另有28种脂肪酸含量无显著变化。与SA处理相比,SA+NaHS处理使5种脂肪酸C16∶0、C18∶1N12、C18∶1N7、C18∶2N6和C18∶3N3含量显著下降,其中有3种脂肪酸C16∶0、C18∶2N6和C18∶3N3含量在50.00 μg·g-1FW以上,2种脂肪酸C18∶1N12和C18∶1N7含量在10.00~20.00 μg·g-1FW之间;其他45种脂肪酸含量变化不显著。与SA处理相比,SA+HA处理下C8∶0、C14∶1T等21脂肪酸含量显著下降,29种脂肪酸含量变化不显著。与SA+NaHS处理相比,SA+NaHS+HA处理的5种脂肪酸C12∶0、C15∶1T、C18∶2N6、C18∶3N3和C23∶0含量显著提高,8种脂肪酸C18∶0、C18∶1N7T、C18∶1N12、C18∶1N7、C20∶2、C20∶3N6、C24∶1和 C22∶4含量显著下降,其他37种脂肪酸含量变化不大。与CK相比,单独NaHS或HA处理仅使脂肪酸 C18∶3N6和C20∶1含量有所升高,而其他脂肪酸含量均呈现不显著或显著降低趋势。
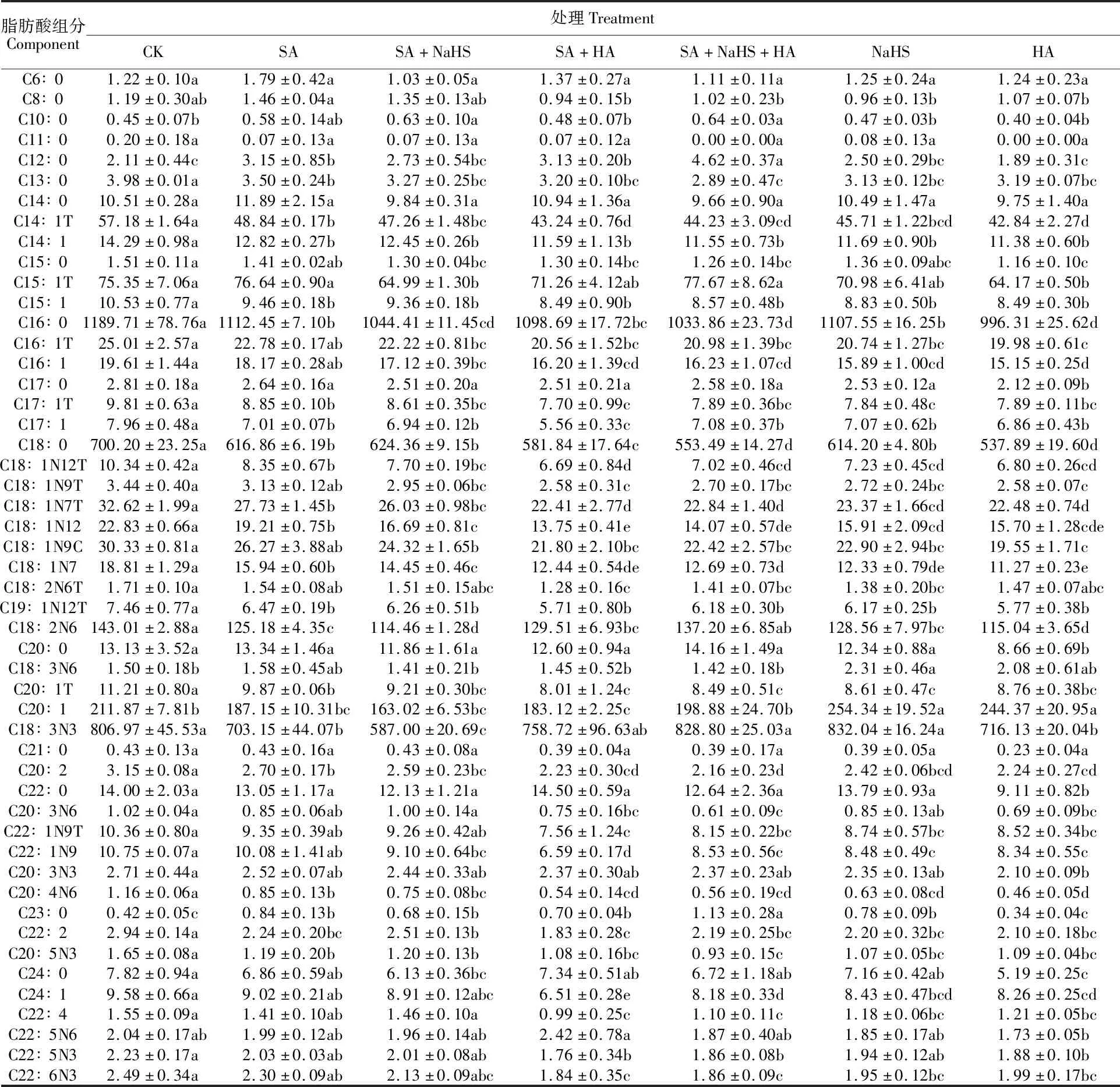
表2 H2S对盐碱混合胁迫下裸燕麦叶片脂肪酸组分含量的影响Table 2 Effect of H2S on the fatty acid component contents in naked oat leaves under salt-alkali stress μg·g-1 FW
2.4 H2S对盐碱混合胁迫下定莜9号叶片饱和脂肪酸和不饱和脂肪酸含量的影响
如图2显示,与CK相比,SA处理使定莜9号叶片饱和脂肪酸(SFA)和不饱和脂肪酸(UFA)含量显著下降;与SA处理相比,SA+NaHS处理对SFA含量无显著影响,但显著降低了UFA含量。SA+HA处理的SFA和UFA含量与SA处理相比均无显著差异。SA+NaHS+HA处理相比SA+NaHS处理的SFA含量变化不大,而UFA含量显著提高。单独NaHS或HA处理与CK相比,SFA含量均显著降低;单独NaHS处理的UFA含量与CK的差异不显著,单独HA处理的UFA含量显著降低。
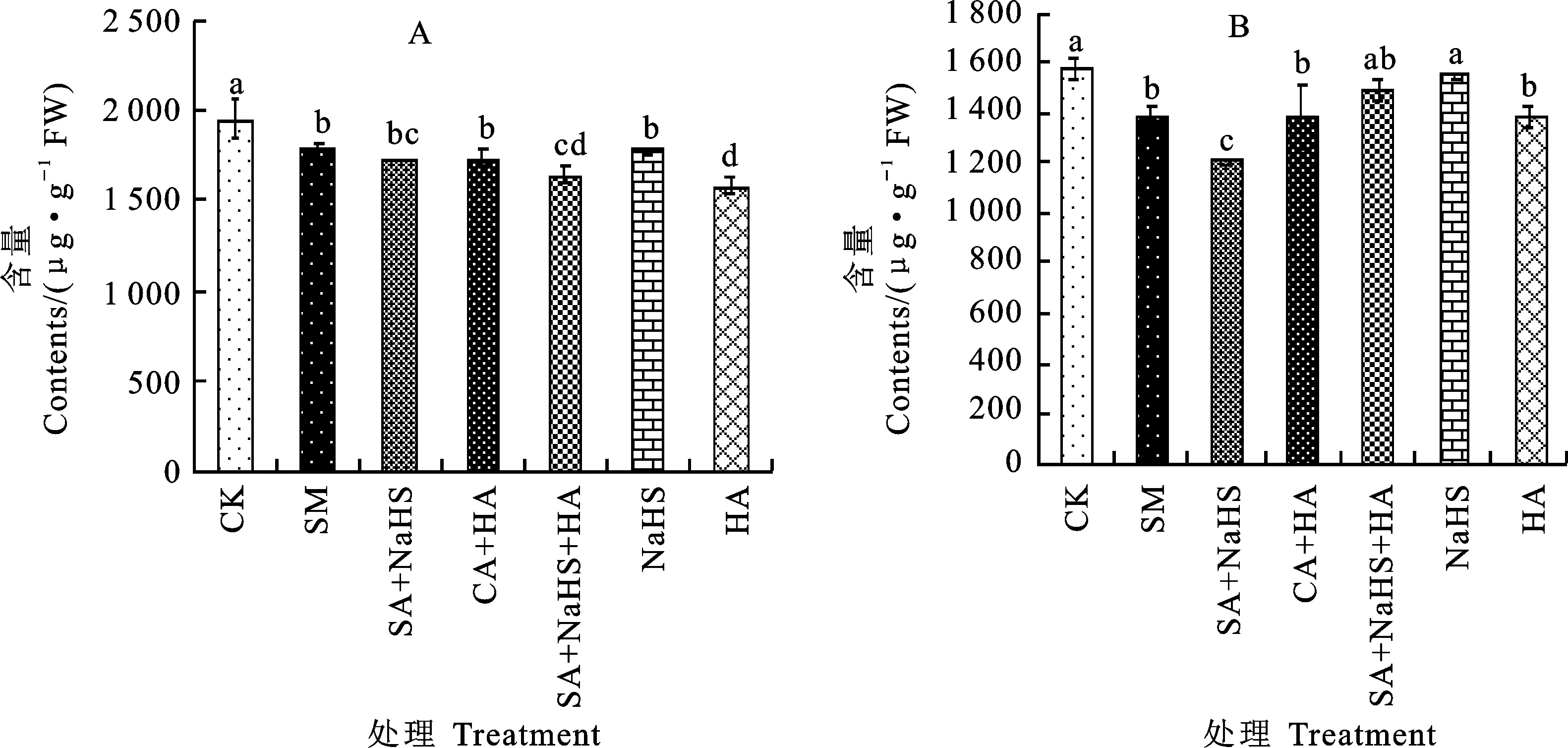
图2 不同处理下裸燕麦叶片饱和脂肪酸(A)和不饱和脂肪酸(B)含量Fig.2 Saturated fatty acid(A)and unsaturated fatty acid(B)contents in naked oat leaves under different treatments
2.5 H2S对盐碱混合胁迫下定莜9号叶片脂肪酸不饱和程度的影响
脂肪酸不饱和度(UFA/SFA)和双键指数(double bond index,DBI)反映脂肪酸不饱和水平。由图3可见,与CK相比,SA处理下定莜9号叶片UFA/SFA和DBI略有下降,但与CK的差异不显著;与SA处理相比,SA+NaHS处理使UFA/SFA和DBI均显著降低。SA+HA处理的UFA/SFA和DBI与SA处理相比均有所提高,但未达到显著水平。SA+NaHS+HA处理与SA+NaHS处理相比,UFA/SFA和DBI均显著提高。单独NaHS或HA处理的UFA/SFA显著高于CK,而DBI与CK的差异不显著。
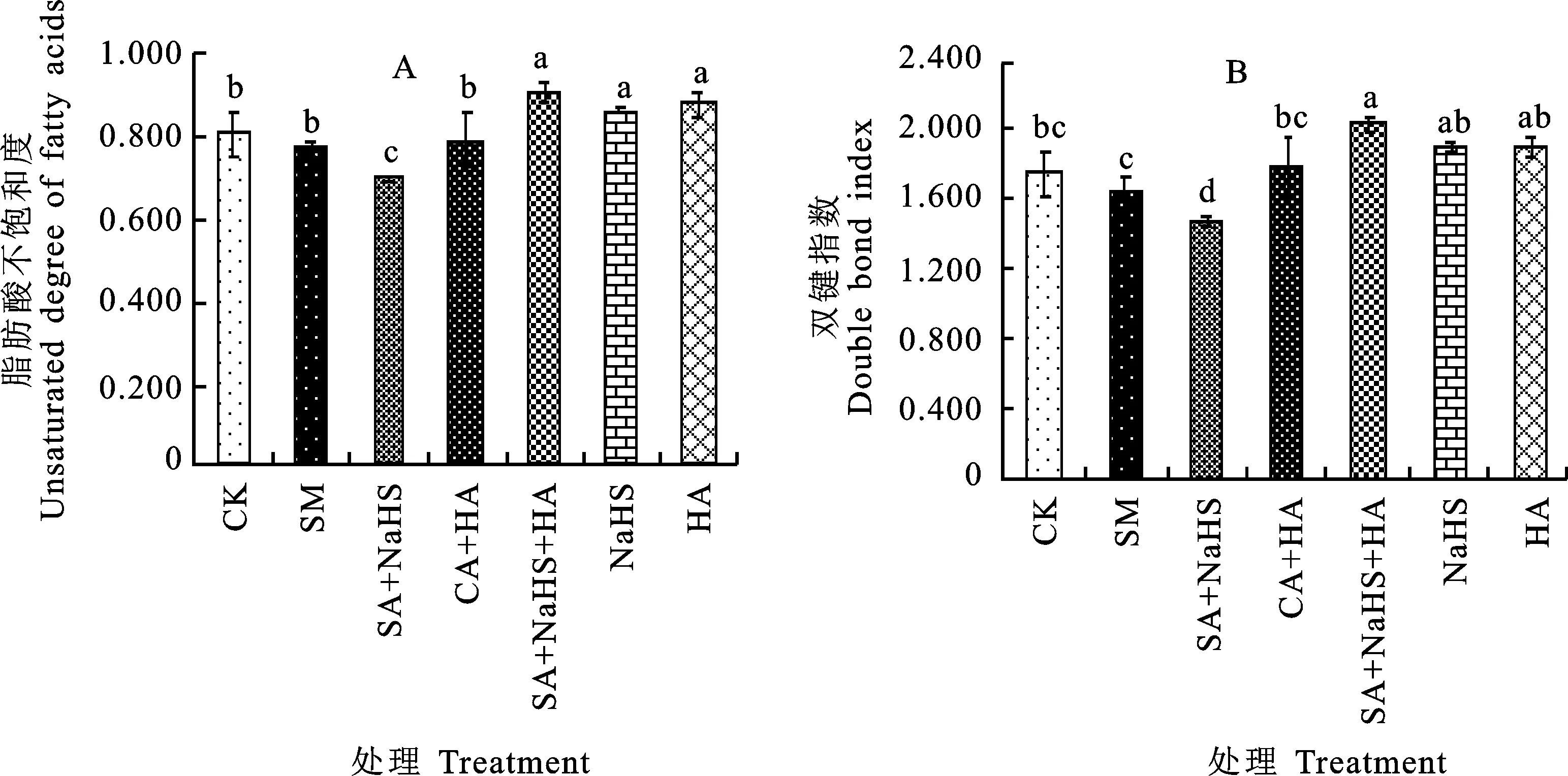
图3 不同处理下裸燕麦叶片的脂肪酸不饱和度(A)和双键指数(B)Fig.3 Unsaturated degree of fatty acids(A)and double bond index(B)in leaves of naked oat under different treatments
3 讨 论
研究证明,维持细胞膜结构的完整性和稳定性是植物抵抗盐碱胁迫的重要特征[26-27]。脂肪酸是生物膜结构的重要组成成分,脂肪酸组成与生物膜稳定性密切相关[28]。随着盐、碱胁迫强度增大,草地早熟禾(Poapratensis)不饱和脂肪酸含量下降,饱和脂肪酸含量上升[29]。盐胁迫下大麦根系液泡膜中不饱和脂肪酸与饱和脂肪酸的比例增加,液泡膜流动性降低[30]。本试验表明,盐碱混合胁迫显著降低了裸燕麦叶片饱和脂肪酸、不饱和脂肪酸和总脂肪酸含量及脂肪酸不饱和度和双键指数,增添HA对上述脂肪酸含量和脂肪不饱和度无显著影响(图1-3)。说明脂肪酸含量改变是裸燕麦适应盐碱逆境的一种重要生理机制,这一过程中抑制H2S合成不会改变脂肪酸水平。究其原因,可能是盐碱混合胁迫引起质膜NADPH氧化酶活性升高,产生大量活性氧攻击细胞膜系统[31],造成膜脂不饱和脂肪酸双键断裂形成脂质氢过氧物,使不饱和脂肪酸组分含量下降;而抑制H2S的生成没有对此过程产生影响。盐碱混合胁迫下外施NaHS显著降低了裸燕麦不饱和脂肪酸和总脂肪酸含量,使脂肪酸不饱和度和双键指数显著下降,而饱和脂肪酸含量变化不明显;添加HA后显著逆转了NaHS的上述作用。这表明外源H2S不仅可以降低盐碱混合胁迫下裸燕麦不饱和脂肪酸含量,而且能够有效降低脂肪酸不饱和水平。有研究表明,膜脂饱和度的增加会使生物膜更易从液晶态转化为凝胶态而降低膜流动性,从而减少对Na+、Cl-的通透性[6],阻止质膜对盐分的透入和液泡中盐分向细胞质的返回,增强植物抗盐性[32]。大量研究证实,H2S能够增强植物抗盐性[11-15]。本研究结果证实H2S能够增强裸燕麦耐受盐碱混合胁迫的能力。由此推测,H2S降低膜脂不饱和脂肪酸含量和膜脂不饱和度是提高植物盐碱耐性的重要机制之一。脂肪酸不饱和度的调节通过脂肪酸去饱和酶实现,不同类型脂肪酸去饱和酶催化脂肪酸链特定位置形成双键,生成不饱和脂肪酸[33-34]。越来越多的研究证明,依赖于H2S的蛋白质硫巯基化修饰参与调节植物新陈代谢和形态建成[35]。外源H2S降低裸燕麦不饱和脂肪酸含量的可能原因是H2S通过脂肪酸去饱和酶蛋白关键Cys巯基 (-SH)修饰化为硫巯基(-SSH),从而使其活性下降所致,但具体机制尚需进一步探讨。
前人研究发现,施用适宜浓度H2S可以维持植物Na+/K+平衡和增强抗氧化能力[11-14],提高光合活性[15],诱导植物耐盐碱性增强[36]。然而,上述研究主要关注H2S对植物离子平衡、抗氧化防御及光合过程的影响,而对H2S调控植物脂肪酸代谢的研究未见报道。本试验发现,裸燕麦叶片中的主要脂肪酸有7种,分别是棕榈酸 (C16∶0)、α-亚麻酸(C18∶3N3)、硬脂酸 (C18∶0)、顺-11-二十碳烯酸(C20∶1)、亚油酸(C18∶2N6)、反-10-十五烯酸(C15∶1T)和反-9-肉豆蔻烯酸 (C14∶1T),其含量总和占检出50种脂肪酸组分总量的90.38%(表2)。盐碱混合胁迫使月桂酸(C12∶0)和二十三烷酸(C23∶0)含量升高;十三烷酸 (C13∶0)、反-9-肉豆蔻烯酸 (C14∶1T)等20种饱和或不饱和脂肪酸组分含量降低。增添HA后使辛酸(C8∶0)、反-9-肉豆蔻烯酸(C14∶1T)等21种脂肪酸组分含量显著下降。说明盐碱混合胁迫下内源H2S参与裸燕麦脂肪酸合成和转化调控。外施H2S不仅影响盐碱混合胁迫下裸燕麦总脂肪酸含量,还使脂肪酸组分含量发生显著改变。其中棕榈酸 (C16∶0)、岩芹酸(C18∶1N12)、异油酸(C18∶1N7)、亚油酸(C18∶2N6)和α-亚麻酸 (C18∶3N3)含量显著下降。添加HA后月桂酸(C12∶0)、反-10-十五烯酸(C15∶1T)、亚油酸(C18∶2N6)、α-亚麻酸(C18∶3N3)和二十三烷酸(C23∶0)含量提高;硬脂酸(C18∶0)、反异油酸(C18∶1N7T)、岩芹酸(C18∶1N12)、异油酸 (C18∶1N7)、顺-11,14-二十碳二烯酸(C20∶2)、HOMO-γ-亚麻酸 (C20∶3N6)、神经酸(C24∶1)和顺-7,10,13,16-二十二碳四烯酸(C22∶4)含量下降。可见,外源H2S主要影响盐碱混合胁迫下裸燕麦12~24碳链长脂肪酸组分水平。关于这一变化的机理,未见文献报道。而脂肪酸合成酶和去饱和酶是控制脂肪酸组分含量变化的关键,进一步研究H2S对脂肪酸合成相关酶基因的表达调控将是揭示H2S影响盐碱混合胁迫下植物脂肪酸组分变化的重点。

