不同升温速率对烟煤热解过程的影响及其动力学分析
林 彬,祁鑫鑫,王厚旺,吴 磊,王鹤寿
(1.应急管理部上海消防研究所,上海 200032;2.上海倍安实业有限公司,上海 200030;3.山东科技大学安全与环境工程学院,山东 青岛 266590)
0 引 言
热解是煤转化中最关键的步骤,主要是指煤在隔绝空气或惰性的气氛下不断加热至较高温度时,在此过程中,将会发生的一系列复杂的物理和化学变化,是煤炭加工的主要方法。例如:煤的气化、炼焦、煤的燃烧和液化在反应过程中都将会发生热解反应这一步。因此,对该工艺的深入研究,对工业生产中改善煤的燃烧、气化、液化和结焦具有一定的实际意义[1,2]。
烟煤的热解可分为挥发性物质的析出和半焦的形成,挥发分物质的析出可包括气体、水分和焦油的形成[3,4]。热重分析(Thermo-Gravimetric,TG)已被大量用作讨论热解动力学的热分析技术,主要是因为它具有很高的准确度,并提供了定量的方法来检查其过程,也可以估算有效的动力学参数(例如活化能,指前因子,各种分解反应的反应阶数n)。郭慧卿等[5]研究了升温速率对煤热解和燃烧特性的影响,根据热解数据使用一级反应方程计算了不同升温速率下动力学参数。田斌等[6]利用热重红外联用技术研究了3 种不同烟煤的热解特性和气体释放行为,得出不同烟煤的热解特性与复杂的化学结构有关。李爱蓉等[7]采用非等温热重法研究在不同得升温速率条件下,热解终温对热解过程的影响,得出热解的挥发分析出速率和升温速率以及热解终温之间的关系。在以上研究的基础上,本文采用Coats-Redfern 方法对热解反应过程进行研究和分析,并采用二级反应模型对烟煤的热解过程进行线性拟合。从微观的角度去解释煤热解转化的过程和机理。
1 实验方法与热解动力学方法
1.1 实验样品
本文实验中所用煤样全部取自于兖矿新疆矿业有限公司硫磺沟煤矿(9-15)06 的综放工作面,实验中煤样均来自此工作面。将原煤样品用球磨机进行粉碎和筛分,以获得<74 μm 的煤样品。使用WS-G818 全自动工业分析仪对实验样品进行工业分析,工业分析数据结果见表1。

表1 烟煤工业分析结果(%)
1.2 非等温热重实验
非等温热重实验使用的是由美国TA 仪器公司研发的TA Q55 型热重分析仪对煤样进行不同升温速率下的热分析,分别以20、30、40 和50 ℃/min 的升温速率升至终温1 000℃。
1.3 热解反应动力学方法
用总动力学模型来描述烟煤的热解过程[8,9],其总反应速率方程可表示为:
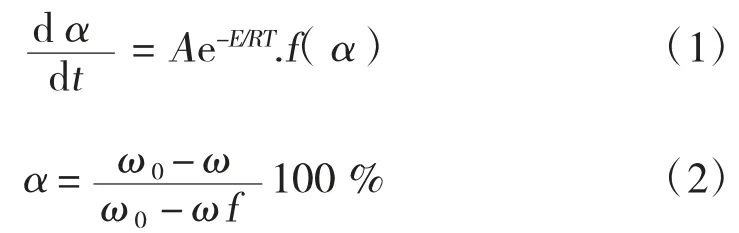
式中:α为煤热解转化率,%;t 为反应时间,min;A为指前因子,min-1,n为反应级数;E 为热解反应活化能,kJ/mol;R为气体常数,取8.314 J/(mol·K);ω0为样品初始质量,g;ω为热解过程中在某一任意时刻时的质量,g;ωf为热解结束时样品的剩余质量,g。
在非等温热解状态下,假设升温速率为常数,热解温度T 和反应时间t 成线性关系,升温速率为β;T0起始温度,则T=T0+βt。
将式子T=T0+βt带入方程(1)得到:
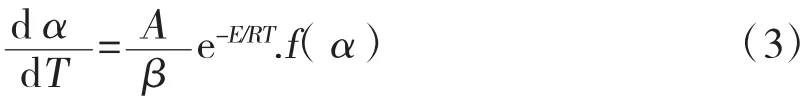
式(3)中f(α)为机理函数,假设热解反应过程为n 级反应,则f(α)=(1-α)n,对式(3)进行取对数变化得:
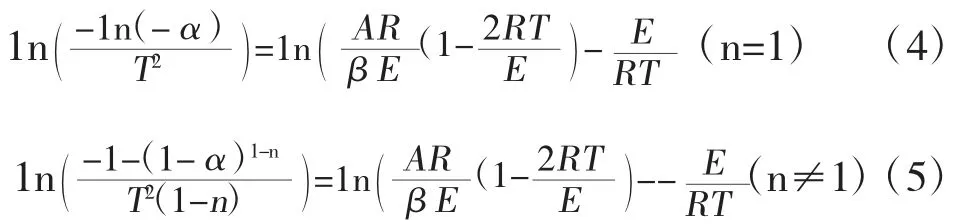
其中,式(4)、(5)为Coats-Redfern 方法的通用表达式,通常,E/RT1;即可以将式(4)右边第一项1n(AR/βE)看做常数,因此1n[-1n(1-α)/T2]可以对1/T 作出一条直线,其斜率为-E/R,截距为1n(AR/βE),从而可以计算出烟煤热解过程的活化能E 和指前因子A的大小。
2 实验结果与分析
2.1 新疆烟煤热解特性
从图1 和表2 可以看出,依据不同升温速率下的TG 和DTG 曲线可知,烟煤样品的热解过程主要是可以分为以下3 个阶段(以20 ℃/min 为例):第1阶段大致可以划分为室温~200 ℃,主要产生吸附气体的解析,试样失重率为7.465%。这一阶段可分为2个过程,从室温至120 ℃除去内部水分和些许的吸附气体。这其中的水分有一些是来自于内部水分的持续脱除(这是由于煤样含水量为4.06%左右,见表2);第2 阶段是热解的主要阶段,其温度范围为200 ℃~600 ℃,煤样失重率约为17.11%。在此过程中,热失重的速率缓慢发展,然后第2 次出现热失重速率峰值(约为492.58)。针对烟煤,随着温度大于200 ℃,慢慢将会开始热解。第3 阶段为烟煤的二次脱气阶段[10],该阶段的温度范围约为600℃~1 000 ℃。样品的失重率明显降低,失重率为10.27%。
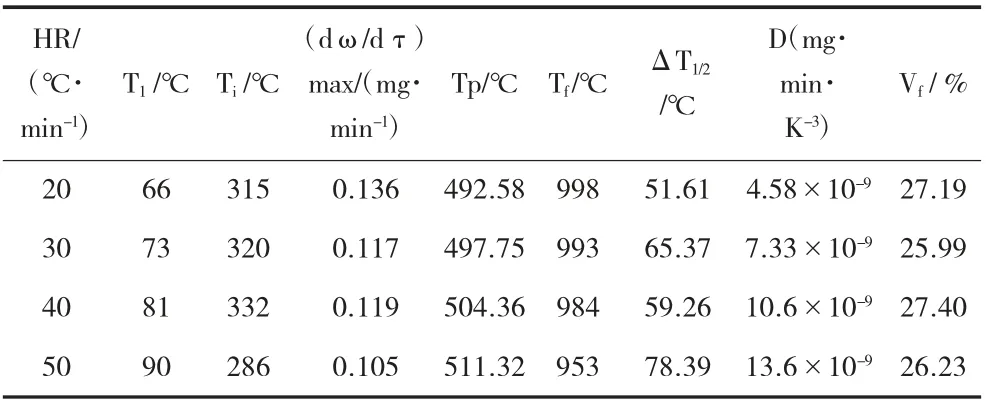
表2 烟煤的热解特性参数
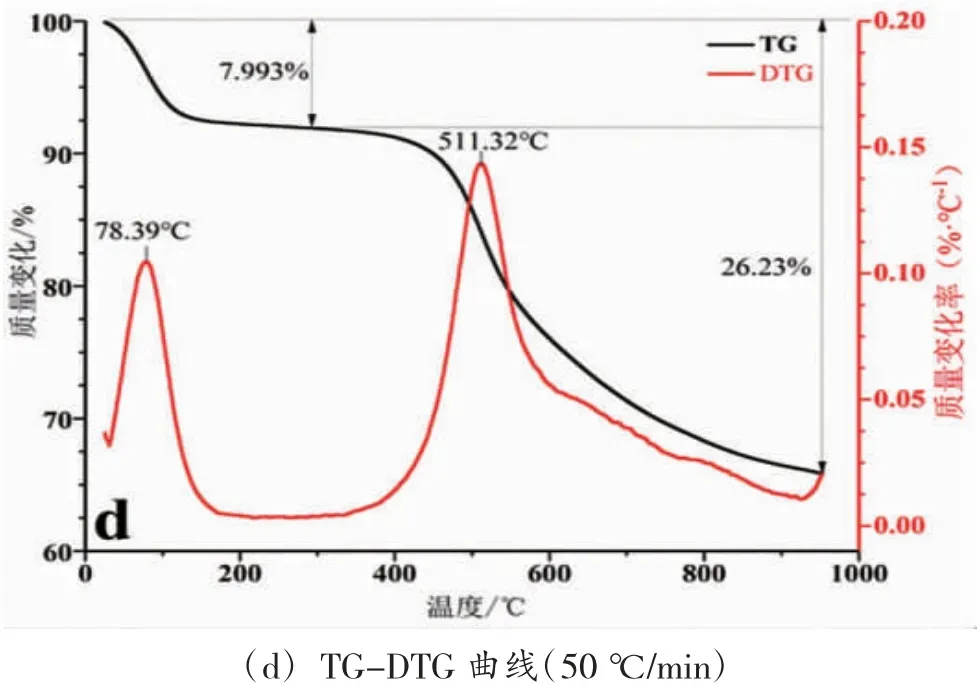
图1 烟煤在不同升温速率下热解反应的TG-DTG 曲线
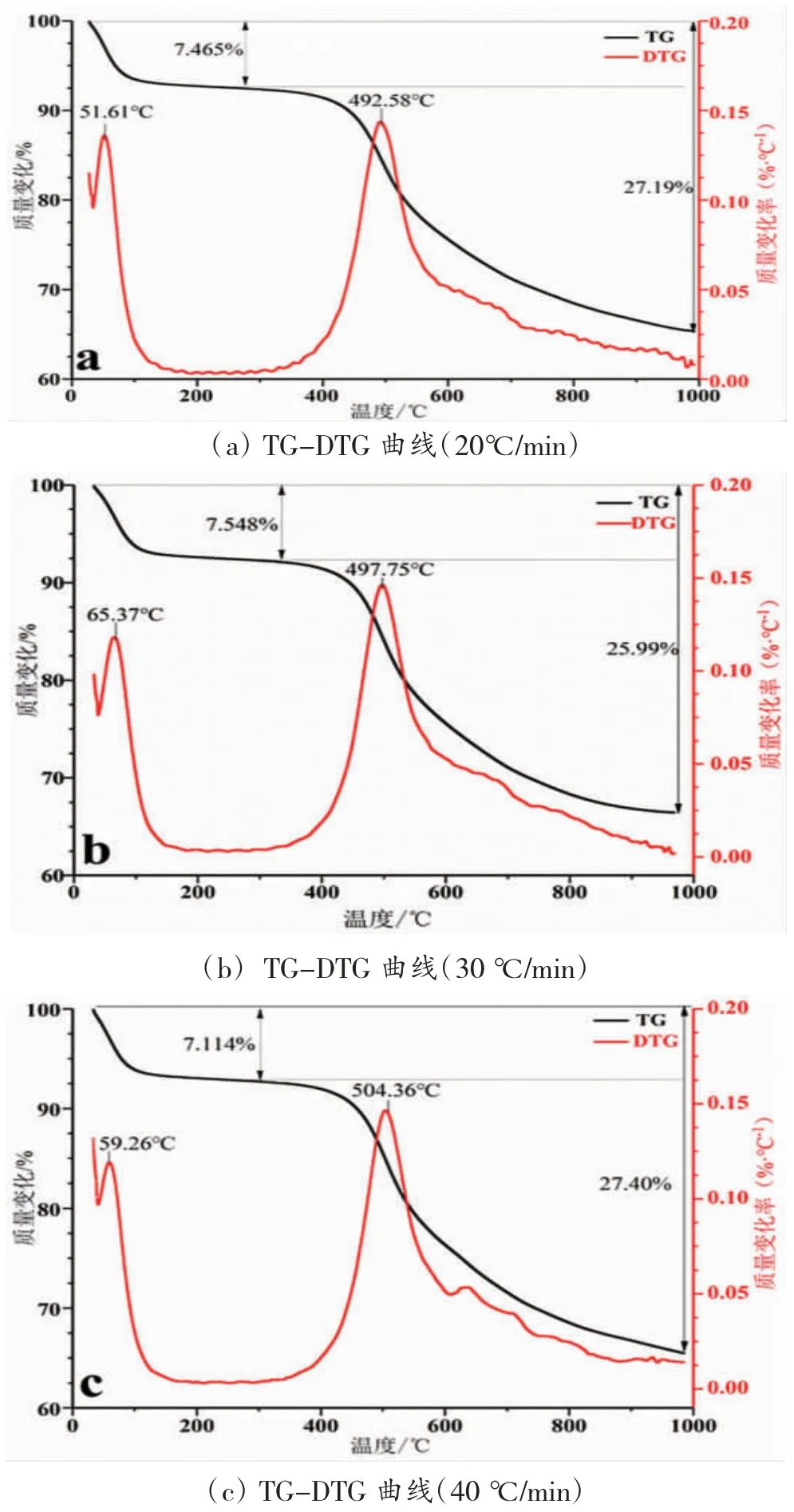
表2 对应的是烟煤热解相关的特征参数值,其中将最大挥发分析出速率的温度定义为T1;将热解开始的温度定义为Ti;热解完成时对应的温度定义为Tf;DTG 曲线的峰值温度(即最大挥发分析出速率所对应的温度)定义为Tp;最大挥发分析出速率是(dω/dτ)max;半峰宽的温度区间为ΔT1/2;热解完成时对应总的失重率是Vf;D 为挥发分热解特性指标,定义为D=(dω/dt)/TmaxTiΔT1/2,煤样的热解性随着D 的增大而变得更好[11,12]。
2.2 升温速率对热解过程的影响
比较和分析了不同升温速率下煤的TG 曲线,结果如图2(a)所示。从图中可以看出:升温速率不同但粒径相同的煤样,表现出的总质量损失率基本相同,在30 ℃/min 升温速率标准下损失率最低,为33.54%,在20 ℃/min 升温速率下损失率最高,表现为34.66%,此实验是在纯氮气惰化环境下进行的,66 %部分热解剩余是固定的灰分与碳等,相比于煤的工业分析结果略高(FCad及Aad的总量占 65.55%),此数差是由于挥发物质与部分的水份在该实验中的惰性环境中释放的不够完全,对于数据展现出的结果是可以接受的。
从图2(b)可以看出:DTG 曲线在不同升温速率下的煤样表现出相对一定的规律。DTG 曲线上的首个极小值点出现在30 ℃~45 ℃之间,此时,煤中吸附气体于解吸气体达到相对平衡状态,此后,煤样品的失重率开始增大,失重速率达到第一个极大值点,极大值点约在50 ℃~80 ℃区间内。温度的不断升高导致煤质量不断减少,将会导致失重速率的增加。煤在180 ℃时会发生干裂反应,从而破坏了煤中的稠环芳香体系桥键等官能团[13,14],进而释放出C1-C3 的烷烃等烯烃类产物,气体的吸附能力在这一阶持续升高,吸附的气体与释放的挥发气体基本维持平衡。但当温度超过200 ℃界限时,质量又呈现下降趋势,从而导致失重率变大,然后失重率的最大值出现在490℃~520℃范围内,失重速率的极大值在这里出现,这阶段中的差异十分突出,极大值的温度和升温速率有较强的联系性。
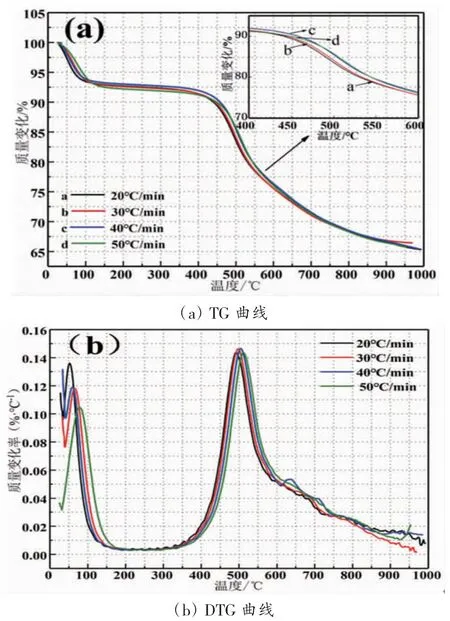
图2 不同升温速率下的TG 和DTG 曲线
根据表1 煤样的工业分析,挥发分含量(Vad)与试样的水分(Mad)总计为34.45%;从表2 可看出,样品热解在4 种升温速率下的最终失重率分别为34.67%、33.55%、33.52%和34.23%,计算得出平均失重为34.01%。两数值比较接近,这也验证说明了烟煤热解过程和热解特性参数在N2气氛下的准确性。
2.3 热解反应动力学分析
由2.2 可以得出,在烟煤热解过程中,升温速率对热解过程起到了决定性的影响。为了从理论上讨论升温速率对热解特性的影响,利用热解实验数据计算了不同升温速率下的反应动力学参数。将烟煤热解过程假设为二级化学反应,即反应级数n = 2,可以拟合出不同升温速率下热解反应动力学曲线,进而计算出动力学参数。
从表3 可知,在升温速率分别为20、30、40 和50 ℃/min 时,烟煤在不同热解阶段活化能和指前因子各不相同。通过Coats-Redfern 方法计算出来的活化能为37.72~107.42 kJ/mol,在热解的主要阶段和二次脱气阶段活化能随着转化率的增大相应地增大,最大值为107.42 kJ/mol。平均值为66.19 kJ/mol。在热解的主要阶段,热稳定性较差的基团和侧链会发生断裂。随着热解温度的升高,热解失重速率达到最大值,大部分化学键开始断裂,形成大量的活性基团。根据拟合结果和实验结果可知,将烟煤热解过程反应假设为二级反应是准确的,计算出的相关系数R2均接近于1 在此反应级数下,计算出的活化能E与指前因子A相对具有较高的可信度,可为烟煤热解过程的研究提供理论依据。
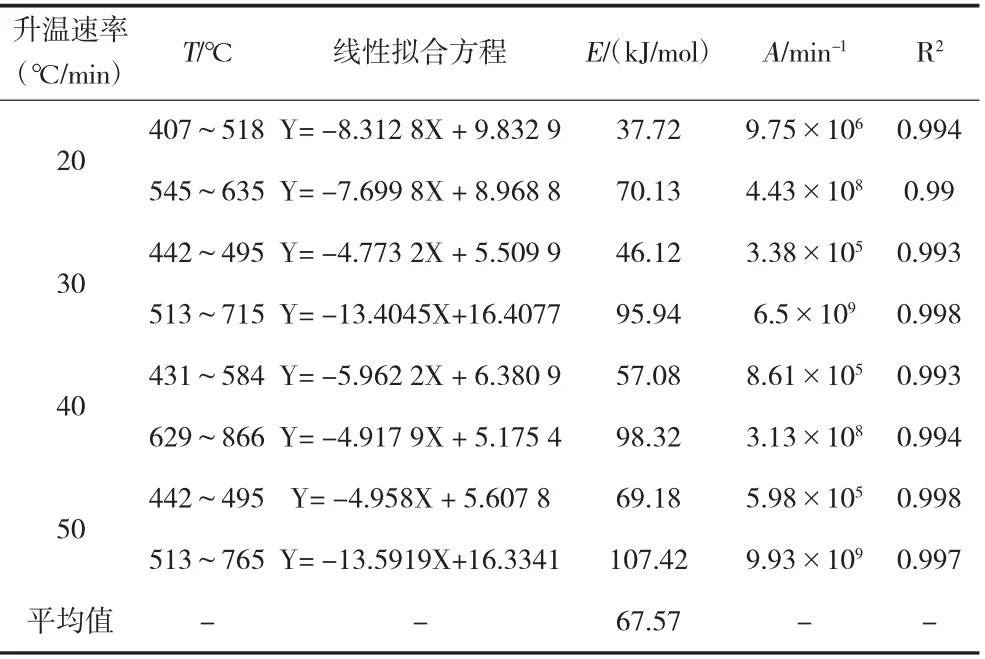
表3 不同升温速率下的热解动力学参数(n=2)
3 结 论
1)从TG、DTG 曲线可以看出,不同升温速率下的烟煤在热解过程中表现出不同的热解反应特性;烟煤热解主要分为3 个过程:热解初始阶段;热解活跃阶段;二次脱气阶段,且从DTG 曲线可以得出失重速率峰值温度主要集中在490 ℃~520 ℃之间。
2)随着升温速率增加,初始热解温度、最大失重速率的峰值温度都呈现出向高温区域迁移趋势。
3)使用Coats-Redfern 方法对烟煤热解的主要阶段和二次脱气阶段进行了动力学分析,得到了不同升温速率下的热解反应动力学参数。结果表明,在相同的升温速率下,烟煤的活化能会随着升温速率的增大而升高。活化能的平均值为66.19 kJ/mol。

