一种分离培养及鉴定小鼠牙龈间充质干细胞的方法
陈丽玲 徐振健 徐安平
间充质干细胞(MSC)具有自我更新、多能分化和免疫调节的作用。近年研究显示,MSC 可在包括变应性结膜炎、变应性鼻炎、急性青光眼、阿尔茨海默病和1 型糖尿病等多种疾病中发挥治疗作用。MSC 可以从不同的组织中分离出来,包括骨髓、脐带、胎盘、脂肪组织和人的牙龈。牙龈MSC(GMSC)是一种从牙龈组织中获得的MSC 亚群,2009 年Zhang 等首次从人牙龈组织中分离出GMSC,并证实了其表型及功能活性。与其他MSC 类似,GMSC 也具有抑制炎症和调节免疫反应的作用。小鼠和人源化动物模型研究显示,GMSC 能够通过减少效应性T 淋巴细胞、树突状细胞、巨噬细胞、破骨细胞和增加调节性T 淋巴细胞等治疗包括类风湿关节炎、1 型糖尿病、SLE、动脉粥样硬化等多种疾病。既往文献提及的小鼠GMSC 的提取方法需使用多种酶及复杂的培养基等。本研究以C57BL/6 小鼠进行实验,旨在建立更为简便、高效的GMSC 体外提取及培养体系,现报道如下。
材料与方法
一、动 物
SPF 级C57BL/6 小鼠5 只,雌雄不限,8~10周龄,体质量15~20 g,购自广东省医学实验动物中心。实验过程中严格遵循减少、替代、优化的伦理规范操作,做到充分考虑动物的利益,善待动物,防止或减少动物的应激、痛苦和伤害,尊重动物生命,采取痛苦最少的方法处置动物。
二、主要试剂
包括:α-MEM 培养基、青霉素-链霉素双抗溶液、胎牛血清(FBS),均购自美国Gibco 公司;Ⅳ型胶原酶、地塞米松、β-甘油磷酸钠、抗坏血酸、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、人胰岛素、油红O 染液,均购自美国Sigma 公司;细胞增殖及细胞毒性检测试剂盒(CCK-8 法)购自美国APExBio 公司;结晶紫染液、茜素红染液,均购自上海碧云天生物技术有限公司;抗小鼠流式抗体CD29、CD34、CD44、CD45、CD73、CD90、CD105,均购自美国BD 公司。
三、培养液配制
原代细胞培养液为α-MEM 培养基+20%FBS。完全培养液为α-MEM+10%FBS。成脂诱导液为α-MEM 培养基+10%FBS+200 μmol/L 吲哚美辛+10 mg/L 胰岛素+1 μmol/L 地塞米松+500 μmol/L IBMX。成骨诱导液为α-MEM+10%FBS+10 nmol/L地塞米松+50 mg/L 抗坏血酸+10 mmol/L β-甘油磷酸钠。
四、实验方法
1. 小鼠GMSC 的分离培养
处死C57BL/6 小鼠,取小鼠下颌骨,清除多余皮肤及肌肉组织,用含有5%双抗的磷酸盐缓冲液(PBS)冲洗下颌骨多次。用注射器针头轻轻分离磨牙区牙龈。收集分离到的组织于培养皿中,加入1 mg/L Ⅳ型胶原酶,于37 ℃中消化30 min,加入含有 FBS 的α-MEM 终止消化,离心,弃上清。将组织铺于6 孔板中,每孔加1 mL 含20%FBS 的α-MEM,置于37℃、5%CO培养箱中培养。待2~3 d 后细胞爬出,换液把剩余组织块洗出,每孔加2 mL 20%FBS 的α-MEM,3 d 换1 次液。细胞长满板底80%后传代,传代后更换为含10%FBS的完全培养液继续培养。
2. 小鼠GMSC 的增殖能力检测
按细胞增殖及细胞毒性检测试剂盒(CCK-8法)说明书进行操作,连续8 d 在同一时间使用酶标仪测量 450 nm 处的吸光度,根据结果绘制GMSC 生长曲线。
3. 小鼠GMSC 的表面标志物流式细胞术检测
将第2 代 GMSC(约1×10个细胞)细胞悬液用PBS 洗涤2 次,用100 μL PBS 重悬后分别加入 流 式 抗 体CD29、CD34、CD44、CD45、CD73、CD90、CD105,4℃避光孵育20 min 后,PBS 洗涤3次,流式细胞仪检测上述细胞表面标志物的表达。
4. 小鼠GMSC 的多向分化潜能诱导
成脂诱导分化:取第2 代GMSC 接种于6 孔板,每孔约3×10个细胞,待细胞铺满板底70%,更换培养液为成脂诱导液,每隔3 d 换1 次液。诱导21 d 后,PBS 洗涤细胞1 次,4%多聚甲醛固定30 min,去离子水洗涤2 次后油红O 染液染色20 min,蒸馏水清洗3 次,干燥后倒置显微镜下观察并拍照。
成骨诱导分化:取第2 代GMSC 接种于6 孔板,每孔约3×10个细胞,待细胞铺满板底70%,更换为成骨诱导液,每隔3 d 换1 次液。诱导28 d 后,PBS 洗涤细胞1 次,4%多聚甲醛固定30 min,去离子水洗涤2 次后茜素红染液染色30 min,蒸馏水清洗3 次,干燥后倒置显微镜下观察并拍照。
五、统计学处理
应用GraphPad Prism 8 软件进行数据分析。数据均符合正态分布,以 表示,组间比较采用t 检验,多个时间点的比较采用单因素方差分析,进一步两两比较采用LSD-t 检验。P < 0.05 为差异有统计学意义。
结 果
一、小鼠GMSC 的分离培养结果
培养2~3 d 后,普通光学倒置显微镜下可见原代细胞从组织爬出,贴壁生长,细胞呈长梭状(图1A)。可见原代细胞培养至10~14 d 时细胞铺满皿底80%(图1B、C),可进行传代培养。

图1 小鼠GMSC 的分离培养与形态(普通光学倒置显微镜)
二、小鼠GMSC 的增殖能力检测结果
CCK-8 法结果显示,GMSC 在第3~4 日增长最快,在第5~8 日增长变得缓慢,出现平台期。普通光学倒置显微镜下可见GMSC 在第3~4 日数量增长明显,在第5~8 日数量逐渐到达最大值,并进入平台期。各时间点的变化组间比较差异有统计学意义(F = 339.90,P < 0.001), 其中第0~2 日、第5~8 日的相邻时间点比较差异无统计学意义(P均> 0.05),第2~5 日相邻时间点比较差异均有统计学意义(P 均< 0.05),见图2。

图2 小鼠GMSC 的增殖能力检测结果
三、小鼠GMSC 的细胞表面标志物流式细胞术检测结果
小鼠GMSC 高表达CD29、CD44、CD90、CD105,最高的表达率达90%及以上,CD73 最高表达率高于70%,CD39 最高表达率为26.3%,同时结果显示所提取细胞几乎不表达CD34、CD45,表达率均低于5%,说明所提取的细胞纯度较高。以小鼠口腔黏膜上皮细胞为对照细胞,可见GMSC 的CD29(t = 2.686,P = 0.036)、CD44(t = 22.582,P <0.001)、CD73(t = 3.183,P = 0.019)、CD90(t =62.944,P < 0.001)、CD105(t = 8.590,P < 0.001)、CD39(t= 5.799,P < 0.001)的表达均高于对照细胞,两者CD34(t = 1.572,P = 0.140)、CD45(t =-1.643,P = 0.151)表达相似,见图3。

图3 小鼠GMSC 的细胞表面标志物流式细胞术检测结果
四、小鼠GMSC 的成脂诱导及鉴定结果
小鼠GMSC 经成脂诱导液培养21 d 后,分化为脂肪细胞并分泌出脂滴,经油红O 染液染色后,在光学显微镜下可见葡萄串状红色脂滴形成,见图4。

图4 GMSC 成脂诱导分化的鉴定(油红O 染液染色)
五、小鼠GMSC 的成骨诱导及鉴定结果
小鼠GMSC 经成骨诱导液培养后,细胞逐渐从长纺锤形变为多边形,并呈多层覆盖生长,可见陆续出现小的钙化。成骨诱导28 d 后,小鼠GMSC 经茜素红染液染色后可见红褐色钙化结节,见图5。
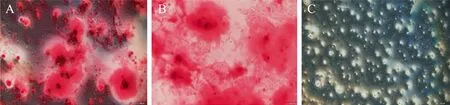
图5 GMSC 成骨诱导分化的鉴定(茜素红染液染色)
讨 论
近年来,GMSC 在自身免疫性和炎症性疾病中的抗炎和免疫调节作用越来越受到重视。与其他组织来源的MSC 相比,GMSC 具有易于分离、便于获取、增殖快、不具致瘤性、同源性好、免疫调节作用及再生功能强于其他MSC 等优点。
目前,小鼠等动物GMSC 的提取方法为组织消化法或组织块法:组织消化法使用胶原酶和分离酶消化分离的组织块,再通过过滤器获得单细胞悬液进行种板,操作步骤繁杂,且多种酶的消化易对原代GMSC 造成损伤,导致细胞提前分化失去其生物学特性;组织块法则将冲洗无菌的组织块直接种板,通过倒立培养瓶的方法获取原代细胞,该法提取细胞数量少、效率低且成功率不稳定。
本研究将2 种提取原代GMSC 的方法相结合并加以改良,对分离的牙龈组织仅用Ⅳ型胶原酶消化半小时,然后把消化后的牙龈组织直接种板,2~3 d 后可见细胞爬出。由此可见该改良方法具有以下优点:①步骤过程简单、易操作;②仅用一种消化酶,减短了消化时间,不仅减少了消化酶对原代细胞的损伤,而且节约了试剂成本;③经胶原酶处理的牙龈组织变软后再进行种板,更有利于种板后GMSC 从组织中爬出,短时间内有较高的细胞获得率,节约时间成本,同时通过换液、传代可进一步纯化细胞;④培养液成分更为简单。与组织消化法及组织块法相比,新的提取GMSC方法更为简便、易行,见表1。

表1 小鼠GMSC 的3 种分离培养方法比较
本研究中小鼠GMSC 生长曲线从一定程度上可反映GMSC 的增殖规律,第3~4 日增殖活跃,第5 日始增殖进入平台期,第7~8 日由于培养时间过长细胞生长过密,细胞开始出现凋亡,数量有少许下降。本研究所提取的细胞高表达CD29、CD44、CD90、CD105,最高表达率均高于90%,CD73 最高表达率高于70%,基本不表达造血细胞的细胞表面标志物CD34、CD45,最高表达率均低于5%,符合GMSC 细胞标志物特性,同时提示所取取的细胞纯度较高。多向分化诱导实验中,小鼠GMSC 在各自特定诱导条件下成功分化成对应组织,证实了GMSC的多向分化功能。本研究表明,改良法提取的GMSC 具有快速增殖的优点,同时通过该法所分离的细胞有较高的纯度,且能表现多向分化的干细胞特性,因此该法提取GMSC 是可行的。
对GMSC 的相关研究表明,GMSC 在伦理学、获取方法和分化潜能等方面具有明显优势,被认为是一种较好的MSC 来源,在细胞治疗、再生医学等方面具有重要的研究意义。本研究的动物GMSC 提取技术的研究与改良有助于促进各类疾病动物模型GMSC 的自体移植的实现,有利于深入研究GMSC 对疾病治疗作用的可能机制。

