电化学检测SARS-CoV-2 的无机及分析化学综合教学实验
史 铠,成 英,陈稼轩,宋九华,韩耀霞,李 艳,蒲军禹,李玉婷,胡 育※
(1.乐山师范学院 新能源材料与化学学院,四川 乐山 614004;2.绵阳普明中学,四川 绵阳 621000)
0 引言
通过大一和大二对无机化学及分析化学课程的学习,高年级的化学专业本科生十分渴望接触具有一定具有理论深度,实验难度且紧贴前沿科学研究的综合性实验。因此,教师选取合适且有特色的科研成果转化为教学综合设计性实验项目,这对于培养学生综合知识应用的能力,锻炼学生实验技能,培养学生严谨的科学态度,开阔学生的学术眼界和帮助学生考研深造具有重要的意义[1-2]。
自2019 年12 月起,严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)的爆发引发全球健康危机[3]。根据Lu 等研究者报道,SARS-CoV-2 是一种单链RNA 的病毒,并且它所具有的特异性RNA 序列是区分其它病原体的标志物[4]。SARSCoV-2 具有很强的传染性,其主要通过呼吸道飞沫传播,粪—口传播和接触传播(血液或含有病原体的分泌物)。目前,超过1.9 亿人被诊断为SARS-CoV-2 且数百万人死于SARS-CoV-2,严重危害全球公共卫生与全球经济[5]。通过研究者们的不懈努力,尽管相关SARS-CoV-2 的疫苗已经问世,但鉴于疫苗的效力有限和SARS-CoV-2的快速突变,例如奥密克戎、德尔塔、阿尔法和贝塔等。因此,实现早期特异性诊断SARSCoV-2 仍然是对相关疫情防控、病毒检测和治疗监测的有效方法[6]。
2000 年,Yurk 等[7]研究者提出一个熵驱动DNA 链置换的核酸诊断方法。该方法的原理是在热力学熵驱动下,一条DNA 链作为入侵序列与一条双链DNA的toehold区域(5-8个碱基组成)进行杂交反应,然后入侵序列将双链DNA 中较短的单链DNA 置换下来。该技术能够在等温且不需要任何蛋白酶的辅助条件下进行反应,其具有操作简单、反应迅速和低成本等优点,符合绿色化学的时代要求。此外,熵驱动DNA 链置换是主要依赖于碱基之间的互补配对,其具有很强的特异性。近年来,研究者们将熵驱动DNA 链置换技术广泛应用于生物检测领域[8-13]。因此,基于熵驱动DNA 链置换反应,设计一个内容新颖且综合性强检测SARS-CoV-2 靶标核酸的实验主要有三个优点:第一,让学生充分了解我国对防疫SARS-CoV-2 做出的贡献,强化思想政治教育,有利于增强学生的文化自信,提升民族自豪感;第二,“千里之行,始于足下”,让学生意识到前沿科技及造福民生的科研离不开扎实的基础知识;第三,可以提高学生的动手能力,开阔学术眼界,埋下为祖国科技事业做贡献的种子。
1 实验目的
a)通过文献调研,了解电化学传感器的应用及前景,掌握电化学检测SARS-CoV-2 靶标核酸的方法。
b)巩固无机及分析化学相关知识,理解熵驱动DNA 链置换的作用机制与电化学分析测试的原理。
c)掌握使用Origin、Photoshop 数据处理与作图软件。
d)了解及时有效检测传染病毒对遏制病毒传播与治疗的重要性。
e)培养学生课题设计与动手能力,以及团队合作与创新思维。
2 实验原理
本实验原理如图1 所示:巯基修饰的固定探针(紫色序列)与信号探针(蓝色序列)经退火形成双链DNA 探针。将双链DNA 探针通过Au-S 键固定在金电极表面,随后采用MCH 对电极表面进行封闭。我们设计位于固定探针3’-末端有6 个碱基组成的Toehold 区域。根据“世界卫生组织人类COVID-19 实验室检测临时指南”,本实验选择一条广泛应用研究的ORF1ab片段(长为26 个碱基)作为SARS-CoV-2 靶标序列[14]。当不存在SARS-CoV-2 靶标核酸时,由于大量信号探针靠近电极表面,从而获得强电流信号。但是,当加入靶标核酸(红色序列),在热力学熵驱动下,靶标核酸与Toehold 区域结合并引发链置换反应将信号探针置换下来,使得信号探针远离电极表面,导致电流信号减弱。因此,根据不同浓度靶标核酸与减弱的电流信号来拟合计算,实现对SARS-CoV-2 靶标核酸简单、低成本及强特异性电化学检测。

图1 基于熵驱动DNA 链置换构建电化学生物传感器检测SARS-CoV-2 靶标核酸的原理图
3 实验试剂与仪器
试剂:氯化钠和三(羟甲基)氨基甲烷购买自国药基团化学试剂有限公司(中国,上海)。6-巯基-1-己醇(MCH)和三(2-羧乙基)磷酸盐(TCEP)都来自从 Sigma 公司(St.Louis,MO,USA)。SARS-CoV-2 靶标核酸和其他核酸购自Sangon Biotech 有限公司(中国,上海),具体序列如表1 所示。所有试剂均为分析级,并使用电阻率为18.2 MΩ-cm 超纯水制备所需的溶液。

表1 本综合实验所用的寡核苷酸序列信息
4 实验方法与内容
4.1 实验方法
4.1.1 电化学传感器的制备
按照Kevin W.Plaxco 等的报道流程来进行电化学传感器的制备[8]。首先对直径为3 mm 金电极进行机械清洗(依次用0.3 和0.05 μm 氧化铝分别打磨5 分钟)和电化学清洗(在0.5 M H2SO4溶液中,进行-0.3 到1.5 V 的范围连续扫描)。最后使用去离子水进行彻底冲洗金电极并用氮气干燥。
在20 mM Tris-HCl 缓冲液(100 mM NaCl,pH 7.4)中的加入巯基修饰的5.0 μM 固定探针和5.2 μM 信号探针混合物加热至95 ℃(5 min),然后通过梯度冷却至室温以形成两条DNA 链组成的双链探针。为了还原固定探针的二硫键,将上述双链DNA 探针与1.0 mM TCEP 混合。接下来,取10 μL 上述溶液滴涂在金电极上,并在室温下孵育2 小时后用氮气吹干金电极。最后,将上述电极浸入新鲜制备的3.0 mM MCH 中孵育1 小时来消除非特异性吸附,待清洗后用氮气吹干,制备好的传感器留作备用。
4.1.2 SARS-CoV-2 的检测
在室温下,将10 μL 含有不同浓度SARSCoV-2 靶标核酸的Tris 缓冲液,孵育在制备好的电极上反应90 min。随后用缓冲溶液清洗传感器,在CHI 660C 工作站(CH Instruments Inc,上海)上进行电化学测量。该电化学工作站由传统的三电极系统构成,其中包括金电极作为工作电极,饱和甘汞作为参比电极,铂丝作为辅助电极。最后在 Tris-HCl 缓冲液中进行方波伏安法(SWV)测量,测试参数:扫描阶跃电位为4.0 mV,扫描频率为25 Hz,扫描振幅为25 mV 以及扫描电位为-0.4 V 至-0.1 V。
4.2 实验内容
4.2.1 熵驱动链置换用于电化学检测SARS-CoV-2的可行性分析
首先结合实验原理,学生设计出实验方案并与老师讨论修改。然后,学生在老师的指导下进行实验,记录数据并学习使用Origin 软件对数据进行处理。最后学生通过以电位为横坐标,以电流强度为纵坐标作图阐述实验结论。

公式中I(Non-target)为不加靶标核酸的电流强度;I(Target)为不加靶标核酸的电流强度。如图2 所示,当在没有靶标核酸的情况下,我们观察到在固定了双链DNA 的金电极上产生明显的电流信号(蓝色曲线);当孵育SARS-CoV-2 的靶标核酸(浓度为100 nM)后,通过DNA 链置换反应将信号探针置换下来,此时金电极产生的电流信号明显减弱(红色曲线)。该步骤主要引导学生学会设计对照实验(有无靶标核酸)和验证实验方案的可行性,为后续实验条件优化、传感器的灵敏度分析以及特异性分析等步骤提供有益思路。

图2 电化学生物传感器检测SARS-CoV-2 的SWV 信号响应
4.2.2 实验条件优化
为了让探索最佳的检测实验条件,本步骤我们采用分组的方式让学生主要优化了两个实验参数(SARS-CoV-2 的靶标核酸浓度为100 nM):固定双链DNA 探针的浓度和熵驱动链置换反应时间,并以变化的条件为横坐标,电流信号减弱百分比(△I%,公式2)为纵坐标作图。

首先保持熵驱动DNA 链置换反应为60 min,学生对0.2 至1.2 μM 范围内的最佳双链探针固定浓度进行探索。如图3A 所示,学生探索结果为:浓度范围为0.2-0.8μM 时,随着固定探针浓度的增加,△I%的值也随之增加。浓度范围为0.8-1.2μM 时,随着固定探针浓度的增加,△I%的值逐渐减弱。因此,当双链探针固定浓度为0.8 μM 时,我们设计的传感器展示出最佳△I%值。接下来,固定双链探针浓度为0.8 μM,学生进一步对最佳链置换反应的时间进行探索。如图3B 所示,△I%值随着链置换反应时间的延长(30 至90 min)而增加。90 min 之后达到稳定,表明90 min 熵驱动DNA 链置换反应达到平衡。因此,该实验最佳链置换反应时间为90 min。

图3 (A)双链固定探针的浓度优化和(B)链置换反应时间优化
4.2.3 传感器的灵敏度分析
在上一步最优的实验条件下,本步骤我们同样采用分组的方式让学生考察传感器的灵敏度。本步骤以△I%值为纵坐标,配制一系列浓度的SARS-CoV-2 靶标核酸溶液,靶标核酸浓度为横坐标绘制标准曲线,建立线性方程,确定线性范围与检测限。如图4A 所示,当靶标核酸的浓度从0 nM 增加至100 nM(曲线b 至g)时,电流强度随之减弱。图4B 展示传感器用于靶标核酸定量分析的校准曲线。在1.0 nM 至100 nM 范围内,电流强度与靶标核酸浓度呈现良好的线性关系。回归方程表示为△I%=0.5470c+6.464(c是SARS-CoV-2 的靶标核酸的浓度),相关系数R2=0.9906。根据3σ 规则(σ 为十一次空白溶液的相对标准偏差),计算出传感器的检测限为0.32 nM。本步骤通过对比传感器与临床检测SARS-CoV-2 靶标核酸的灵敏度,引导学生深刻认识灵敏度在对病毒、癌症以及环境污染等标志物检测的重要意义。
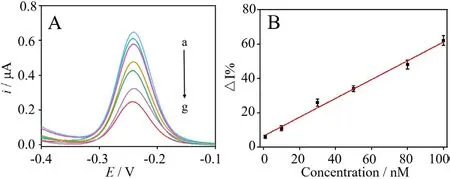
图4 (A)传感器对不同浓度靶标核酸的SWV 信号响应和(B)靶标核酸浓度测定的标准工作曲线
4.2.4 传感器的特异性分析
为了精准诊断SARS-CoV-2 靶标核酸和避免错误地实验结果,特异性地诊断COVID-19 是构建传感器的另一个重大挑战。为了评估我们构建传感器的特异性,本实验选择靶标核酸(浓度为100 nM),相同浓度地单到四碱基错配靶标核酸(M1 到M4)和任意RNA 序列(miRNA-21)进行对比实验。然后学生记录数据,并以不同的测试序列为横坐标,电流强度为纵坐标作图分析实验结论。如图5 所示,相比于靶标核酸,单碱基错配的样本产生的电流强度急剧上升(1.8 倍)。随着碱基错配数目的增加(M1 到M4),电流强度也随之升高。当靶标核酸序列出现四碱基错配时,传感器的电流强度与任意RNA 序列样本相似。因此,上述结果证明我们构建的传感器能够强特异性地检测SARS-CoV-2,这与熵驱动链置换反应的序列依赖性相关。本步骤主要引导学生对特异性检测SARS-CoV-2 靶标核酸重要性的认识,以及理解SARS-CoV-2 突变对疫情防控带来的干扰。

图5 传感器对不同核酸序列的特异性探究
4.2.5 实际样品中SARS-CoV-2 靶标核酸的检测
为了进一步评估电化学生物传感器在复杂生物样品中的分析性能,我们将三种不同浓度的靶标核酸(10 nM,50 nM,100 nM)分别添加在人血清(10%)中进行加标回收试验。实验结果如表2 所示,血清中的加标核酸回收率在95.2%到105.3%之间,RSD 在3.7%到4.8%之间。上述结果表明,我们构建的电化学生物传感器应用于检测复杂的生物样品中SARS-CoV-2 具有良好的实用潜力。

表2 加标回收实验结果
5 教学组织实施及效果
本综合性实验充分带领学生回顾无机化学与分析化学课程中熵、电化学基础、电位、伏安法、样品处理等相关知识。本实验无需昂贵的实验材料和大型分析设备,实验操作简单,是一项值得推广的无机及分析化学综合设计性实验。该实验重点在于让学生理解熵驱动DNA 链置换检测SARS-CoV-2 的原理;掌握对SARS-CoV-2 靶标核酸的定量分析方法,以及学会对分析方法性能的评价。实验难点是如何引导学生设计实验方案,验证实验方法的可行性,探索实验条件优化,分析传感器的灵敏度与特异性等,以及培养学生将思维及数据转化为图形的能力。建议该综合性实验面向化学专业本科三年级的学生开设,安排12课时,分3 次实验课完成,按照实验进度可以灵活掌握。
a)预习内容与要求:复习无机及分析化学知识,完成相关文献调研,理解实验原理,设计相应实验方案并与指导老师进行讨论。
b)第一次实验(4 学时):制备电化学传感器和完成实验内容中实验可行性分析,同时学习使用origin 处理实验数据的方法。
c)第二次实验(4 学时):完成实验条件优化(分组完成)与标准曲线的建立(分组完成)。
d)第三次实验(4 学时):完成传感器特异性分析以及血清实际样品的测试,学习使用Photoshop 绘制实验原理图。
思考与讨论可设置了以下问题:
a)查阅文献阐述及时有效地检测SARSCoV-2 靶标核酸对疫情防控和治疗监测的意义?
b)本实验采用最优的双链固定探针浓度是多少?为什么双链固定探针浓度太低或太高都不太好?
c)在医院,测定SARS-CoV-2 普遍采用的核酸方法是反转录加实时聚合酶链式反应法(RT-PCR)。通过文献调研,你觉得本实验与RT-PCR 方法相比,有什么优势?
d)通过文献调研,为什么高灵敏和强特异性对传感器检测SARS-CoV-2 靶标核酸至关重要?
e)通过文献调研,对于提高传感器检测SARS-CoV-2 靶标核酸的灵敏度有什么改进方法?
6 结论
本综合性实验利用熵驱动链置换反应,导致电流信号强度变化与SARS-CoV-2 靶标核酸浓度的关系,设计了一个SARS-CoV-2 检测的无机及分析化学综合教学实验。从上述实验结果可知,该实验的构建的电化学生物传感器可以实现低成本、特异性及简单地检测SARS-CoV-2。此外,本实验兼顾实验的综合性与设计性,可以让学生运用熵、电化学基础、电位、伏安法等相关理论知识和掌握相关实验技能的同时,培养学生的科学态度,开阔学术眼界,使学生掌握系统的科学研究方法,提升他们的综合素质。

