柑橘黄龙病常规PCR 与qPCR 检测体系的比较
邹剑锋,郝晨星,汤 丹
(1. 湖南农业大学动物医学院,湖南 长沙 410128;2. 湖南农业大学园艺学院,湖南 长沙 410128)
柑橘黄龙病(Huanglongbing,HLB)是世界柑橘生产上极具毁灭性的病害之一[1]。20 世纪初在中国的华南地区首先发现了柑橘黄龙病,随后在福建、广西、海南、 江西、 浙江、 四川、 云南、 贵州、 湖南和台湾等地相继发现。江西赣南地区于2010 年首次发现柑橘黄龙病,由于监测预警未得到重视,导致近年来该地区柑橘黄龙病疫情异常严重,柑橘栽培面积已减少了近3 成。目前,湖南省的邻近省份江西、广东、广西省的柑橘黄龙病疫情已经相当严重,受害面积占柑橘栽培总面积的80%以上,之前湖南省只有永州地区出现零星的疫情,但截至2014 年底湘南地区均发现了木虱,各地相继暴发柑橘黄龙病疫情。为促进全省柑橘产业的可持续发展,病害检测和监测预警工作刻不容缓。
黄龙病菌耐热性亚洲种“CandidatusLiberibacter asiaticus”(CLas)是一种革兰氏阴性菌,属于α 变形菌纲[2],是我国柑橘黄龙病的主要病原。目前,HLB 的检测难度较大,一方面是因为CLas 主要存在于植株的韧皮部细胞中,难以培养,不能进行人工接种,以亚洲柑橘木虱作为媒介进行传播[3];另一方面是因为CLas 在植株内分布不均匀,细菌滴度存在差异。同时,该病的潜育期和发病周期较长[4]也给HLB 的监测增加了难度。
随着分子生物学技术的发展,大量准确灵敏的分子检测方法被用于HLB 病的检测。常规PCR 检测手段尽管成本低,但其检出效率不高,易导致检测结果的偏差,而实时荧光定量PCR(qPCR)检测具有初始模板准确定量、灵敏度高、特异性强、闭管操作、简便迅速等优点[5]。早期对黄龙病菌的分子检测主要聚焦于 HLB 菌的以下基因:16S rDNA、 β-操纵子和外膜蛋白基因。研究发现,用16S rDNA 和16S rRNA 进行定量分析的灵敏度要高于用β-操纵子的。因为16S rDNA 在CLas 基因组中有3 个拷贝,而16S rRNA 在CLas 基因组的拷贝数大约是16S rDNA 的7.8 倍[6]。随着HLB 菌基因组测序工作的完成[7],有学者将HLB 菌部分可检测的原噬菌体基因应用于HLB 病害诊断和多态性分析等方面,并根据原噬菌体基因中的hyvI和hyvII基因分别设计了适用于SYBR Green Ⅰ法和探针法的real time 检测引物LJ900r 和LJ900f。结果表明,该基因包含多个串联重复序列,是qPCR 检测中理想的目的基因扩增区域[8]。
近期,湖南柑橘脱毒中心建立并优化了柑橘黄龙病qPCR 的检测体系,为柑橘黄龙病的早期诊断及鉴定提供了特异准确、灵敏快速的检测体系。笔者选取8 对根据CLas 菌DNA 不同保守区域设计的扩增引物,分别利用常规PCR 和qPCR 体系对柑橘HLB 病原进行检测,对2 种检测体系的灵敏度和检出率进行比较。
1 材料与方法
1.1 试验材料
1.1.1 柑橘叶片样品和阳性对照11 个柑橘HLB 疑似样品由湖南省郴州市汝城县农业局提供,取新鲜叶片液氮冷冻后置于-80℃冰箱保存,待检。以含有HLB 菌16S rDNA 重组质粒(浓度为98 ng/μL)的10倍梯度稀释液作为HLB 阳性对照。
1.1.2 常规PCR 引物使用LB1/LB2、In1/In2、OL1/OL2、OI1/OI2 这4 对引物进行常规PCR 检测,引物由生工生物工程股份有限公司合成,具体信息见表1[9]。
1.1.3 qPCR 引物qPCR 因为包括用于特异性结合HLB 菌hyv I 和hyv II 序列的引物LJ900f/LJ900r,以及用于扩增HLB 菌种16S rDNA 的引物Las-I-F/Las-I-R、Las-O-F/Las-O-R、HLBas/HLBr,引物由生工生物工程股份有限公司合成,具体信息见表1。
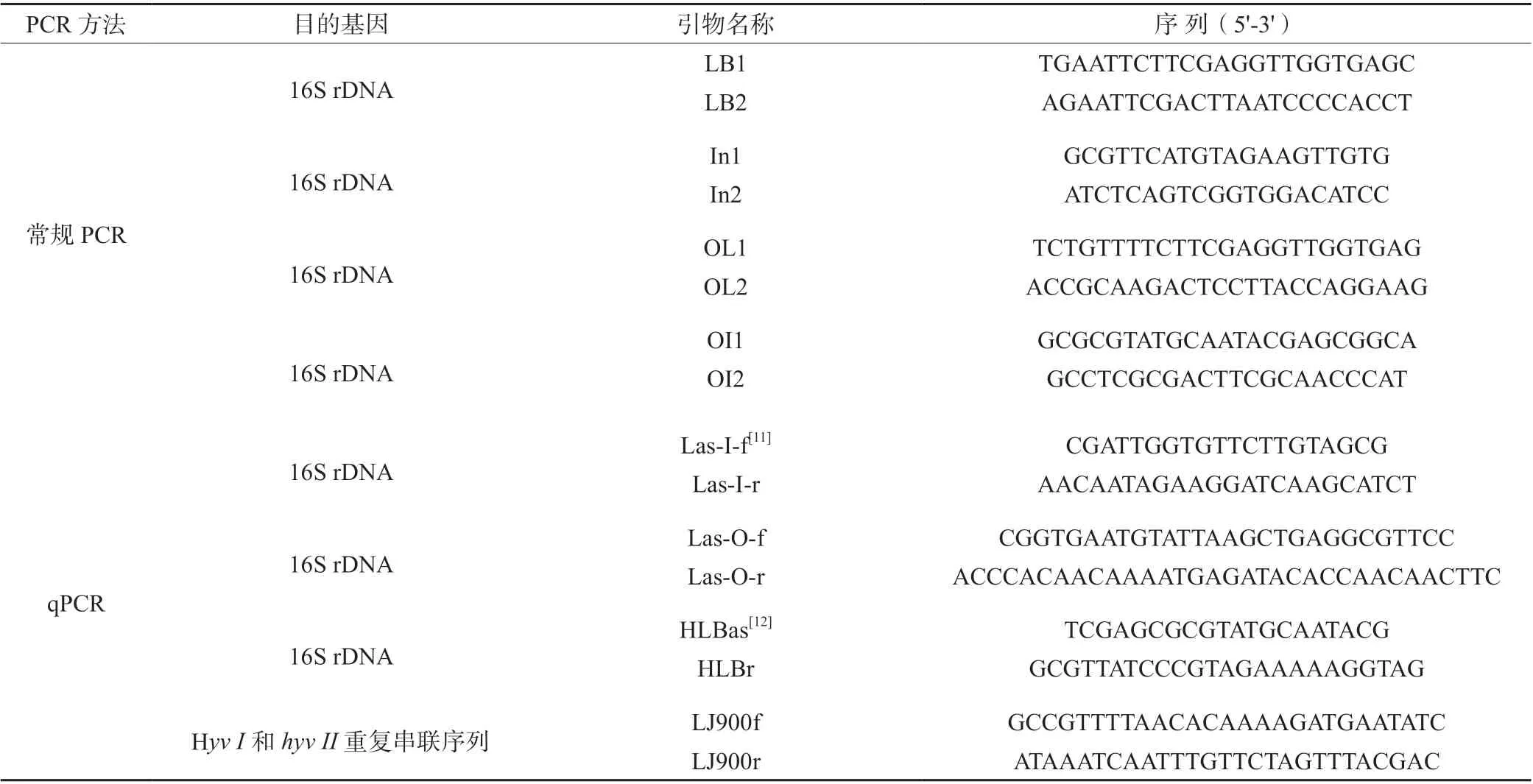
表1 引物信息
1.2 试验方法
1.2.1 常规PCR 反应体系和反应程序(1)反应体系(25 μL):Taq 酶0.4 μL,10 μmol/L 引物各0.4 μL,2.5 mmol/L dNTPs 0.4 μL,Taq Buffer 2 μL,DNA 模 板 1 μL,ddH2O 补足至25 μL。(2)反应程序:94℃预变性3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,共35个循环;72℃延伸10 min。
1.2.2 qPCR 反应体系和反应程序(1)反应体系(20 μL):SYBG premix taq 10 μL,10 μmol/L 引 物 各0.4 μL,DNA 模 板 1 μL,ddH2O 补 足至20 μL。(2)反应程序:95℃预变性2 min;95℃ 10 s,55℃ 30 s,72℃ 30 s,共40 个循环;扩增结束后进行熔解曲线分析,用于验证扩增的特异性。
1.2.3 灵敏度检测将黄龙病菌重组质粒DNA(母液 浓 度 为98 ng/μL)按10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8进行梯度稀释,稀释后质粒DNA 浓度依次为9.8 ng/μL、980 pg/μL、98 pg/μL、9.8 pg/μL、980 fg/μL、98 fg/μL、9.8 fg/μL、0.98 fg/μL,以此为扩增模板分别进行常规PCR 扩增和qPCR 扩增,分析2种检测体系的检测下限。
1.2.4 特异性检测在田间选取叶片黄化斑驳的疑似黄龙病植株样品11 个,分别提取核酸,用于检测各引物的特异性,按照上述方法分别进行常规PCR 检测和qPCR 检测。
2 结果与分析
2.1 常规PCR 各引物的检测效果
使用HLB 菌16S rDNA 特异性引物LB1/LB2、In1/In2、OL1/OL2、OI1/OI2 对梯度稀释的HLB 菌重组质粒阳性样品进行扩增,结果如图1 所示,In1/In2引物未扩增出目的条带(图1A),LB1/LB2(图1B)、OL1/OL2(图1C)和OI1/OI2(图1D)引物对稀释10-1、10-2和10-3的HLB 菌重组质粒阳性样品均扩增出目的条带。这表明4 组引物中,LB1/LB2、OL1/OL2、OI1/OI2 引物对HLB 菌浓度检测的下限为98 pg/μL。从扩增条带的亮度来看,OI1/OI2 这组引物的扩增效果最好。
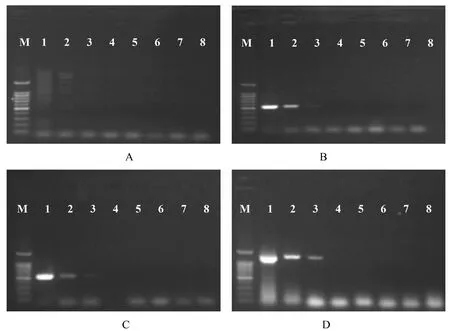
图1 4 对引物在柑橘HLB 菌常规PCR 体系的灵敏度检测
2.2 qPCR 各引物的检测效果
使用SYBG Green 染料法对梯度稀释的阳性样品进行实时荧光定量扩增,结果见图2~5。采用Las-O-r/Las-O-f(图2)和HLBas/HLBr(图4)这2 组引物对10-1、10-2、10-3浓度的阳性样品扩增,均能出现明显的荧光累积而使荧光值达到阈值以上,熔解曲线分析结果也显示扩增产物具有单一性;利用Las-I-r/Las-I-f(图3)和LJ900r/LJ900f(图5)这2 组引物对10-1、10-2、10-3、10-4浓度的阳性样品扩增,均能出现明显的荧光累积而使荧光值达到阈值以上,熔解曲线分析结果也显示扩增产物具有单一性。在qPCR 检测体系中,Las-I-r/Las-I-f 和LJ900r/LJ900f 的检测灵敏度较好,其检测下限为9.8 pg/μL。
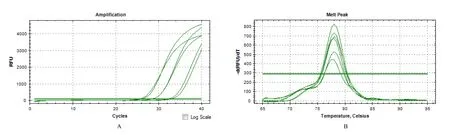
图2 引物Las-O-r/Las-O-f 在qPCR 体系中的检测灵敏度分析
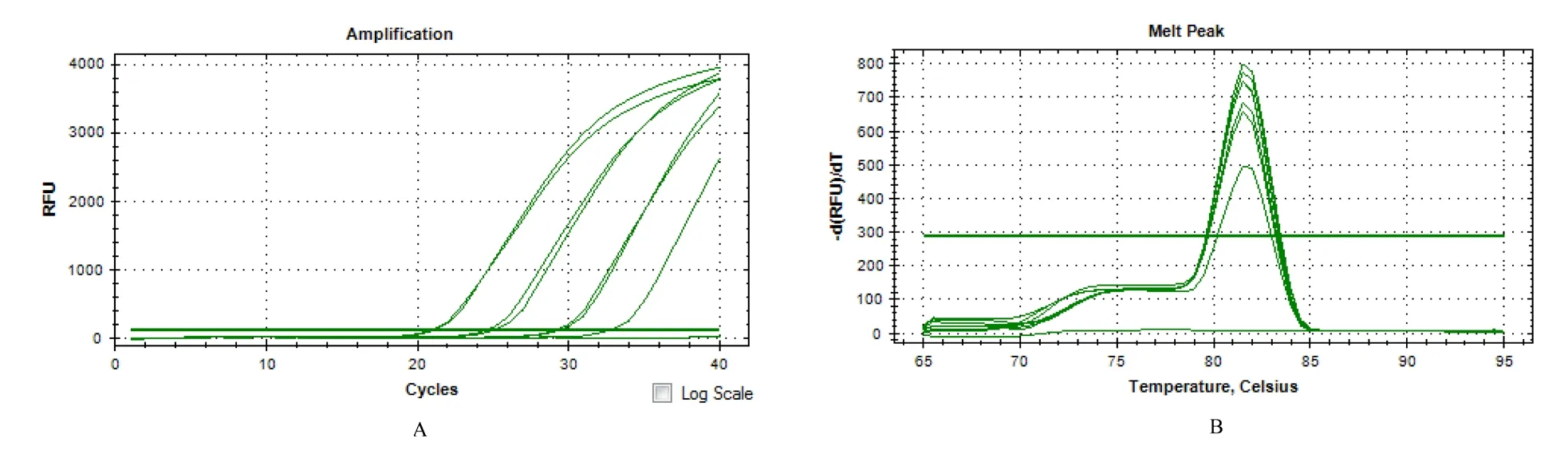
图3 引物Las-I-r/Las-I-f 在qPCR 体系中的检测灵敏度分析
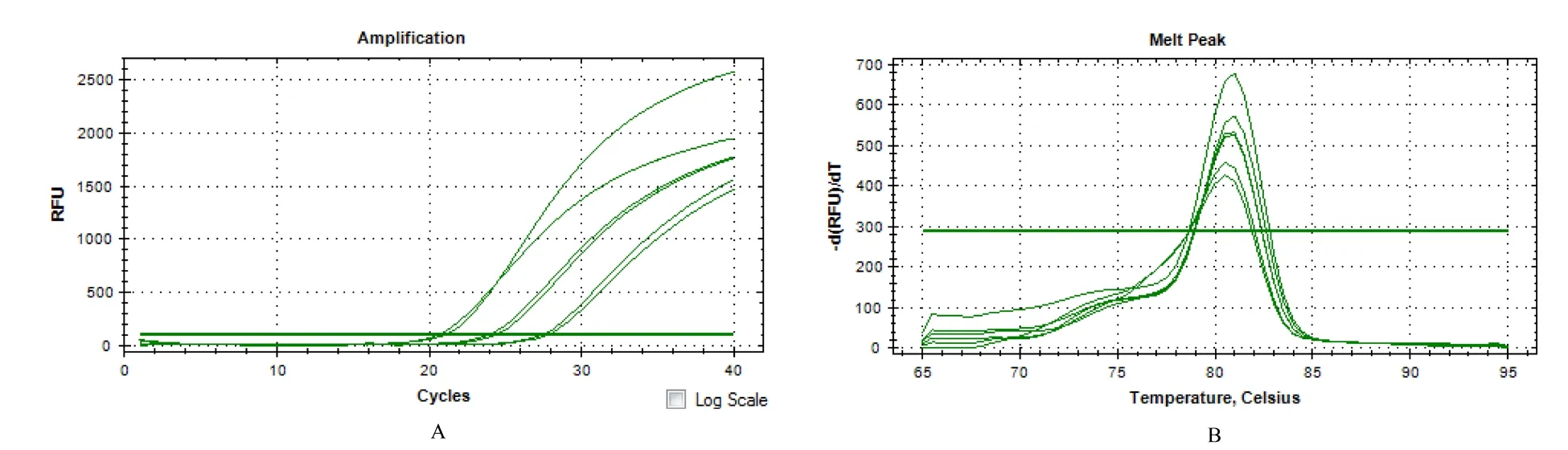
图4 引物HLBas/HLBr 在qPCR 体系中的检测灵敏度分析
2.3 田间样品的HLB 鉴定
对郴州市汝城县农业局送检的11 个HLB 疑似样品分别进行常规PCR 扩增(引物为OI1/OI2)和qPCR 扩增(引物为LJ900r/LJ900f)。常规PCR 检测结果(图6)显示,样4、样8、样9、样10 和样11这5 个样品均扩增出明显的目的条带,其中样10 的扩增产物条带较为微弱模糊。

图6 常规PCR 对田间样品的HLB 检测
qPCR 结果(图7)显示,样3、样4、样5、样7、样8、样9、样10、样11 这8 个样品的荧光累积达到阈值以上,且熔解曲线分析结果显示扩增产物具有单一性。
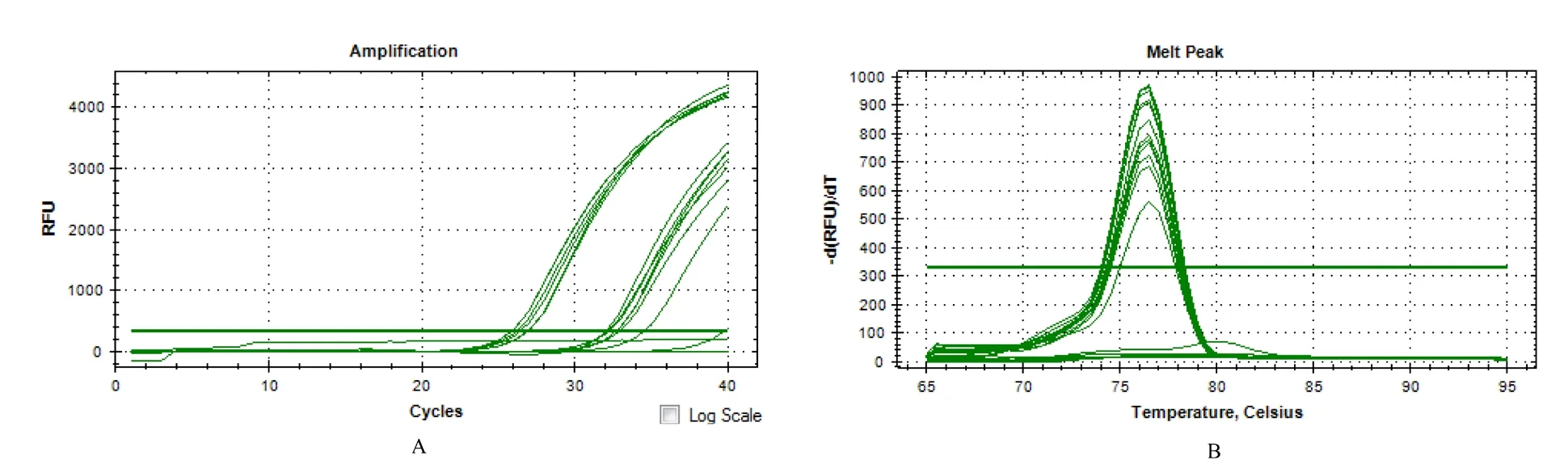
图7 qPCR 对田间HLB 疑似样品的检测结果
综合比较2 种检测体系发现,对同一批次11 个样品,采取常规PCR 检测,5 个样品呈阳性,HLB的检出率为45.5%;而采取qPCR 检测,8 个样品呈阳性,HLB 的检出率为72.7%(表2)。
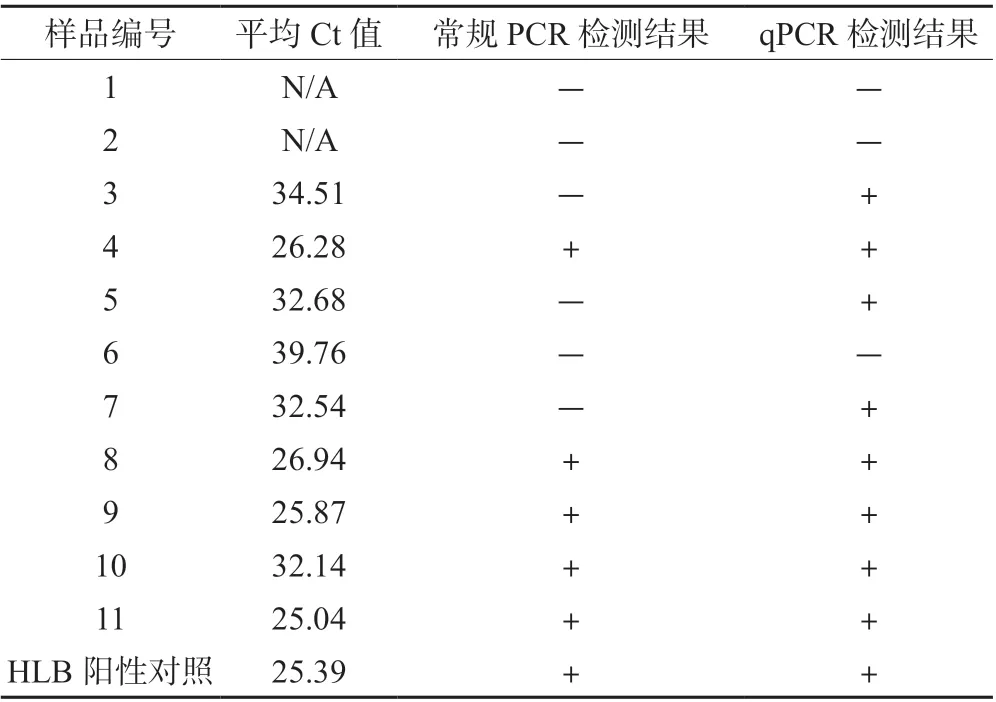
表2 2 种检测体系对田间样品检测结果的比较
3 结论与讨论
由于HLB 菌在树体上分布不均匀,且具有较长的潜伏期,树体感染黄龙病菌后较长时间内不会显示症状,同时病菌浓度与病害的严重程度并不严格地呈对应关系。因此,柑橘HLB 的准确检测难度较大。加上样品本身所含背景DNA 的干扰(HLB 病菌DNA浓度所占比例较低),导致检测时容易出现不可靠的结果[10]。
目前,HLB 检测主要是通过扩增拷贝数较低的16S rDNA 保守区域来进行的。该研究共选取了8 对引物进行HLB 检测,其中LB1/LB2、In1/In2、OL1/OL2、OI1/OI2、Las-O-r/Las-O-f、HLBas/HLBr、Las-I-r/Las-I-f 是根据16S rDNA 保守区域设计的上下游引物,LJ900r/LJ900f 是根据噬菌体中高拷贝数hyv I/hyvII保守区域设计的上下游引物[11]。
在灵敏度试验中,将已经定量的含有HLB 菌16S rDNA 的重组质粒的梯度稀释液作为阳性模板,分别进行常规PCR 和qPCR 扩增,结果显示,常规PCR 供试的4 组引物中,In1/In2 引物未扩增出目的条带,其他3 组引物的灵敏度由高到低排列依次为OI1/OI2 >LB1/LB2= OL1/OL2,OI1/OI2 这组引物对HLB菌的检测下限为98 pg/μL;qPCR 供试的4 组引物的灵敏度由高到低排列依次为LJ900f/LJ900r >Las-I-f/Las-I-r >HLBas/HLBr >Las-O-f/Las-O-r(根据可检测到最低浓度样本的Ct 值排序),其中LJ900f/LJ900r这组引物对HLB 菌的检测下限为9.8 pg/μL。
对11 个田间疑似HLB 样品的检测结果显示,LJ900r/LJ900f 这组引物的检出率为72.7%,OI1/OI2 这组引物的检出率为45.5%。这表明引物LJ900r/LJ900f结合qPCR 方法对于HLB 菌的检测效率更高。
目前,HLB 的分子检测方法主要有常规PCR 检测和qPCR 检测,该研究通过分析对比2 种检测方法的灵敏度发现,qPCR 的检测结果相对常规PCR 的更为可靠、灵敏、快速。qPCR 检测所用引物以根据噬菌体中高拷贝数hyv I/hyv II保守区域设计的上下游引物LJ900r/LJ900f 具有更好的检测效率。
随着人们对HLB 菌基因组信息剖析的进一步深入,将会有更多可利用的标记基因或序列用于其分子检测,不同标记的适用普遍性和特异性(可能因寄主、地域来源、样品浓度、纯度等而异)也会有更深入地探讨。

