植物乳杆菌R23胞内抗氧化酶高效提取与保存技术研究
任香芸 何志刚 林晓姿 李维新 梁璋成 汪媛媛


摘 要:为获得植物乳杆菌R23高活力胞内抗氧化酶,以蛋白质含量、菌量和超氧化物歧化酶(SOD)活力为主要指标,对该菌胞内抗氧化酶提取、保存等技术进行研究。结果表明,超声波法可有效破碎植物乳杆菌R23菌体细胞并保持理想的酶活力,在功率400 W、工作总时间20 min和变幅杆φ2 mm时,获得的蛋白质含量较高且SOD活力最大(47.06 U·g-1);酶提取液在4℃冷藏12 h或-20℃冻藏24 h均有利于保持酶活力。有无二氧化硫胁迫下植物乳杆菌R23生长量均与蛋白质含量变化相对应,因此可用蛋白质含量指示菌体生长量,用于胞内抗氧化酶活力的计算。
关键词:植物乳杆菌;细胞破碎;抗氧化酶;菌量;蛋白质含量
中图分类号:Q 939.9 文献标志码:A 文章编号:0253-2301(2022)03-0001-06
DOI: 10.13651/j.cnki.fjnykj.2022.03.001
Study on the Efficient Extraction and Preservation Techniques of Intracellular AntioxidantEnzymes from Lactobacillus plantarum R23
REN Xiang-yun1,2, HE Zhi-gang1,2, LIN Xiao-zi1,2*, LI Wei-xin1,2,LIANG Zhang-cheng1,2, WANG Yuan-yuan3
[1. Institute of Agricultural Engineering Technology, Fujian Academy of Agricultural Sciences, Fuzhou,
Fujian 350003, China; 2. Fujian Key Laboratory of Agricultural Products (Food) Processing, Fuzhou, Fujian
350013, China; 3. Fujian Xilong Biological Technology Co., LTD, Fuzhou, Fujian 350015, China]
Abstract: In order to obtain the intracellular antioxidant enzymes of Lactobacillus plantarum R23 with high activity, the extraction and preservation techniques of the intracellular antioxidant enzymes of Lactobacillus plantarum R23 were studied by using the protein content, the amount of bacteria and the activity of superoxide dismutase (SOD) as the main indexes. The results showed that the ultrasonic method could effectively disrupt the fungal cells of Lactobacillus plantarum R23 and maintain the ideal enzyme activity. When the ultrasonic parameters were as follows: the power of 400 W, the total working time of 20 min and the amplitude transformer of φ2 mm, the protein content was relatively high and the activity of SOD was the highest (47.06 U·g-1). The enzyme activity could be maintained by freezing the enzyme extracting solution at 4℃ for 12 h or -20℃ for 24 h. The growth of Lactobacillus plantarum R23 corresponded with the change of protein content which was not affected by the stress of sulfur dioxide. Therefore, the protein content could be used to indicate the growth of bacterial cells for the calculation of the activity of intracellular antioxidant enzymes.
Key words: Lactobacillus plantarum; Cell disruption; Antioxidant enzyme; Amount of bacteria; Protein content
植物乳桿菌(Lactobacillus plantarum)R23是福建省农产品(食品)加工重点实验室人员在前期研究过程中获得的优良苹果酸-乳酸发酵(malolactic fementation, MLF)乳酸菌,该菌不仅能够耐受120 mg·L-1高二氧化硫胁迫且苹果酸-乳酸酶活性高,由此大大减弱了酒体中二氧化硫对菌体的损伤[1-2],MLF功能得以有效发挥。目前,植物乳杆菌R23已在山葡萄酒、枇杷酒和杨梅酒等高酸性果酒的生物降酸中成功应用并显著提高酒体品质[3-4]。初步研究发现,植物乳杆菌R23抗氧化系统在菌体应答二氧化硫胁迫过程中发挥重要作用。因此,测定分析这一过程菌体胞内抗氧化酶活力变化,将有助于揭示菌体对二氧化硫胁迫的耐受性机制,而行之有效的抗氧化酶制备技术与活力测定方法是前提基础。
作为抗氧化酶等胞内酶的制备,首先必须将细胞破壁,使产物得以释放。目前常见的微生物细胞破壁方法主要有:化学法,如表面活性剂和酸等;物理法,如反复冻融法、超声法、玻璃珠法等;生物法,如酶解法等[5-6],各种方法都有自己的适用范围及优缺点。曾敏等[7]比较了超声波、高速匀浆、反复冻融对鼠李糖乳杆菌LT22肽聚糖提取的影响,认为超声波法效果最好,其理想条件为:功率500 W,处理时间10 min;赵瑞香等[8]通过单因素试验和正交试验,优选出了超声波破碎嗜酸乳杆菌释放β-半乳糖苷酶的条件,即处理时间7.6 min,工作/间歇28 s/20 s,温度36℃;李艳等[9]以融合蛋白浓度为主要考察指标,比较了酶法辅助超声波和酶法辅助冻融法对大肠杆菌BL21细胞破碎溶出血管紧张素转化酶抑制肽(ACEIP)的影响,结果发现反复冻融6次或超声波破碎30 min,细胞破碎率可达100%,但反复冻融法操作较烦琐、耗时长、试剂昂贵且处理量小,而超声波破碎具有时间短、效率高且能减低黏度等优点。由此可见,针对不同种微生物、破碎目的的差异性,破碎方式或条件也不尽相同。如何对植物乳杆菌R23细胞进行有效破碎,如何正确保存酶液样品,以及如何合理表达酶活力,都是在抗氧化酶活力测定分析前需要解决的问题。
鉴于此,本研究将针对这些问题,以植物乳杆菌R23为试验菌,着重从细胞破碎方法、酶液保存条件和菌体生长特点等方面展开研究,旨在获得菌体胞内抗氧化酶高效提取与保存方法,并确定酶活力的合理表达方式,为后续探讨抗氧化系统在菌体耐受二氧化硫胁迫中的作用等研究提供科学、有效的技术手段。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源 植物乳杆菌(Lactobacillus plantarum)R23,由福建省农产品(食品)加工重点实验室分离、鉴定与保存,NCBI号为HQ58056。
1.1.2 培养基 (1)LHR20液体培养基[10];(2)改良TJA培养基[11]。
1.1.3 主要仪器与试剂 SCIENTZ-950E型细胞破碎仪(宁波新芝生物科技股份有限公司);GI54DW型高压灭菌器(美国致微仪器有限公司);SPX-250BS-Ⅱ型生化培养箱(上海新苗医疗器械制造有限公司);SW-CJ-IFD型单人单面净化工作台(苏州净化设备有限公司);TGL-18C型高速冷冻离心机(上海安亭科学仪器厂);ZQLY-180S型立式双层恒温振荡器(上海知楚仪器有限公司);BioTek Epoch2型全波长酶标仪(美国宝特仪器有限公司);UV-1705型紫外可见分光光度计(日本岛津公司)。SOD试剂盒(上海起子生物科技有限公司);考马斯亮蓝G-250试剂:称取100 mg考马斯亮蓝G-250,溶于50 mL 95%乙醇中,加入100 mL 85%(w/v)磷酸,用水定容至1 L;标准蛋白质溶液(0.1 mg·mL-1):准确称取牛血清蛋白0.01 g,加水溶解并定容至100 mL,4℃冰箱保存,备用。
1.2 试验方法
1.2.1 菌种活化 将植物乳杆菌R23甘油冻存种接种于LHR20液体培养基中,30℃培养24 h,再以5%(v/v)转接入LHR20进行二次活化,30℃培养15~18 h,备用。
1.2.2 有无胁迫条件下菌体短时生长过程菌量和蛋白质含量变化分析 将植物乳杆菌R23活化种以10%(v/v)接种于不同二氧化硫浓度(0、120 mg·L-1)的LHR20液体培养基中,30℃培养,每隔4 h取样1次,共培养12 h,分别测定样品中菌量和蛋白质含量,并分析两者之间的关系,评价蛋白质含量用于抗氧化酶活力计算的可行性。
1.2.3 不同细胞破碎方法对菌体胞内抗氧化酶提取效果的影响 取植物乳杆菌R23活化种50 mL,9 000 r·min-1、4℃离心10 min,弃上清,加无菌生理盐水洗涤1次,菌泥中加入5 mL PBS(pH 8.0)缓冲液,旋涡震荡混匀,获得的菌悬液分别作以下3种处理:(1)反复冻融:将菌悬液置于-70℃冰箱冻存30 min取出,随后置20℃水浴锅溶解5~10 min(至溶解),如此反复操作5次,备用;(2)超声波破碎:条件为功率200 W、工作1 s、间歇2 s、时间20 min、变幅杆直径5 mm,破碎后的菌悬液于12 000 r·min-1、4℃离心10 min,上清液装于10 mL离心管,备用;(3)溶菌酶辅助超声波破碎:向菌悬液中加入50 mg·mL-1溶菌酶0.1 mL,使溶菌酶的终浓度为1 mg·mL-1,4℃孵育10 min,加Triton-X至终浓度为1%,然后进行超声处理,具体操作同(2)。测定以上3种处理获得的样品中蛋白质含量和抗氧化酶活力(以SOD作代表),考察每种方法对菌体细胞的破碎程度以及对抗氧化酶活力的影响。
1.2.4 超声波破碎条件对菌体胞内抗氧化酶提取效果的影响 以破碎功率、工作总时间和变幅杆直径为主要考察因素,固定间歇2 s、工作1 s不变,其他超声条件分别设置为:(Ⅰ)功率200 W,工作总时间20 min,变幅杆φ5 mm;(Ⅱ)功率200 W,工作总时间10 min,变幅杆φ5 mm;(Ⅲ)功率200 W,工作总时间20 min,变幅杆φ2 mm;(Ⅳ)功率200 W,工作總时间10 min,变幅杆φ2 mm;(Ⅴ)功率400 W,工作总时间20 min,变幅杆φ5 mm;(Ⅵ)功率400 W,工作总时间20 min,变幅杆φ2 mm;(Ⅶ)功率600 W,工作总时间20 min,变幅杆φ5 mm;(Ⅷ)功率600 W,工作总时间20 min,变幅杆φ2 mm;分别利用以上8种条件对1.2.2制备的菌悬液进行超声波破碎处理,并测定获取的样品中蛋白质含量和SOD活力,进而确定适宜的超声波破碎参数。
1.2.5 不同保存条件下菌体抗氧化酶样品活力分析 采用优化后的细胞破碎方法制取植物乳杆菌R23胞内酶样品,分别于常温(30~35℃)、4℃和-20℃保存,并测定0、12和24 h样品的SOD活力,分析保存温度和时间对酶活力的影响。
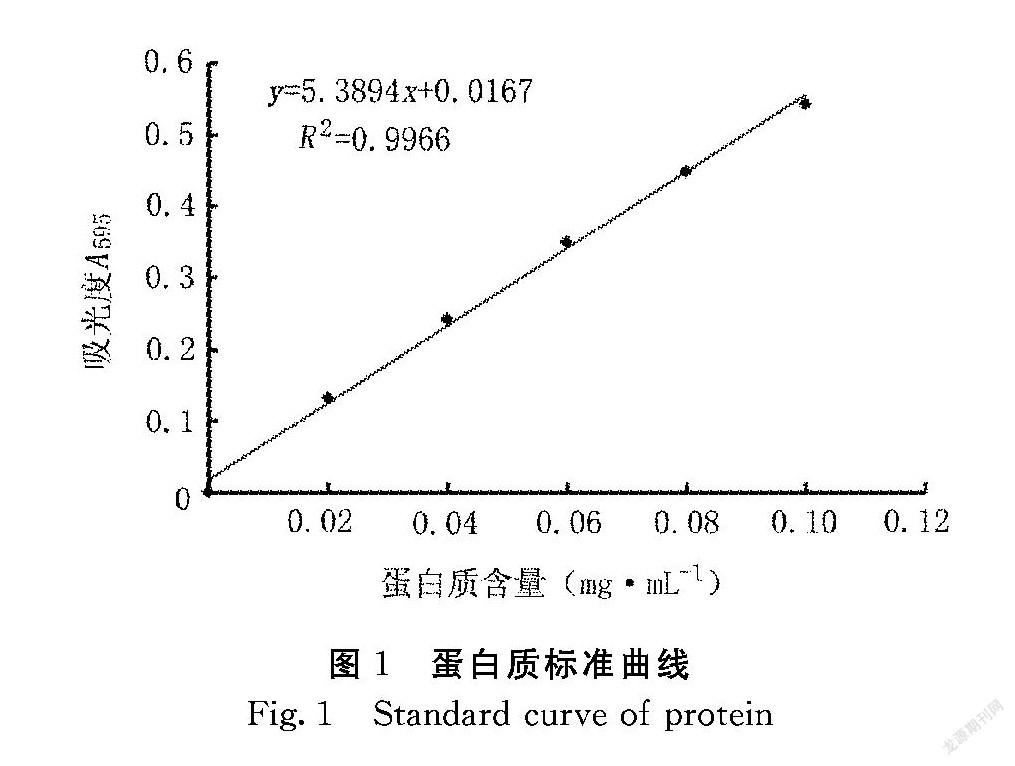
1.2.6 测定方法 (1)菌量测定,采用平板计数法[12];(2)蛋白质含量测定,采用考马斯亮蓝法[13],标准曲线见图1;(3)SOD酶活力测定:采用试剂盒法,具体操作按照产品说明书进行。
1.2.7 数据分析 采用Excel 2010和Origin 2018软件对试验数据进行处理与作图,显著性分析采用SPSS 23.0軟件的one-way ANOVA算法进行。
2 结果与分析
2.1 有无胁迫条件下菌体短时培养过程生长量和蛋白质含量变化特点
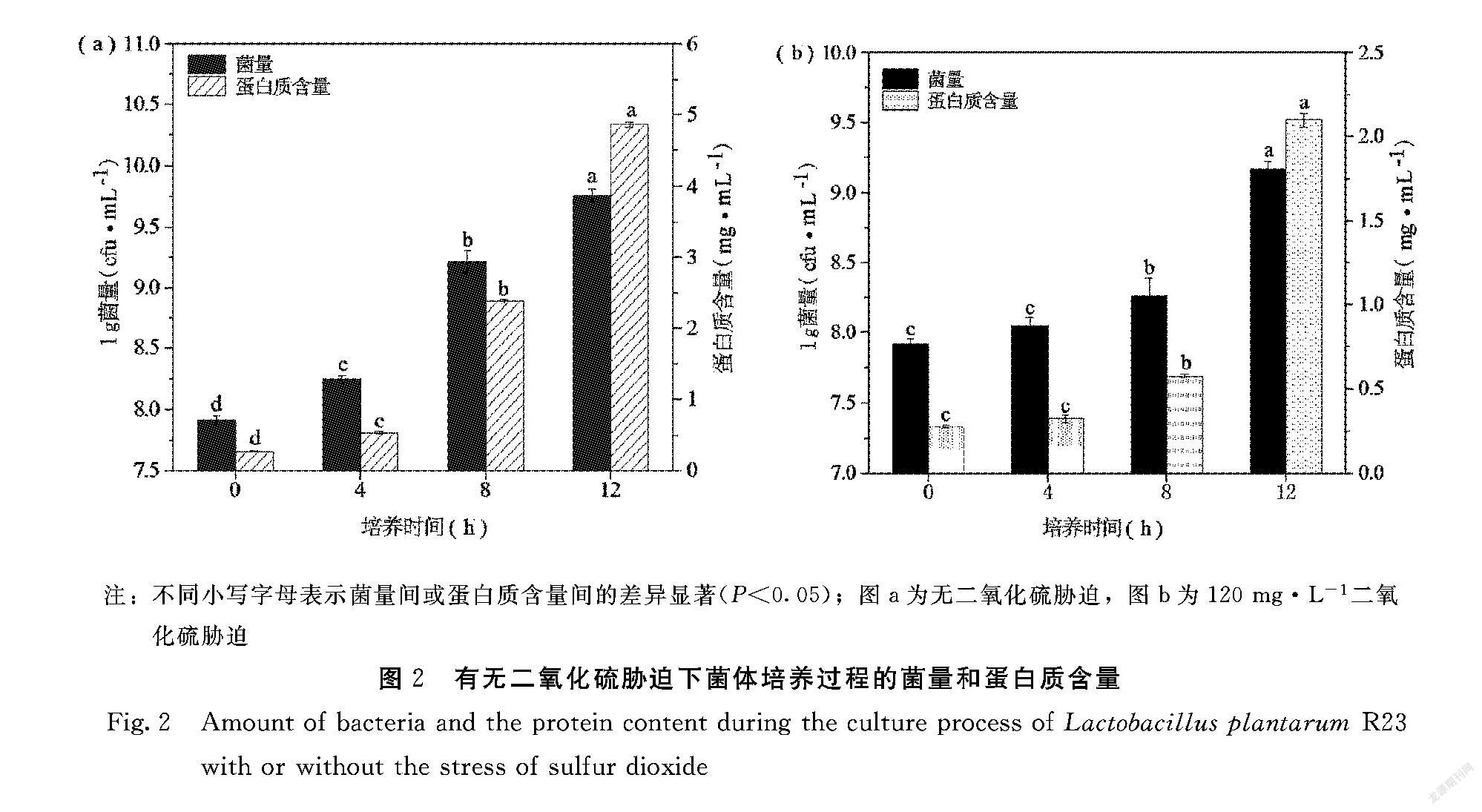
由图2可知,自然条件下(无二氧化硫胁迫)
植物乳杆菌R23生长量在4 h即发生显著增加,之后增长速率进一步提升,整体蛋白质含量增长趋势与菌量相似(图2a)。与之相比,在二氧化硫胁迫条件下菌体生长量和蛋白质含量起初增势缓慢,8 h后才有显著提升(图2b)。可见,二氧化硫胁迫使得菌体延滞期加长且导致生长总量下降,培养12 h的菌量比自然条件下低1个数量级;但两种条件下菌体生长量和蛋白质含量变化大体是一致的,提示抗氧化酶活力计算中可用蛋白质含量指示菌量大小,并适用于后续菌体对二氧化硫胁迫的耐受性机制研究中。
2.2 不同细胞破碎方法对菌体胞内抗氧化酶提取效果的影响
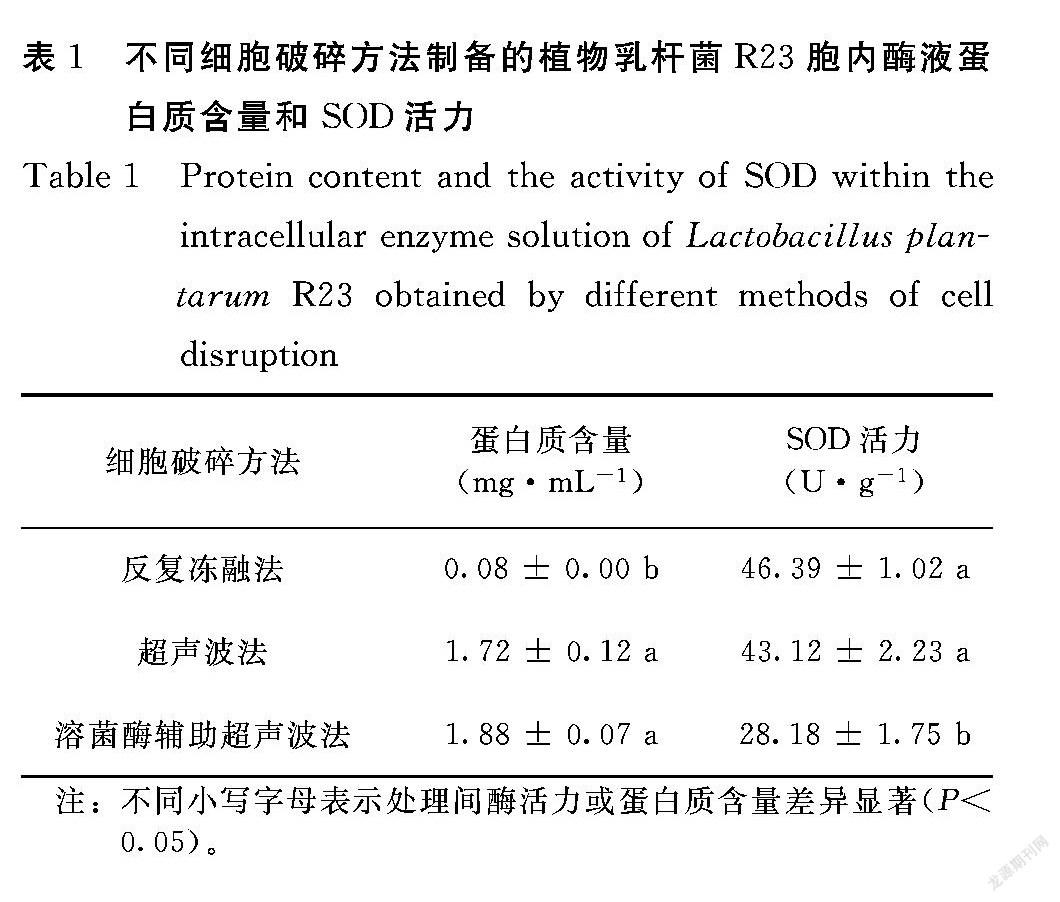
由表1可知,采用反复冻融法获得的蛋白质含量最小,为0.08 mg·mL-1,提示该方法对植物乳杆菌R23细胞破碎效果并不理想;采用超声波法获得的蛋白质含量为1.72 mg·mL-1,其破碎效果显著优于反复冻融法(P<0.05);溶菌酶辅助下菌体细胞破碎程度进一步增大(蛋白质含量为1.88 mg·mL-1),但未发生显著提升。从SOD酶活力看,反复冻融法的细胞破碎率虽低,但对酶活力的影响最小,溶菌酶辅助超声波法对酶活力影响最大。因此,从操作简便性、细胞破碎程度和酶活力保持三方面考虑,宜选择单纯超声波法用于后续菌体细胞破碎。
2.3 超声波破碎条件对菌体胞内抗氧化酶提取效果的影响
8种超声处理条件下获得的蛋白质含量和SOD活力见表2。超声波破碎功率越大、工作总时间越长或变幅杆直径越大,细胞破碎效果越好;其中处理Ⅶ的蛋白质含量高达2.17 mg·mL-1,比常用超声条件即处理I提高31.52%。但是,酶活力并非与之完全相对应,在200 W功率范围内,较长工作时间或较大直径的变幅杆均会降低酶活力,且变幅杆直径的影响大于工作总时间;功率在400 W(处理Ⅵ)时酶活力最大为47.06 U·g-1;当功率进一步增大时,蛋白质含量虽然在继续增加,但酶活力发生显著下降。
2.4 保存条件对菌体胞内抗氧化酶测定样品活力的影响
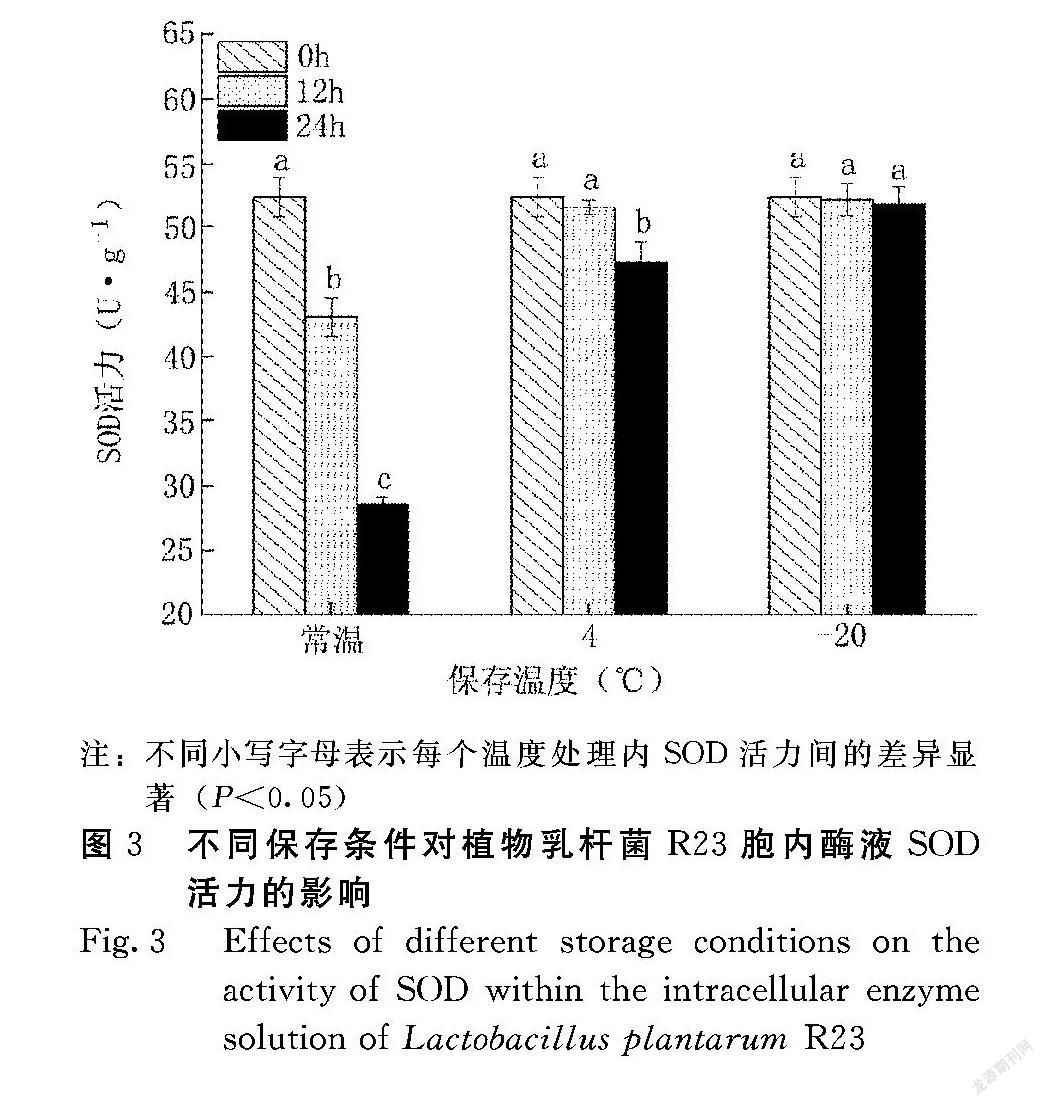
由图3可知,常温(30~35℃)放置的样品酶活力随着时间延长迅速减小;4℃冷藏的样品在12 h内酶活力差异不显著,-20℃冻藏的样品酶活力在24 h内差异不显著。即常温放置对酶活力影响最大,其次为4℃冷藏,-20℃冻藏酶活最为稳定。因此,在样品量较小的情况下,应尽快测完,且测定全程需冰浴;如果样品量较大无法及时完成检测,可将样品作短时冷藏或长时冷冻处理。
3 结论与讨论
反复冻融法可使细胞壁变疏松,增大通透性,加大细胞质中蛋白溢出及细胞破裂[7]。本试验选择-70℃反复冻融5次的方法破碎植物乳杆菌R23细胞,与其他2种方法相比,该方法虽然可以有效保持胞内抗氧化酶活力,但获得的蛋白质含量偏低,仅是超声波法的4.4%,因此并不适宜用于该菌胞内酶液的制备。溶菌酶辅助超声波法虽然可以增强细胞破碎效果,但胞内抗氧化酶活力发生显著下降。已有报道显示,酶解法在溶解细胞过程中,不仅会增加溶液的黏度,干扰对目的产物的检测,而且易使目的产物生物活性受损[14-15]。推测,本试验中SOD活力的降低,可能是由溶菌酶的使用引起的。因此,综合考虑宜选择单纯超声波法对植物乳杆菌R23细胞进行破碎。
本研究在对超声波参数的优化过程中,选用了3种功率、2种工作总时间和2种变幅杆直径;从试验结果看,超声波功率、工作总时间和变幅杆直径均影响细胞破碎效果和胞内酶活力。其中,处理Ⅷ(功率600 W、工作总时间20 min、变幅杆直径5 mm)获得的蛋白质含量最大,但酶活力显著下降。原因分析为,大功率、长时间、粗杆超声条件产生更加强劲的“空穴作用”[16-17],使菌体细胞得以有效裂解;但同时超声波振动的过程中机械能转变成热能,即使操作过程中样品处于冰浴状态,但热量无法及时传递出去,进而影响了释放出的蛋白质(酶)活性。顾思天等[18]研究发现,当超声波功率增大到400 W以上时,会导致植物乳杆菌ZS2058细胞破碎液中的蛋白质变性、酶失活;赵瑞香等[8]研究发现,高强度超声条件会导致溶液产生泡沫,进而导致蛋白质变性。因此,功率过大、时间过长或变幅杆过粗均不利于酶活力的保持。在处理Ⅵ(功率400 W、工作总时间20 min、变幅杆直径2 mm)超声条件下,酶活力虽然保持最高,但是蛋白质含量相对偏低一些。综合考虑,可选择处理V作为后续植物乳杆菌R23细胞破碎条件,在此条件下,酶活力与处理Ⅵ无显著差异,蛋白质含量较高且与处理Ⅶ无显著差异。
参考文献:
[1]FERNDEZ-PREZ R, RODRGUEZ C T, RUIZ-LARREA F.Fluorescence microscopy to monitor wine malolactic fermentation[J].Food Chemistry,2019,274:228-233.
[2]JIANG J,SUMBY K M,SUNDSTROM J F,et al.Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment[J].Food Microbiology,2018,73:150-159.
[3]LIN X Z,HE Z G,LI W X,et al.Validation of reference genes for real-time quantitative polymerase chain reaction analysis in Lactobacillus plantarum R23 under sulfur dioxide stress conditions[J].Australian Journal of Grape and Wine Research,2018,24(3):390-395.
[4]李维新,何志刚,郑宝东,等.植物乳杆菌R23产苹果酸乳酸酶特性研究[J].中国食品学报,2012,12(5):35-40.
[5]王晓敏,董璐,张继福,等.细胞破碎方法对Bacillus sp.DL-2 胞内蛋白酶拆分乙酸苏合香酯的影响[J].热带海洋学报,2021,40(2):39-48.
[6]梁蕊芳,徐龙,岳明强.细胞破碎技术应用研究进展[J].北方农业学报,2013(1):113.
[7]曾敏,谢为天,潘丽媚,等.鼠李糖乳杆菌细胞破碎方法的比较及其肽聚糖含量的测定[J].饲料工业,2010,31(8):31-33.
[8]赵瑞香,王大红,牛生洋,等.超声波细胞破碎法检测嗜酸乳杆菌 β-半乳糖苷酶活力的研究[J].食品科学,2006,27(1):47-50.
[9]李艳,孙海燕,周丽珍,等.重组血管紧张素转化酶抑制肽工程菌细胞破碎条件优化[J] .湖北农业科学,2014,53(9):2127-2130.
[10]任香芸,何志刚,林晓姿,等.植物乳杆菌R23高效增殖条件优化[J].中国食品学报,2015(8):94-100.
[11]任香芸,何志刚,李维新,等.枇杷酒苹果酸乳酸发酵耐硫优良菌株的筛选[J].食品与发酵工业,2010,36(2):12-16.
[12]THOMAS P,SEKHAR A C,UPRETI R,et al.Optimization of single plate-serial dilution spotting (SP-SDS) with sample anchoring as an assured method for bacterial and yeast cfu enumeration and single colony isolation from diverse samples[J].Biotechnology Reports,2015(8):45-55.
[13]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40-41.
[14]RICCI-SILVA M E, VITILO M, ABRAHAO-NETO J.Protein and glucose 6-phosphate dehydrogenase releasing from baker′s yeast cells disrupted by a vertical bead mill[J].Process Biochemistry, 2000, 35(8): 831-835.
[15]王曦,李彩梅,劳文燕,等.表達乙型肝炎表面抗原重组汉逊酵母细胞破碎方法的比较[J].中国生物制品学杂志,2012,25(6):759-762.
[16]许愈,张昭寰,赵莉,等.应用酸性点解水联合超声波杀灭副溶血性弧菌[J].上海海洋大学学报,2020,29(4):578-584.
[17]WANG Q X,MANMI K.Three dimensional microbubble dynamics near a wall subject to high intensity ultrasound[J].Physics of Fluids,2014,26(3):DOI:10.1063/1.4866772.
[18]顾思天,陈海琴,叶强,等.植物乳杆菌ZS2058中亚油酸异构酶的定位研究[J].食品工业科技,2008,(12):57-60.
(责任编辑:柯文辉)

