冷藏过程中凡纳滨对虾颜色变化与鲜度指标间的相关性研究
汤夕瑶,张旭飞,任惠峰,罗文钊,毛伟杰,2*
1(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋生物制品工程实验室,广东省海洋食品 工程技术研究中心,水产品深加工广东普通高等学校重点实验室,广东 湛江,524088)2(海洋食品精深加工关键技术省部 共建协同创新中心,大连工业大学,辽宁 大连,116034)3(东京海洋大学 海洋环境学科,日本 东京,108-8477)
凡纳滨对虾是我国主要养殖对虾品种之一,其营养丰富,味道鲜美,深受广大民众喜爱,具有较高的经济价值。鲜度是表征对虾品质的最重要因素,对产品的商品价值具有较大的影响。评价鲜度的指标很多,如质构、颜色、感官、气味和电导率等物理指标[1];挥发性盐基氮(total volatile basic nitrogen,TVB-N)、多酚氧化酶(polyphenol oxidase,PPO)值、K值和pH值等化学指标;致病菌含量、真菌含量和菌落数等微生物指标[2]。化学与微生物的检测方法客观性强,但操作繁琐、设备要求高、耗时长、材耗高、具有破坏性,因此需要简单和非破坏性的检测方法来解决上述问题。近年来对虾的无损检测和在线检测技术取得了很大的进展。QUAN等[3]设计一种对生物胺敏感的智能纳米纤维比例荧光传感器用于检测虾的新鲜度;HUANG等[4]通过羟丙基甲基纤维素改性的荧光醇膜与玫瑰茄花色苷的结构修饰来改善功能特性以监测虾的新鲜度变化;DAI等[5]利用可见/近红外高光谱成像技术快速检测未冷冻和冷冻虾的新鲜度;代琼[6]、QU等[7]基于高光谱成像技术对虾仁新鲜度进行检测。快速无损检测技术检测灵敏度高、快速,但也存在设备昂贵、数据建模复杂以及需要大量数据分析对比等很多问题。
人们往往通过颜色判断食品鲜度品质,但这种判断方法缺乏客观性和再现性。贮藏过程中对虾颜色变化是否与其他鲜度指标之间存在较好的相关性仍不明确。对虾颜色变化通常通过色差仪进行测定,但是使用色差仪需要在相对稳定的环境条件下精确地标定。色差仪检测样品时具有不连续性,需要人为操作并对样品进行多点检测,对数据准确性存在影响。利用计算机可视化系统(computer visualization system,CVS)则可以实现颜色变化的定量化、连续化测定[8]。CVS是利用计算机、摄像机、图像卡以及相关处理技术来模拟人的视觉,用以识别、感知和认识世界。CVS不仅可以分析一个检测点的颜色,还可以估计样品的总体颜色。利用CVS捕获、处理和分析图像可以对颜色进行客观性检测,也可以将其用于在线检测,实现质量自动评估,提高生产速度和效率[9]。作为一个客观、快速和非接触的质量评估工具,CVS已经被应用于鱼肉[10-11]、奶酪[12]等食品的质量非破坏性评价和分级等方面。但是CVS只是颜色测定结果,并没有和鲜度变化指标联系起来,如果颜色变化和鲜度指标存在相关关系,就能够实现对虾鲜度变化的在线分析和智能化检测。智能检测可以以无创、无损、简单和快速的方式为用户(制造商、零售商和消费者)提供食品状况方面的信息,将在品质监控方面发挥重要作用。
因此本文通过测定不同贮藏期对虾颜色的变化,研究颜色变化和鲜度指标之间的相关关系,以期通过颜色变化对对虾鲜度进行判断。首先建立色差仪和CVS测定的色差值之间的相关关系,然后探讨颜色变化与pH、TVB-N值、K值、感官评价及质构等变化的相关关系,实现利用颜色指标预测贮藏加工过程中对虾鲜度变化的目的,为无损检测及在线评估提供一种有效途径和方法。为对虾鲜度的智能化检测设备的开发提供理论基础。
1 材料与方法
1.1 材料
鲜活的凡纳滨对虾规格为每只12~17 g,广东省湛江市东风市场。采集质量在每只15~18 g(55~56只/kg),体型完好,为无损伤鲜虾。当天采购的凡纳滨对虾置于0 ℃冰水混合物中致死后,先将其均分为“去头”和“带头”2份样品,每份的虾数量不少于36只。之后以6只虾为1组,将样品分为去头虾6组、带头虾6组,并放入(4±1)℃的冰箱内冷藏。以6 d为1个试验周期,从冷藏后的第1天开始,每天取“去头”样品和“带头”样品各1组进行检测。
试剂:氧化镁、硼酸、盐酸、氢氧化钠均为国产分析纯,西陇科学股份有限公司(中国广东汕头市)。
仪器:HITACHI CR22G Ⅱ高速冷冻离心机,日本株式会社日立制作所;pH仪、SIM-F140制冰机,日本SANYO公司;TMS-PRO质构仪,美国FTC公司;VAPODEST450全自动凯氏定氮仪,德国Gerhardt公司;Titroline5000自动电位滴定仪,德国SI Analytics公司;DDSJ-308A型电导率仪,上海雷磁仪器厂;DEEP40 cm型摄影棚,上海诺美摄影器材有限公司;柯尼卡美能达CR-20色差仪,柯尼卡美能达控股株式会社;SONY ILCE-A7RM3数码相机、SONY SEL50M28镜头,索尼(中国)有限公司;RAL-D9标准色卡,德国劳尔公共有限责任公司。
1.2 实验方法
1.2.1 凡那滨对虾贮藏过程中颜色变化测定
1.2.1.1 对虾色差测定
从4 ℃冰箱中取出预处理的样品,虾去头去壳,放在20 mm的比色皿中,用色差仪对虾体第2腹节、第3腹节的侧面进行色泽检测。测3次取平均值,记录L*、a*、b*值,计算△E*值。3个值的正负以色差仪配备的标准白板、黑板为基准校正。△E*值表示总体色差值[13],按公式(1)计算:
(1)
式中:L*、a*、b*为样品测量值;L0*、a0*、b0*为标准值。
1.2.1.2 色卡色差测定
把287色哑光色卡根据色差仪测量面积要求进行适当裁剪,编号后按照上述方法进行测定。
1.2.1.3 CVS测定
CVS系统由照明系统、图像采集系统及图像处理系统组成。照明系统采用两盏平行灯照明,灯长40 cm、每盏灯均匀分布着120颗LED灯珠,灯板可以在棚体框架上移动以灵活布光。色温为5 700 K,显色指数(Ra)大于92%,两盏灯都位于样品上方的40 cm处并与样品呈45°的角度,作为标准照明系统。考虑到环境照明对实现可重现成像条件有着至关重要的影响,为保证整个实验过程中照明条件的统一性,在采集图像之前,照明系统应先打开30 min以保持光源的稳定。数码相机垂直放置在距背景板30 cm处,相机镜头与光源轴线之间的角度为45°时可以减少颜色的漫反射(造成颜色的漫反射主要发生在入射光45°),作为标准的拍摄条件。图像在白色背景下拍摄,相机设置如为手动模式,感光度(ISO)为400,镜头光圈f为4.0,快门速度为1/160;分辨率为2 816×1 880像素;无变焦、无闪光联合图象专家组(joint photographic experts group,JPEG)格式存储。相机通过IFC-400PCU界面连接线连接到带有Adobe Photoshop 2017的计算机USB端口,直接从计算机中获取图像。样品为287色哑光色卡和不同贮藏期的对虾,重复测量3次取平均值。用Adobe Photoshop 2018软件打开待处理图片,用菜单栏中的椭圆选框工具选定需要分析的区域,在图像中选择Lab颜色模式,然后在图像里的“直方图”中查看选中区域的图像数据并实时记录L*、a*、b*值,重复测量3次取平均值[14-15]。
1.2.2 凡那滨对虾贮藏过程中主要鲜度指标测定
1.2.2.1 电导率的测定
对虾经预处理后去头去壳,迅速剁碎,称取虾肉5.00 g,加入45 mL蒸馏水,用均质机18 000 r/min均质40 s,在振荡机上300 次/min振荡30 min,在离心机中以8 000 r/min常温条件下离心5 min。取上清液,用电导率仪测定电导率[16]。
1.2.2.2 pH值的测定
对虾经预处理后去头去壳,迅速剁碎,称取虾肉5.00 g,加入45 mL蒸馏水,用均质机16 000 r/min均质40 s,室温静置30 min后,8 000 r/min离心5 min,取上清液测其pH值。
1.2.2.3 质构的测定
质构的测定采用质地剖面分析(texture profile analysis,TPA)(二次咀嚼测试)法[17],通过使用质构仪模拟人的口腔咀嚼活动,2次挤压样品,测试感应探头与电脑连接,通过电脑软件输出检测过程中的质构曲线图。从曲线图中可以得到样品质构特性的变量,本文选择硬度和弹性做为质构的代表性指标进行分析。
1.2.2.4 TVB-N的测定
参照GB 5009.228—2016中自动凯氏定氮仪法。将凡纳滨对虾样品去头,去壳和虾线,用打浆机搅碎后取5 g(精确至0.001 g)样品加入45 mL蒸馏水,再次匀浆,浸渍30 min。转移至蒸馏管中,加入0.5 g氧化镁后迅速连接到蒸馏器上,按照仪器设定条件测定。样品中TVB-N含量以100 g样品中所含氮的质量(mg)表示。
1.2.2.5K值的测定
色谱柱采用COSMOSIL5C18(4.6 mm×250 mm,5 μm);流动相A为CH3OH溶液,B为0.05 mol/L KH2PO4和0.05 mol/L K2HPO4混合溶液,pH调至6.5;C为超纯水;将甲醇用0.22 μm的有机相膜抽滤,水溶液和盐溶液用0.22 μm的水相膜抽滤,并进行超声脱气;柱温25 ℃;进样量10 μL;样品运行程序:采用等度洗脱,98%的0.05 mol/L KH2PO4和0.05 mol/L K2HPO4混合液和体积分数2%的甲醇溶液,样品运行时间19 min,在波长254 nm处进行检测。计算ATP关联化合物的浓度,6种核苷酸的浓度计算如公式(2)所示:
(2)
式中:X,凡纳滨对虾样品中的核苷酸及其关联化合物的含量,μmol/g;ρ,6种核苷酸及其关联化合物的标准混合品浓度校准曲线,μg/mL;V,样品提取物的体积,mL;m,样品的质量,g;M,每个核苷酸及其关联化合物的分子质量。K值计算如公式(3)所示:
(3)
式中:HxR为次黄嘌呤核苷含量,μmol/g;Hx为次黄嘌呤含量,μmol/g;ATP为腺苷三磷酸含量,μmol/g;ADP为腺苷二磷酸含量,μmol/g;AMP为腺苷酸含量,μmol/g;IMP为肌苷酸含量,μmol/g。
感官评价方法:取出存放在4 ℃的样品解冻至室温,感官评定小组成员由10名经过培训的人员组成,按照国标SC/T 3113—2002《冻虾》感官鉴定标准对样品品质进行评分(表1)。

表1 冷藏过程中对虾品质评分标准Table 1 Sensory evaluation standard for prawns quality during storage
1.2.3 数据统计
每个样品平行处理3次,数据处理和表格由excel处理。样本值由平均值±标准偏差表示。使用SPSS 17.0进行显著性分析,P<0.05表示具有显著性差异。相关性分析通过Excel中CORREL函数来计算相关系数。根据实测值(Xmeasure)和预测值(Xmodel)的差异计算均方根误差(root-mean-square error,RMSE),通过拟合优度(R2)评定拟合程度,R2越接近1,拟合度越好。RMSE计算如公式(4)所示:
(4)
2 结果与分析
2.1 CVS系统与色差仪测定颜色相关性分析
CVS系统替代色差仪就可以对颜色进行连续化的测定。将CVS系统测定的287色色卡的L*、a*、b*值,与色差仪测定的L*、a*、b*值进行相关分析。由图1可知CVS与色差仪在颜色数据测量上呈线性相关,且相关性较好,L*、a*、b*值相关系数分别是0.95、0.87、0.96。说明可以利用CVS系统代替色差仪来进行颜色的测定。
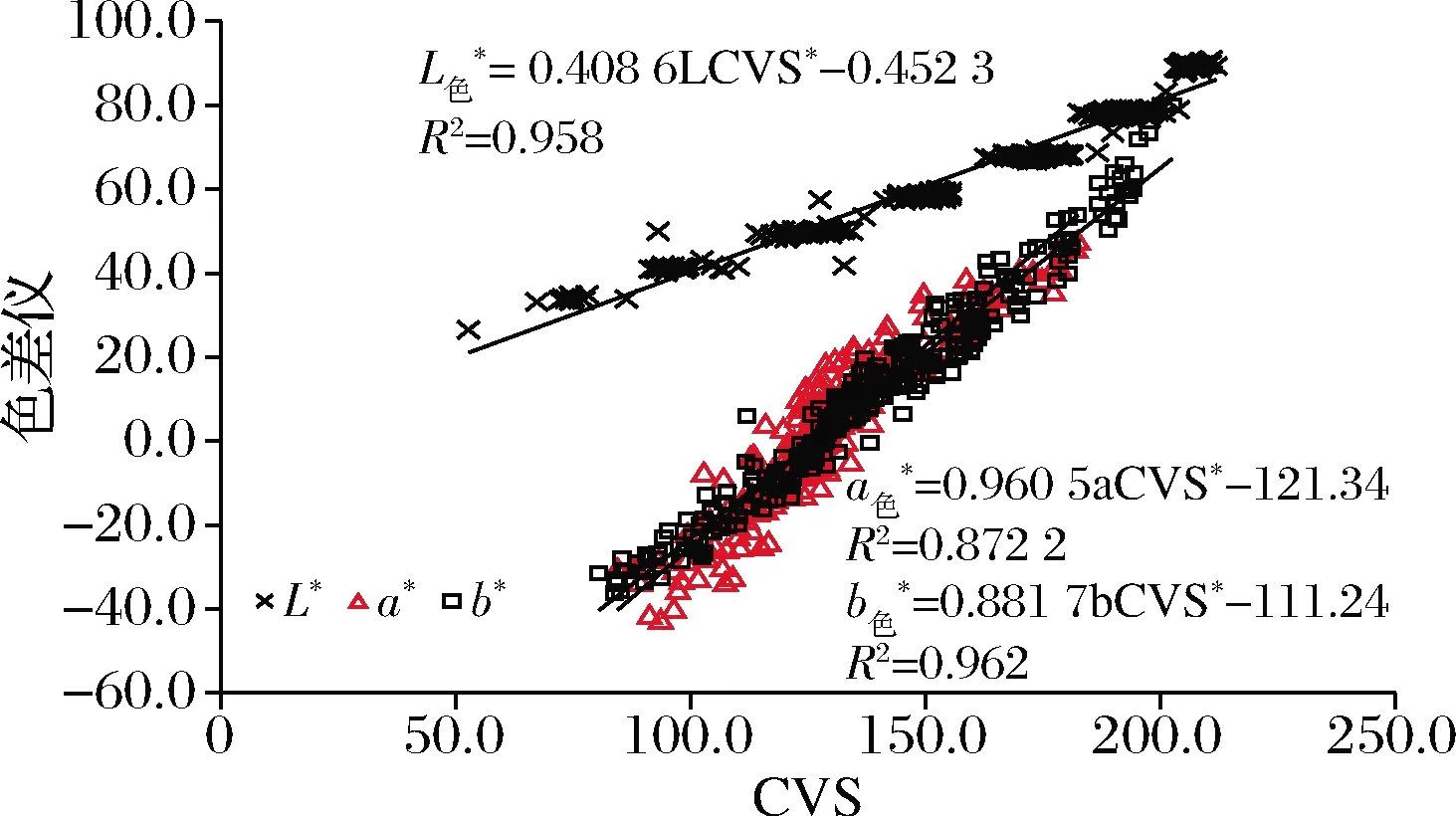
图1 CVS系统与色差仪测定色卡板L*、a*、b*值相关关系Fig.1 The correlation between the L*, a* or b* values of the color chart measured by the CVS and the colorimeter
a*相关系数没有达到0.90以上,可能是因为色卡与数码相机制造商的颜色设定不是很匹配,因此造成颜色测定上的差异。利用普通数码相机拍摄的图像是对每个像素通过R、G和B 3个数值,记录拍摄对象的颜色。通常应用制造商自己的颜色校正,在理想情况下使用符合通用色彩标准(standard Red Green Blue,sRGB)(国际电工委员会指定的RGB色彩空间)的数码相机拍摄,所得照片的颜色是准确的。但是实际上市场上数码相机的测量精度并不能保证,互换镜头可能也会影响记录的RGB值;另外一个原因可能是由于拍摄的色彩数据以JPEG压缩格式进行储存,对相邻像素进行平均,使合并所得色彩的部分信息不准确。以上都是可能导致a*值的相关系数不高的原因,但是相关性>0.85,可以认为CVS也可以代替色差仪进行测定。
2.2 冷藏过程中对虾颜色变化规律研究
如图2所示,L*、a*、b*、△E*值从第1天开始保持逐渐上升的趋势,L*值和b*值上升幅度明显,都能较好体现对虾冷藏过程中颜色变化,肉眼也能明显观察到颜色变化。a*值从冷藏第1天到第6天的数值呈缓慢上升的趋势,带头处理的对虾a*值上升了0.65,去头处理的对虾a*值上升了0.55。上升的幅度不大,肉眼观察颜色变化不明显(图2-a)。相较于去头冷藏处理的虾肉,带头冷藏处理的虾肉更透亮发白。b*值从冷藏第1天到第6天的数值呈缓慢上升趋势,带头对虾b*值上升了1.87,去头处理的对虾b*值上升了1.29。带头与去头对虾b*值在冷藏前2 d相差不大,从第3天开始2组样品b*值上升速率均有提高,带头冷藏处理的对虾上升速率提高更为明显,从第3天开始两组b*值相差0.13,到第6天两组b*值相差0.65,颜色相差十分明显,带头虾组虾肉较去头冷虾肉更显黄(图2-b)。如图2-c所示,在检测周期内带头虾L*值上升了4.84,去头虾L*值上升了3.42。随冷藏时间推移,L*值在第1天~第4天呈一定速率上升,在第4天起带头虾L*值上升速率增加,去头虾上升速率变化不明显。带头虾的L*值比去头虾低,说明随着对虾鲜度变化带头虾颜色变暗较快。对虾体表色泽变化的主要原因是在多酚氧化酶的催化作用下,虾体内无色的一元酚和氧气发生生化反应形成无色的二元酚,二元酚继续氧化形成有色的醌类物质,醌类物质极易和虾体里的蛋白质或者氨基酸类物质结合成褐色的复合物。虾肉随着酪氨酸和醌类物质的产生而腐败分解,褐变逐渐明显,虾体逐渐失去光泽,颜色逐渐变暗直至变成黑色,而虾头中的多酚氧化酶含量较多,在贮藏过程中可以加速虾体变质。ΔE*值越大,说明色差越大,随着贮存期的延长,带头和去头虾的ΔE*值都呈上升趋势,且带头虾的ΔE*变化更大。
从图3中可以看出,无论是带头虾还是去头虾,其在贮藏过程中颜色变化的色差值和CVS值之间都呈相关度较高的线性相关关系,因此可以采用计算机视觉系统代替色差仪对样品颜色进行测定,这也为连续化无损检测提供了基础数据。
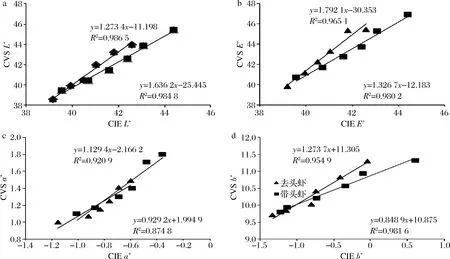
a-L*值;b-△E*值;c-a*值;d-b*值;CIE-色差仪测定所得数据图3 对虾在4 ℃贮藏过程中色差仪和CVS测定的颜色变化的相关性分析Fig.3 Correlation analysis of color changes of prawns measured by colorimeter and CVS during storage at 4 ℃
2.3 冷藏过程中对虾鲜度指标的变化规律
2.3.1 冷藏过程中对虾电导率的变化
从图4可见带头对虾与去头处理对虾随冷藏时间延长,两组样品电导率值均呈上升趋势,带头冷藏对虾的电导率值均比去头冷藏对虾高。对虾在冷藏过程中,因为虾肉中内源酶和微生物发生分解作用,高分子蛋白降解为低分子物质形成单电离子,虾肉制成匀浆,匀浆电导率相比新鲜的虾肉电导率值相对偏高。带头虾与去头虾的电导率与贮藏时间的相关性很高,相关系数分别达0.98和0.94,呈正相关。
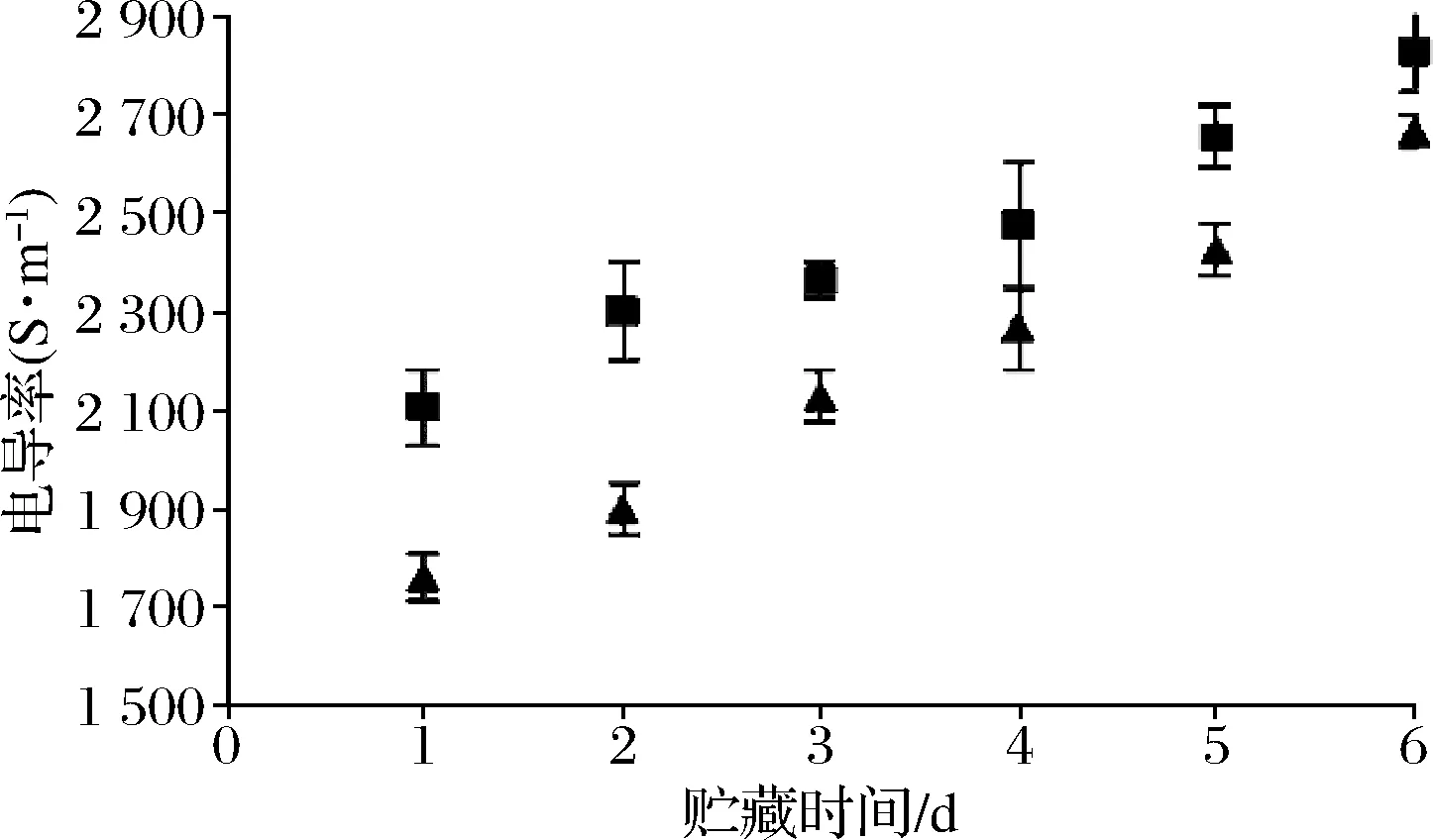
图4 在贮藏过程中虾肉的电导率变化Fig.4 The electrical conductivity changes of prawns meat during storage
2.3.2 TVB-N的变化
TVB-N值是反映对虾鲜度的一个重要指标。贮藏过程中在对虾中微生物和内源酶的作用下,蛋白质分解成氨和胺类等碱性物质与腐败中产生的有机酸结合形成盐基态氮。TVB-N指食物浸出液在碱性环境下蒸馏出的总氮含量,即此条件下能形成氨气的含氮类物质的总称。如图5所示,在第1天,带头虾的TVB-N为(5.62±0.53)mg/100 g,去头虾为(4.79±0.41)mg/100 g,均在可接受范围。从冷藏第1天开始对虾的TVB-N含量都呈持续上升趋势,带头虾TVB-N含量均高于去头虾。在第3天后带头和去头虾TVB-N含量增加的趋势更明显,带头虾在第6天TVB-N数值超出国标海虾的卫生标准30 mg/100 g,鉴定为不可食用。去头虾在第6天的TVB-N数值为29 mg/100 g临近不可食用标准线。此增长趋势与刘金昉[18]和YUAN等[19]研究结果相似,但其样品中TVB-N含量在贮藏第4天已达到临界值30 mg/100 g附近。
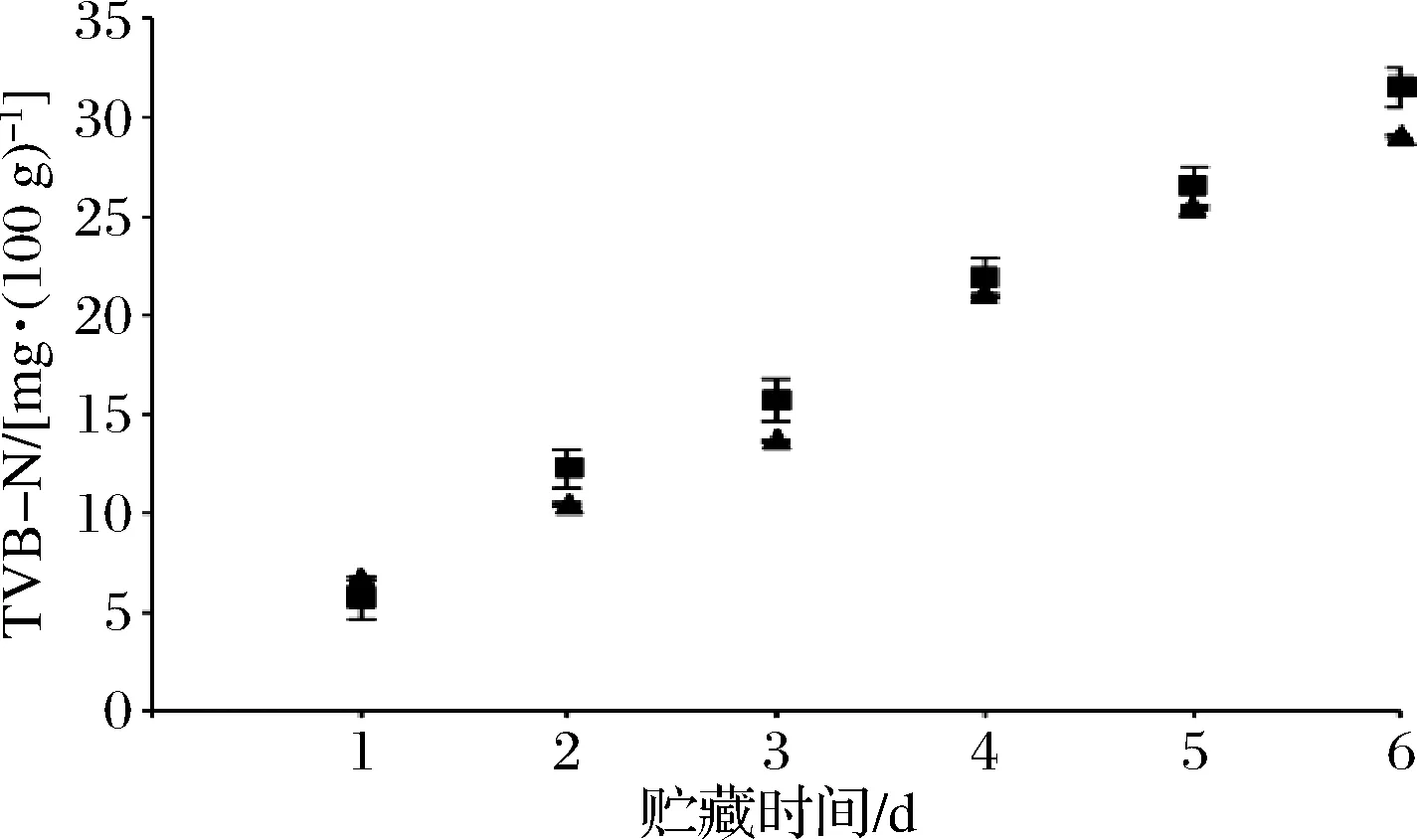
图5 对虾在贮藏过程中TVB-N变化Fig.5 Changes in TVB-N of prawns during storage
2.3.3 贮藏时间对虾肉pH值的影响
pH值的变化与TVB-N含量变化相似,对虾冷藏中pH的变化主要是由于对虾内源酶以及寄生的外源微生物分解蛋白质,产生并积累氨类、三甲胺等碱性物质使pH上升。新鲜凡纳滨对虾的pH值为7.2~7.3[20-21]。如图6所示,本研究中新鲜对虾pH约为(7.2±0.02),随冷藏时间的推移,带头虾与去头虾pH呈上升趋势,带头对虾在冷藏期间的pH上升较迅速且除第1天后带头虾pH均高于去头虾。
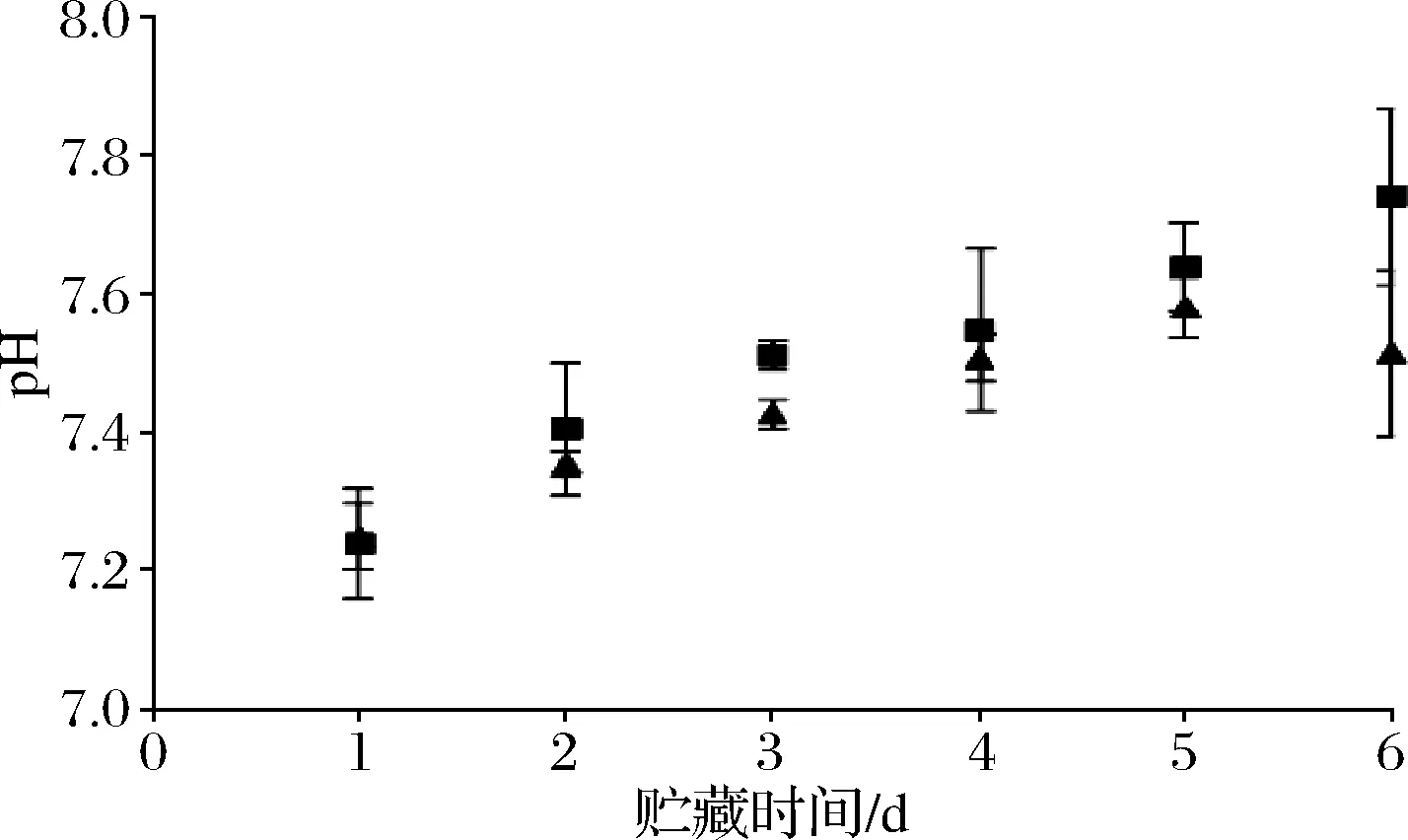
图6 在贮藏过程中对虾虾肉pH值变化Fig.6 Changes in the pH value of prawns meat during storage
2.3.4 质构的变化
对虾在死亡后会先进入僵直期,再经过内源酶和外源微生物的分解作用使肌肉自溶从而使硬度下降[22]。硬度变化如图7-a所示,对虾在冷藏过程中,总体硬度先提升再逐渐下降。对虾肌肉硬度在第1天~第3天先上升,第3天之后硬度呈下降趋势,到第6天趋于稳定,带头虾硬度上升和下降的幅度都比去头虾大。对虾的弹性来自肌肉中蛋白质与水化层结合形成结构紧密的网状结构,如果网状结构被破坏,肌肉就会失去弹性[23],弹性变化趋势和硬度相似(图7-b),贮藏第3天达到最高后变化趋势不显著(P>0.05),而带头虾和去头虾的弹性下降幅度没有显著差别。但ZHANG等[24]的研究显示在冰藏过程中虾肌肉的弹性降低。质构的变化受到很多因素的影响,如pH值变化,肌原纤维蛋白或结缔组织的降解。王伟等[13]研究结果表明4 ℃冷藏条件下,虾体的硬度在2.5 d时出现最大值,并进入了僵直阶段,之后硬度下降并趋于平缓。
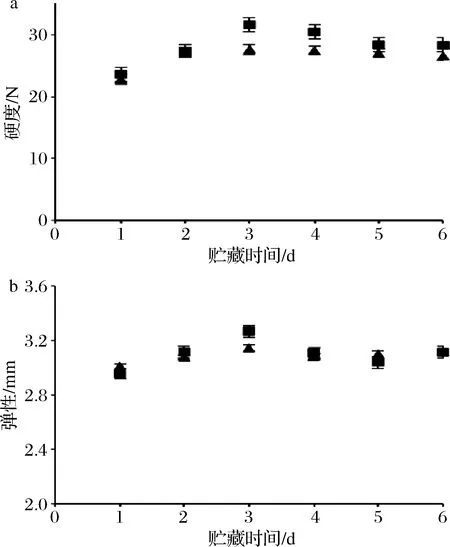
a-硬度;b-弹性图7 对虾在贮藏过程中质构变化Fig.7 The texture changes of prawns during storage
2.3.5 贮藏时间对感官评分的影响
感官评定小组对国标SC/T 3113—2002感官鉴定标准的评定标准进行优化后,对对虾品质分级进行分数制评定,如图8所示。带头虾在第4天与去头虾在第5天表现为外壳开始失去光泽,出现黑斑,有少许残缺,气味虽然正常但是肌肉组织出现松弛感。第6天带头冷藏处理的少部分对虾开始出现令人不愉快的味道,肌肉组织弹性略差,局部出现轻微红变,并出现软壳的现象。去头虾的感官评分要高于带头虾,说明带头虾在贮藏过程中鲜度下降更快。
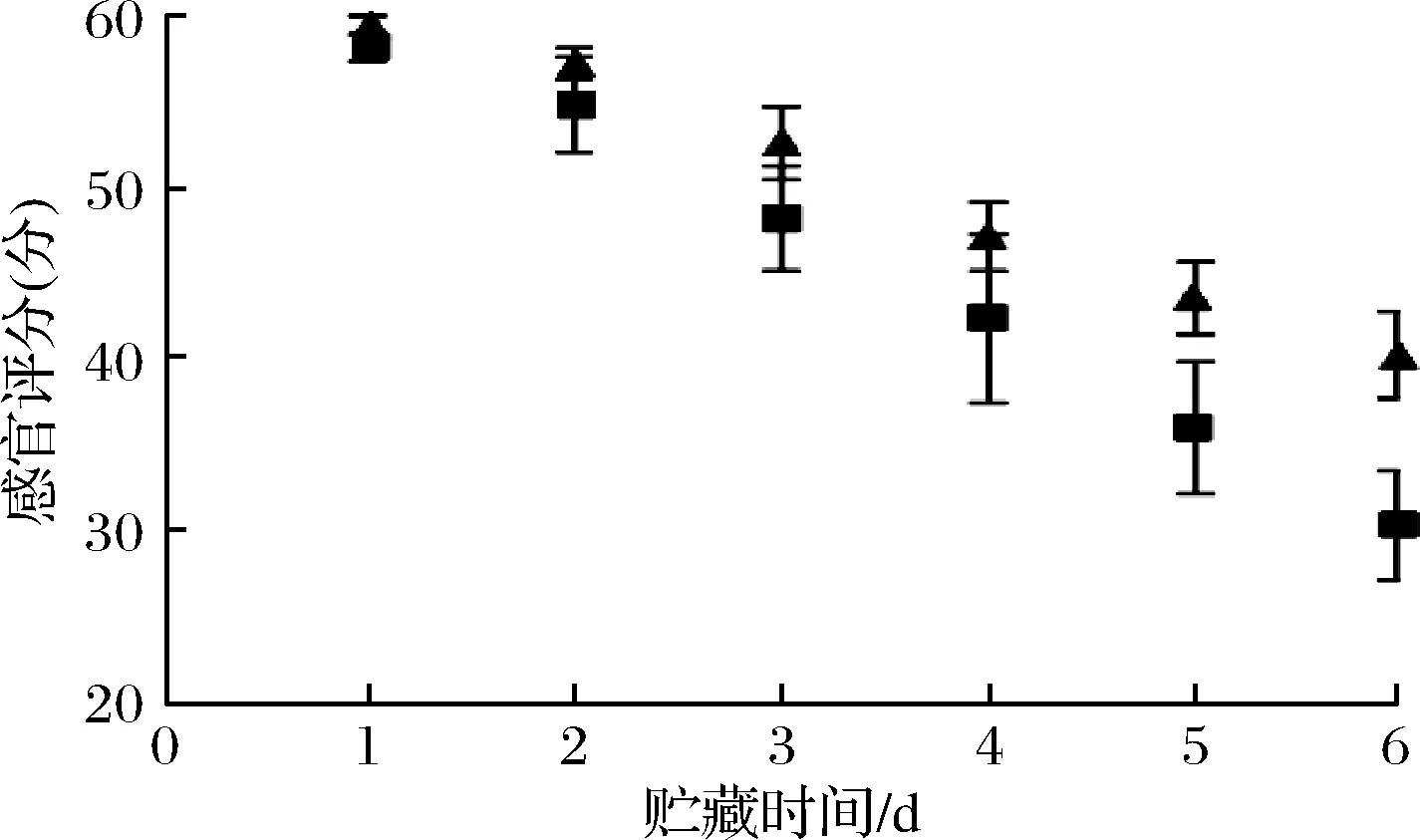
图8 对虾在贮藏过程中感官评分变化Fig.8 Changes in sensory scores of prawns during storage
2.3.6 贮藏过程中K值的变化
K值是以核苷酸的分解产物作为指标的鲜度判定方法,它是对ATP降解产物分别进行定量而求得的比值,K值通常作为评价鱼肉鲜度的重要指标[22],但许多研究表明K值也可以用来评价虾肉的鲜度。中国对虾[24]、凡纳滨对虾[25]、日本沼虾[26]等在冷藏期间K值与TVB-N值的变化趋势基本相似。随着贮藏时间的增加,带头虾和去头虾的K值(图9)都呈线性增长趋势,说明对虾的新鲜度不断降低。带头虾的K值要高于去头虾,带头虾在贮藏过程中的鲜度更容易下降。
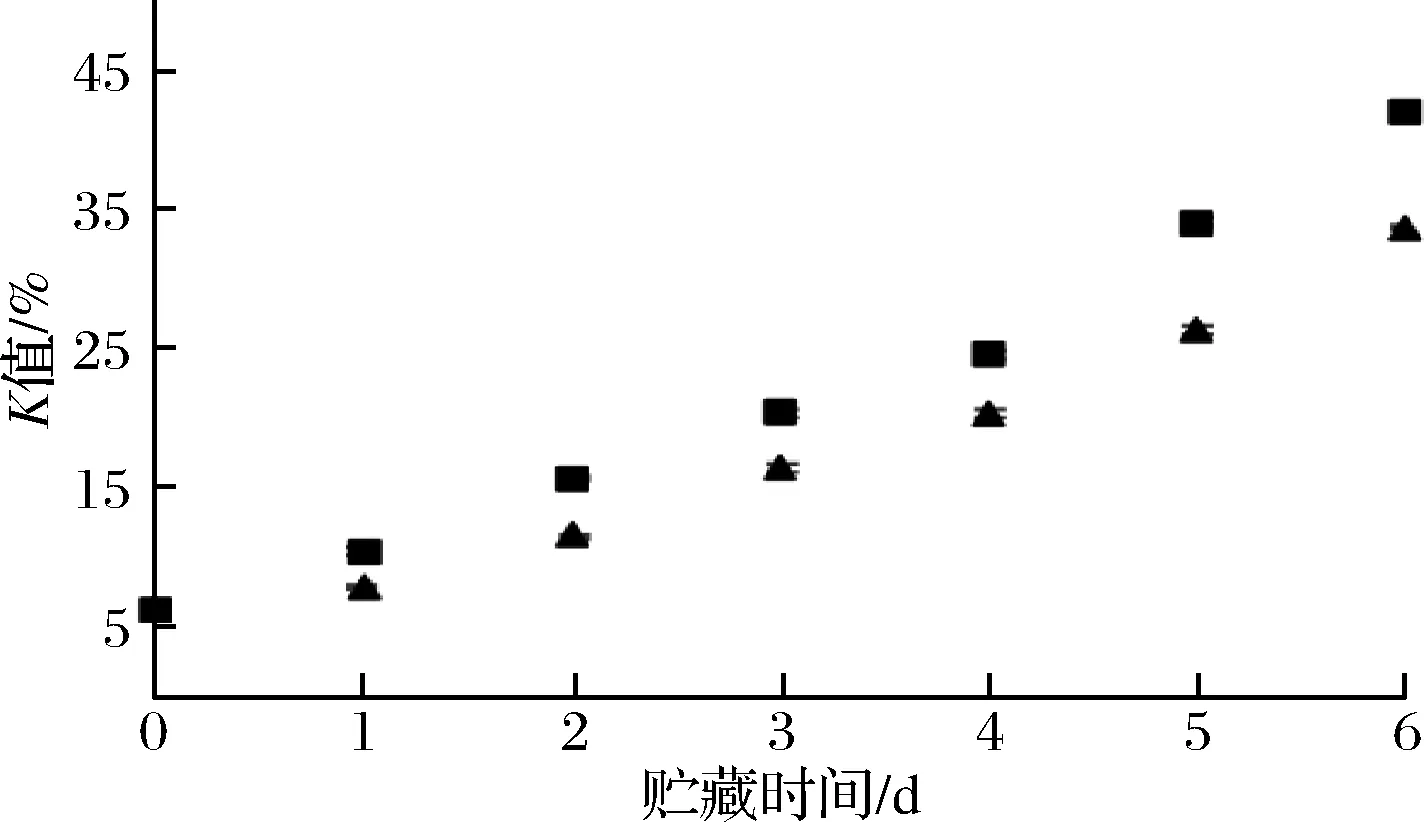
图9 对虾在贮藏过程中K值变化Fig.9 Changes in K value of prawns during storage
2.4 冷藏过程中各鲜度指标的变化与颜色变化的相关关系
从表2中可以看出,无论是带头虾还是去头虾在贮藏过程中的颜色变化都与电导率、pH、TVB-N值、K值呈线性正相关关系,与感官评分呈线性负相关且相关系数都>0.9,说明相关性很高。因此,可以利用CVS测定的总体色差值来推测其他指标的变化,为智能鲜度检测工具的开发提供了理论依据。但是色差值与硬度和弹性等表征质构的指标之间没有相关关系,这说明颜色变化可能与肌肉中某些成分的变化有关,但与肌肉蛋白质的力学变化无关。

表2 贮藏期过程中对虾鲜度指标与CVS △E*值 相关关系分析Table 2 Correlation analysis of prawns freshness index and CVS △E* value during storage
从表2中可以看出对虾带头与否对预测模型的影响,因为虾头和虾壳富集了大量微生物,酚氧化酶活力也较高[27],所以对各鲜度值的影响比较大,带头虾和去头虾的模拟公式也有所区别,但是两者模拟公式的区别不是很大,因此对2个公式进行整合,通过1个公式来表示颜色和各鲜度指标之间的关系,见表3。通过RMSE和R2来判断预测值和实测值的偏差和拟合程度,RMSE越小说明偏差越小,R2值越接近1说明回归直线对观测值的拟合程度越好。将模拟公式整合后发现拟合优度都>0.9,预测方程和实测值的拟合度很好,同时更加简便地表达了颜色和相关鲜度指标的关系。
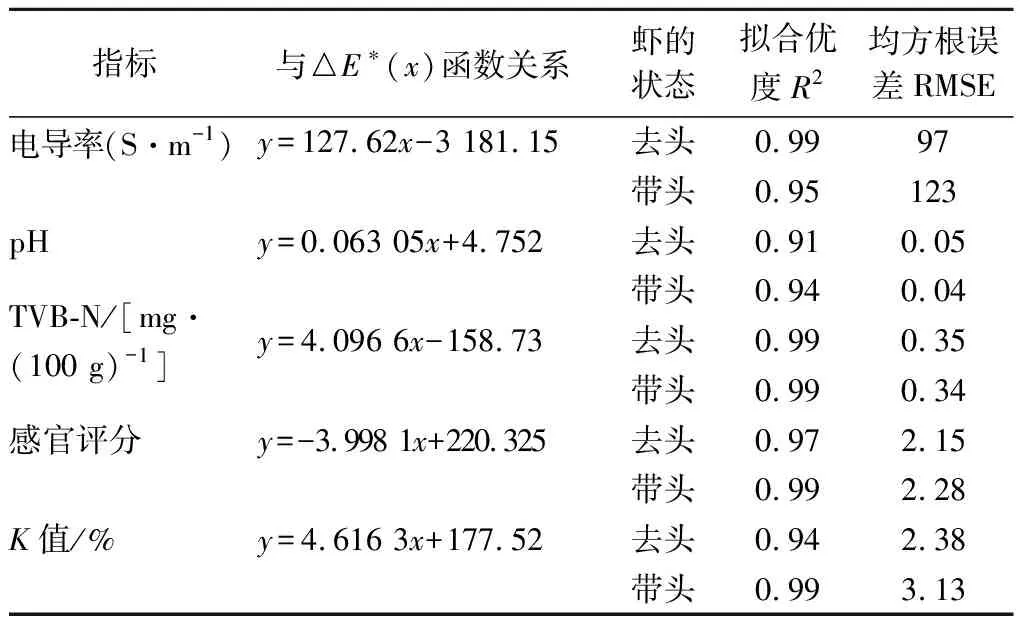
表3 贮藏期过程中对虾鲜度指标与△E*值函数关系Table 3 Function relation of prawns freshness index and △E* value during storage
3 结论
在4 ℃贮藏条件下,随着贮藏期的延长,对虾样品色差值逐步增大,说明样品颜色逐渐加深;其他鲜度指标如:电导率值、pH值、TVB-N值和K值呈上升趋势;弹性和硬度先增大后减小;感官评分呈下降趋势。带头虾与去头虾在色差值、电导率值上区别较显著,表示虾头中的酶类物质可能会加速鲜度的下降。
CVS测定的对虾颜色与色差仪测定的对虾颜色值呈高度相关,说明可以利用CVS代替色差仪对对虾的颜色进行测定。同时色差值和对虾鲜度值之间呈高度相关,建立了总体色差值与电导率、pH、TVB-N值及K值的关系模型。本项研究结果表明可以通过CVS系统测定的颜色值变化推导出其他鲜度值的变化,可以实现对虾颜色的在线监测,为鲜度在线监测仪器的开发提供了理论依据。

