可切除肝细胞癌患者癌旁肝组织中分泌型簇集蛋白的表达与术后生存预后的相关性
黄 蓉, 樊 斌, 丁 俊
(湖北省恩施土家族苗族自治州中心医院 肝胆胰脾外科, 湖北 恩施, 445000)
肝细胞癌(HCC)占所有肝癌病例的70%~85%, 是导致肿瘤相关死亡的主要原因[1]。目前,手术切除仍是治愈HCC的主要手段,但约80%的HCC患者在根治性切除术后仍会发生肝内复发, 5年病死率超过50%[2]。原发性HCC复发包括肝内复发和多中心复发,肝内复发主要与肿瘤因素有关,而多中心复发还可能与其他肝脏背景因素有关[3-4]。因此,仅关注肿瘤组织是不够的,癌旁组织有关分子学改变也可能会直接或间接影响手术后疾病进展。簇集蛋白(CLU)是最初从大鼠睾丸中分离出的一种高度保守的糖蛋白,在人体所有组织中都有表达[5]。事实上,CLU基因可编码分泌型sCLU蛋白(sCLU)和核sCLU蛋白(nCLU), 而sCLU和nCLU蛋白在肿瘤发生和发展的各个病理生理过程中可能发挥着相反的作用[6-7]。多项研究[6-9]证实了sCLU在各种恶性肿瘤中的预后价值,但结果却相互矛盾。本研究调查sCLU在可切除HCC患者癌旁肝组织和血清中的表达水平及预后评估作用,现将结果报告如下。
1 资料与方法
1.1 一般资料
本研究是在获得本院机构审查委员会的批准并在赫尔辛基宣言指导原则下进行的。患者在样本获取前签署了知情同意书,所有患者数据都是匿名的。选取2010年1月—2015年12月在本院肝胆胰脾外科接受治愈性肝切除术的208例HCC患者为研究对象,均获得血清样本、切除的肿瘤组织和癌旁肝组织样本。排除接受过任何术前治疗(如化疗、乙醇注射或经动脉化疗栓塞)的患者。经术后病理组织学检查证实了原发性HCC诊断。根治性切除定义为宏观上完全切除肿瘤,组织学检查阴性。208例患者的平均年龄为(59.0±13.56)岁,其中男162例(77.88%); 126例(60.58%)为乙型肝炎表面抗原(HBsAg)阳性, 63例(30.29%)为抗丙型肝炎病毒(HCV)阳性, 31例(14.90%)有HCC家族史; 中位肿瘤直径为5.0 cm[四分位距(IQR)为3.5~12.0 cm]; 病理检查证实微血管侵犯105例(50.48%); 根据美国癌症联合委员会(AJCC)/国际癌症控制联盟(UICC)第7版肿瘤、淋巴结和转移(TNM)分期系统[10]对HCC组织进行分类, Ⅰ期54例, Ⅱ期84例, Ⅲ期70例; 84例(40.38%)为肝硬化。因此,大部分患者被诊断为慢性肝病、肝功能异常,平均吲哚菁绿15 min滞留率(ICG-R15)为(14.5±10.8)%(正常为0%~10%)。
1.2 样本获取和临床资料收集
所有患者在手术前禁食≥10 h后采集血液样本,立即分离血清并存储于-80 ℃环境中。每个样本只经历1次冻融。此外,手术切除后立即获得组织标本,在液氮中迅速冷冻, 24 h后转移至-70 ℃环境中保存。前瞻性获取术前临床和实验室数据、切除标本的组织学分析以及术后生存数据。详细的临床病理特征包括常规肝脏生化指标、肝炎标志物、血清甲胎蛋白(AFP)水平、肿瘤大小、肿瘤数量和血管浸润。基于苏木精-伊红染色(HE染色)切片检查进行组织学评估。分析HCC标本、血清中凝聚素表达与重要的临床病理参数的关系,包括年龄、性别、抗HCV状态、HBsAg状态、血清AFP水平、肿瘤大小、肿瘤数量、ICG-R15水平、血清白蛋白水平、血清丙氨酸转氨酶水平、宏观/微观血管浸润和肝硬化。
1.3 酶联免疫吸附法(ELISA)测定血清中sCLU水平
采用ELISA试剂盒(捷克BioVendor Laboratory Medicine Inc公司)测定血清sCLU水平。所有样品和标准品以一式两份进行评估,并计算平均值。首先将稀释后的样品和标准品用移液管移入96孔板中,室温下孵育2 h后洗涤平板,采用sCLU偶联物孵育2 h; 然后加入底物溶液并在室温下孵育30 min, 加入终止液终止反应,在450 nm处通过Spectra Max 250酶标仪(美国Molecular Devices. 公司)读板。sCLU浓度以μg/mL表示,并通过与参考标准进行比较来评估。
1.4 免疫组化法检测组织sCLU蛋白表达
将组织标本在4%多聚甲醛中4 ℃固定过夜,并使用自动包埋机包埋在蜡中。此外,样品通过一系列乙醇梯度脱水(70%、80%、90%、100%)后经氯仿清洗,然后包埋在石蜡中。将再水化的组织切片用柠檬酸钠缓冲液(10 mmol/L, pH值6.0)微波处理,用3.0% H2O2孵育10 min,封闭液浸泡10 min。将组织切片与sCLU单克隆抗体(克隆B-5, 1∶200稀释; 美国Santa Cruz Biotechnology公司)在4 ℃的湿室中孵育过夜。此外,将组织切片载玻片用生物素标记的二抗孵育10 min, 然后用链霉亲和素辣根过氧化物酶结合物再处理10 min, 3, 3′-二氨基联苯胺底物显色10 min, Mayer′s苏木精复染10 min。将载玻片安装在显微镜下评估。采用PBS替代一抗作为阴性对照。评估标准[11]: 阴性(-)为弱染色或未染色, (+)为<10%的肿瘤细胞中观察到阳性表达,阳性表达≥10%的肿瘤细胞为中度染色()至强染色()。
1.5 统计学分析
2 结 果
2.1 血清sCLU水平与术后生存率的关系
208例HCC患者随访时间为2~130个月,中位随访时间为58个月; 复发142例(68.27%), 复发时间为38.0个月; 随访期间死亡112例(53.85%)。所有患者术前血清sCLU水平为89.11(63.23, 119.47) μg/mL, 且血清sCLU水平与肿瘤分期无相关性; 单因素分析显示,术前高sCLU水平(≥89.11 μg/mL,n=104)与低sCLU水平(<89.11 μg/mL,n=104)患者的生存期比较,差异无统计学意义(Log-rankχ2=1.815,P=0.178)。见图1。
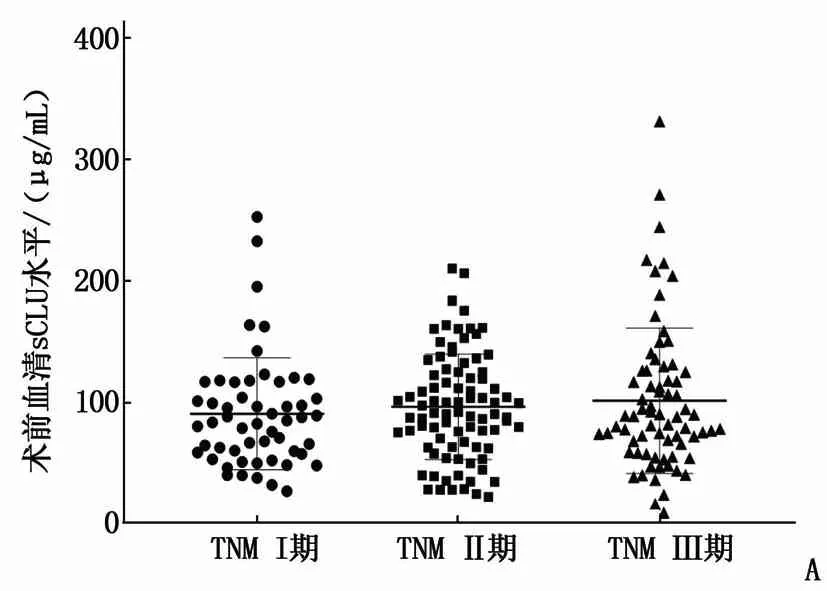

A: 不同TNM分期患者血清sCLU水平比较; B: Kaplan-Meier生存曲线。
2.2 HCC和癌旁肝组织中sCLU的免疫组化染色结果
在115例(55.29%)肿瘤组织和81例(38.94%)癌旁肝组织中检测到sCLU蛋白阳性表达,见图2。
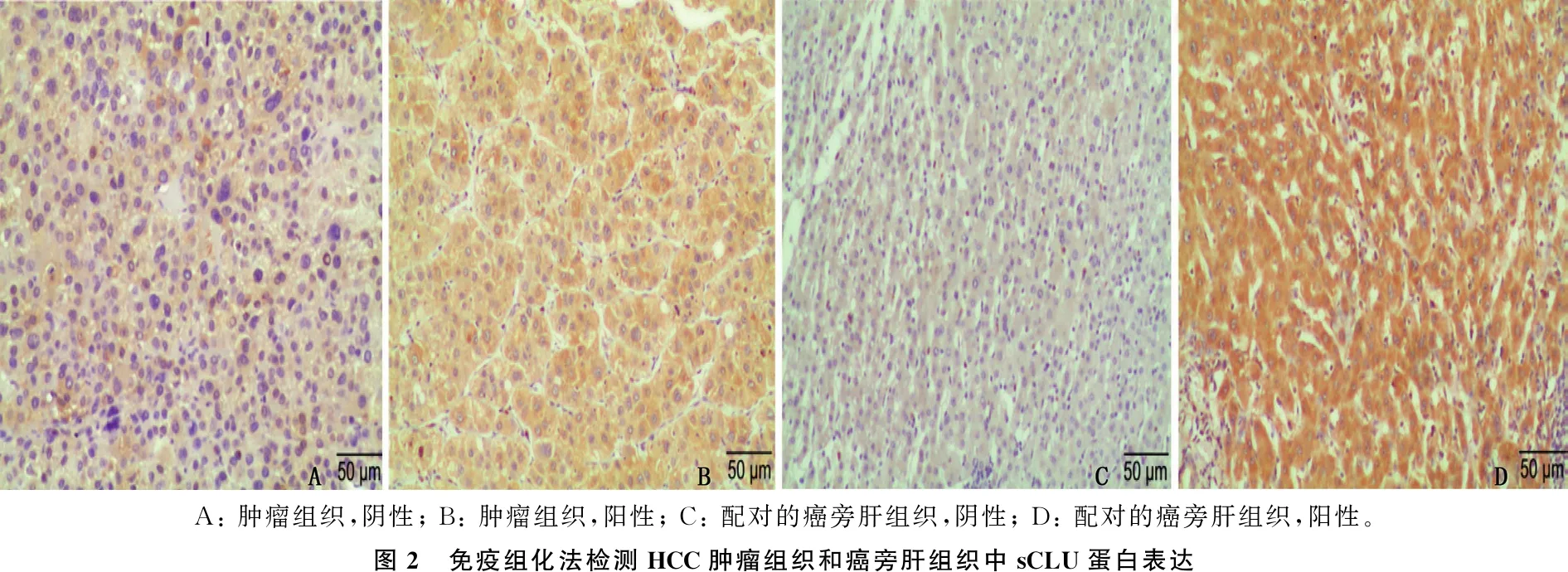
A: 肿瘤组织,阴性; B: 肿瘤组织,阳性; C: 配对的癌旁肝组织,阴性; D: 配对的癌旁肝组织,阳性。图2 免疫组化法检测HCC肿瘤组织和癌旁肝组织中sCLU蛋白表达
2.3 HCC和癌旁肝组织中sCLU的免疫组化染色结果与术后生存率的关系
肿瘤组织中sCLU蛋白表达阳性与阴性患者的无病生存率差异无统计学意义(Log-rankχ2=1.763,P=0.184); 癌旁肝组织中sCLU表达阳性的患者的术后无病生存率低于sCLU表达阴性的患者,差异有统计学意义(Log-rankχ2=9.853,P=0.002)。见图3。生存分析结果显示,癌旁肝组织sCLU蛋白表达与肿瘤组织sCLU蛋白表达呈显著正相关性(rs=0.679,P<0.001)。此外,癌旁肝组织sCLU阳性表达者的肿瘤复发率为81.48%(66/81), 高于阴性表达者的59.84%(76/127), 差异有统计学意义(χ2=10.691,P=0.001)。HCC组织中sCLU阳性表达者的肿瘤复发率为71.30%(82/115), 阴性表达者为64.52%(60/93), 差异无统计学意义(χ2=1.094,P=0.296)。
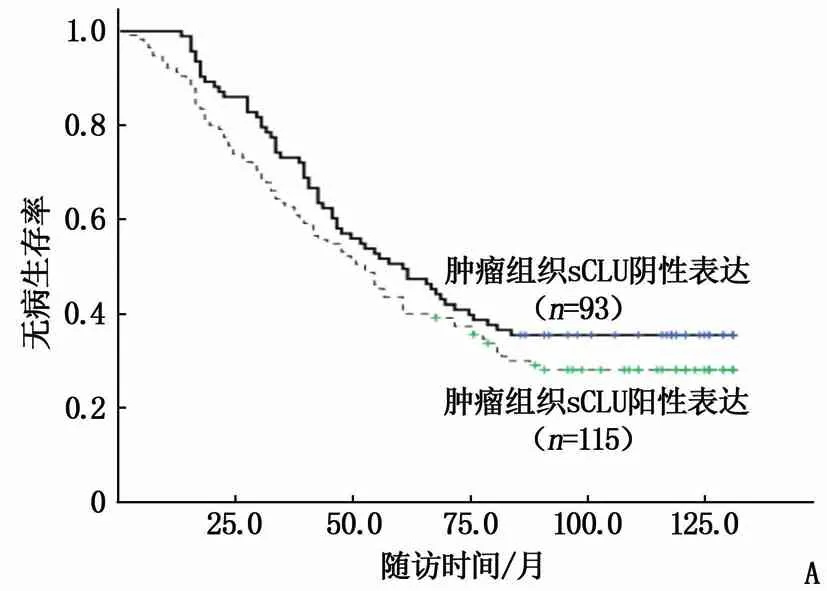

A: 肿瘤组织sCLU蛋白表达; B: 癌旁肝组织sCLU蛋白表达。
2.4 肝组织中sCLU蛋白表达与患者临床病理特征的关系
肿瘤组织及癌旁肝组织中, sCLU蛋白阳性表达者血清sCLU水平均高于阴性表达者,差异有统计学意义(P<0.05)。此外,肿瘤组织sCLU蛋白表达与TNM分期有关(P=0.008), 而癌旁肝组织sCLU蛋白表达与其他临床病理特征无相关性(P>0.05)。见表1。
表1 肝组织sCLU蛋白表达与HCC患者临床病理特征的关系
2.5 影响HCC患者术后复发的临床因素
单因素分析显示,血清AFP>200 ng/mL、血清白蛋白≤4.0 g/dL、多发肿瘤、肿瘤直径>5 cm、微血管浸润、TNM分期Ⅱ~Ⅲ期以及癌旁肝组织中sCLU蛋白阳性表达是影响HCC患者术后复发的独立危险因素(P<0.001)。见表2。

表2 Kaplan-Meier法对术后复发的单因素生存分析[n(%)]
2.6 多因素Cox比例风险模型分析
将重要的协变量从单变量分析进入多因素Cox比例风险模型。结果显示,血清AFP>200 ng/mL、血清白蛋白≤4.0 g/dL、微血管浸润、TNM分期Ⅱ~Ⅲ期以及癌旁肝组织sCLU蛋白阳性表达是HCC患者术后无病生存的独立危险因素(P<0.05)。此外,多发肿瘤、微血管浸润、TNM分期Ⅱ~Ⅲ期以及癌旁肝组织sCLU蛋白阳性表达亦是影响HCC患者术后总生存的独立危险因素(P<0.05)。见表3。
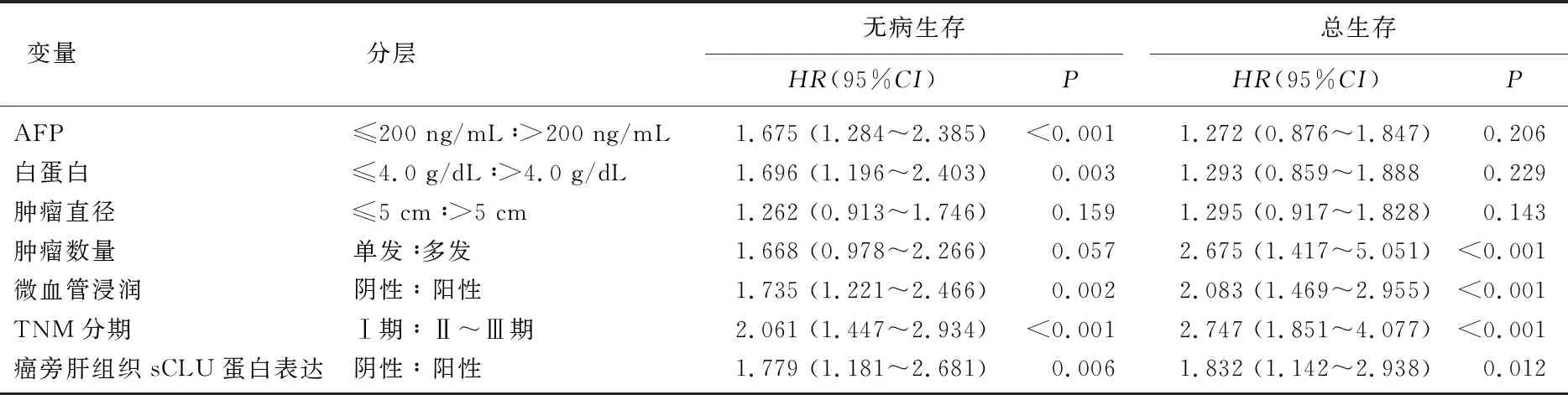
表3 无病生存和总生存相关因素的多因素分析结果
3 讨 论
本研究评估了HCC患者在肿瘤切除前的血清和切除组织(包括肝癌组织以及邻近的癌旁肝组织)中sCLU浓度。本研究结果表明,术前血清sCLU水平、HCC肿瘤组织中sCLU蛋白表达情况与可切除HCC患者术后复发无相关性。有趣的是,本研究发现癌旁肝组织中sCLU蛋白阳性表达者较阴性表达者的预后更差。
研究[5]表明, sCLU与肿瘤集落蛋白的特性和肿瘤癌细胞的化学耐药性相关[9, 12]。sCLU基因是一个单拷贝基因,位于染色体8p21~p12上,由9个外显子、8个内含子和1个5′-非翻译区组成,编码3种不同的人类转录异构体。在人体中,sCLU基因可编码2种蛋白质: sCLU蛋白(75~80 kDa)和nCLU蛋白(55 kDa)[6]。sCLU蛋白的前22个氨基酸代表一个经典的疏水性先导信号序列,这些氨基酸被转化成一个先导多肽,将蛋白质作用于内质网; 22肽通过蛋白水解过程被去除,产生一个50 kDa的前体,然后在内质网中进一步加工成60 kDa的形式。当蛋白质被转运到高尔基复合体时,即被糖基化,进一步分裂成2个40 kDa亚基,α 链和 β 链。然后,这2个亚基组装成异二聚体络合物,由5个二硫键连接。nCLU是由缺乏外显子II剪接的mRNA合成的。第一和第三外显子是拼接在一起的,放置第二帧外显子III的第2个AUG序列作为翻译起始位点。nCLUmRNA的翻译产生了一种约49 kDa 的nCLU前体蛋白,定位于细胞质中,并保持休眠状态。在全身电离辐射或细胞损伤后, nCLU前体蛋白经过翻译后修饰产生1个成熟的约55 kDa促凋亡蛋白形式,其具有N端和C端的卷曲螺旋结构域。研究[7, 14]表明, sCLU具有细胞保护作用和抗凋亡作用[6, 13], 而 nCLU蛋白具有促凋亡作用。
sCLU是一种异二聚硫酸化糖蛋白,牵涉到多种生物学功能,包括脂质转运、衰老、补体级联、膜循环、细胞黏附和细胞程序性死亡等[5, 13]。基于sCLU在抗凋亡、血管生成和促转移方面的作用, sCLU被证实与肝癌的进程有关[15-16]。此外,鉴于其良好的诊断和预后表现, sCLU也被推荐为多种癌症的重要生物标志物[16-20]。AL-MAGHRABI J A等[16]研究发现, CLU在子宫内膜癌组织中表达上调,可作为诊断标志物,但是与疾病复发、生存或任何其他临床病理参数无明显相关性。CHEN Q F等[17]也发现乳腺癌患者血清CLU水平显著高于正常对照组,且与临床分期高、淋巴结转移、总生存率和无病生存率低有显著相关性,提示血清CLU水平可能是诊断和评价乳腺癌化疗敏感性的有效指标。有研究[18]称,通过原位杂交检测, sCLU在大鼠肝细胞中以低基础水平表达,在肝细胞生长和促肝细胞分裂素的诱导下, sCLU表达上调。
既往研究[19-20]报道了使用免疫组织化学染色的人肿瘤组织中sCLU细胞质过表达。本研究结果显示,在癌旁肝组织中有类似的sCLU表达,在HCC组织的肿瘤细胞中有细胞质和额外的微管分泌染色模式。本研究中, 55.29%的HCC组织表达sCLU, 38.94%的癌旁肝组织表达sCLU。本研究对癌旁肝组织中sCLU过表达与各种临床病理参数进行了比较,结果显示癌旁肝组织sCLU蛋白表达与肝功能恶化程度无关,因此其表达增加对HCC患者术后预后的影响可能只是与促癌分子机制有关,并不受肝硬化或纤维化的影响。本研究仍存在一些局限性: 本研究为单中心研究,样本量相对较小; 本研究采用的数据库主要基于HCC和乙肝病毒感染的患者队列,应该考虑对HCC和主要HCV感染人群或有酗酒史的人群进行分层研究。
综上所述,癌旁肝组织中的sCLU表达是与HCC患者术后无病生存和总生存都密切相关的独立不良预后因素, sCLU在可切除HCC患者癌旁肝组织中表达上调,可作为HCC切除术后预防肿瘤复发的有效靶点。

