Cu(II)联咪唑硝基衍生物配合物的合成表征及其与CT-DNA相互作用研究*
王航天,范倩倩,李 焱,杨莉宁
(西安医学院药学院,陕西 西安 710021)
人类在长期与恶性肿瘤斗争过程中,持续不断地进行高效低毒的抗癌药物的研发。咪唑类生物配体能与生物酶和受体等形成氢键、发生疏水作用和π-π相互作用,且具有抗癌、抗微生物和抗氧化的药用特性,因而被人们广泛关注[1]。作为人体的内源性金属,铜的有机配体配合物能够与DNA相互作用,它们具有较好的生物氧化还原活性和较强的核碱亲和力[2-3]。探究金属配合物与DNA之间的相互作用方式,对识别DNA特异结构、设计和筛选抗癌金属药物,以及研究DNA的水解断裂等都有着重要意义[4-6]。我们设计合成了联咪唑硝基衍生物—N,N’-二甲基-5-硝基-2,2’-联咪唑(NO2Me2biim, L) (图1),并以它为配体,得到了其过渡金属铜(Ⅱ)配合物,采用紫外-可见光谱(Uv-vis)、荧光光谱、相对黏度等分析方法初步研究了配体及其配合物与小牛胸腺DNA(CT-DNA)的相互作用。

图1 —N,N’-二甲基-5-硝基-2,2’-联咪唑结构式
1 材料与方法
1.1 仪器试剂
德国EA 元素分析系统公司VARI-EL型元素分析仪,上海大谱仪器有限公司DDS-307型电导仪,德国 Brucker 公司EQUINOX55 型红外光谱仪,日本岛津公司UV-1800紫外分光光度计,日本日立公司F-4500荧光分光光光度计,上海申玻玻璃仪器厂乌氏黏度计。
小牛胸腺DNA(CT-DNA),三羟甲基氨基甲烷(Tris)均购自美国Sigma公司,Cu(ClO4)2结晶水合物自制,按文献方法合成配体NO2Me2biim[7],其余试剂均为国产分析纯试剂,蒸馏水为二次蒸馏水。
1.2 配合物的合成
称取 0.5 mmol 自制的Cu(ClO4)2结晶水合物溶于甲醇中,加入 15 mL 0.5 mmol 配体NO2Me2biim的甲醇溶液,室温下搅拌反应 1 h,过滤,滤液静置 14 d,析出绿色球状晶体。
1.3 配体及配合物与CT-DNA相互作用实验
配体及配合物与CT-DNA相互作用的紫外光谱、荧光光谱及黏度法实验均采用文献已报道的经典方法进行[8]。
2 结果与讨论
2.1 配合物的组成与结构表征
配合物的化学式、元素分析及摩尔电导率(Λm)列于表1。

表1 配合物的元素分析及摩尔电导率
室温条件下,配合物乙醇溶液的摩尔电导率值表明配合物在乙醇中是非电解质[9],即铜离子与配体和高氯酸根离子配位形成中性配合物。


表2 配体及配合物的主要红外吸收频率(cm-1)及归属
由图2紫外-可见吸收光谱可见,配体中咪唑环共轭体系的π→π*跃迁使其在 240 nm 和 336 nm 处表现出两个主要吸收峰。配体与金属离子发生配位形成配合物后,相应的紫外吸收峰的强度发生了明显变化。

图2 配体和配合物的紫外吸收光谱
综合上述IR、摩尔电导率、UV-Vis和元素分析结果,推测配合物组成为[Cu(NO2Me2biim)2(ClO4)2],高氯酸根和配体都与金属进行单齿配位形成四配位的铜配合物[12],结构如图3所示。

图3 [Cu(NO2Me2biim)2(ClO4)2]结构式
2.2 配体及Cu(Ⅱ)配合物与DNA相互作用紫外吸收光谱
图4表明,当配体和配合物溶液的浓度一定时,二者的最大紫外特征吸收峰随着CT-DNA加入量的增加均表现为减色效应,而Cu(Ⅱ)配合物在 240 nm 附近的吸收峰却又表现为增色效应,与配体不同的是位移和强度都发生了一定的变化。此现象发生的原因可能是当配合物与DNA相互作用时,破坏了配合物聚集体及配合物分子之间的氢键[13-14],同时配合物的紫外吸收还出现1个等吸收点,等吸收点的产生代表了配合物与DNA形成了复合物[15]。吸收减弱及出现等吸收点是静电作用或嵌插作用的特征。

图4 配体L及Cu(Ⅱ)配合物与DNA作用的紫外吸收光谱
2.3 配体及Cu(Ⅱ)配合物与DNA相互作用的荧光光谱
配体的荧光强度随着DNA浓度的增大而减小,荧光发射峰发生了较大的红移,而Cu(Ⅱ)配合物的荧光光谱强度则增大,如图5所示。研究表明,当小分子与DNA相互作用,其荧光光谱减弱甚至发生猝灭,可能是二者在水溶液中互相碰撞发生能量交换所致。
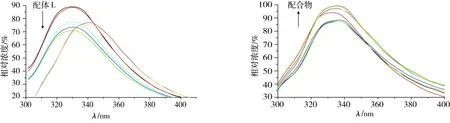
图5 配体L及Cu(Ⅱ)配合物与DNA作用的荧光发射光谱
2.4 配体及其配合物与 DNA 相互作用的黏度
DNA相对黏度随配合物浓度的增加而逐渐减小,随配体浓度的增加而逐渐增大,如图6所示。小分子以插入模式与DNA作用,使DNA双螺旋链增长,黏度增大;以部分插入方式与DNA作用,DNA双螺旋发生扭曲,黏度减小[16]。
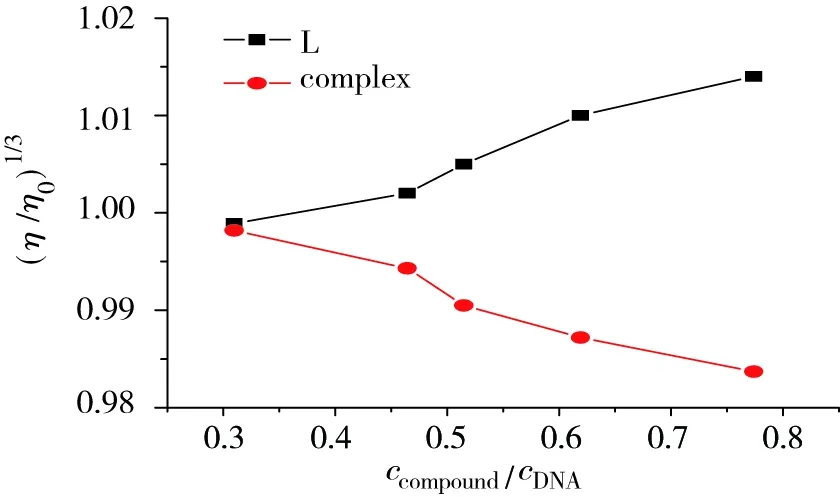
图6 DNA的相对黏度随配体及Cu(Ⅱ)配合物加入量的变化
3 结论
合成了N,N’-二甲基-5-硝基-2,2’-联咪唑的铜(Ⅱ)配合物并对其进行了性质表征,确定了配合物的可能结构。与DNA相互作用的研究结果表明,配体及其Cu(Ⅱ)配合物与DNA相互作用模式分别为典型插入和部分插入模式,配体结构的平面性比配合物更好,所以其与DNA的相互作用力较强。

