红景天苷对高氧致新生小鼠支气管肺发育不良的保护作用研究*
王小勤,幸黔鲁,马一翔
(遵义医科大学第二附属医院儿科,贵州 遵义 563000)
随着呼吸机的广泛使用,危重症新生儿救治水平逐年提高,早产儿成活率逐年上升,而支气管肺发育不良(BPD)作为机械通气或高浓度吸氧的主要并发症之一,其发生率亦逐年增高,严重影响新生儿生存质量,造成了严重的社会和经济负担[1-2]。BPD的组织病理学改变主要为炎症、肺泡祖细胞分化受损、肺组织纤维化等因素导致的肺泡发育障碍[2]。目前,针对BPD的分子策略和有效的治疗方法仍然不明确。红景天苷作为藏药红景天的主要有效成分,具有调节氧化、抑制炎症细胞浸润、调节免疫等药理作用[3-4]。本研究通过构建新生小鼠BPD模型,探讨了红景天苷对新生小鼠BPD的保护作用。
1 材料与方法
1.1主要材料 36只24 h内出生的C57BL/6J新生小鼠(体重14~20 g,雌雄不限)购自遵义医科大学动物中心,红景天苷购自西格玛奥德里奇公司,酶联免疫吸附试验(ELISA)检测试剂盒购自北京索莱宝科技有限公司,抗体购自美国CST公司。
1.2方法 将C57BL/6J新生小鼠随机分为常氧组、高氧组、红景天苷组,每组12只。常氧组新生小鼠暴露于室内空气中由母鼠喂养,高氧组、红景天苷组新生小鼠置于自制氧气箱中饲养[5],母鼠与小鼠同箱。氧箱条件:氧浓度维持在60%以上,箱内置钠石灰使CO2水平小于0.5%,温度为25~27 ℃,湿度为50%~70%。每天持续给氧23.5 h,上午定时开舱0.5 h以添加食物、水及更换垫料。14 d后暴露于室内空气中饲养。红景天苷组每天腹腔内注射红景天苷40 mg/kg,常氧组、高氧组腹腔内注射等体积0.9%生理盐水。
经眼球取血1 mL,室温下血液自然凝固20 min后,在4 ℃条件下,1 000×g离心10 min,然后将上清液等量分装并于-20 ℃下保存(24 h内检测可于2~8 ℃下保存)。按ELISA检测试剂盒说明书检测血清白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)水平。使用5%戊巴比妥以70 mg/kg腹腔注射麻醉后处死小鼠,剪开胸腔取出肺组织,左上肺行苏木精-伊红(HE)染色,左下肺叶行免疫印迹法检测。取小鼠右肺组织即刻称重,记为湿质量(W),然后放入60 ℃烤箱,48 h后再次称重3次,取平均值记为干质量(D),以W/D值表示肺组织含水量。取小鼠左上肺于10%福尔马林固定24 h,经脱水、通透、包埋、切片(厚度为5~6 μm)、二甲苯脱水脱蜡、HE染色后封片,倒置显微镜下观察肺组织形态变化。每只小鼠HE染色图片随机选取至少20个高倍视野(400×),采用MATUTE-BELLO等[6]肺损伤评分系统进行肺损伤评分。取小鼠左下肺叶提取总蛋白,采用二喹啉甲酸法检测核转录因子κB(NF-κB)、Smad7蛋白表达水平,按每孔25 μg的上样量等体积行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,经转模和封闭后,放入一抗稀释液(1∶1 000)中于4 ℃孵育过夜,TBST清洗后放于二抗(1∶2 000)中于37 ℃孵育2 h,洗膜,加发光液,置于凝胶成像系统进行曝光,拍照后利用Image J软件对蛋白条带进行分析。

2 结 果
2.1各组HE染色及肺损伤评分比较 HE染色结果显示,经高氧暴露后,新生小鼠出现肺泡发育障碍,表现为肺泡数量相对减少,肺泡间隔厚度增加,肺组织毛细血管形态破坏。各组HE染色结果见图1。高氧组肺损伤评分[(0.310±0.015)分]明显高于常氧组[(0.080±0.016)分]和红景天苷组[(0.200±0.012)分],差异有统计学意义(P<0.05)。
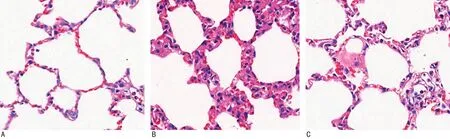
A.常氧组;B.高氧组;C.红景天苷组。
2.2各组肺组织W/D值比较 高氧组肺组织W/D值[(4.550±0.014)]明显高于常氧组[(3.440±0.236)]和红景天苷组[(3.950±0.142)],差异有统计学意义(P<0.05)。
2.3各组血清IL-1β、IL-6、TNF-α水平比较 高氧组血清IL-1β、IL-6、TNF-α水平明显高于常氧组和红景天苷组,差异有统计学意义(P<0.05)。见表1。
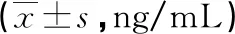
表1 各组血清IL-1β、IL-6、TNF-α水平比较
2.4各组肺组织NF-κB、Smad7蛋白相对表达水平比较 高氧组肺组织NF-κB、Smad7蛋白相对表达水平与常氧组和红景天苷组比较,差异有统计学意义(P<0.05)。见图2、表2。
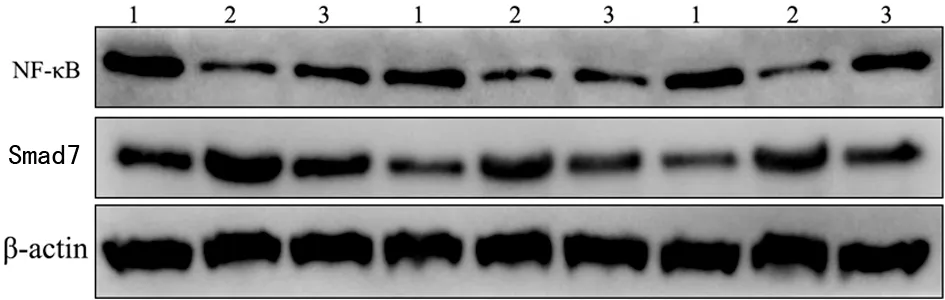
1.常氧组;2.高氧组;3.红景天苷组。
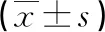
表2 各组肺组织NF-κB、Smad7蛋白相对表达水平比较
3 讨 论
BPD是影响早产儿的最常见并发症,目前尚无治愈方法。虽然,婴儿可以从BPD中恢复,但部分患儿在成年后会发生严重的远期并发症,表现为神经发育障碍、哮喘和肺气肿改变[7-8]。BPD的典型特征是肺泡生长发育异常、肺泡简化、血管发育受损及肺功能异常[9]。红景天苷作为藏药红景天的提取物,具有延缓衰老、抑制炎性反应、抗氧化应激等特性,并具有高效低毒的药理学特点[10]。LAN等[11]研究证实,红景天苷可通过上调沉默信息调节因子1调控NF-κB/高迁移率族蛋白1信号途径,减轻脂多糖诱导的小鼠急性肺损伤。然而,红景天苷对高氧诱导的新生小鼠BPD是否具有保护和治疗效果,仍需进一步研究。
本研究结果显示,高氧组和红景天苷组新生小鼠持续暴露于60%的高浓度氧气14 d后,均出现不同程度肺泡发育异常,表现为肺泡数量相对减少,肺泡间隔厚度增加,肺组织毛细血管形态破坏,且肺损伤评分显著升高。肺泡毛细血管屏障通透性改变的病理生理学标准是肺组织W/D值改变[6]。本研究结果显示,高氧暴露后,小鼠肺组织W/D值明显升高,且IL-1β、IL-6、TNF-α水平升高,而经红景天苷治疗后,小鼠各炎症指标水平明显降低,且肺泡毛细血管屏障通透性好转,肺泡发育受损情况得到明显改善,与文献[12]研究结果一致。提示红景天苷不但具有抗炎作用,同时具有促进肺泡发育、减轻肺损伤的作用。
转化生长因子β1(TGF-β1)/Smads信号通路具有趋化和促进增殖作用,可刺激、诱导各种炎症及纤维化因子表达,促进肺间质转化,造成肺泡发育受损[13]。Smad7作为TGF-β1信号转导途径的负调控因子,其表达的增强可显著抑制上皮间质转化,从而抑制肺纤维化进程[14]。有研究表明,在博来霉素诱导的小鼠肺纤维化模型中,Smad7的上调可显著抑制TGF-β1/Smads信号通路,调控肺泡间质转化[15]。本研究结果显示,高氧暴露后,Smad7蛋白表达明显下调,而经红景天苷治疗后,Smad7蛋白表达明显上调。提示红景天苷可促进Smad7表达,从而抑制TGF-β1/Smad7信号通路,调控肺泡上皮细胞间质转化。
NF-κB信号通路是炎性反应的重要信号通路,在脓毒症、急性呼吸窘迫综合征、溃疡性结肠炎等疾病中起促进作用[16]。NF-κB作为一种极其重要的核转录因子[17],参与多种生物学效应,包括细胞增殖分化、血管再生、炎症、肺泡化等过程。有研究显示,NF-κB具有双向调节作用,炎症介质IL-6、IL-1β、TNF-α可通过激活NF-κB通路,启动细胞免疫应答,而NF-κB的磷酸化可显著促进IL-6、IL-1β、TNF-α等炎症因子表达,从而加重炎性反应[18]。本研究结果显示,高氧组血清IL-6、IL-1β、TNF-α水平与肺组织NF-κB相对表达水平显著高于常氧组,提示高氧介导的BPD增强了NF-κB的磷酸化,促进了炎性反应的加重。而经红景天苷治疗后,小鼠血清IL-6、IL-8、TNF-α水平和肺组织NF-κB相对表达水平明显降低,提示红景天苷可能通过抑制NF-κB信号通路介导的炎性反应,发挥修复BPD新生小鼠肺损伤的作用。
综上所述,红景天苷可能通过调控NF-κB及TGF-β1/Smad7信号通路抑制炎性反应及肺泡上皮细胞间质转化,从而对新生小鼠BPD发挥保护作用。本研究不足之处:未抑制或沉默NF-κB和TGF-β1信号通路,以进一步研究红景天苷对新生小鼠BPD保护作用的分子机制。
——题《圣山系-金巅》

