吡喃酮对黑土微生物群落结构的影响
司马鑫琪,钟佳辉,张延慧,谭怡颖,王 江,杨雪芳,孙大生
(1.山西农业大学 资源环境学院,山西 太谷 030801;2.中国科学院大学 现代农业科学学院,北京 100049;3.南京林业大学 林学院,江苏 南京 210037;4.山西农业大学 农学院,山西 太谷 030801)
杂草是作物减产的主要生物因素。据统计,世界范围内杂草能够造成作物平均减产34%,每年我国由于杂草所损失的作物产量在10%以上[1]。20世纪40年代,2,4-二氯苯氧乙酸(2,4-D)的引入彻底改变了农业,开启了化学除草的时代。化学除草剂目前仍是控制杂草最直接有效的方式,但除草剂使用不合理不仅不能控制田间杂草,更有可能产生药害[2],而且化学除草剂的使用会带来环境安全等问题,甚至还会引起环境污染,危害人畜健康[3-4]。因此,安全有效防控农田杂草变得日益迫切。
目前,越来越多的研究集中于杂草的综合防治,利用植物化感作用开发除草剂来防除杂草就是其中一个理念[5]。研究发现,麦黄酮的一类衍生物吡喃酮具有高效的除草活性,可选择性地杀灭田间杂草而不伤害农作物[6],其除草机理与内吸性除草剂2,4-D相似。吡喃酮可引起杂草激素代谢紊乱,同时,其施入土壤后释放缓慢,药效比2,4-D持久[6]。土壤微生物在陆地生态系统中具有重要作用,负责调节土壤养分的生物地球化学循环,促进植物生长,维持生态系统的稳定[7]。土壤中微生物群落对环境因素变化十分敏感,因此,土壤微生物群落多样性及群落结构的研究是揭示土壤质量状况的基础[8-9]。故一般通过不同剂量农药对土壤中微生物群落结构和多样性等方面的研究来确定除草剂对土壤微生物的影响,为评价除草剂对土壤环境的生态风险提供了指导。
吡喃酮虽然作为化感物质衍生物,能够抑制杂草生长并对作物安全[10],然而,目前对于吡喃酮对土壤微生物影响程度尚不清楚,在投入生产使用前,评价其对土壤微生物群落结构的影响是安全使用的重要前提。
东北黑土区是我国重要的商品粮基地,在国家粮食安全战略中发挥着重大的作用。新型除草剂吡喃酮的使用有望进一步提高东北黑土区的粮食产量,但目前对于吡喃酮的广泛使用是否存在威胁微生物群落安全的风险还有待进一步研究。因此,本研究选用我国北方典型黑土作为研究对象,通过室内模拟试验,采用高通量测序技术分析吡喃酮对黑土微生物群落结构的影响,以期为吡喃酮的安全使用以及黑土区农田生态系统安全提供一定理论依据。
1 材料和方法
1.1 试验材料
供试药剂为化感物质衍生物3-[2-(2-氯-4-氟苯氧基)乙酰基]-4-羟基-6-甲基-2-氢-吡喃-2-酮(简称吡喃酮),以麦黄酮为前体自行合成。
供试土壤类型为黑土,采自黑龙江省哈尔滨市延寿县玉合乡河心村(N45.39°,E128.38°)。供试土壤化学性质为pH值6.64,有机质37.31 g/kg,碱解氮114.44 mg/kg,有效磷45.98 mg/kg,速效钾135.66 mg/kg,全 氮3.38 g/kg,全 磷0.8174 g/kg,全钾26.49 g/kg。
1.2 试验设计
试验在山西农业大学资源环境学院矿区复垦与微生物多样性研究室进行。称取3份900 g过2 mm筛的风干土,调节含水量至40%WHC(土壤持水量),25℃预培养7 d。用丙酮作为溶剂配制0.25 mg/mL和2.5 mg/mL的吡喃酮溶液,将1 mL上述溶液和丙酮溶剂分别加到100 g过0.154 mm筛的细土中,迅速混匀,待丙酮挥发后,将细土与预培养土样按质量比1∶10均匀混合,最后用蒸馏水调节含水量至50%WHC,从而得到吡喃酮添加量分别为0(CK)、0.25 mg/kg(低质量分数)、2.5 mg/kg(高质量分数)的土样,其中,0.25 mg/kg为推荐剂量,2.5 mg/kg用以评估土壤受到不可控的吡喃酮污染时土壤微生物的响应。将土样于25℃避光培养,并于第7、60天时取样测定,7 d模拟短期药剂施用效果,60 d模拟长期药剂施用效果,每个处理重复3次。
1.3 测定项目及方法
1.3.1 DNA提取 将3个处理的新鲜土样经过冷冻干燥后,称取0.5 g,使用FaStDNA SpinKit for soil(MP Biomdecals,LLC)试 剂 盒 提 取 土 壤DNA。
1.3.2 测序分析 提取的总DNA浓度和质量用分光光度计测定(Nano Drop2000,Thermo Scientific,Wilmington,DE,USA)。16S rRNA扩增引物对为:V 3+V 4区域(428 bp)引物(上游引物为5'-CCTAC GGGNGGCWGCAG-3',下游引物为5'-GACTAC HVGGGTATCTAATCC-3')和 真 菌ITS1区 域(187-298)引物(上游引物为5'-CTTGGTCATTT AGAGGAAGTAA-3',下游引物为5'-GCTGCGT TCTTCATCGATGC-3')。运用FLASH软件对原始DNA片段进行读取整合,进一步用USEARCH v5.2.32软件对序列进行过滤除噪,并且将非相似程度小于3%的序列进行聚类,形成可操作分类单元(OTU)。委托诺和致源生物科技股份有限公司就土壤微生物多样性测定与分析等项目进行专项技术服务。
1.4 数据分析
利用Microsoft Excel 2010对多样性指数和相对丰度数据进行处理,利用SPSS 19.0软件对各处理间的指标差异显著性进行分析。利用Origin 2021软件绘制主要优势细菌和真菌在门和属水平的相对丰度。基于OTU水平计算微生物的丰富度指数(Shannon指数)和多样性指数(Chao1指数),计算公式如下:
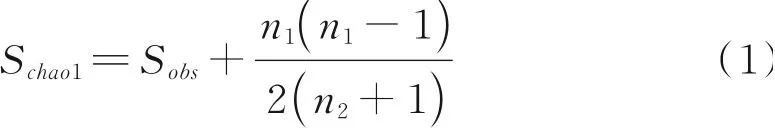
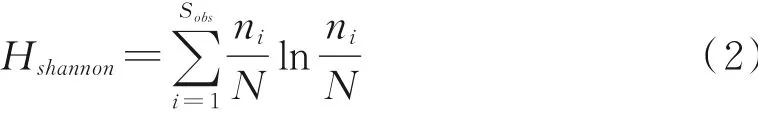
式中,Sobs表示实际观测到的OTU数;n1表示只有1条序列的OTU数目,n2表示只有2条序列的OTU数目;ni表示第i个OTU所含的序列数;N表示所有序列数。
2 结果与分析
2.1 样品中所含OTU数目分析
97%序列相似度下对3个处理的黑土细菌和真菌OTU进行归并和划分,绘制Venn图。图1展示了各处理共有和特有的OTU数,以及OTU的重叠情况。从图1可以看出,培养7 d后,0、0.25、2.50 mg/kg共3个吡喃酮处理下黑土细菌的OTUs总数分别为5 302、5 081、4 936个,特有的OTU的数目分别是808、624、520个,各组样品中共同检测到的OTUs数目为3 479个。至60 d时,0、0.25、2.50 mg/kg 3个处理下细菌的OTUs总数分别为4 789、4 884、5 384个,特有的OTU数目分别为427、473、846个,各组样品中共同检测到OTUs数目为3 431个。
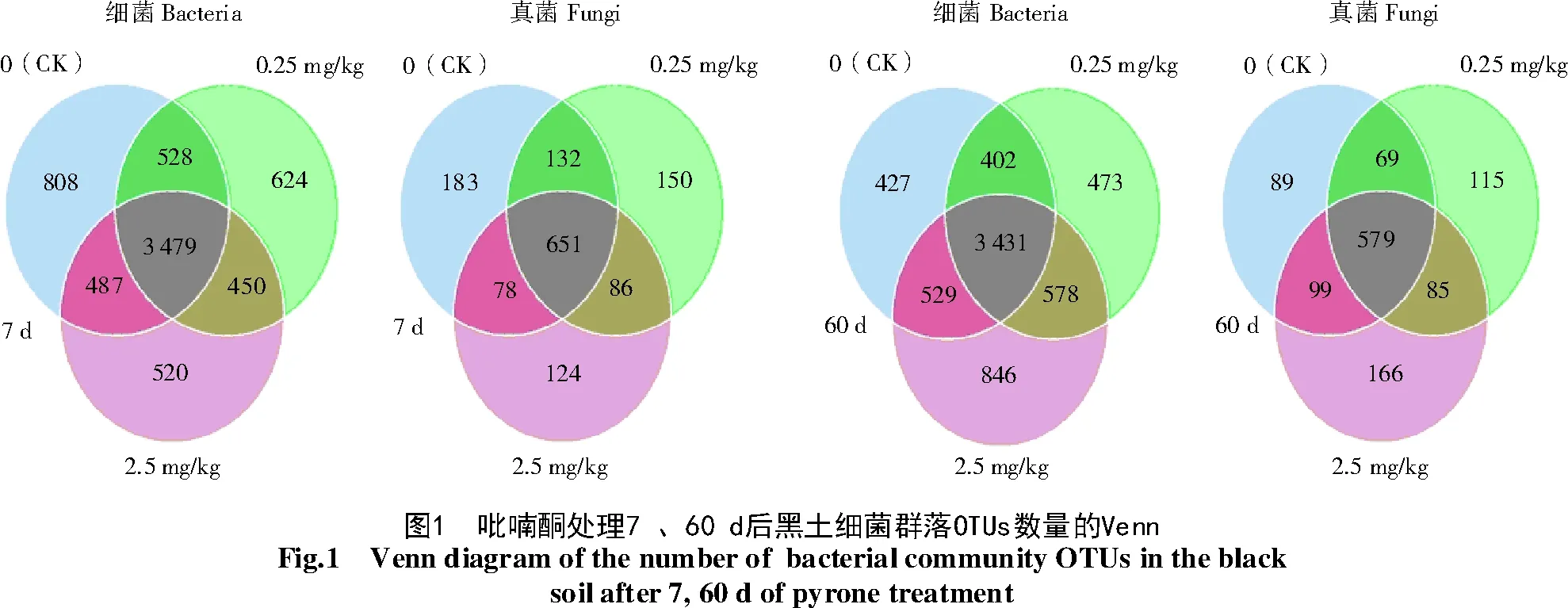
培养7 d后,0、0.25、2.50 mg/kg等3个吡喃酮处理下黑土真菌的OTUs总数分别为1 044、1 019、939个,特有的OTU的数目分别是183、150、124个,各组样品中共同检测到OTUs数目为651个。至60 d时,0、0.25、2.50 mg/kg等3个处理下黑土真菌的OTUs总数分别为836、848、929个,特有的OTU的数目分别是89、115、166个,各组样品中共同检测到OTUs数目为579个。
2.2 不同质量分数吡喃酮处理对黑土细菌和真菌群落多样性的影响
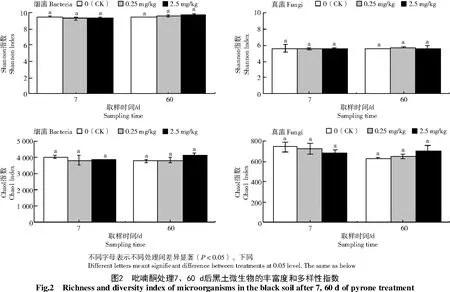
从图2可以看出,吡喃酮处理7 d后细菌群落Shannon指数和Chao1指数分别为9.29~9.34和3 842~3 891,真菌群落Shannon和Chao1指数分别为5.58~5.63和729~682;60 d后,细菌群落Shannon和Chao1指数分别为9.64~9.69和3 841~4 143,真菌群落Shannon和Chao1指数分别为5.51~5.74和654~702。与CK相比,0.25、2.50 mg/kg吡喃酮处理 对细菌、真菌群落Shannon和Chao1指数无显著影响。
2.3 不同质量分数吡喃酮处理对黑土细菌和真菌群落组成的影响
2.3.1 不同质量分数吡喃酮处理对黑土细菌门水平相对丰度的影响 由图3可知,黑土相对丰度>10%的优势细菌门有变形菌门(Proteobacteria,Pro)、芽单胞菌门(Gemmatimonadetes,Gem)、放线菌门(Actinobacteria,Act)和酸杆菌门(Acidobacteria,Aci),其余相对丰度高于1%的细菌门还有绿弯菌门(Chloroflexi,Chl)、厚壁菌门(Firmicutes,Fir)、拟杆菌门(Bacteroidetes,Bac)、疣微菌门(Verrucomicrobia,Ver)、浮霉菌门(Planctomycetes,Pla)、奇古菌门(Thaumarchaeota,Tha)。培养7 d与对照 相比,2.5 mg/kg高质量分数吡喃酮处理显著提升了绿弯菌门的相对丰度,增幅为30.3%,但对其他优势菌门无显著影响;至60 d时,高质量分数吡喃酮处理的绿弯菌门相对丰度与对照相比无显著差异。培养过程中,低质量分数吡喃酮对细菌门相对丰度无显著影响。
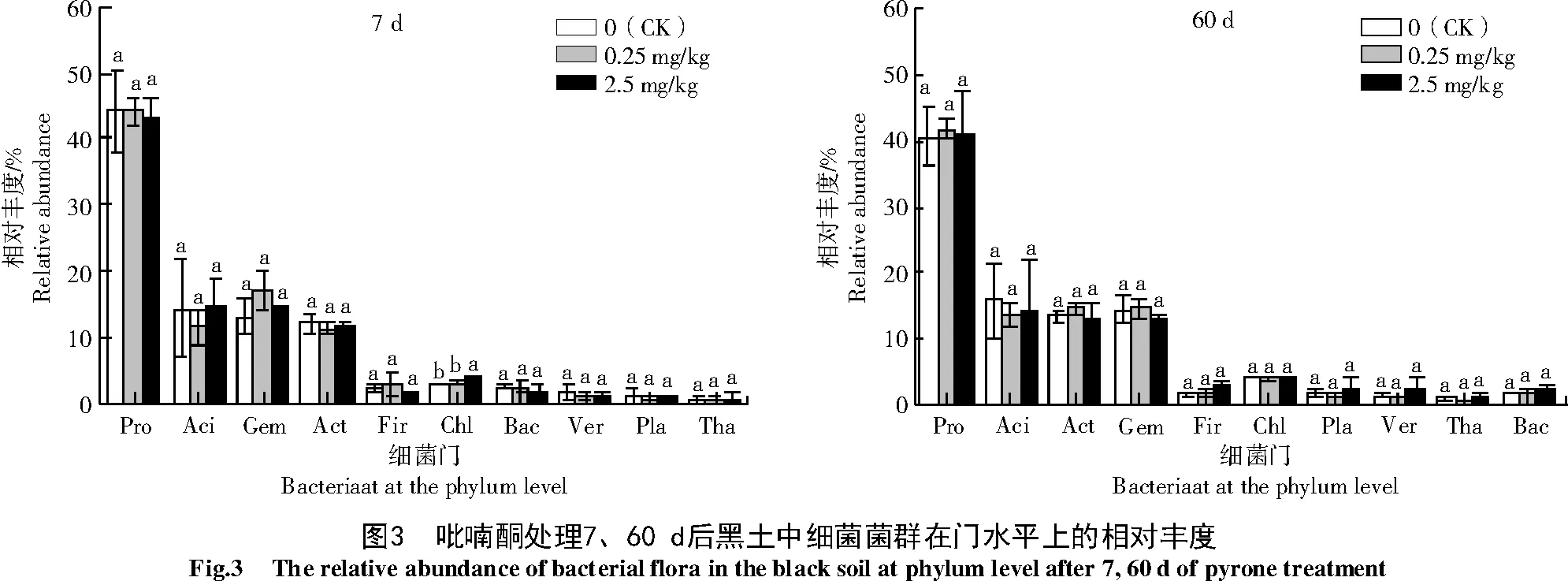
2.3.2 不同质量分数吡喃酮处理对黑土细菌属水平相对丰度的影响 由图4可知,供试土壤前11个优势细菌属为鞘氨醇单胞菌(Sphingomonas,Sph)、芽孢杆菌属(Gemmatimonas,Gem)、假单胞菌属(Pseudomonas,Pse)、不明γ菌(unidentified_Gammaproteobacteria,u_Gam)、不明酸杆菌(unidentified_Acidobacteriau,u_Aci)、不动杆菌属(Acinetobacter,Aci)、Haliangium(Hal)、Gemmatirosa(Gem)、尿杆念珠菌属(Candidatus_Udaeobacter,c_Uda)、溶杆菌属(Lysobacte,Lys)、氮水单胞菌属(Azohy-dromonas,Azo)。处 理7、60d后,芽 孢 杆 菌 属(Gemmatimonas)的相对丰度均要比Gemmatirosa相对丰度高。与CK相比,处理7 d时2.5 mg/kg吡喃酮处理显著提高了鞘氨醇单胞菌属的相对丰度,增幅35.5%;处理60 d后,2个处理的鞘氨醇单胞菌属相对丰度无显著差异。低质量分数吡喃酮对其他优势菌属无显著影响。高质量分数吡喃酮处理60 d时,与CK相比显著降低优势菌属鞘氨醇单胞菌属和Haliangium的相对丰度,降幅分别为12.6%和37.0%。
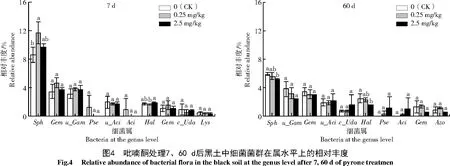
2.3.3 不同质量分数吡喃酮处理对黑土真菌门水平相对丰度的影响 由图5可知,供试土壤的前4个优势真菌门为子囊菌门(Ascomycota,Asc)、被孢霉门(Mortierellomycota,Mor)、担子菌门(Basidiomycota,Bas)和壶菌门(Chytridiomycota,Chy),其中,子囊菌门是最大的优势真菌门。与对照相比,低质量分数和高质量分数吡喃酮处理7 d显著降低了子囊菌门的相对丰度,降幅分别为20.8%和25.9%,但处理60 d后,低质量分数和高质量分数吡喃酮处理的子囊菌门相对丰度与对照相比无显著差异。吡喃酮处理对其他优势菌门均无显著影响。
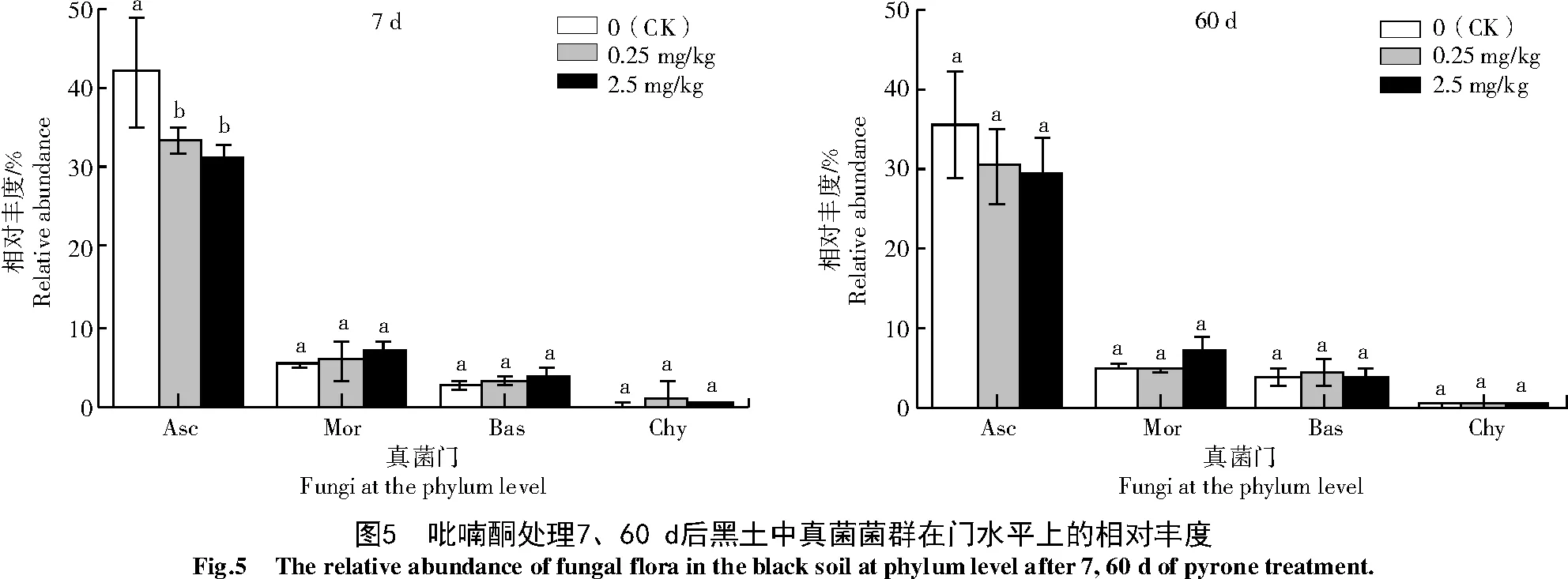
2.3.4 不同质量分数吡喃酮处理对黑土真菌属水平相对丰度的影响 由图6可知,供试土壤的优势真菌属分别为镰刀菌属(Fusarium,Fus)、黄色篮状菌 属(Talaromyces,Tal)、腐 质 霉 属(Humicola,Hum)、曲 霉 属(Aspergillus,Asp)、葡 萄 穗 霉 属(Stachybotrys,Sta)、假雨盘菌属(Pseudombrophila,Pse)、毛壳菌属(Chaetomium,Cha)、Minimedusa(Min)、Solicoccozyma(Sol)和Sagenomella(Sag)。与对照相比,低质量分数处理7、60 d显著提高了葡萄穗霉属的相对丰度,增幅为34.7%。低质量分数处理60 d显著提高了供试黑土的镰刀菌属相对丰度(41.1%),显著降低了篮状菌属的相对丰度(72.0%)。高质量分数处理60 d显著提高了镰刀菌属和葡萄穗霉属的相对丰度,增幅分别为51.9%和60.1%,但对其他优势真菌属无显著影响。
3 讨论
3.1 吡喃酮对细菌群落结构的影响
细菌多样性和丰富度是评价除草剂对土壤细菌群落结构影响的重要指标。许艳蕊等[11]研究发现,除草剂使它隆处理玉米土壤10 d后降低了细菌群落多样性和丰度,而处理60 d后细菌群落的多样性和丰度提高。姚斌等[12]研究发现,除草剂阿特拉津处理7 d细菌群落多样性显著低于对照,而处理60 d后,多样性有所恢复。2,4-D对细菌群落的影响与药剂浓度有较高的相关性,在100倍田间浓度下,细菌生长明显受到抑制,至培养结束仍显著低于对照水平[13]。吡喃酮与2,4-D具有相似的杀草原理,本研究表明,低质量分数和高质量分数吡喃酮对供试土壤细菌群落的Chao1和Shannon指数无显著影响,表明正常喷施甚至高质量分数吡喃酮污染等极端情况对供试黑土的细菌多样性也不会造成危害。
大量研究表明,除草剂施入土壤后会引起土壤微生物组成的变化,且对不同菌群的影响程度不一。杜慧玲等[14]研究表明,不同浓度的2,4-D处理对细菌生长呈极显著的抑制效应,随浓度提高,抑制效果增强。许艳蕊等[11]研究发现,除草剂使它隆会导致细菌群落组成发生明显变化,使它隆处理10 d后酸杆菌门相对丰度提高了30.8%,放线菌门和绿弯菌门相对丰度分别降低了24.4%和25.6%;使它隆处理60 d后变形菌门和绿弯菌门相对丰度仍低于对照水平。有研究表明,变形菌门细菌可以参与土壤氮磷循环,从而起到改善土壤环境的作用[15]。本研究表明,在细菌门水平上,高质量分数处理7 d后显著提升了绿弯菌门的相对丰度,增幅为30.3%,但处理60 d后恢复至对照水平。研究发现,绿弯菌门与群落中的其他微生物存在密切的互作[16-17],可以吸收同化环境中生物和非生物来源的多种有机酸物质,参与有机卤化物降解[18],对维持生态环境动态平衡有着积极作用。吴静等[19]进一步从属水平上分析发现,草甘膦对土样中细菌群落属水平上的组成影响显著,草甘膦处理6 d后Acidobacteriales norank相对丰度提高了87.4%,未培养型黄单胞菌属Xanththobacteraceae uncultured相对丰度降低41.5%;草甘膦处理12 d后Subgroup6 norank相对丰度降低了48.1%,未培养型芽单胞菌属相对丰度提高了91.2%。本试验结果发现,吡喃酮对细菌属水平组成有一定影响,但与吴静[19]等的研究结果不同,低质量分数吡喃酮处理7 d显著提高了鞘氨醇单胞菌属的相对丰度,增幅为35.5%,到60 d时恢复至对照水平;高质量分数吡喃酮处理7 d时,优势菌属与对照相比无显著差异,处理60 d显著降低了鞘氨醇单胞菌属和Haliangium的相对丰度,降幅分别为12.6%和37.0%。有研究发现,鞘氨醇单胞菌属对土壤污染有修复作用[20],低浓度吡喃酮加入土样可能对鞘氨醇单胞菌属起激活作用而提高其相对丰度,随时间的延长,吡喃酮逐渐降解,鞘氨醇单胞菌属的相对丰度也就逐渐下降;低浓度吡喃酮加入土样刺激其他微生物,使之其相对丰度提高,微生物之间竞争作用导致Haliangium相对丰度降低[21]。本研究的高低2个水平吡喃酮处理对细菌群落并没有表现出明显的抑制效果。
3.2 吡喃酮对真菌群落结构的影响
除草剂对真菌群落结构的影响是评价除草剂安全性的一个重要方面。张雯雯等[22]研究发现,低浓度苄嘧磺隆处理对土壤真菌群落多样性有促进作用,处理14 d后促进作用消失,处理28 d后多样性显著降低;高浓度苄嘧磺隆处理(除第1 d)使土壤真菌群落多样性持续显著降低。陶波等[23]研究发现,低浓度草甘膦处理对真菌群落的影响不显著;高浓度草甘膦处理对真菌群落则有明显的抑制作用,随时间的延长种群数量有一定恢复。邓晓等[24]研究发现,0.05~5 mg/kg的百草枯处理2 d时抑制率达14.5%~82.4%,30 d内严重抑制真菌种群。上述研究表明,主流商品除草剂均会一定程度上影响土壤真菌群落。相反本试验发现,低质量分数和高质量分数吡喃酮处理对黑土真菌群落的多样性和丰富度的影响均不显著,因而表现出更强的安全性。
吴静等[19]研究发现,草甘膦对真菌群落组成的影响与处理时间密切相关,推荐剂量的草甘膦处理6 d后子囊菌门相对丰度下降了14.6%,担子菌门相对丰度提高了39.8%;处理12 d后毛霉菌相对丰度持续增加,Uncalsstidied相对丰度持续减少。陶波等[23]研究发现,草甘膦对真菌群落组成的影响与药剂浓度具有较高相关性,低浓度草甘膦处理会抑制真菌群落,但真菌群落对低浓度的草甘膦处理具有较快的适应性,而高浓度草甘膦处理下真菌群落就不能恢复。杜慧玲等[13]研究发现,高质量浓度(50 mg/kg)2,4-D处理3 d对真菌群落表现为激活效应,激活率可达33.9%~109.1%,处理7~60 d则表现为抑制作用,60 d后真菌数量仅为对照的55.4%;低质量分数(10 mg/kg)2,4-D处理对真菌群落也表现为抑制作用,随时间的延长,抑制效果减弱。本试验研究发现,高低2个水平吡喃酮处理后都会导致子囊菌门相对丰度显著下降,但在60 d后这种抑制效果消失。陶波等[23]研究发现,从属水平上,在10、20 mg/kg的低质量分数草甘膦会激活土壤中的镰刀菌属,50~500 mg/kg的高质量分数处理下则表现为明显的抑制作用。ZOBIOLE等[25]研究也发现,草甘膦会导致镰刀菌属的增殖。本试验也发现,2个处理60 d显著提高了供试黑土的镰刀菌属相对丰度,且显著降低了篮状菌属的相对丰度,低质量分数处理7、60 d及高质量分数处理60 d均显著提高了葡萄穗霉属的相对丰度。这可能是由于吡喃酮对镰刀菌属和葡萄穗霉菌属有激活作用,可被其作为代谢底物。因此,长期(60 d)来看,按推荐浓度正常施用吡喃酮具有较高的安全性。
4 结论
本研究表明,吡喃酮对黑土微生物丰富度和多样性无显著影响,吡喃酮对黑土大部分优势菌门、菌属均无显著影响。培养7 d后,低质量分数吡喃酮处理显著降低了真菌子囊菌门的相对丰度;高质量分数吡喃酮处理显著提高了细菌绿弯菌门相对丰度,显著降低了真菌子囊菌门的相对丰度,培养60 d后恢复至对照水平。至培养结束,低质量分数吡喃酮对真菌葡萄穗霉属、镰刀菌属表现为刺激作用。高质量分数吡喃酮对细菌鞘氨醇单胞菌属、细菌Haliangiu和真菌篮状菌属表现抑制作用。总体而言,低质量分数吡喃酮虽会短时间内改变部分菌群的相对丰度,但随着培养时间延长其作用消失,表明吡喃酮对黑土微生物群落结构具有较高的安全性。

