癫痫清颗粒改善AD模型小鼠血脑屏障损伤的作用研究
齐越 李昭 侯侠 黄培池 贾冬 杨彩瑜 董笑博 房小楠 明彩荣




中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2022)09-1062-06
DOI 10.6039/j.issn.1001-0408.2022.09.07
摘 要 目的 研究癫痫清颗粒通过调控核苷酸结合域样受体蛋白3(NLRP3)炎症小体信号通路对阿尔茨海默病(AD)模型小鼠血脑屏障(BBB)损伤的改善作用。方法 将125只小鼠按体质量随机分为假手术组(n=25)和造模组(n=100)。造模组小鼠采用侧脑室注射β-淀粉样蛋白25~35的方法复制AD模型;假手术组小鼠同法注射生理盐水。选取造模成功的100只小鼠,按体质量随机分为模型组、盐酸多奈哌齐片组(阳性对照1,1.3 mg/kg,灌胃给药)、MCC950组[阳性对照2(选择性NLRP3抑制剂),10 mg/kg,腹腔注射给药]和癫痫清颗粒组(以生药总量计12.48 g/kg,灌胃给药),每组25只。造模后第2天,各给药组小鼠给予相应药物,每天1次,连续21 d;假手术组和模型组小鼠灌胃水并腹腔注射生理盐水。末次给药后,采用Y迷宫实验检测小鼠的学习记忆能力,采用伊文思蓝渗漏实验测定小鼠BBB通透性;检测小鼠脑组织中NLRP3、离子钙接头蛋白(IBA-1)、核转录因子κB(NF-κB)p65、p53上调凋亡调控因子(PUMA)、咬合蛋白(ocln)、闭锁小带蛋白1(ZO-1)、紧密连接蛋白5(cldn5)的表达水平。结果 与模型组比较,各给药组小鼠的自发交替反应率和脑组织中ocln、cldn5、ZO-1蛋白表达水平均显著升高(P<0.05或P<0.01),脑组织内的伊文思蓝含量及NLRP3、IBA-1、PUMA、NF-κB p65蛋白表达水平均显著降低(P<0.05或P<0.01)。结论 癫痫清颗粒可通过抑制NLRP3炎症小体信号通路起到改善AD模型小鼠BBB损伤的作用。
关键词 癫痫清颗粒;阿尔茨海默病;血脑屏障;核苷酸结合域样受体蛋白 3炎症小体;紧密连接蛋白
Improvement effects of Dianxianqing granule on blood-brain barrier injury in Alzheimer’s disease model mice
QI Yue1,LI Zhao2,HOU Xia1,HUANG Peichi1,JIA Dong3,YANG Caiyu3,DONG Xiaobo3,FANG Xiaonan2,MING Cairong3(1. Dept. of Pharmaceutical Technology, Jiangsu Provincial Xuzhou Pharmaceutical Vocational College, Jiangsu Xuzhou 221116, China; 2. Dept. of Pharmacology, College of Pharmacy, Shenyang Medical College, Shenyang 110031, China; 3. Dept. of Pharmacology, the Second Affiliated Hospital of Liaoning University of TCM, Shenyang 110034, China)
ABSTRACT OBJECTIVE To study the improvement effects of Dianxianqing granule on blood-brain barrier (BBB) injury in Alzheimer’s disease (AD) model mice by regulating NLR family pyrin domain containing 3 (NLRP3) inflammasome signaling pathway. METHODS Totally 125 mice were randomly divided into sham operation group (n=25) and modeling group (n=100) by body weight. AD model was induced by intracerebroventricular injection of β-amyloid 25-35 in model group. Sham operation group was given normal saline with same method. The 100 model mice were randomly divided into model group, Donepezil hydrochloride tablets group (positive control 1,1.3 mg/kg,i.g.), MCC950 group [positive control 2 (selective NLRP3 inhibitor),10 mg/kg, i.p.] and Dianxianqing granule group (12.48 g/kg by crude drug, i.g.) by body weight, with 25 mice in each group. Second day after modeling, administration groups were given relevant medicine, once a day, for consecutive 21 d. Sham operation group and model group were given intragastric administration of water and intraperitoneal injection of normal saline. At last administration,the learning and memory ability was determined by Y maze test,and blood-brain barrier permeability was measured by Evans blue leakage assay. The expressions of NLRP3, anti-ionized calcium-binding adapter molecule 1 (IBA-1), nuclear factor kappa B (NF-κB) p65, p53 upregulated modulator of apoptosis (PUMA), occludin (ocln), zonula occluden-1 (ZO-1) and claudin-5 (cldn5) in cerebral tissue were determined. RESULTS Compared with model group, spontaneous alternate response rate, protein expressions of ocln, cldn5 and ZO-1 in cerebral tissue were increased significantly in administration groups (P<0.05 or P<0.01); Evans blue content and protein expressions of NLRP3, IBA-1, PUMA and NF-κB p65 in cerebral tissue were decreased significantly(P<0.05 or P<0.01). CONCLUSIONS Dianxianqing granule can improve BBB injury of AD model mice by inhibiting NLRP3 inflammasome signaling pathway.
KEYWORDS Dianxianqing granule; Alzheimer’s disese; blood-brain barrier; NLRP3 inflammasome; tight junction proteins
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的与年龄相关的神经退行性疾病[1],主要病理特征为淀粉样蛋白沉积、Tau蛋白磷酸化以及神经元死亡等[2]。近年来,越来越多的证据表明,血脑屏障(blood brain barrier,BBB)功能障碍可能是导致AD发生的病理机制之一[3]。BBB由脑微血管内皮细胞、周细胞、细胞外基质和血管周围的小胶质细胞足突组成,对于维持脑稳态和中枢神经系统微环境有重要作用[4]。研究发现,AD患者BBB通透性增加,而炎症反应是促进BBB损伤的关键机制之一[5]。
炎症小体是机体固有免疫系统的重要组成部分,主要存在于小胶质细胞、巨噬细胞和树突状细胞中,其中核苷酸结合域样受体蛋白3(NLR family pyrin domain containing 3,NLRP3)是较为常见的炎症小体,已被认为是潜在的AD炎症标志物之一[6]。当脑中小胶质细胞被激活后,NLRP3炎症小体的表达会增加,继而诱导炎症因子的产生,导致BBB通透性增强[7-8]。核转录因子κB(nuclear factor-kappa B,NF-κB)可通过调节炎症因子的转录,在保持BBB完整性中发挥着重要作用[9]。p53上调凋亡调控因子(p53 upregulated modulator of apoptosis,PUMA)是一种凋亡调控因子,其可通过增加下游NF-κB、NLRP3蛋白的表达,参与脑微血管内皮细胞的凋亡过程,诱导BBB损伤[10]。因此,阻断或抑制NLRP3表达已成为保持BBB完整性的关键[11]。
癫痫清颗粒为专利药(专利号ZL201110069494),由熟地黄、制何首乌、芍药(白芍)、石菖蒲、柴胡、郁金、知母等10味中药组成,主要含芒果苷、芍药苷和α-细辛醚等成分[12-14],具有填精益智、开窍豁痰、活血祛瘀的功效,临床主要用于神情淡漠、寡言少语、反应迟钝、善忘、终日不语、言辞颠倒、忽笑忽哭、不欲食及举动异常等的治疗。笔者前期研究发现,经癫痫清颗粒干预后,AD模型小鼠的学习记忆能力和脑组织病理改变均有明显改善,其具体机制与维持BBB完整性有关[15]。因阻断或抑制NLRP3炎症小体对维持BBB完整性有重要作用,故本课题组推测癫痫清颗粒改善BBB功能障碍的作用可能与抑制NLRP3炎症小体信号通路活化密切相关。鉴于此,本研究在前期研究的基础上,采用癫痫清颗粒干预AD模型小鼠,观察其对BBB损伤的改善作用与抑制NLRP3炎症小体信号通路活化的关联性,旨在进一步探讨癫痫清颗粒改善AD的潜在作用机制。
1 材料
1.1 主要仪器
本研究所用的主要仪器有DW-200型脑立体定位仪(成都泰盟科技有限公司),Neofuge 13R型酶标仪(美国BioTek公司),ImageQuant 350型凝胶成像系统(美国GE Healthcare公司),DMI3000 B型光学显微镜(德国Leica公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有癫痫清颗粒(由辽宁中医药大学附属第二医院提供,批号20180310,每1 g颗粒相当于生药5.31 g),盐酸多奈哌齐片[卫材(中国)药业有限公司,批号140606 A,规格5 mg/片],选择性NLRP3炎症小体抑制剂MCC950(美国Selleck公司,批号S780907,纯度99.4%),β-淀粉样蛋白25~35(β-amyloid 25~35,Aβ25~35,美国Sigma公司,批号038M4822V),兔抗咬合蛋白(occludin,ocln)多克隆抗体、兔抗闭锁小带蛋白1(zonula occluden-1,ZO-1)多克隆抗体、兔抗紧密连接蛋白5(claudin-5,cldn5)多克隆抗体(沈阳万类生物科技有限公司,批号分别为WL01996、WL03419、WL03731),兔抗NF-κB p65多克隆抗体、兔抗β-肌动蛋白(β-actin)多克隆抗体(北京博奥森生物技术有限公司,批号分别为bs-0465R、bs-10966R),兔抗PUMA多克隆抗体(英国Abcam公司,批号ab9643),兔抗NLRP3多克隆抗体(美国Proteintech公司,批号1977-1-1-AP),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号120219200821),辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(北京中杉金桥生物技术有限公司,批号141987),小鼠离子钙接头蛋白1(anti-ionized calcium-binding adapter molecule 1,IBA-1)酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司,批号Ac02061708);其余试剂均为分析纯,水为纯净水。
1.3 动物
本研究所用动物为SPF级ICR雄性小鼠,共125只,体质量为20~24 g,来源于辽宁长生生物技术有限公司,实验动物生产合格证号为SCXY(辽)2020-0001。小鼠在沈阳医学院实验动物中心进行饲养,环境温度控制在20~23 ℃、空气相对湿度控制在50%~60%。本实验得到了沈阳医学院动物伦理委员会的批准(批准号SYYXY2020082702),实验操作符合《中华人民共和国實验动物管理条例》要求。小鼠于实验动物中心适应性饲养7 d后进行实验。
2 方法
2.1 AD小鼠模型制备
小鼠用戊巴比妥钠(50 mg/kg)麻醉后,将其头部固定在脑立体定位仪上,沿正中线切开头部皮肤约2 cm,寻找囟门位置。以囟门为原点,移动微量进样器(将微量进样器向右移动1 mm,再向后移动0.5 mm),然后垂直进入脑组织(深约3 mm),缓慢注射老化的Aβ25~35(用无菌生理盐水稀释Aβ25~35至1 mg/mL,37 ℃孵育7 d老化)3 μL,弥散5 min,缝合消毒[16]。假手术组小鼠同法注射等体积无菌生理盐水。术后第2天,采用Y迷宫实验进行自发交替反应率的测定。若与假手术组相比,造模组小鼠的自发交替反应率明显降低,则视为造模成功[17]。
2.2 分组与给药
将125只小鼠按体质量随机分为假手术组(n=25)和造模组(n=100)。造模组小鼠按“2.1”项下操作复制AD模型;假手术组小鼠在相同部位注射等体积无菌生理盐水,其余步骤与造模组相同。造模组小鼠在手术过程中无死亡,且均造模成功。将造模成功的100只小鼠按体质量随机分为模型组、盐酸多奈哌齐片组(阳性对照1,1.3 mg/kg,灌胃给药)、MCC950组(阳性对照2,10 mg/kg,腹腔注射给药)和癫痫清颗粒组(以生药总量计12.48 g/kg,灌胃给药),每组25只。造模后第2天,各给药组小鼠给予相应药物(灌胃给药体积均为20 mL/kg,腹腔注射体积为10 mL/kg),每日给药1次,连续给药21 d。为避免给药途径对小鼠精神状态的影响,假手术组、模型组小鼠灌胃水20 mL/kg,并腹腔注射生理盐水10 mL/kg。癫痫清颗粒组和盐酸多奈哌齐片组的给药剂量参考文献[18]设置;MCC950组的给药剂量参考文献[19]设置。
2.3 Y迷宫实验
各组小鼠在第21天灌胃/腹腔注射结束后进行Y迷宫实验。实验装置为自制器材,由3个木质支臂组成。实验时,把小鼠放在支臂的交叉点处,记录8 min内小鼠进入支臂的总次数(N)。连续进入3个不同支臂记录为1次正确交替反应,计算自发交替反应率:自发交替反应率=正确交替反应次数/(N-2)×100%。
2.4 伊文思蓝渗漏实验
在Y迷宫实验结束后,各组随机选取7只小鼠尾静脉注射伊文思蓝溶液(4 mL/kg);3 h后,以戊巴比妥钠(50 mg/kg)麻醉小鼠,剪开胸腔,暴露心脏,将输液器针头插入左心室,用生理盐水进行心脏灌流,直至流出液体澄清、透明为止。断头取脑,用滤纸拭去脑组织表面液体,称质量,然后放置于3 mL甲酰胺内,剪碎,45 ℃避光水浴72 h,离心(4 ℃,3 500 r/min)20 min,取上清液。根据文献[15]方法制作标准曲线,并根据标准曲线计算每克小鼠脑组织内伊文思蓝的含量(μg/g)。
2.5 脑组织中NLRP3蛋白表达水平测定
采用免疫组化法进行测定。在Y迷宫实验结束后,每组随机选取6只小鼠,采用戊巴比妥钠(50 mg/kg)麻醉后,以生理盐水进行心脏灌流。将小鼠处死,取出其脑组织,以4%多聚甲醛固定24 h。将组织常规脱蜡、脱水后,制备5 µm厚的石蜡切片,脱蜡至水;以3%过氧化氢灭活内源性过氧化物酶10 min,切片浸入0.01 mol/L枸橼酸盐溶液(pH6.0)中,以高压方式加热至沸腾,然后冷却至室温;以5%胎牛血清封闭,37 ℃孵育30 min;加入NLRP3一抗(稀释比例1 ∶ 100),4 ℃孵育过夜;滴加二抗(稀释比例1 ∶ 3 000),37 ℃孵育30 min;二氨基联苯胺显色后以苏木素复染;脱水,透明,封片,然后在光学显微镜下进行观察(细胞内棕黄色颗粒为NLRP3蛋白阳性表达)。采用JEOA 801D形態学图像分析系统计算各组小鼠脑组织中阳性细胞的平均光密度值,平均光密度值越大表示NLRP3蛋白表达水平越高。
2.6 脑组织中IBA-1蛋白表达水平测定
采用ELISA法进行测定。在Y迷宫实验结束后,将每组剩余的12只小鼠用戊巴比妥钠(50 mg/kg)麻醉,处死后分离其脑组织,置于-80 ℃下冷冻保存。每组随机选取7只小鼠的脑组织,按照1 ∶ 10(mg/mL)的比例加入磷酸盐缓冲液,匀浆,以3 500 r/min离心15 min,取上清液,按照试剂盒说明书方法测定脑组织中IBA-1蛋白表达水平。
2.7 脑组织中PUMA、NF-κB p65、ocln、cldn5、ZO-1蛋白表达水平测定
采用Western blot法进行测定。每组选取“2.6”项下冷冻保存的5只小鼠脑组织,以RIPA裂解液提取组织中总蛋白,以BCA法测定总蛋白浓度。取60 µg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压180 V,电泳时间40 min),电转(转膜电流100 mA,转膜时间2 h)至聚偏二氟乙烯(PVDF)膜上;以含5%TBST缓冲液的脱脂奶粉室温封闭 2 h,加入NF-κB p65一抗(稀释比例1 ∶ 500)、ocln一抗(稀释比例1 ∶ 300)、cldn5一抗(稀释比例1 ∶ 300)、ZO-1一抗(稀释比例1 ∶ 200)和β-actin一抗(稀释比例1 ∶ 1 000),4 ℃孵育过夜;TBST洗膜,加入二抗(稀释比例均为1 ∶ 5 000),室温孵育2 h;加入发光液进行曝光,在凝胶成像系统中成像。以Image J V1.8.0.112 图像分析软件进行灰度值分析,以目标蛋白条带与内参 β-actin条带的灰度值比值表示目标蛋白的表达水平。
2.8 统计学方法
采用SPSS 21.0统计学软件进行数据分析。计量资料以x±s表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 Y迷宫实验结果
各组小鼠进入支臂的总次数差异均无统计学意义(P>0.05),说明盐酸多奈哌齐片、MCC950及癫痫清颗粒不影响小鼠的自发活动。与假手术组比较,模型组小鼠自发交替反应率显著降低(P<0.01);与模型组比较,盐酸多奈哌齐片组、MCC950组和癫痫清颗粒组小鼠的自发交替反应率均显著升高(P<0.05)。各组小鼠Y迷宫实验结果见表1。
3.2 伊文思蓝渗漏实验结果
与假手术组比较,模型组小鼠脑组织内的伊文思蓝含量显著增加(P<0.01)。与模型组比较,盐酸多奈哌齐片组、MCC950组和癫痫清颗粒组小鼠脑组织内的伊文思蓝含量均显著减少(P<0.01)。各组小鼠脑组织内的伊文思蓝含量测定结果见表2。
3.3 小鼠脑组织中NLRP3蛋白表达水平测定结果
与假手术组比较,模型组小鼠脑组织中NLRP3蛋白表达水平显著升高(P<0.01)。与模型组比较,盐酸多奈哌齐片组、MCC950组和癫痫清颗粒组小鼠脑组织中NLRP3蛋白表达水平均显著降低(P<0.05或P<0.01)。各组小鼠脑组织中NLRP3蛋白表达测定结果见图1、表2。
3.4 小鼠脑组织中IBA-1蛋白表达水平测定结果
与假手术组比较,模型组小鼠脑组织中IBA-1蛋白表达水平显著升高(P<0.01)。与模型组比较,盐酸多奈哌齐片组、MCC950组和癫痫清颗粒组小鼠脑组织中IBA-1蛋白表达水平均显著降低(P<0.05或P<0.01)。各组小鼠脑组织中IBA-1蛋白表达水平测定结果见表2。
3.5 小鼠脑组织中PUMA、NF-κB p65、ocln、cldn5、ZO-1蛋白表达水平测定结果
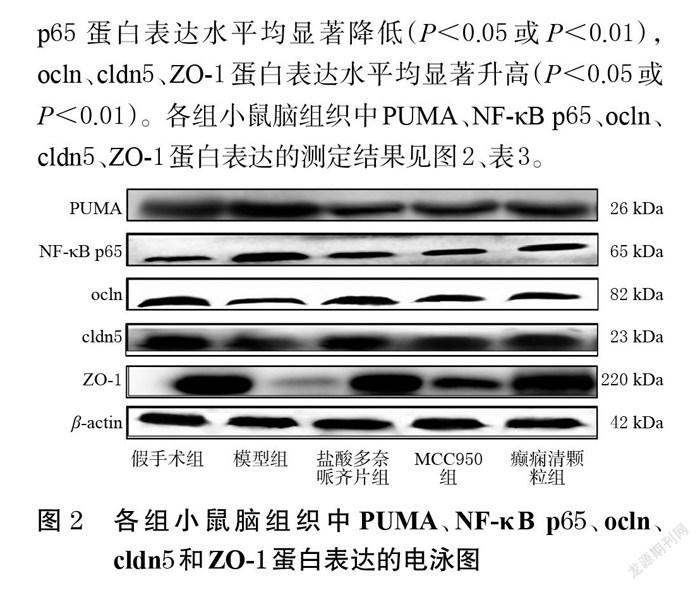
与假手术组比较,模型组小鼠脑组织中PUMA、NF-κB p65蛋白表达水平均显著升高(P<0.05或P<0.01),ocln、cldn5、ZO-1蛋白表达水平均显著降低(P<0.05或P<0.01)。与模型组比较,盐酸多奈哌齐片组、MCC950组和癫痫清颗粒组小鼠脑组织中PUMA、NF-κB p65 蛋白表达水平均显著降低(P<0.05或P<0.01),ocln、cldn5、ZO-1蛋白表达水平均显著升高(P<0.05或P<0.01)。各组小鼠脑组织中PUMA、NF-κB p65、ocln、cldn5、ZO-1蛋白表达的测定结果见图2、表3。
4 讨论
NLRP3炎症小体是目前AD药物研发的新靶点[20]。NLRP3炎症小体与AD患者的BBB通透性密切相关——抑制NLRP3炎症小体表达,可降低BBB通透性[21]。MCC950是目前最为有效的选择性NLRP3炎症小体小分子抑制剂,其通过抑制NLRP3炎症小体的形成和激活,改善AD患者的BBB功能[22-23]。盐酸多奈哌齐片作为胆碱酯酶抑制剂,多用于AD的治疗,可改善AD患者的行为学变化[15]。因此,本研究选择MCC950和盐酸多奈哌齐片同时作为阳性对照药。
小胶质细胞是神经胶质细胞的一种类型,活化的小胶质细胞可促进AD患者的炎症进程。NLRP3广泛表达于小胶质细胞中,在启动炎症反应中扮演重要角色[24]。紧密连接蛋白是构成BBB基本结构并维持其功能的主要部分,在保持BBB通透性方面起到了较为重要的作用[25]。小胶质细胞活化后,NLRP3的表达量增加,紧密连接蛋白(ocln、cldn5和ZO-1)表达降低[26],BBB通透性增强,导致学习记忆功能障碍[27]。IBA-1参与小胶质细胞骨架形成,是小胶质细胞的特异性标志物,其表达量的多少与小胶质细胞活性密切相关[28]。在伊文思蓝渗漏实验中,可以通过测定小鼠脑组织内的伊文思蓝含量来评估BBB的完整性[29]。本研究结果显示,与假手术组比较,模型组小鼠脑组织内的伊文思蓝含量明显增加,小鼠自发交替反应率明显降低;且脑组织中的IBA-1、NLRP3蛋白表达明显上调,ocln、cldn5、ZO-1蛋白表达明显下调。以上結果提示,AD模型小鼠脑组织中NLRP3表达上调可促使BBB通透性增强,导致其学习记忆功能受损。癫痫清颗粒干预后可以显著提高AD模型小鼠的自发交替反应率,减少其脑组织内的伊文思蓝含量,并可显著下调脑组织中IBA-1、NLRP3蛋白表达,上调其脑组织中ocln、cldn5、ZO-1蛋白表达。
以往研究表明,PUMA作为一种凋亡调控因子,具有强大的促凋亡作用[30]。近期研究发现,PUMA与BBB完整性密切相关[31],敲除PUMA基因能够显著抑制脑血管内皮细胞凋亡,起到保护BBB完整性的作用[32];而沉默NF-κB基因可抑制PUMA过表达引起的紧密连接蛋白(ocln、cldn5、ZO-1)表达量的降低,说明PUMA是NF-κB的上游调控因子,可调节BBB通透性[33]。NF-κB作为一条经典的炎症信号转导通路,当外源性刺激存在时,可促使NF-κB p65进入细胞核内,使NLRP3表达增加,而抑制NF-κB p65的核转录可以减少AD模型小鼠脑组织中NLRP3的表达,降低BBB通透性,从而改善AD模型小鼠的学习记忆障碍[32]。本研究结果显示,与假手术组比较,模型组小鼠脑组织中PUMA、NF-κB p65蛋白表达均明显上调;癫痫清颗粒干预后可以显著下调AD模型小鼠脑组织中PUMA、NF-κB p65蛋白表达。
综上所述,癫痫清颗粒可能通过抑制NLRP3炎症小体信号通路,有效改善AD模型小鼠的BBB损伤,有望为临床治疗AD提供新的思路和靶点。本课题组后续将进一步探讨癫痫清颗粒是否能通过抑制Aβ沉积和Tau蛋白磷酸化来降低NLRP3炎性小体的激活,从而发挥其维持BBB完整性的作用。
参考文献
[ 1 ] NAJM R,JONES E A,HUANG Y D. Apolipoprotein E4,inhibitory network dysfunction,and Alzheimer’s disease
[J]. Mol Neurodegener,2019,14(1):24.
[ 2 ] KRAUSE D L,MÜLLER N. Neuroinflammation,microglia and implications for anti-inflammatory treatment in Alzheimer’s disease[J]. Int J Alzheimers Dis,2010,2010:732806.
[ 3 ] ZHEN H,ZHAO L Z,LING Z J,et al. Wip1 regulates blood-brain barrier function and neuro-inflammation induced by lipopolysaccharide via the sonic hedgehog signaling signaling pathway[J]. Mol Immunol,2018,93:31-37.
[ 4 ] 尚俊奎,李巍,张杰文.血脑屏障损伤在正常衰老过程中的作用[J].中华实用诊断与治疗杂志,2022,36(1):99- 101.
[ 5 ] ZENARO E,PIACENTINO G,CONSTANTIN G. The blood-brain barrier in Alzheimer’s disease[J]. Neurobiol Dis,2017,107:41-56.
[ 6 ] ZHANG Y,DONG Z,SONG W. NLRP3 inflammasome as a novel therapeutic target for Alzheimer’s disease[J]. Signal Transduct Target Ther,2020,5(1):1-7.
[ 7 ] LIU N,YU Z Y,XUN Y,et al. Amyloid-β25-35 upregulates endogenous neuroprotectant neuroglobin via NF-κB activation in vitro[J]. J Alzheimers Dis,2018,64(4):1163-1174.
[ 8 ] WARD R,LI W G,ABDUL Y,et al. NLRP3 inflammasome inhibition with MCC950 improves diabetes-media- ted cognitive impairment and vasoneuronal remodeling after ischemia[J]. Pharmacol Res,2019,142:237-250.
[ 9 ] WENG C Y,CHIOU S Y,WANG L S,et al. Arsenic trioxide induces unfolded protein response in vascular endothelial cells[J]. Arch Toxicol,2014,88(2):213-226.
[10] DEMPSEY C,RUBIO ARAIZ A,BRYSON K J,et al. Inhibiting the NLRP3 inflammasome with MCC950 promotes non-phlogistic clearance of amyloid-β and cognitive function in APP/PS1 mice[J]. Brain Behav Immun,2017,61:306-316.
[11] LIU L M,WANG N,KALIONIS B,et al. HMGB1 plays an important role in pyroptosis induced blood brain barrier breakdown in diabetes-associated cognitive decline[J]. J Neuroimmunol,2022,362:577763.
[12] 張婧涵,王光函,邹桂欣.高效液相色谱法同时测定癫痫清颗粒中3组分含量[J].中国药业,2014,23(18):46-47.
[13] 姜鸿,王光涵,张颖,等.癫痫清颗粒中β-细辛醚在大鼠体内的药代动力学研究[J].时珍国医国药,2014,25(12):2892-2894.
[14] 张婧涵,王光函,邹桂欣.癫痫清颗粒中α-细辛醚含量测定方法研究[J].中国中医药信息杂志,2014,21(10):83-85.
[15] 李荧,杨彩瑜,贾冬,等.癫痫清颗粒对阿尔茨海默病模型小鼠血脑屏障的影响[J]. 中成药,2021,43(2):497-502.
[16] QI Y,JI X F,CHI T Y,et al. Xanthoceraside attenuates amyloid β peptide1-42-induced memory impairments by reducing neuroinflammatory responses in mice[J]. Eur J Pharmacol,2018,820:18-30.
[17] 李晓晖,王艳霞,董依依,等.姜黄素衍生物Cur20通过抑制乙酰胆碱酯酶改善阿尔茨海默病小鼠的记忆和认知能力实验研究[J].药物评价研究,2022,45(3):449-454.
[18] 齐越,李荧,贾冬,等.癫痫清颗粒对阿尔茨海默病小鼠学习记忆能力的影响和作用机制研究[J].中国现代医生,2021,59(32):34-39,193.
[19] 尚立芝,毛梦迪,许二平,等.柴胡加龙骨牡蛎汤对抑郁大鼠海马组织PI3K/Akt/GSK3β/β-catenin信号通路的影响[J].中国实验方剂学杂志,2020,26(23):12-19.
[20] YANG Y,WANG H N,KOUADIR M,et al. Recent advances in the mechanisms of NLRP3 inflammasome activation and its inhibitors[J]. Cell Death Dis,2019,10(2):128.
[21] BAKHSHI S,SHAMSI S. MCC950 in the treatment of NLRP3-mediated inflammatory diseases:latest evidence and therapeutic outcomes[J]. Int Immunopharmacol,2022,106:108595.
[22] COLL R C,HILL J R,DAY C J,et al. MCC950 directly targets the NLRP3 ATP-hydrolysis motif for inflammasome inhibition[J]. Nat Chem Biol,2019,15(6):556-559.
[23] FEKETE C,VASTAGH C,DÉNES Á,et al. Chronic amyloid β oligomer infusion evokes sustained inflammation and microglial changes in the rat hippocampus via NLRP3[J]. Neuroscience,2019,405:35-46.
[24] GUSTIN A,KIRCHMEYER M,KONCINA E,et al. NLRP3 inflammasome is expressed and functional in mouse brain microglia but not in astrocytes[J]. PLoS One,2015,10(6):e0130624.
[25] THUBRON E B,ROSA H S,HODGES A,et al. Regional mitochondrial DNA and cell-type changes in post-mortem brains of non-diabetic Alzheimer’s disease are not present in diabetic Alzheimer’s disease[J]. Sci Rep,2019,9(1):11386.
[26] WEISS N,MILLER F,CAZAUBON S,et al. The blood- brain barrier in brain homeostasis and neurological diseases
[J]. Biochim Biophys Acta,2009,1788(4):842-857.
[27] ZHANG F,LI Y,TANG Z S,et al. Proliferative and survival effects of PUMA promote angiogenesis[J]. Cell Rep,2012,2(5):1272-1285.
[28] CAHILOG Z,ZHAO H L,WU L Z,et al. The role of neutrophil NETosis in organ injury:novel inflammatory cell death mechanisms[J]. Inflammation,2020,43(6):2021- 2032.
[29] PARRA-ANGUITA L,SÁNCHEZ-GARCÍA I,DEL PINO-CASADO R,et al. Measuring knowledge of Alzheimer’s:development and psychometric testing of the UJA Alzheimer’s Care Scale[J]. BMC Geriatr,2019,19(1):63.
[30] TUERXUN M,MUHDA A,YIN L X.The molecular mechanisms of signal pathway activating effect of E2F-1/NF-κB/GSK-3β on cognitive dysfunction of Alzheimer rats[J]. Bioengineered,2021,12(2):10000-10008.
[31] YAN J H,LI L,KHATIBI N H,et al. Blood-brain barrier disruption following subarchnoid hemorrhage may be faciliated through PUMA induction of endothelial cell apoptosis from the endoplasmic Reticulum[J]. Exp Neurol,2011,230(2):240-247.
[32] 白瑩. miR-143调节血脑屏障完整性及其调控机制[D].南京:东南大学,2018.
[33] IBRAHIM S S,ABO ELSEOUD O G,MOHAMEDY M H,et al. Nose-to-brain delivery of chrysin transfersomal and composite vesicles in doxorubicin-induced cognitive impairment in rats:insights on formulation,oxidative stress and TLR4/NF-κB/NLRP3 pathways[J]. Neuropharmacology,2021,197:108738.
(收稿日期:2022-01-29 修回日期:2022-04-05)
(编辑:林 静)

