某院免疫检查点抑制剂类药物超说明书用药分析*
钱 灿,蒋 倩,李 超,袁 婷,宿怀予△
(1. 四川省德阳市人民医院,四川 德阳 618000; 2. 四川省肿瘤研究所·四川肿瘤医院药学部,四川 成都 610000)
目前,抗肿瘤药物发展迅速,已从细胞毒类药物、分子靶向药物阶段进入到免疫治疗阶段。免疫检查点抑制剂(ICIs)是肿瘤免疫治疗药物的代表。靶向程序性死亡受体1(PD-1)/程序性死亡受体-配体1(PD-L1)通路因其抗肿瘤疗效持久、适用性相对广,已成为极具发展前景和治疗价值的肿瘤免疫治疗策略[1]。同时,国内原研PD - 1/ PD - L1 抑制剂相继上市,部分品种甚至通过2020年国家医保谈判,提高其可及性。尽管越来越多的ICIs 在美国食品药物管理局(FDA)或国家药品监督管理局(NMPA)获批了越来越多的适应证,但药品说明书中适应证的获批速度仍不及临床试验证据的更新速度。结合疾病治疗的迫切需要和患者意愿,临床ICIs的使用不可避免地会存在超说明书用药现象。高级别循证医学证据是临床超说明书用药的重要支撑。为调查某院ICIs的超说明书使用情况,本研究中回顾并提取某院使用ICIs类药物患者的病历相关信息,对其超说明书用药情况进行判定,并查阅相关循证医学证据,参照Thomson 超说明书用药分析系统标准进行证据分级[2],以为ICIs 类药物的临床应用提供参考,并提出其超说明书用药管理要点。现报道如下。
1 资料与方法
1.1 资料来源
选取四川省德阳市人民医院2019年4月至2021年3月使用PD-1/PD-L1 抑制剂的患者142 例,通过医院信息系统及电子病案系统提取其用药情况,包括是否使用PD - 1/PD - L1 抑制剂及其用法用量、主要诊断、是否有敏感基因突变、首次给予时间等。
1.2 方法
通过美康合理用药信息支持系统(MCDEX)V3.3.4.0查询相应药品说明书中在国内所批准的适应证和用法用量,同时通过NMPA官网查询尚未载入药品说明书的最新批准的适应证信息。凡首次用药时国内药品说明书未载录相应用法且NMPA未公布批准的,视为超说明书用药。同时依次通过查询FDA 批准的适应证,美国国家综合癌症网络(NCCN)指南推荐情况,中国临床肿瘤学会(CSCO)指南推荐情况,临床试验开展情况,结合Thomson 分级系统[2]分析ICIs 类药物超说明书用药概况,以及证据强度及证据变迁,并分级和评价PD - 1/PD-L1类药物超说明书用药情况。
1.3 数据处理
所有数据均录入Excel软件,采用SPSS 19.0统计学软件分析。计数资料用率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
共收集到142 例患者,涉及7 种ICIs 类药物存在超说明书用药。ICIs类药物国内获批适应证见表1,患者首次使用ICIs 类药物时间分布见图1。122 例患者首次使用时存在超说明书用药,详见表2。其中,国产药品超说明书用药构成比为89.34%,显著高于进口药品的65.00%(χ2= 8.42,P<0.05)。ICIs 类药物超说明书包括超癌种、超用法使用、跨期治疗、跨线治疗4 种类型,其中超癌种例数最多,为84例,占68.85%。但在临床使用中,部分患者对应的药品适应证获批情况发生变化(表3)。截至2021年3月31日,卡瑞利珠单抗用于晚期鼻咽癌二线治疗与信迪利单抗用于晚期肺鳞癌一线治疗均为超说明书用药,但这2项适应证先后于2021年4月和6月获得NMPA 批准。以当前证据和NMPA 批准情况评判仍有84 例患者对应适应证目前仍未获得NMPA 批准。2021年3月31日,我院Thomson 分级系统综合评价为B级以上超说明书用药涉及6种药品的15种用法(表4)。其中,度伐利尤单抗治疗广泛期小细胞肺癌(ES-SCLC)不仅为NCCN 指南所推荐,同时相应适应证也被FDA批准,证据等级综合评定为A 级;卡瑞利珠单抗联合奥沙利铂化疗用于(肝功能Child - Pugh A 级或较好的B级)晚期肝细胞癌的一线治疗已被《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南2020》(简称《指南》)推荐,在该《指南》发布之时部分Ⅱ期临床试验已有结果,如中位缓解持续时间(mDOR)、中位总生存期(mOS)尚未达到终点,但该《指南》认为从已有数据[中位疾病进展期(mTTP)和中位无进展生存期(mPFS)]上看,该疗法从疗效上仍显示出良好前景,患者安全性和耐受性良好,该《指南》给出Ⅲ级推荐,2B级证据,Thomson分级为B 级;信迪利单抗用于晚期肺鳞癌的二线治疗,尽管目前尚无指南推荐,但因多中心的随机、开放、平行对照Ⅲ期临床试验(ORIENT - 3)的结果支持,证据强度综合评价仍为A 级。目前,该院仍存在部分证据暂未达到Thomson分级为B级以上的超说明书用法(表5)。
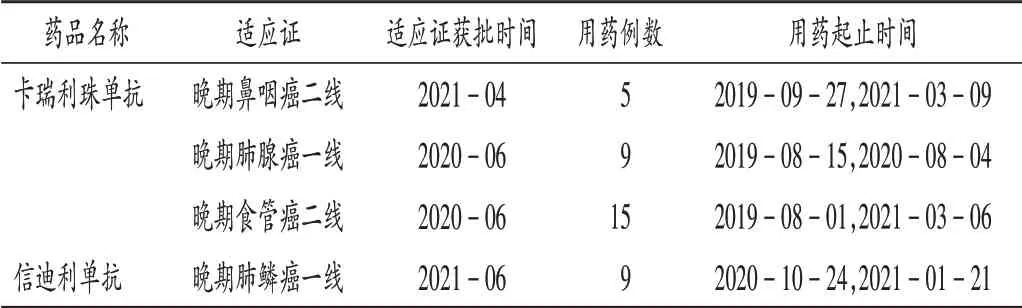
表3 首次用药与当前证据存在适应证获批变化的用药情况Tab.3 The use of drugs with the change in approved indications of current evidence and initial drug use
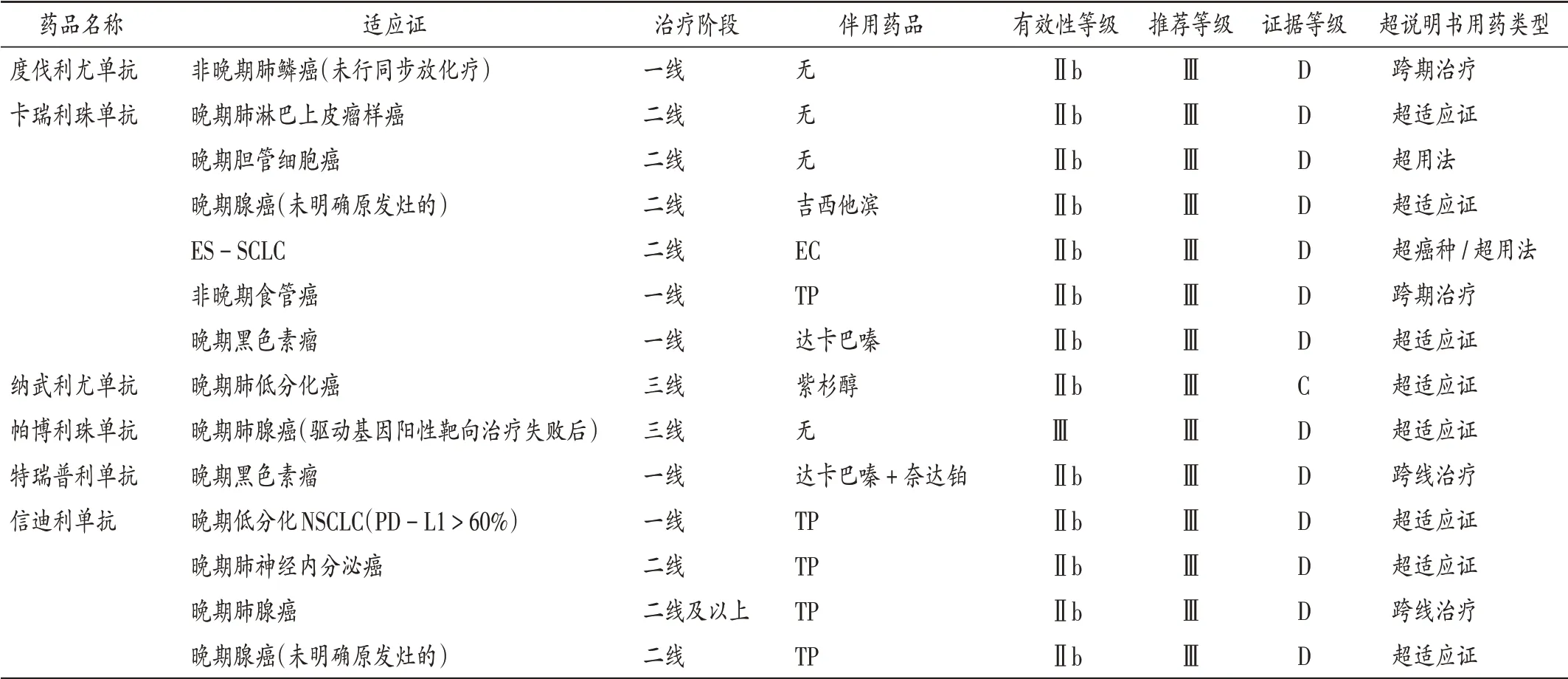
表5 证据强度暂未达到Thomson分级为B级以上的药品使用情况Tab.5 The use of drugs with the evidence strength which has not yet reached the Thomson Category B
3 讨论
3.1 ICIs 类药物使用概况
我院ICIs 类药物的使用始于2019年4月,由图1 可知,在起步阶段选药相对单一。用药初期,患者卡瑞利珠单抗使用例数相对较多,这与其在非小细胞肺癌(NSCLC)和食管癌等高发实体瘤临床试验的结果及适应证获批相对较早,如食管癌Ⅲ期临床试验ESCORT完成于2019年7月,NSCLC Ⅱ期临床试验结果于2019年9月公布,相应适应证同时获批于2020年6月;且相对于进口药品更具经济性和依从性,初期治疗病例也多以NSCLC 和食管癌为主有关。随后,ICIs 类药物的品种选择向多元化衍变,这与使用经验积累、循证医学证据不断涌现,如2020年1月NSCLC 治疗药物信迪利单抗ORIENT - 11 临床试验达到主要终点、2020年12月特瑞普利单抗CHOICE-01研究达到主要研究终点,以及经济性和可及性进一步提高有关。
3.2 对ICIs 类药物超说明书用药证据的评述
我院国产药品超说明书用药构成比显著高于进口药品,与国产药品相对于进口药品的经济性、可及性、依从性有关。以首次用药时的情况判定,122 例患者涉及超说明书用药,而以2021年6月获批适应证来看,仍有84 例患者存在超说明书用药,侧面反映了新的临床试验结果的不断发布及证据的持续更新。该院使用ICIs类药物的大部分病例在首次用药时其对应适应证有Thomson 分级B 级以上循证医学证据支持,但因患者主观用药意愿等原因,少部分患者仍存在证据强度不足的用药情况。
Thomson 分级B 级以上要求至少是“结论不一致的随机对照试验的Meta 分析,小规模或研究方法有缺陷的随机对照试验,非随机研究”,而A 级以上即要求“随机对照试验的Meta 分析,多个、设计良好、大样本的随机试验”。我院A 级证据的超说明书用药如度伐利尤单抗联合化疗用于ES-SCLC 的一线治疗,有设计良好的多中心随机开放标签对照试验CASPIAN 研究结果[10]所支持,该适应证已获FDA 批准,并在NCCN 小细胞肺癌指南(2021.V2)上获得推荐(1 类证据)。卡瑞利珠单抗单药用于肺鳞癌二线治疗证据由前瞻性Ⅱ期伞式研究SHR-1210-Ⅱ-201[11]所支持,但因其样本量、试验设计等原因,综合给予B 级评价。而CameL - sq 研究[5]中则为多中心、随机、双盲、Ⅲ期对照临床研究,论证了卡瑞利珠单抗联合化疗用于晚期或转移性鳞状NSCLC 患者一线治疗,可显著延长患者的无进展生存期,则给予A 级评价。相对地,若无高质量临床试验证据,仅有个案报道或专家意见,抑或是治疗方法尚存争议、现有证据与患者疾病分期或治疗阶段不符,证据强度均评价为C级或以下。
个案报道:如人群中发病率较低的低分化NSCLC、肺神经内分泌癌、肺淋巴上皮瘤样癌等,暂未开展ICIs类药物对对应癌种的相关临床试验,目前仅有部分个案报道,如我院1 例为将纳武利尤单抗用于复发性晚期肺低分化癌多周期治疗后的患者。MAUCLET 等[12]报道的1 例纳武利尤单抗治疗胸部姑息放疗后的神经内分泌癌患者,虽获得良好疗效,但个案的证据强度有限,综合评价为C 级。同理,对于卡瑞利珠单抗或信迪利单抗用于肺神经内分泌癌和肺淋巴上皮瘤样癌,尚无高质量个案报道,Thomson 分级证据强度评价为D 级。
不同治疗阶段用药证据不足:药物在一线治疗获得推荐并不代表其在二线治疗就一定有效,反之亦然。如度伐利尤单抗联合EC用于ES- SCLC 初始治疗(1 类证据),而复发时却不再被推荐。反之,一种ICIs 如果二线治疗有阳性证据,不代表用于一线治疗就会取得相应良好疗效。如CheckMate 078 试验证实,在既往含铂双药治疗中或治疗后出现进展的晚期NSCLC 患者中,纳武利尤单抗在中国人群中的有效性和安全性均优于标准化疗方案[13],但一线使用纳武利尤单抗并未得出优于化疗方案的临床试验结果[14]。同理,特瑞普利单抗用于恶性黑色素瘤一线、信迪利单抗用于肺腺癌二线及以上治疗均无高质量循证医学证据支持。故Thomson分级证据评价强度均为D级。
疾病不同分期的治疗证据不足:分期治疗的意义在于根据肿瘤大小、淋巴结转移情况和远处转移情况,结合患者自身情况,参照既有证据及有效性、安全性、经济性、可及性和依从性,选择最佳治疗方案。如度伐利尤单抗用于ⅢA 期肺鳞癌(患者情况为cT3N0M0)。尽管《CSCO 非小细胞肺癌指南2020年版》推荐临床N2 且预期无法行根治切除的NSCLC 患者给予度伐利尤单抗作为同步放化疗后巩固治疗,但并未推荐其他淋巴结转移程度且未经放化疗的非晚期肺癌一线治疗。这类分期治疗证据不足的,Thomson 分级证据评价强度均为C 级及以下。
联合/非联合用药方案证据不足:卡瑞利珠单抗联合依托泊苷与卡铂方案用于ES-SCLC二线治疗属联合用药方案证据不足,卡瑞利珠单抗单药用于胆道细胞癌二线治疗属非联合用药证据不足。《CSCO 小细胞肺癌指南2020年版》中ES-SCLC的一线治疗推荐了阿替利珠单抗和纳武利尤单抗联合EC 方案。而二线治疗中,卡瑞利珠单抗联合阿帕替尼用于铂类化疗后ES - SCLC二线治疗的随机开放标签的临床试验得到了良好的临床疗效[15],但并不能推导出卡瑞利珠单抗联合EC 方案就能取得相似结果,缺乏高质量循证医学证据。
超适应证用药证据不足:适应证的获批是基于高质量循证医学证据支持的结果。如前所述CASPIAN 试验为度伐利尤单抗适用于ES - SCLC 一线治疗适应证获批的关键试验。但如尚无适应证获批,绝大部分则是因为尚无高质量循证医学证据支撑。如将卡瑞利珠单抗用于晚期恶性黑色素瘤的一线治疗。帕博利珠单抗和纳武利尤单抗均获批FDA 黑色素瘤适应证,特瑞普利单抗于2018年在NMPA 获批用于特定阶段黑色素瘤的治疗。而卡瑞利珠单抗针对恶性黑色素瘤目前仅有少量药代动力学数据[16],在临床Ⅰ期试验[17]或以上研究中,尚无严谨的治疗黑色素瘤的试验结果,故Thomson分级证据评价强度判定为D级。
ICIs类药物的临床应用中,须注意循证医学证据的变迁,如新适应证的获批和既往适应证的撤回,甚至是临床结果的问世。临床药师应将此类证据变迁信息及时向临床传递,做到用药告知。随着ICIs 类药物的临床应用,不同的免疫治疗相关不良反应也会伴随出现,涉及皮肤、内分泌系统、肝脏、胃肠道、肺部、眼部、神经、血液等多器官系统[18]。特别是对免疫性肺炎这一类罕见且严重的不良反应,临床治疗过程中应做好监护,并及时处置。
3.3 ICIs 类药物超说明书用药的规范化备案审批
医疗机构应对ICIs 类药物超说明书备案制订完善的备案审批流程,而临床药师在审批过程中应重视循证医学证据,严格把握适应证、肿瘤的分期与治疗阶段及联用药物的遴选。院内超说明书用药申请应在医疗组讨论后,由科主任填写申请表格(包括患者信息、说明书相应信息和拟超说明书用法等),同时附带循证医学证据、风险处置预案,临床药师对循证医学证据进行审查和判定。安全性可控且Thomson 分级B 级以上证据的超说明书用药可提呈药学部和医务部主管审批流程。在药事管理委员会和医学伦理委员会审议后,最终通知相关管理科室和临床科室发起人,完成超说明书用药申请审批的闭环流程。
3.4 小结
ICIs 类药物上市时间相对较短,证据及临床使用经验均相对欠缺。该院ICIs 类药物的使用尚处于起步阶段,药品品种选择由相对集中向相对分散变化,并存在较多超说明书用药情况,其中部分超说明书用药Thomson 证据未达到B 级以上。ICIs 类药物的超说明书用药应充分兼顾患者意愿、经济性、临床证据及知情同意。同时,医院对于涉及超说明书用药的情况,应鼓励临床完善备案,临床药师应遵循高质量循证医学证据进行审核,并及时将药物适应证最新信息反馈至临床,在保障患者利益最大化的同时降低医疗风险。

