齐帕特罗人工抗原合成及其多克隆抗体制备
郭东光,陈明艳,冯春花,王 丰,卞爽丽,2,李文明,王凯露,吕薇薇,郑文珺,陈子怡,孙国鹏,李雪华,田金河,李 鹏,朱艳平,岳 锋,王选年*
(1.新乡学院 生命科学与基础医学学院/动物疫病分子诊断河南省工程实验室,河南新乡 453000;2.郑州大学 生命科学技术学院,河南郑州 450000;3.新乡市农业综合行政执法支队,河南新乡 453000)
近年来,随着我国对传统“瘦肉精”监管力度的不断加强,一些新型“瘦肉精”药物可能被非法用于畜禽养殖,当被动物机体摄入后,同样导致畜产品(肌肉、肝脏、肾脏等器管)中有较高的残留量。因“瘦肉精”是苯乙醇胺类化合物,与机体分泌的多巴胺(dopamine)、去甲肾上腺素(noradrenaline,NA)及肾上腺素(adrenaline,A)等儿茶酚胺类化合物化学结构相似,会对人体造成严重危害,如组织器官的损伤,心悸、头晕、乏力、恶心呕吐等中毒现象[1]。
齐帕特罗(zilpaterol,ZIL)是β2肾上腺素受体(β2-adrenergic receptors,β2AR)激动剂的一种,与莱克多巴胺(ractopamine,RAC)和克伦特罗(clenbuterol,CLB)一样同属于“瘦肉精”类,其分子式为C14H19N3O2,分子质量为297.784 u,熔点为123℃~126℃,外观呈白色或类白色结晶性粉末(图1)[2-3]。作为一种新型瘦肉精,ZIL其主要作用也是促进蛋白质合成和肌肉生长,减少脂肪组织的沉淀。当作为饲料添加剂饲喂动物后能明显增加动物的肌肉/脂肪比,显著提高饲养动物胴体瘦肉率和饲料转化率,明显改善肉的品质和降低动物的养殖成本。但相比于传统“瘦肉精”CLB,ZIL因其毒性相对较弱,其药效仅相当于CLB的十分之一,却比RAC更有效。因此,ZIL可能迅速发展成为动物饲料添加剂CLB的替代品,被广泛应用于养殖业[4]。所以,建立有效、快速、简便、灵敏的食品污染物检测方法是当务之急。
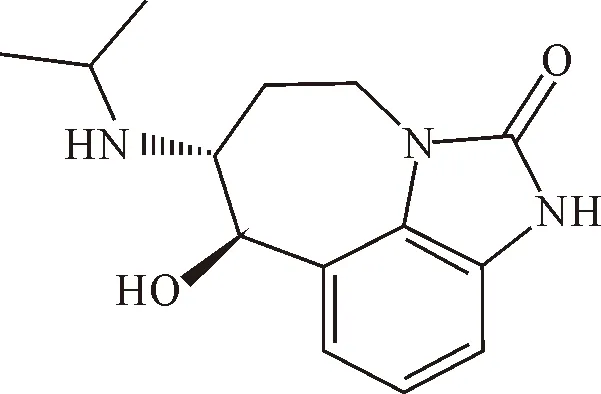
图1 齐帕特罗的分子结构
很多国家已经明令禁止使用ZIL,但美国、加拿大、墨西哥和南非曾批准在牛上使用ZIL,给全世界食品安全带来严重威胁[5-6]。目前,欧盟国家对ZIL使用和动物组织中残留方面的研究相对较多,仪器检测方法主要涉及气相色谱-串联质谱联用法(gas chromatography-tandem mass spectrometry,GC-MS/MS)、液相-串联质谱法(liquid liquid-tandem mass spectrometry,LC-MS/MS)[7-9]。在快速和高通量筛选方面,因免疫学检测技术具有高灵敏度、高通量、重现时间快等优点,是当前检测食品污染物常用的检测方法之一[10-12]。
抗体是建立免疫学快速检测方法的核心试剂,由于ZIL和其他β2AR在结构上的巨大差异,要检测食品污染物中ZIL的残留,则需要制备应用于ZIL检测的特异性抗体,而ZIL完全抗原的制备是获得ZIL抗体和建立免疫学检测方法的重要前提[13]。因此,本研究通过制备ZIL完全抗原,免疫新西兰大白兔后获得抗ZIL高特异性和高灵敏度多克隆抗体(polyclonal antibody,pAb),为后期建立ZIL免疫学快速检测方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 新西兰大白兔,由新乡学院动物疫病分子诊断河南省工程实验室提供。
1.1.2 主要试剂 ZIL、沙丁胺醇(salbutamol,SAL)、特布他林(terbutaline,TBL)、溴布特罗(brombuterol,BRO)、西马特罗(cimaterol,CIM)、CLB、盐酸多巴胺(dopamine hydrochloride,DH)、RAC、达氟沙星(danofloxain,DAN)、泰乐菌素(tylosin,TYL)标准品,德国Dr.Ehrenstorfer GmbH公司产品;牛血清白蛋白(bovine serum albumin,BSA)、鸡卵清白蛋白(ovalbumin,OVA)、弗氏完全佐剂(Freund's complete adjuvant,FCA)、弗氏不完全佐剂(Freund's incomplete adjuvant,FIA)、吗啉乙磺酸(monohydrate,MES)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺 (1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide)德国Sigma公司产品;HRP-羊抗兔IgG,北京索莱宝生物科技有限公司产品;4-溴丁酸乙酯、无水碳酸钾、丙酮、乙酸乙酯,上海有朋化工有限公司产品。
1.1.3 主要仪器 多功能酶标仪(Enspire)和蛋白电泳仪(Mini-PROTEAN Tetra Cell 1658001),美国Bio-Rad司产品;旋转蒸发仪(RV10 digitalV)、加热磁力搅拌器(CMAGHS4),德国IKA公司产品;紫外可见分光光度计(UV-3010),日本Hitachi公司产品;透析袋(MD25),北京索莱宝生物科技有限公司产品。
1.2 方法
1.2.1 齐帕特罗半抗原的修饰及改造 将1g ZIL盐酸盐添加到20 mL的NaOH溶液中(pH>10),并用乙酸乙酯萃取ZIL游离碱。将得到的产物溶于50 mL丙酮后,加入4-溴丁酸乙酯和碳酸钾回流,过滤除去碳酸钾,用旋转蒸发仪蒸发丙酮。然后,用乙醇和KOH水溶液回流,将酯转化为游离酸,并用液相色谱-质谱(liquid chromatography-mass spectrometry,HPLC-MS)进行鉴定。
1.2.2 齐帕特罗完全抗原的合成及鉴定 将1.2.1得到的产物全部溶于2-[N-吗啉基]乙烷磺酸(MES)中,加50 mg EDC和20 mg NHS,室温搅拌反应2 h即为A液,并将溶液分成2份。然后,将20 mg BSA和20 mg OVA分别溶解于MES中,4℃冷藏即为B液。将A液缓慢滴加至B液中,室温搅拌2 h,用0.01 mol/L的PBS溶液透析3 d,每天换液6次,收集透析后的产物后,分装冻存于-80℃冰箱,具体合成路线见图2。
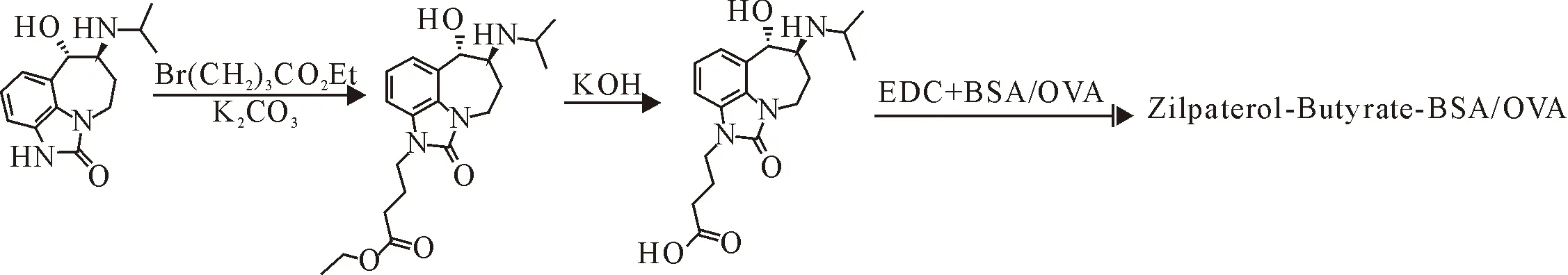
图2 齐帕特罗完全抗原合成路线图
1.2.3 齐帕特罗完全抗原的鉴定 参考本实验室前期研究方法[14-15],根据Bradford蛋白浓度测定试剂盒说明书对偶联后的产物进行浓度测定后,分别采用SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)和紫外扫描(ultraviolet scanning,UV)鉴定完全抗原的合成情况。SDS-PAGE检测时,浓缩胶浓度为50 g/L,分离胶浓度为150 g/L,电泳电压为200 V,最后用考马斯亮蓝染色。UV鉴定完全抗原时,先用PBS稀释BSA、OVA和ZIL标准溶液,并调整浓度与ZIL-BSA、ZIL-OVA的浓度一致,约为1 mg/mL。然后采用光谱扫描模式获得上述溶液在200 nm~400 nm范围内的吸收光谱图。
1.2.4 齐帕特罗多克隆抗体的制备 选择健康的新西兰大白兔2只,体重约1.5 kg左右,免疫剂量为500 μg,1 mL/只,首次免疫用等体积的弗氏佐剂进行乳化,乳化完全后进行背部皮下多点注射。从第2次免疫开始,用弗氏不完全佐剂进行乳化,每隔20 d免疫1次,共免疫5次。最后1次免疫后10 d,耳缘静脉取血2 mL,37℃放置2 h后,4℃过夜,6 000 r/min离心5 min,抽取血清,分装后,置-20℃保存。
1.2.5 齐帕特罗多抗血清的效价检测 采用间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)评估免疫后的血清效价。基本步骤如下:(1)包被:将包被原(ZIL-OVA)用包被缓冲液(CBS,0.01 moL/L,pH=9.6)稀释到2 μg/mL,50 μL/孔加入96孔酶标板中,4℃包被过夜;(2)洗涤:次日,甩干孔内液体,先用PBST清洗5次,第5次静置5 min,随后在吸水纸上拍干;(3)封闭:每孔加入200 μL封闭液(50 g/L脱脂奶粉-PBST),于37℃恒温箱中孵育2 h,甩干孔内液体,洗涤5次,方法同上;(4)一抗孵育:先在每孔加入50 μL的PBS,然后在第1孔加入1∶100倍稀释的50 μL的抗血清并进行倍比稀释,完成后于37℃恒温箱中孵育40 min,甩干孔内液体,洗涤5次,方法同上;(5)加入二抗:以辣根过氧化物酶(peroxidase)HRP标记的羊抗兔-IgG作为二抗,用封闭液1∶5 000稀释,50 μL/孔,于37℃恒温箱中孵育30 min,甩干孔内液体,洗涤5次,方法同上;(6)显色:显色液为TMB单组分显色液,50 μL/孔,37℃避光10 min后,立即加入50 μL/孔的终止液;(7)读数:酶标仪测定各孔在450 nm处的吸光值。(8)判断标准:以OD450nm值>0.3且P/N>3.1判断兔血清产生的效价反应层度。待效价符预期后,用500 μg 进行超免,7 d后进行心脏大量釆血,得到ZIL抗血清。
1.2.6 齐帕特罗多抗血清半数抑制浓度的测定 采用间接竞争ELISA评估多抗血清的半数抑制浓度(half-inhibitory concentration,IC50)。基本步骤如下:(1)包被:将包被原(ZILL-OVA)用包被缓冲液稀释到2 μg/mL,100 μL/孔加入96孔酶标板,4℃包被过夜。(2)封闭:甩去孔内液体,PBST-5%脱脂奶粉洗涤5次,每次3 min;每孔加入200 μL封闭液,于37℃恒温箱中孵育2 h,甩干孔内液体,洗涤5次。(3)竞争反应:将0.5 μg/mL的标准品用稀释液稀释成系列浓度,50 μL/孔加入到已包被抗原的酶标板中;再依次加入稀释至合适浓度的50 μL/孔抗血清,37℃反应90 min,洗涤5次,甩干。(4)加酶标二抗:每孔加入100 μL 5 000倍稀释的HRP-羊抗兔IgG,37℃反应60 min,洗涤5次,甩干。(5)显色:每孔加显色液100 μL,室温避光显色15 min,加入50 μL/孔终止液终止反应。(6)测定:酶标仪测定各孔在450 nm处的吸光值。(7)计算:使用Origin 9.0软件中的四参数拟合函数对数据进行拟合,以标准品浓度的对数值为横坐标,以吸光值B/B0作为纵坐标绘制标准曲线,根据IC50=(ZIL抗血清效价-ZIL抗血清抑制)/ ZIL抗血清效价×100%进行计算。
1.2.7 齐帕特罗多抗血清的特异性鉴定 选取瘦肉精类小分子CL、RAC、SAL、DH、BRO、BAM、CIM、TBL和2种临床抗菌药物DAN、TYL作为抑制物,评价该方法的特异性。按步骤1.2.6测定,绘制标准曲线,并按公式交叉反应率(CR)=IC50(标准品)/ IC50(反应物)×100%计算相对应的交叉反应率。
2 结果
2.1 齐帕特罗丁酸盐的合成
为在ZIL分子结构上引入-COOH,将ZIL与4-溴丁酸乙酯反应即得到ZIL-丁酸盐。HPLC-MS鉴定结果表明,如图3A所示,在反应体系中检测到2种主要产物,保留时间(RT)分别为11.48 min和12.94 min。其中RT值为11.48的分子质量348.217 3 u(图3B),RT为12.94的分子质量290.014 4 u(图3C)。经质谱(MS)鉴定结果显示,RT值为11.48的分子质量与ZIL-丁酸盐的分子量完全相符,约占体系中总反应产物的92.23%(表1),以上结果表明成功合成ZIL-丁酸盐。
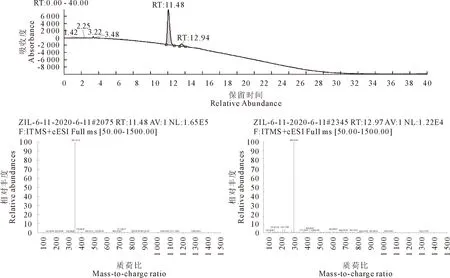
A.HPLC分离结果;B.样品的MS检测结果;C.样品的MS检测结果
2.2 齐帕特罗完全抗原的鉴定
2.2.1 SDS-PAGE鉴定 如图4和图5所示,SDS-PAGE电泳结果显示,ZIL-丁酸盐与载体蛋白BSA/OVA偶联后的产物的分子质量分别为66 ku和45 ku,相比BSA和OVA均有所增加,并且偶联后产物的迁移速率明显小于载体蛋白BSA或OVA,可初步证明ZIL与载体蛋白偶联成功。
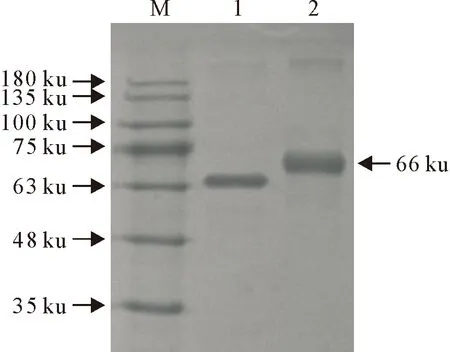
M.蛋白分子量标准;1.BSA载体蛋白;2.偶联产物
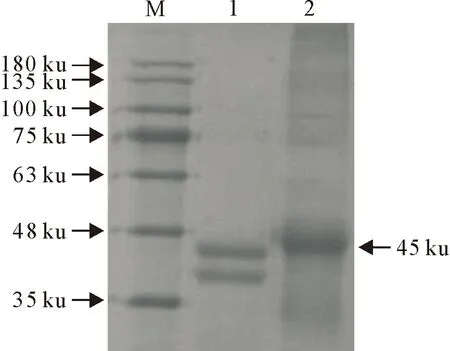
M.蛋白分子量标准;1.OVA载体蛋白;2.偶联产物
2.2.2 紫外(UV)扫描鉴定结果 为进一步鉴定完全抗原是否制备成功,UV结果显示,载体蛋白BSA和OVA的最高吸收峰分别为276 nm 和278 nm,小分子ZIL的最高吸收峰约为225 nm,而偶联后的ZIL-BSA和ZIL-OVA的最高吸收峰分别为282 nm和275 nm。因此,相对于载体蛋白BSA/OVA,偶联产物在200 nm~500 nm波长范围特征吸收峰明显不同,ZIL-BSA特征吸收峰发生明显右移(图6A)。虽然ZIL-OVA在268 nm~281 nm处的吸光值没有明显变化,其450 nm吸光值波动范围在0.6207~0.6212之间,最大吸光值在275 nm处,为0.6271。因此,ZIL-OVA的特征吸收峰均发生了明显左移(图6B)。以上结果进一步证明ZIL与载体蛋白BSA/OVA偶联成功。
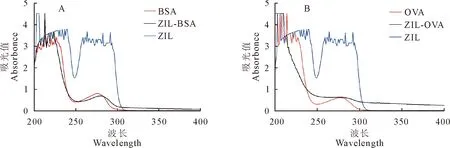
A.ZIL-BSA紫外扫描鉴定结果;B.ZIL-OVA紫外扫描鉴定结果A.ZIL-BSA UV scanning identification results; B.ZIL-OVA UV scanning identification results
2.3 齐帕特罗多抗血清效价检测
第5次免疫后,通过对2只新西兰大白兔耳缘静脉采血,采用间接ELISA检测血清抗体效价。如表2所示,以OD450nm值>0.3且P/N>3.1为判断标准。相比于阴性兔血清,2只兔子均产生了良好的抗体效价,其中1号兔在第5次免疫后效价最高,达到1∶12 800,2号兔效价约为1∶6 400,说明完全抗原免疫后具有良好的免疫效果。
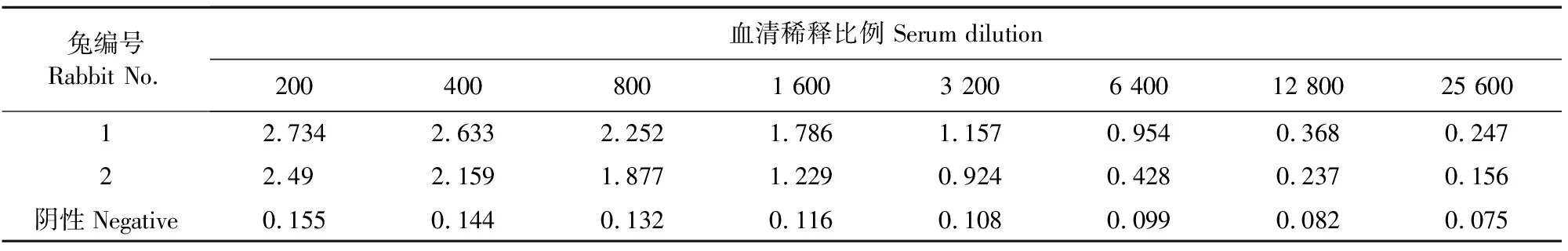
表2 间接ELISA检测兔血清抗体效价结果
2.4 齐帕特罗多抗血清的IC50测定
为鉴定ZIL抗血清灵敏度,间接竞争法ELISA检测结果显示,所建立的标准曲线拟合度良好,1号兔和2号兔血清标准曲线的相关系数R2值分别为0.999 75和0.998 95(图7)。根据建立的标准曲线分别计算出1号和2号兔血清IC50值分别为0.38 ng/mL和1.13 ng/mL。由于1号兔血清敏感性较好,因此选择1号兔血清用于后续试验,经计算1号兔血清IC20-IC80值为0.054 ng/mL~1.554 ng/mL。
2.5 抗体的特异性测定
为进一步鉴定ZIL抗血清的特异性,共选取了7种β2AR激动剂和2种兽用标准品与ZIL抗血清进行反应。结果如表3所示,ZIL抗血清与CL、RAC、SAL、DH、BRO、BAM、CIM、TBL等7种常见β2AR激动剂均无交叉反应,并且与2种兽药DAN、TYL也无交叉反应,其IC50值均高于1 000 ng/mL。
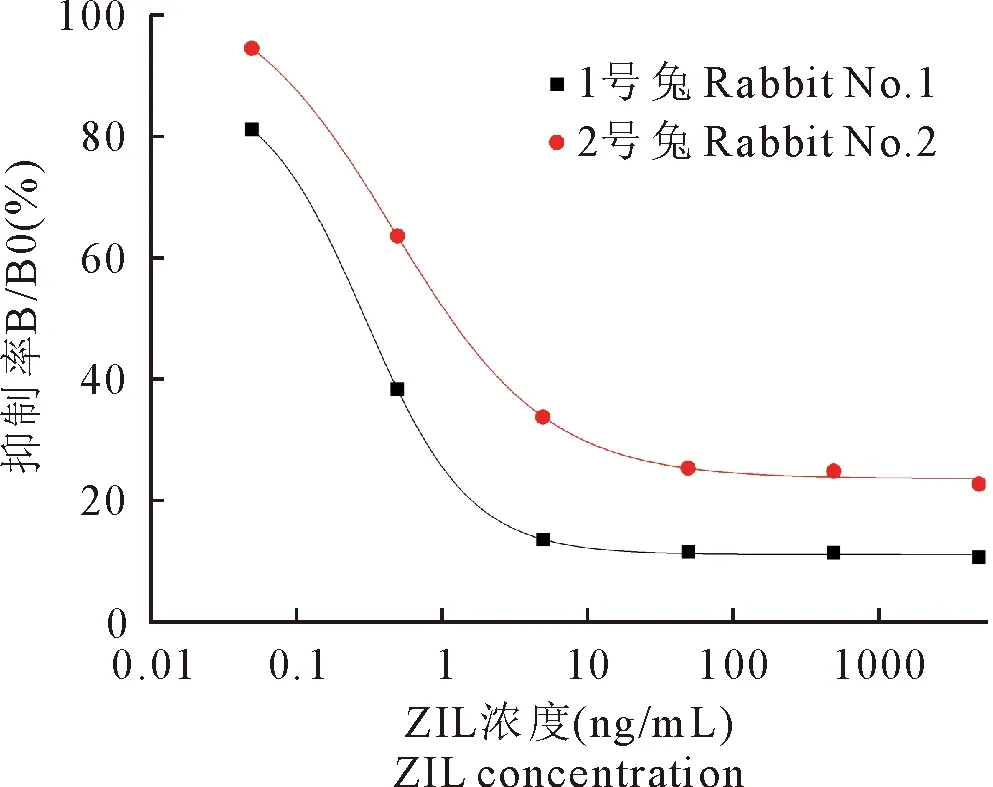
图7 1号兔和2号兔血清敏感度标准曲线
3 讨论
ZIL属于小分子半抗原,不具备免疫原性,只有与相应载体蛋白偶联后才能诱导动物产生相应的免疫反应。在合成完全抗原时,半抗原必须经过合理的设计以获得较好的特异性[14-15]。本研究将ZIL与4-溴丁酸乙酯进行反应,最终使丁酸酯连接物的游离羧基被激活,使ZIL小分子被修饰成为ZIL-丁酸盐,使之能与目标蛋白的氨基偶联[13]。为鉴定修饰后小分子是否改造成功,用HPLC-MS技术鉴定了小分子ZIL改造后的分子质量和纯度,其结果表明,分子质量为348.91 u的化合物为主要产物,约占整个反应体系产物的92.23%,与预期结果完全相符,表明成功引入了-COOH,获得了ZIL-丁酸盐。
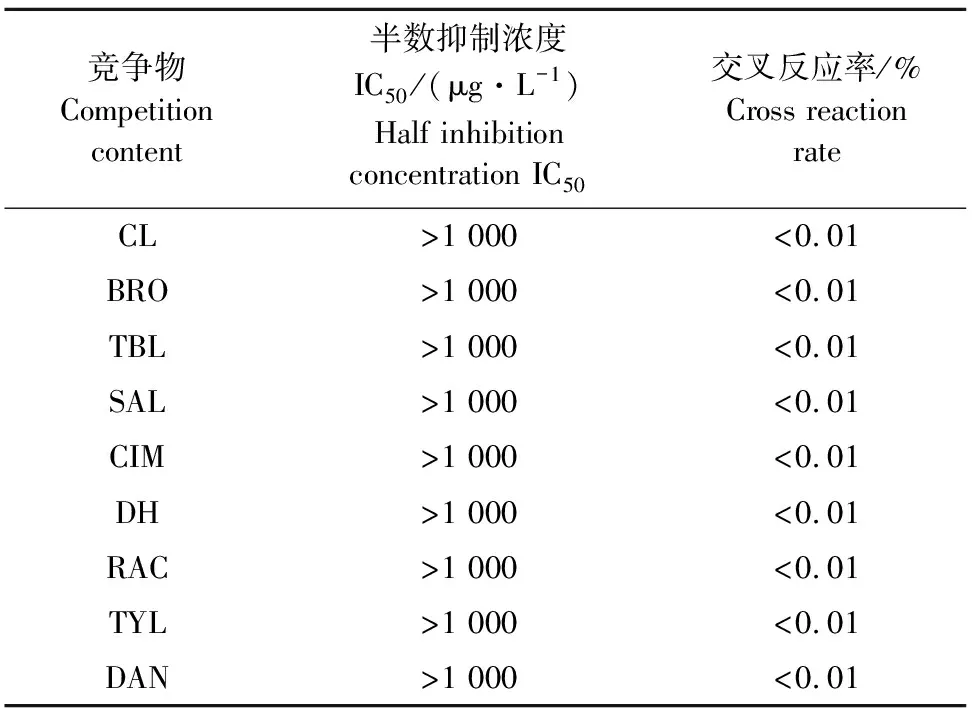
表3 ZIL抗血清的特异性鉴定
为获得ZIL-BSA/OVA完全抗原,首先对ZIL化学结构进行了分析,其包含3个亲核基团,分别为仲醇、仲胺和苯并咪唑酰胺,它们有可能取代4-溴丁酸乙酯上的溴原子。但与脂肪族或苯并咪唑类硝基物相比,ZIL仲醇基的反应活性要小得多。由于仲胺具有较大的旋转空间位阻,因此ZIL和4-溴丁酸乙酯最可能的反应位点是苯并咪唑部分上的仲胺[13,16]。另外,从设计的角度考虑,在仲胺或酰胺的基础上都有可能产生合适的半抗原。因此,在ZIL-丁酸盐的基础上,本研究通过EDC/NHS方法,将其与载体蛋白BSA/OVA分别进行偶联。SDS-PAGE电泳鉴定结果表明,相比于载体蛋白,偶联后的分子质量均明显增加,且泳动速率明显变慢,初步证实成功制备了完全抗原ZIL-BSA/OV。UV结果进一步表明,偶联后的ZIL-BSA/OVA最大吸收峰明显发生变化,同时具备小分子ZIL和载体蛋白BSA/OVA的分子特征,进一步证实成功制备了完全抗原ZIL-BSA/OVA。
此外,从引入的侧链长度分析,与载体蛋白质结合的-COOH和ZIL分子之间的3个碳原子的距离完全可以满足和载体蛋白的有效偶联,并能适当暴露ZIL分子抗原表位,以提高抗体的特异性[13]。通过免疫新西兰大白兔后,成功制备了高特异性和高灵敏度抗ZIL多抗血清,其效价在1∶6 400以上, IC50分别为0.38 ng/mL和1.13 ng/mL,并且与7种常见的“瘦肉精”类小分子和2种临床常用抗菌药物均无交叉反应。更为重要的是,获得的ZIL pAb均没有与常见的“瘦肉精”(如CLB、RAC、SAL)发生任何交叉反应。因为与这些常用“瘦肉精”的任何一种产生交叉反应,都有可能导致在检测过程中假阳性结果的出现。
此外,ZIL抗体具有高特异性的主要原因还可能与ZIL属于苯乙醇胺激动剂有关,由于其具有独特的苯并咪唑核,在结构上与其他苯乙醇胺激动剂完全不同,这也可能是抗体具有高特异性的另一个重要原因。Shelver WL等[13]采用相似的方法制备了山羊源抗ZIL的pAb,虽然与其他β2AR也无交叉反应,但是其IC50=3.94 ng/mL,相比而言,本研究制备的兔源ZIL抗体具备更好的灵敏度。通过本实验室前期对CLB、CIM、SAL、TBL等不同小分子研究结果,发现即使是同一种抗原,甚至是同一批制备的完全抗原免疫小鼠和兔子后,产生的免疫效果均存在很大差异。但是从整体情况分析,同种抗原免疫兔子后获得的血清敏感度较好,IC50较低,并且效价较好。因此,相比Shelver WL等研究,我们推测本研究获得的兔抗ZIL pAb IC50较低的原因,可能是相比于其他动物,与兔子免疫系统能够产生更好的免疫反应相关。
综上所述,本研究利用ZIL与4-溴丁酸乙酯反应,再通过与载体蛋白BSA/OVA偶联后,成功制备了ZIL完全抗原ZIL-BSA/OVA,免疫新西兰大白兔后,获得一种高灵敏度和高特异性的抗ZIL pAb,为后续建立ZIL免疫学快速检测方法奠定了基础。

