SLP-2在胃癌中的表达及临床意义的Meta分析
陶嘉楠,田王钊,安 琪,王学红, 张盛祺,刘 吉
(1.青海大学研究生院,青海 西宁 810016;2.青海大学附属医院 消化内科,青海 西宁 810000)
胃癌是发病率全球排名第五的恶性肿瘤[1]。2018年我国胃癌的粗发病率约为32.1/10万,在所有恶性肿瘤发病率中排名第三,仅次于肺癌及结直肠癌;胃癌粗死亡率约27.4/10万,在恶性肿瘤中排名第二,仅次于肺癌[2]。胃癌在发病早期常无明显症状,故确诊时常处于进展期,此期预后多不良[3]。尽管在手术、化疗、分子靶向治疗、免疫治疗等多种治疗方式下,进展期胃癌的预后得以改善,但其总体预后仍然较差[4]。Stomatin样蛋白-2(stomatin-like protein-2,SLP-2)属于stomatin蛋白家族,该家族有4个成员即Stomatin、SLP-1、SLP-2、SLP-3[5]。近年来研究显示,SLP-2参与一些肿瘤增殖、迁移、浸润、黏附等关键过程,编码它的SLP-2基因可能是一种新的癌基因[6]。研究提示SLP-2在卵巢癌[7]、结直肠癌[8]、宫颈癌[9]、胆囊癌[10]、肝细胞癌[11]、肺癌[12]等恶性肿瘤中常存在过度表达,SLP-2在胃癌中的表达研究数量较少,且研究结论有诸多不一致。因此,目前有必要针对SLP-2在胃癌中的表达及临床意义进行Meta分析,以期为胃癌的诊断与分子靶向治疗提供更高级别的证据。
1 资料与方法
1.1纳入与排除标准 纳入标准:有关SLP-2在胃癌中的表达及临床意义的病例-对照研究;病例组为确诊为胃癌且胃癌组织中SLP-2阳性表达的患者,对照组为胃癌组织中SLP-2阴性表达的患者;暴露因素为SLP-2阳性表达;结局指标为SLP-2在胃癌组织和癌旁组织中的表达差异,不同性别、年龄、肿瘤分化程度、肿瘤直径、浸润深度、淋巴结转移情况、血行转移情况、临床分期时SLP-2 的表达差异。排除标准:非中英文文献;重复发表的文献;非病例-对照研究文献;数据不完整的文献;未报告此次Meta分析所关注指标的文献。
1.2文献检索策略 计算机检索各大数据库:PubMed、Cochrane Library、EMbase、CBM、CNKI、WanFang Date和VIP数据库,搜集国内外关于SLP-2在胃癌中表达及临床意义的各种病例-对照研究,并且手工追查纳入文献的参考文献,检索时限为建库至2021年11月。中文检索词包括:stomatin样蛋白-2、SLP-2、胃癌、胃肿瘤;英文检索包括:STOML2 protein、SLP-2 protein、stomatin-like protein 2、STOML2 (stomatin (EPB72)-like 2) protein、HUSLP2 protein、SLP-2、SLP2 protein、Stomach Neoplasms、Gastric Neoplasms、Stomach Cancers、Gastric Cancer、Cancer of the Stomach等。
1.3文献筛选与资料提取 由2名研究者独立筛选文献、提取资料并且交叉核对,若出现分歧,将由第三方裁定。按照提前设计好的资料提取表提取纳入文献中的数据,内容包括:纳入研究的题目、作者、国家、年份;病例组与对照组例数、性别构成、中位年龄、实验方法、胃癌组织中SLP-2的阳性率等;相关结局指标;偏倚风险评价的相关要素。
1.4纳入研究的偏倚风险评价 由2名研究者独立对纳入病例-对照研究的偏倚风险进行评价,若有分歧则协商解决,评价工具为纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)。
1.5统计学方法 Meta分析采用Revman 5.3软件,采用比值比(odds ratio,OR)及其95%的可信区间(confidence interval,CI)作为效应量。纳入研究间的异质性评估采用I2检验,当I2<50%时,表示研究试验间具有同质性,采用固定效应模型分析;当≥50%时,表示研究试验间具有异质性,采用随机效应模型分析。明显的临床异质性可采用亚组分析或敏感性分析等方法进行。P<0.05为差异有统计学意义。
2 结 果
2.1文献筛选流程及结果 初检出相关文献272篇,经逐层筛选后,最终纳入8篇病例-对照研究[13-20],共计1 079例患者。文献筛选流程及结果见图1。
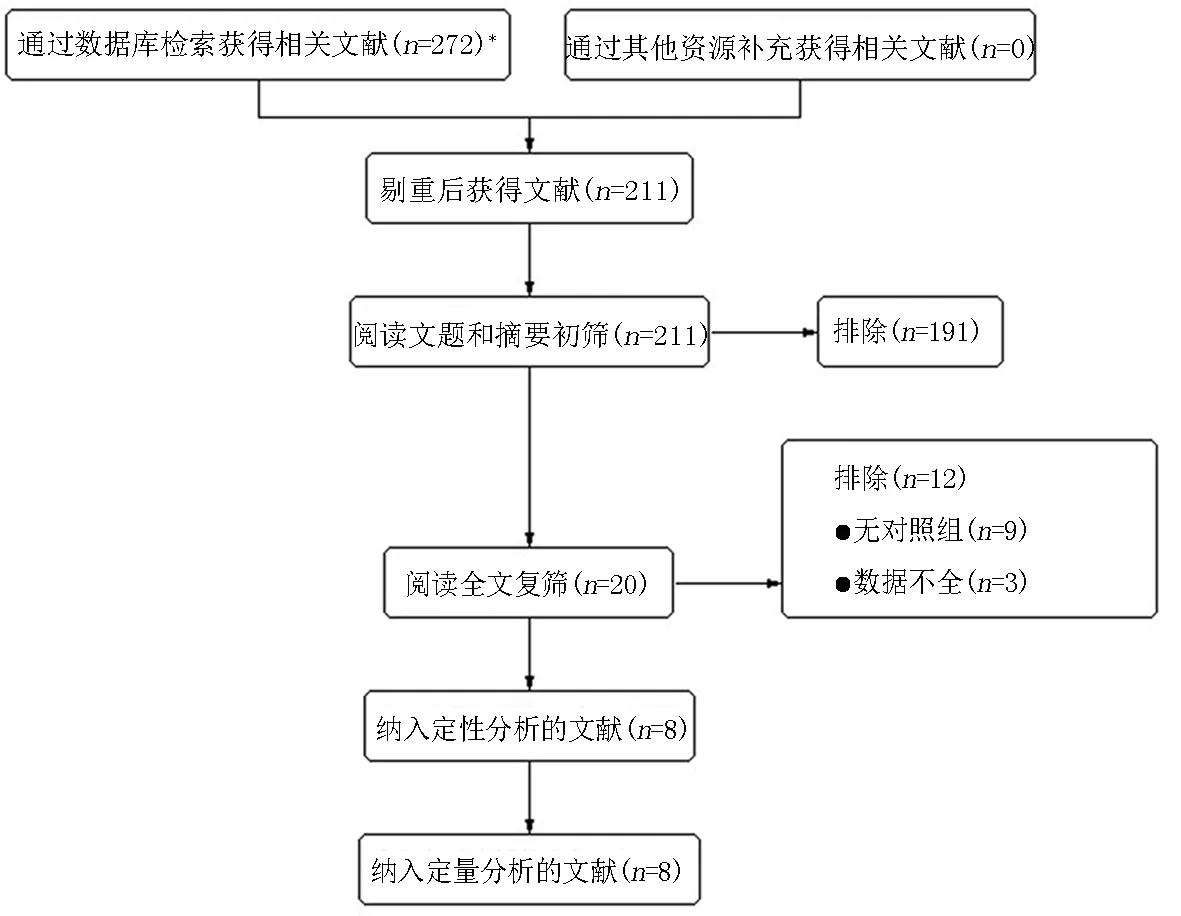
图1 文献筛选流程及结果 *pubmed(n=5)、Cochrane Library(n=0)、EMbase(n=12)、CBM(n=9)、CNKI(n=11)、VIP(n=4)、WanFang Date(n=231)
2.2纳入研究的基本特征及偏倚风险评价结果 纳入研究的基本特征见表1,偏倚风险评价结果见表2。
2.3Meta分析结果
2.3.1胃癌组织与癌旁组织 共有5个研究[14,16-18,20]报告了SLP-2在胃癌组织和配对癌旁组织中的表达情况。固定效应模型meta分析结果显示,SLP-2在胃癌组织中的表达水平明显高于癌旁组织,差异有统计学意义[OR=6.20, 95%CI(4.41,8.73),P<0.01]。见图2。

表1 纳入研究的基本特征
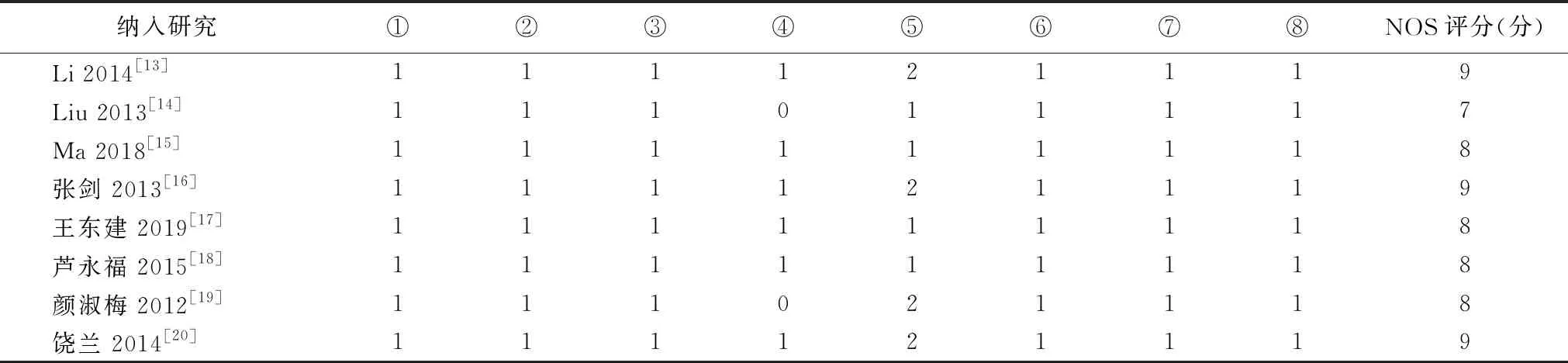
表2 纳入研究的偏倚风险评价结果

图2 SLP-2在胃癌组织和癌旁组织中表达的Meta分析
2.3.2年龄≥55岁组与年龄<55组 共有4个研究[13-15,19]报告了SLP-2在不同年龄组(以55岁为界)胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在不同年龄组中的表达水平差异无统计学意义[OR=0.90, 95%CI(0.67, 1.20),P=0.47]。
2.3.3男性组与女性组 共有7个研究[13-17,19-20]报告了SLP-2在不同性别组胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在不同性别组中的表达水平差异无统计学意义[OR=0.93, 95%CI(0.70, 1.22),P=0.58]。
2.3.4肿瘤直径>5 cm组与肿瘤直径≤5 cm组 共有3个研究[14,16,19]报告了SLP-2在不同肿瘤直径组(以5 cm为界)胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在不同肿瘤直径组中的表达水平差异无统计学意义[OR=1.19, 95%CI(0.75, 1.90),P=0.46]。
2.3.5低分化组与高-中分化组 共有6个研究[13-16,19-20]报告了SLP-2在不同分化程度组胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在低分化组中的表达水平高于中-高分化组,差异有统计学意义[OR=1.41, 95%CI(1.04, 1.93),P=0.03]。
2.3.6浸润深度T3-T4组与浸润深度T1-T2组 共有4个研究[13-15,19]报告了SLP-2在不同浸润深度组胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在T3-T4组中的表达水平高于T1-T2组,差异有统计学意义[OR=3.84, 95%CI(2.70, 5.47),P<0.01],见图3。

图3 SLP-2在不同浸润深度胃癌组织中表达的Meta分析
2.3.7淋巴结转移组与无淋巴结转移组 共有7个研究[13-17,19-20]报告了SLP-2在有/无淋巴结转移组胃癌组织中的表达情况。随机效应模型Meta分析结果显示,SLP-2在淋巴结转移组中的表达水平高于无淋巴结转移组,差异有统计学意义[OR=2.21, 95%CI(1.37, 3.56),P=0.001],见图4。
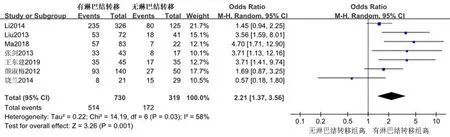
图4 SLP-2在淋巴结转移和无淋巴结转移胃癌组织中表达的Meta分析
2.3.8血行转移组与无血行转移组 共有3个研究[13,14,19]报告了SLP-2在有/无血行转移组胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在血行转移组中的表达水平高于无血行转移组,差异有统计学意义[OR=2.05, 95%CI(1.25, 3.35),P=0.004],见图5。

图5 SLP-2在血行转移和无血行转移胃癌组织中表达的Meta分析
2.3.9临床分期Ⅲ、Ⅳ期组与临床分期Ⅰ、Ⅱ期组 共有5个研究[13,14,16,17,19]报告了SLP-2在不同临床分期组胃癌组织中的表达情况。固定效应模型Meta分析结果显示,SLP-2在Ⅲ、Ⅳ期组中的表达水平高于Ⅰ、Ⅱ期组,差异有统计学意义[OR=2.79, 95%CI(2.08, 3.74),P<0.01]。
3 讨 论
SLP-2的编码基因SLP-2基因最早在2000年被首次发现,是stomatin基因超家族的一员,定位于染色体9p13.1[21],其编码产物SLP-2蛋白广泛存在于胃、结肠、小肠、食管黏膜等组织中[22]。近年来诸多学者研究显示,SLP-2与肿瘤的发生发展密切相关,被推测为是一种新的癌基因,但目前SLP-2蛋白在恶性肿瘤中的作用机制及潜在应用价值仍处于初步研究阶段。SLP-2参与肿瘤发生发展的主要机制包括:①SLP-2参与Wnt/β-catenin信号通路调节细胞的增殖、分化和迁移:Yang等[23]研究显示,SLP-2抑制非小细胞肺癌细胞中Survivin的表达,并证实SLP-2通过调节Wnt/β-catenin信号通路中的成员β-catenin促进Survivin的表达。同样,Rahmani等[24]学者研究证实,SLP-2可能通过调节Wnt/β-catenin信号通路对大肠癌细胞的生长起促进作用;②SLP-2通过参与MEK-ERK信号通路改变线粒体中Ca2+浓度,从而调节肿瘤的发生发展[25],但具体机制尚未阐明;③SLP-2通过参与JAK2-STAT3-PIM1通路在肿瘤性疾病中调控肿瘤细胞增殖及凋亡。Liu等[26]在结直肠癌细胞中敲除SLP-2基因后,JAK2及PIM1的转录明显下降,且相关蛋白质含量也随之下降,提示SLP2可能参与了JAK2-STAT3信号通路从而调节PIM1的含量,进而影响结直肠癌细胞的增殖及凋亡;④SLP-2参与Notch通路调节癌细胞增殖、凋亡:Guo等[27]研究表明,在卵巢癌组织中SLP-2表达与肿瘤分化程度、远处转移及临床分期相关,下调SLP-2表达可以通过激活Notch信号通路而显著抑制卵巢癌细胞增殖,促进细胞凋亡。
本研究结果提示SLP-2在胃癌组织中的表达显著高于癌旁组织,在胃癌组织中,低分化组、浸润深度T3-T4组、淋巴结转移组、血行转移组、临床分期Ⅲ、Ⅳ期组中SLP-2的表达水平分别高于中-高分化组、浸润深度T1-T2组、无淋巴结转移、无血行转移组、临床分期Ⅰ、Ⅱ期组,差异有统计学意义,提示SLP-2在胃癌中可能充当着癌基因的作用,这与SLP-2在其他肿瘤中的作用相一致。关于SLP-2在人胃癌组织中表达的研究较少,且研究结论存在诸多差异,本研究纳入了为数不多的8篇文献,共1 079例患者,进行Meta分析后得出的结论可能比单个研究可信度更高,对于临床上诊断乃至后期可能针对于SLP-2的分子靶向治疗具有一定意义。本研究的不足之处有:①总体上纳入文献数量较少,患者总例数较少,一定程度上影响了可信度;②研究仅限于SLP-2单因素对临床病理参数的影响,未考虑其他分子的多因素影响;③所纳入的文献缺乏预后研究的数据;④所纳入研究的患者均为中国人,尚缺乏国外人群的相关研究。
综上所述,SLP-2在胃癌组织中的表达水平明显上调,且其上调常伴随着胃癌恶性程度的增加,对临床具有一定的指导意义,但仍需要更高质量的、更多数量的研究加以验证。

