三种新型化合物对草地贪夜蛾海藻糖与几丁质代谢及生长发育的影响
王思彤,陈艳,罗雨嘉,杨缘缘,蒋志洋,蒋鑫怡,钟樊,陈好,徐红星,吴俨,段红霞*,唐斌*
三种新型化合物对草地贪夜蛾海藻糖与几丁质代谢及生长发育的影响
王思彤1,陈艳1,罗雨嘉1,杨缘缘1,蒋志洋2,蒋鑫怡1,钟樊1,陈好1,徐红星3,吴俨4,段红霞2*,唐斌1*
1杭州师范大学生命与环境科学学院,杭州 311121;2中国农业大学理学院,北京 100193;3浙江省农业科学院植物保护与微生物研究所,杭州310021;4贵阳学院生物与环境工程学院,贵阳 550005
【目的】几丁质是昆虫外骨骼和围食膜的主要成分,其合成始于海藻糖酶(trehalase,TRE),终于几丁质合成酶(chitin synthase,CHS),蜕皮与外表皮重塑过程则需要依靠几丁质酶(chitinase,CHT)完成。本研究通过注射3种新型化合物,检测草地贪夜蛾()体内海藻糖酶和几丁质酶活性、相关基因表达量并观察其生长发育,验证新型化合物对海藻糖酶及几丁质酶的抑制效果,对效果显著的化合物进行筛选,探究其调控草地贪夜蛾生长发育的机理。【方法】利用显微注射法向草地贪夜蛾3龄幼虫分别注射丁烯内酯类化合物ZK-I-21、ZK-I-23和胡椒碱类似物ZK-PI-4。注射后48 h检测其海藻糖酶活性、几丁质酶活性及相关糖含量的变化情况,并利用实时荧光定量PCR(qRT-PCR)在分子水平上测定4个关键基因(、、、)的相对表达量;观察注射后草地贪夜蛾幼虫至成虫期间的表型变化,记录发育过程中的死亡率及畸形情况。【结果】与对照组相比,注射ZK-I-21和ZK-PI-4后草地贪夜蛾膜结合型海藻糖酶活性分别为极显著下降(<0.01)和显著下降(<0.05)。qRT-PCR检测结果显示,注射ZK-I-21后表达量极显著上升,表达量极显著下降;注射ZK-I-23后表达量极显著下降,表达量极显著上升;注射ZK-PI-4后表达量极显著下降。发育历期观察结果显示,ZK-I-21使草地贪夜蛾6龄幼虫发育历期极显著延长,同时蛹重变轻、蛹长变短;ZK-I-23使5龄和6龄幼虫长度显著缩短;ZK-PI-4使成虫羽化率显著降低。3种抑制剂均可紊乱草地贪夜蛾的海藻糖代谢进而紊乱几丁质代谢,造成草地贪夜蛾蜕皮困难甚至死亡。【结论】ZK-I-21与ZK-PI-4是膜结合型海藻糖酶抑制化合物,ZK-I-23可抑制可溶性海藻糖酶基因的表达,3种化合物均通过影响海藻糖代谢过程进而导致几丁质代谢的紊乱,导致昆虫蜕皮困难、畸形、生长发育受影响。以上结果可为将来利用新型抑制剂调控害虫生长发育从而防控害虫提供理论依据,为绿色、高效杀虫剂的研发提供支持。
草地贪夜蛾;海藻糖酶;几丁质酶;实时荧光定量 PCR;抑制剂
0 引言
【研究意义】草地贪夜蛾()属鳞翅目夜蛾科灰翅夜蛾属,原生于美洲的亚热带和热带地区[1],于2019年1月入侵我国的云南地区并迅速扩散[2]。该害虫具有适应性强、食性广、繁殖和迁飞能力强及防控难度大等特点[3],破坏力极大。其幼虫主要危害玉米、水稻、小麦等植株[4-5],造成减产甚至颗粒无收。传统化学农药的使用不仅会使害虫产生抗药性,加大防控难度,还会破坏生态环境。因此,筛选安全有效的新型生物农药迫在眉睫。【前人研究进展】几丁质广泛存在于甲壳类动物和昆虫外骨骼中[6],是构成昆虫肠围食膜、表皮和气管等的主要成分[7-8]。几丁质合成通路始于海藻糖酶(trehalase,TRE)[9-10],终于几丁质合成酶(chitin synthase,CHS)[11-13]。其中海藻糖酶包含可溶性海藻糖酶(soluble trehalase,TRE1)和膜结合型海藻糖酶(membrane-bound trehalase,TRE2)[14]两类,在几丁质合成通路具有重要的调控功能[15]。在昆虫蜕皮过程中,幼虫需蜕掉旧表皮,形成新表皮,几丁质合成酶为几丁质合成过程中最为关键的酶[9],几丁质酶(chitinase,CHT)为几丁质降解酶,这两类酶在调控蜕皮过程中起着非常重要的作用[16],共同负责昆虫的蜕皮过程[9,17]。由于海藻糖酶和几丁质酶的重要作用,使用海藻糖酶或几丁质酶抑制剂调控几丁质合成与代谢通路进而影响害虫蜕皮,成为害虫防治上的一种非常重要的手段。海藻糖酶抑制剂基本作用机理是与海藻糖酶活性位点上的氨基酸通过氢键紧密结合形成复合物,竞争性地抑制海藻糖酶的活性[18-20]。前人已从天然来源中分离出几种有效的海藻糖酶抑制剂,如井冈霉素[21]、有效霉素、Salbostatin、海藻唑啉和单环亚胺糖(如DNJ)[22]及其衍生物、双环亚氨基糖及其糖基衍生物[23]。近年来报道的几丁质酶抑制剂大多是通过虚拟筛选或以天然产物为先导发现的,缺少人工合成的,其中部分化合物具有很高的抑制活性,但其杀虫活性仍有待探究和提高[24],几丁质酶抑制剂包括糖类(如脱乙酰壳多糖、阿洛氨菌素等)、肽类(如环五肽类、二肽类化合物、Psammaplin A等)和新型几丁质酶抑制剂(如香豆素类化合物、噻唑烷酮类化合物等)等[24-25]。核苷类似物(C21H18N2O6和C22H20N2O6)具备候选杀虫药物潜在活性[26-27],本研究所用丁烯内酯类化合物ZK-I-21(C21H18N2O6)、ZK-I-23(C22H20N2O6)和胡椒碱类似物ZK-PI-4(C20H19NO4)能否作用于几丁质合成及潜在的分子调控机制有待进一步研究。【本研究切入点】海藻糖酶抑制剂注入幼虫体内后可有效抑制海藻糖酶活性[28-29],注射几丁质酶抑制剂则可以特异性地抑制几丁质酶活性,影响下游几丁质代谢通路,导致昆虫因蜕皮困难而死亡。对草地贪夜蛾注射ZK-I-21、ZK-I-23、ZK-PI-4这3种新型抑制化合物,检测几丁质代谢相关基因表达量及相关糖含量,并结合前人研究结果对化合物的抑制效果进行评价。【拟解决的关键问题】以草地贪夜蛾作为试验对象注射ZK-I-21、ZK-I-23、ZK-PI-4,根据3种抑制化合物能否调节海藻糖代谢或几丁质代谢通路以及对生长发育等指标是否有影响,筛选抑制作用强的化合物,探讨其作用机制,推动绿色、高效生物杀虫剂的研发。
1 材料与方法
试验于2020年9月至2021年6月在杭州师范大学完成。
1.1 昆虫饲养
供试草地贪夜蛾虫源来自浙江省农业科学院,饲养于杭州师范大学动物适应与进化实验室。草地贪夜蛾幼虫饲养在人工气候箱内,成虫饲养在人工气候室内,条件为温度(25±1)℃、相对湿度(60±10)%、光周期16L﹕8D。幼虫饲喂人工饲料,成虫饲喂10%蜂蜜水。以3龄第1天的草地贪夜蛾幼虫作为试验对象,进行化合物的显微注射。
1.2 主要试剂
3种新型抑制化合物ZK-I-21、ZK-I-23、ZK-PI-4,由中国农业大学合成并提供,其名称、分子量及分子式见表1,使用2% DMSO溶解为2×10-3mmol·mL-1的化合物溶液用于后续注射。
DNA Marker DL2000、6×Loading buffer、荧光定量试剂SYBR Premix Ex Taq、PrimeScriptTMRT regeant Kit with gDNA Eraser试剂盒(Takara);Ambion T7转录试剂盒(T7 RiboMAXTMExpress RNAi system Promega Corporation,Madison,Wl);葡萄糖分析试剂盒(Sigma-Aldrich);几丁质酶试剂盒(苏州科铭生物技术有限公司);Trizol试剂盒(Invitrogen);1×PBS Buffer(上海生工);BCA工作液(Beyotime,China);DEPC处理水(上海生工)等常规试剂(国药集团化学试剂有限公司)。
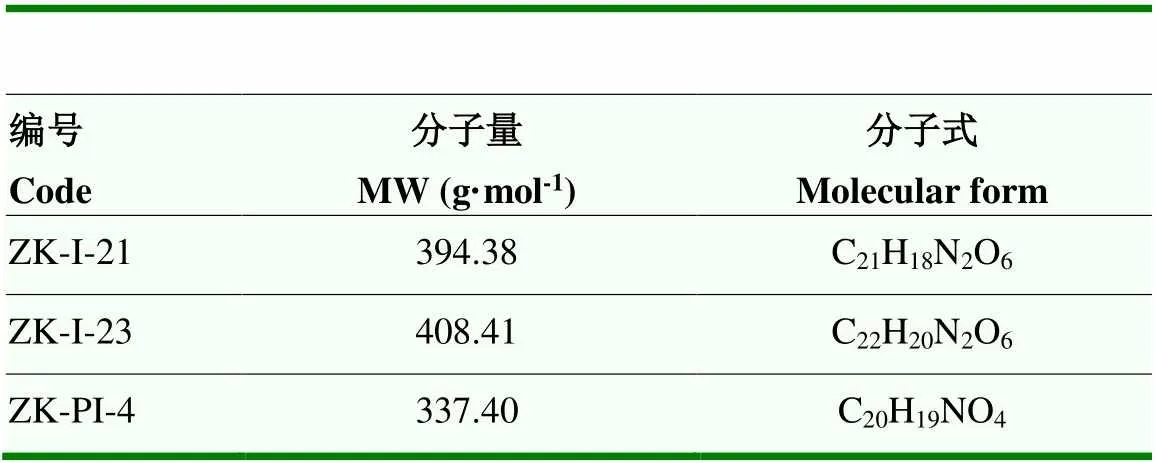
表1 3种抑制化合物信息
1.3 试验方法
1.3.1 新型化合物的显微注射 使用Eppendorf TransferMan® 4r显微注射系统进行注射,注射前调整泵出体积符合注射量。注射部位为草地贪夜蛾第2对胸足与第3对胸足之间;注射量为6×10-7mmol/头(浓度为2×10-3mmol·mL-1,注射体积为300 nL)。以注射同体积的2% DMSO的草地贪夜蛾为对照组。不同注射组每24 h观察一次,注射后48 h取材用于后续试验,试验材料未区分雌雄。
1.3.2 总RNA的抽提及cDNA的合成 注射后48 h草地贪夜蛾幼虫及组织的总RNA抽提采用Trizol试剂盒并按照产品说明进行提取。提取后用1%的琼脂糖检测总RNA的质量,使用微量核酸测定仪NanoDropTM2000测定提取RNA的浓度及纯度。根据PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒说明配置体系,进行cDNA第一链的合成。
1.3.3 海藻糖和几丁质代谢途径相关通路基因表达量的测定 使用SYBR Premix Ex Taq试剂盒进行实时荧光定量PCR(qRT-PCR),以核糖体蛋白质L10(ribosomal protein L10,RPL10)作为内参基因[30],PCR引物见表2。PCR反应体系(10 μL):primer F(10 pmol)0.4 μL、primer R(10 pmol)0.4 μL、模板cDNA 1 μL、RNase Free ddH2O 3.2 μL、TB Green 5 μL。PCR反应程序:95℃预变性2 s,95℃变性30 s,59℃退火延伸30 s,35个循环。qRT-PCR数据采用2-ΔΔCT法进行分析[31]。计算公式:2-ΔΔCT=2-[(CT待测组-CT待测RPL10)-(CT对照组-CT 对照RPL10)]。
1.3.4 海藻糖酶活性及糖含量的测定 将注射后7只草地贪夜蛾幼虫放进1.5 mL离心管中,进行3次生物学重复。每个离心管中加入200 μL磷酸盐缓冲溶液(PBS)超声破碎30 min,破碎后加入800 μL PBS,4℃,1 000×g离心20 min。取350 μL上清,4℃,20 800×超离心60 min,另取350 μL上清用于海藻糖浓度(蒽酮法)和总糖原浓度(Sigma葡萄糖分析试剂盒)的测定。超离心后的上清用于可溶性海藻糖酶的测定;沉淀用PBS悬浮后用于膜结合型海藻糖酶和蛋白质含量(贝博BCA试剂盒)的测定,具体步骤按照对应试剂盒说明书及文献[32]操作。

表2 实时荧光定量PCR检测基因引物序列
1.3.5 几丁质酶活性的测定 将注射后10只草地贪夜蛾幼虫放进1.5 mL离心管中,进行3次生物学重复,用于检测几丁质酶活性。根据苏州科铭生物技术有限公司的几丁质酶试剂盒说明书进行活性测定。
1.3.6 生长发育观察 注射新型抑制化合物后,每天对其幼虫生长状况进行观察,记录幼虫死亡数、龄期,观察幼虫的蜕皮情况;待其成蛹,测量蛹重与蛹长,统计其化蛹天数、化蛹率、羽化率及死亡率。使用相机对蜕皮失败或畸形个体拍照记录,蛹在30 d后仍未孵化为成虫,则认为已死亡;羽化时如果成虫无法从蛹中脱出或没有正常展开翅则被认为是畸形。使用Adobe Photoshop 2020对图片进行处理。
1.3.7 数据统计与分析 使用Microsoft Office Excel 2019软件进行数据整理与分析。以2% DMSO注射组为对照组,采用IBM SPSS Statistics 23软件中的独立样本T检验和单因素方差分析LSD法分析差异显著性,数值用平均值±标准误表示。使用GraphPad Prism 9软件绘图。
2 结果
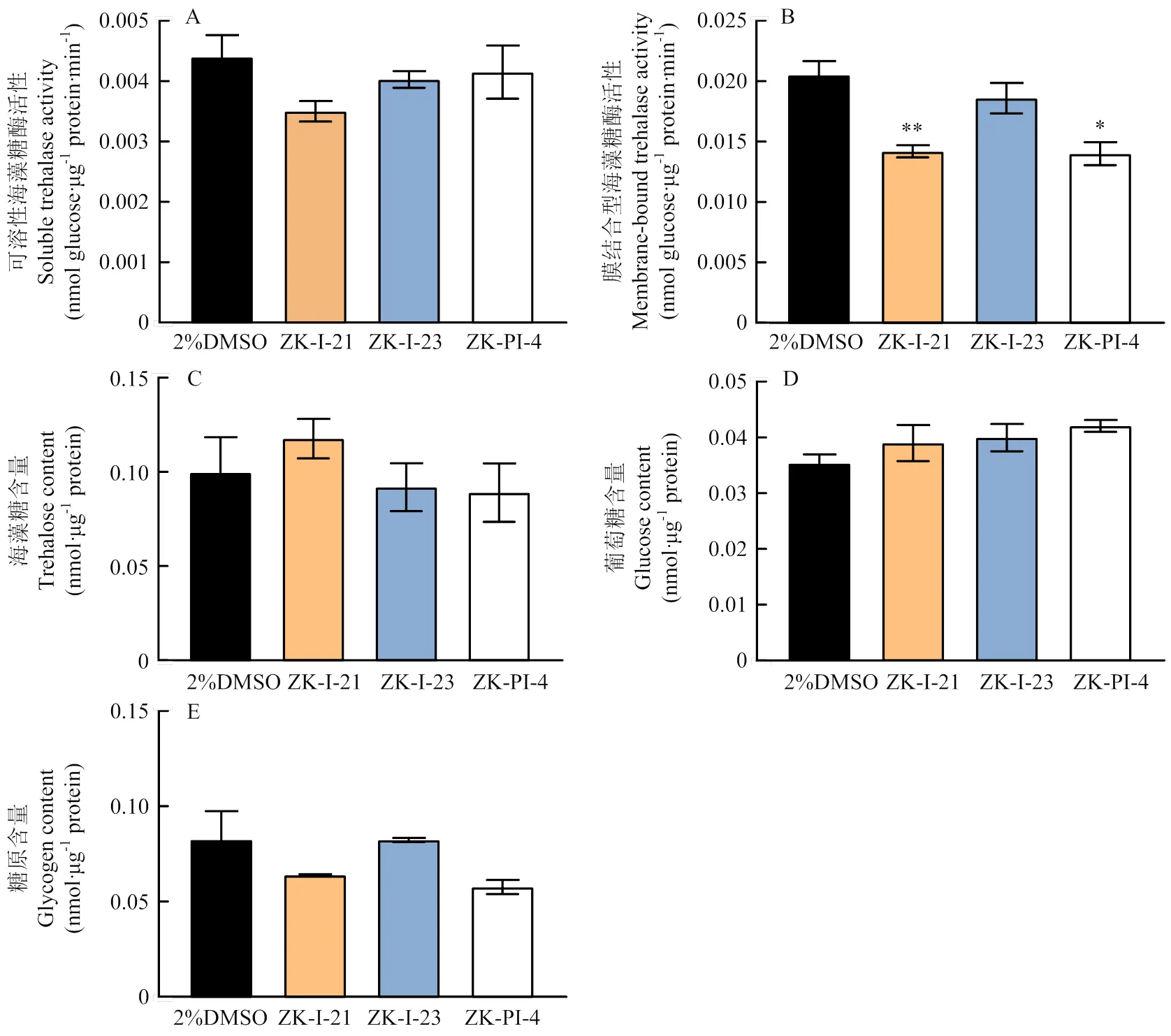
2.1 3种新型化合物处理后海藻糖酶活性变化
注射48 h后海藻糖酶活性测定结果显示,3种新
型化合物抑制可溶性海藻糖酶活性效果不明显,均与对照组无显著性差异(图1-A);ZK-I-21使膜结合型海藻糖酶活性极显著下降,ZK-PI-4使膜结合型海藻糖酶活性显著下降(图1-B);注射3种化合物后海藻糖、葡萄糖和糖原含量均无显著变化(图1-C、1-D、1-E)。
2.2 注射3种新型化合物后海藻糖与几丁质代谢通路关键基因表达量的变化
注射3种新型化合物48 h后相关基因表达量检测结果显示,ZK-I-21处理组中的mRNA表达量与对照组相比极显著升高,ZK-I-23处理组则极显著下降(图2-A);注射3种化合物后、的mRNA表达量与对照组相比,除ZK-I-23处理组中显著上升,其他均无显著变化(图2-B、2-C);化合物ZK-I-21和ZK-PI-4处理后的mRNA表达量极显著下降,ZK-I-23组极显著上升(图2-D)。
2.3 3种新型化合物处理后几丁质酶活性的变化
与对照组相比,注射ZK-I-21后几丁质酶活性极显著上升,注射ZK-I-23与ZK-PI-4后几丁质酶活性显著上升(图3)。
2.4 3种新型化合物处理后对草地贪夜蛾发育的影响
ZK-I-21处理组中6龄幼虫长度,ZK-I-23处理组中5龄幼虫与6龄幼虫长度与对照组相比均显著减小,其余各组幼虫长度同样变短,但与对照无显著差异(表3)。各组化合物注射草地贪夜蛾后显示发育有延迟或提前,但总体发育历期差异不大,其中注射ZK-I-21后6龄幼虫发育时间极显著延长,而预蛹时间极显著降低;注射3种化合物后4龄幼虫发育时间均极显著缩短(图4)。蛹重和蛹长测量结果显示,注射ZK-I-21后草地贪夜蛾蛹重和蛹长较对照组显著降低(图5)。
采用独立样本T检验进行数据分析,误差用平均值的标准误差表示。*代表差异显著(<0.05),**代表差异极显著(<0.01)。使用2% DMSO作为对照,下同
The independent sample T test was used for data analysis, and the error was represented by the standard error of the average.* indicated significant differences (<0.05), ** indicated extremely significant differences (<0.01).2% DMSO was used as control.The same as below
图1 注射不同新型化合物后草地贪夜蛾海藻糖酶活性及相关糖含量
Fig.1 Trehalase activity and sugar content inafter injection of different novel compounds
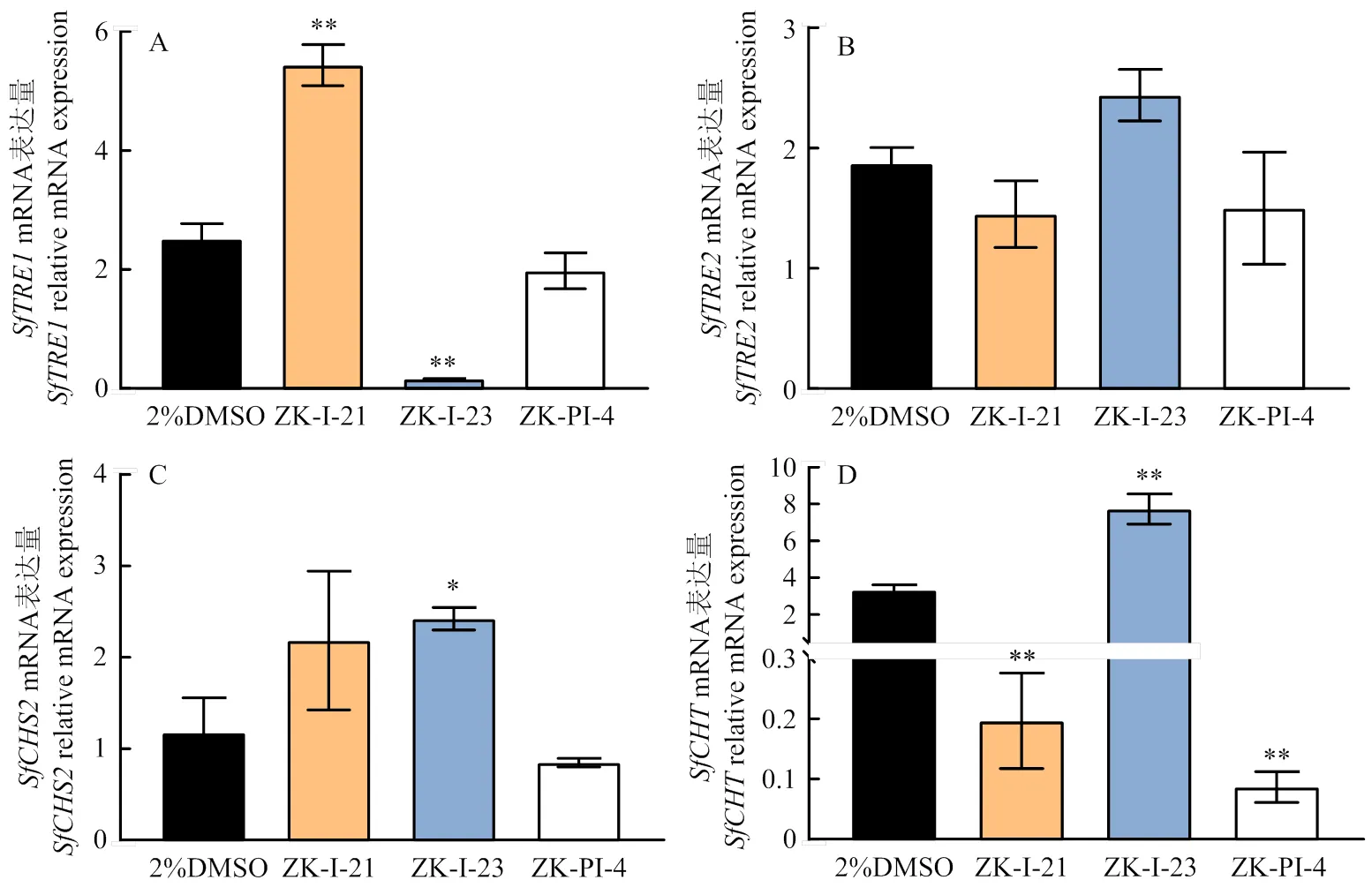
图2 注射不同新型化合物后草地贪夜蛾海藻糖与几丁质代谢通路关键基因mRNA表达量
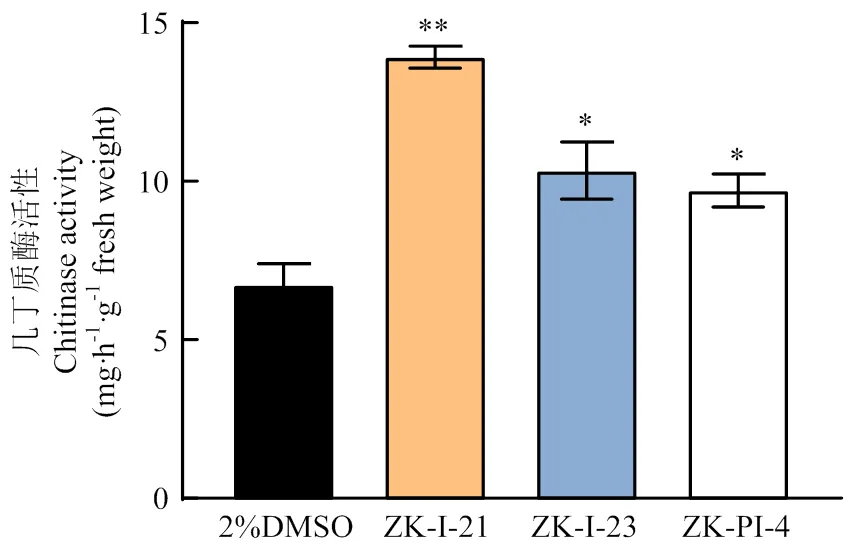
图3 注射不同新型化合物后草地贪夜蛾几丁质酶活性
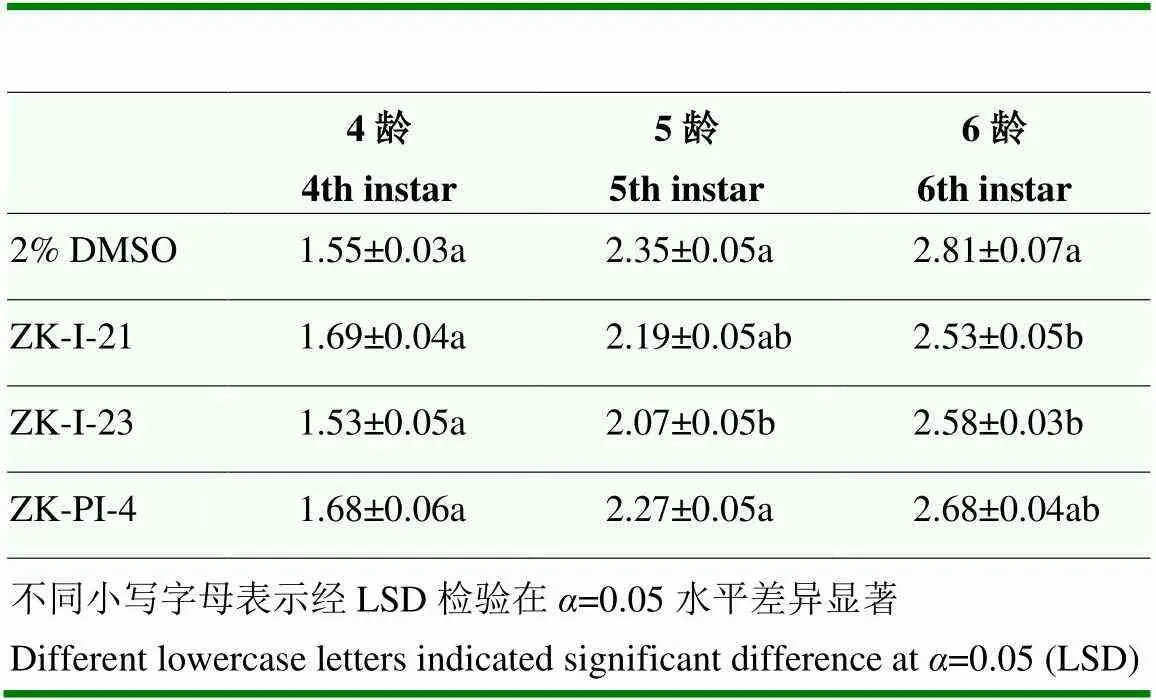
表3 注射不同新型化合物后草地贪夜蛾不同龄期的幼虫长度
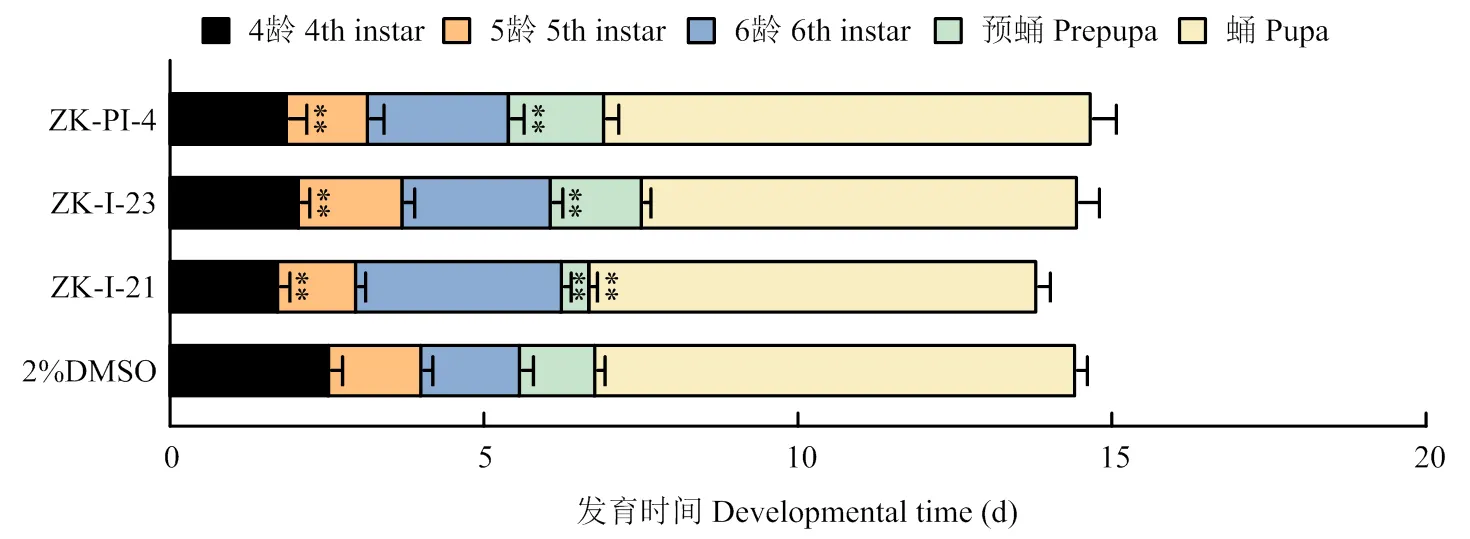
图4 注射新型化合物后草地贪夜蛾的发育历期
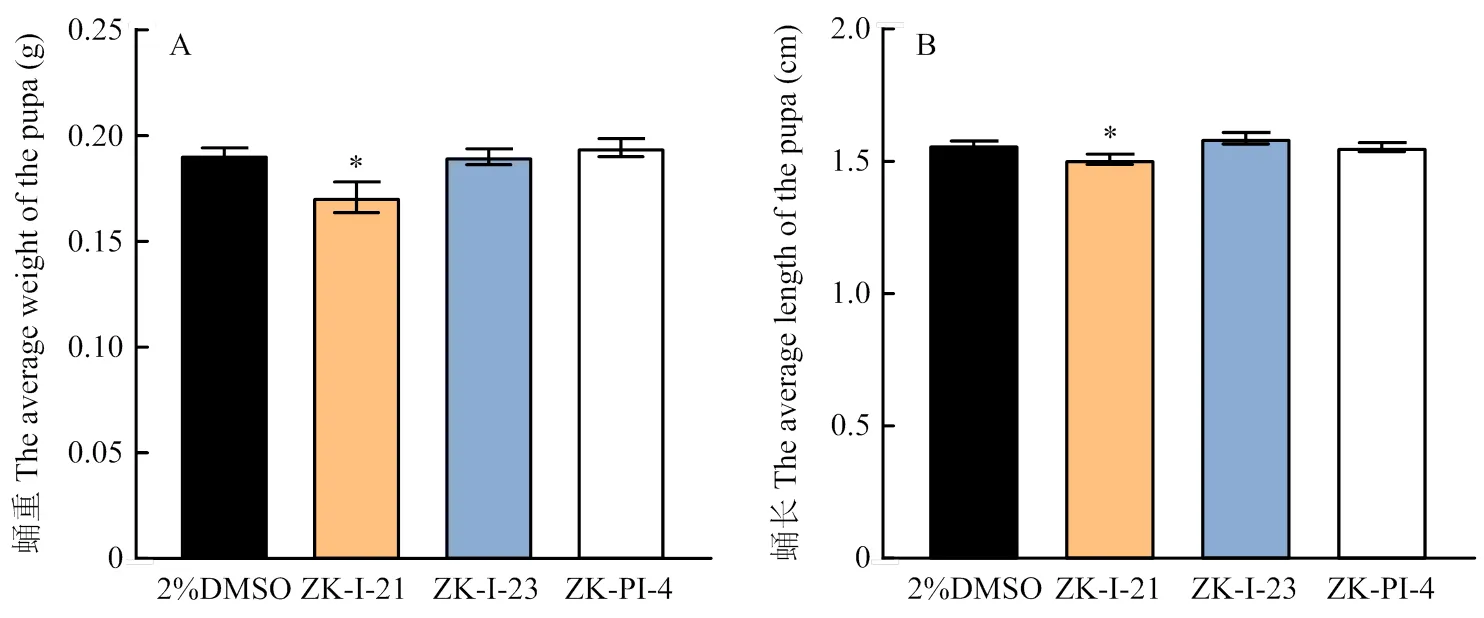
图5 注射不同新型化合物后草地贪夜蛾蛹重、蛹长
2.5 3种新型化合物处理后草地贪夜蛾的死亡率及畸形
注射3种化合物后,草地贪夜蛾的死亡率均有所增加,特别是注射ZK-I-21后3龄、4龄幼虫的死亡率极显著高于对照组(图6)。3种新型化合物均可致使草地贪夜蛾在发育过程中呈现类似的畸形状态,ZK-I-21致死效果最为明显,其中死亡幼虫表型包括黑化、蜕皮困难、干瘪,蛹的表型包括蜕皮失败、畸形化蛹,成虫的表型包括翅畸形、无法破蛹等(图7)。另外,注射ZK-PI-4可显著降低成虫的羽化率(图8)。
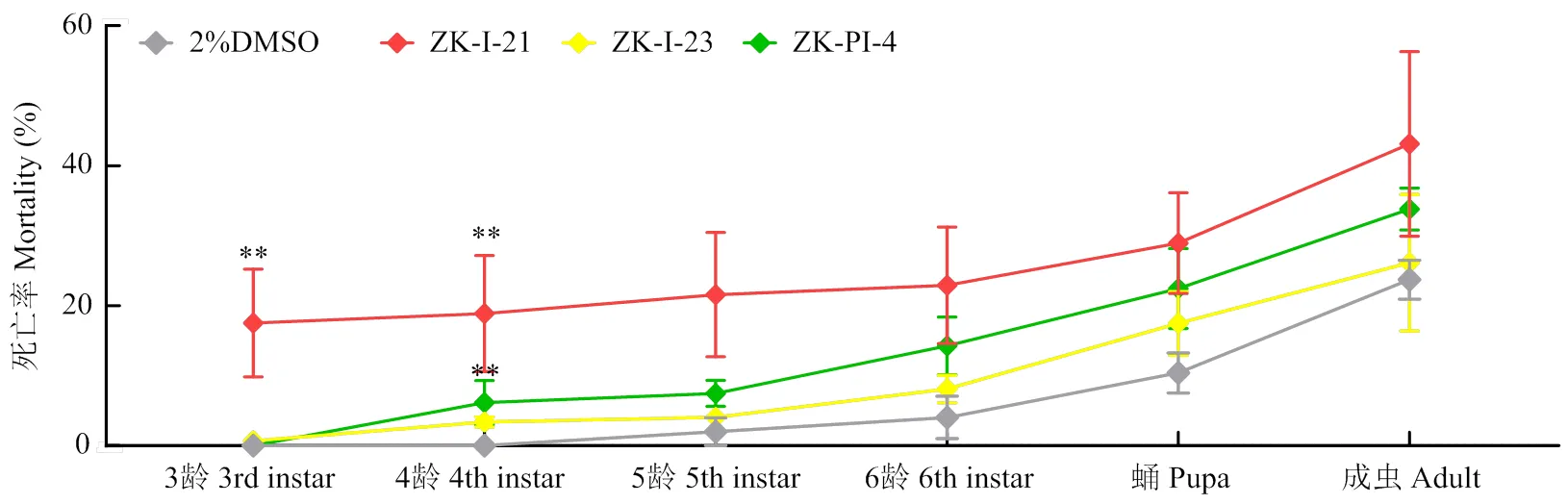
图6 注射不同新型化合物后草地贪夜蛾不同虫态死亡率

图7 不同新型化合物处理草地贪夜蛾后死亡表型发育变化
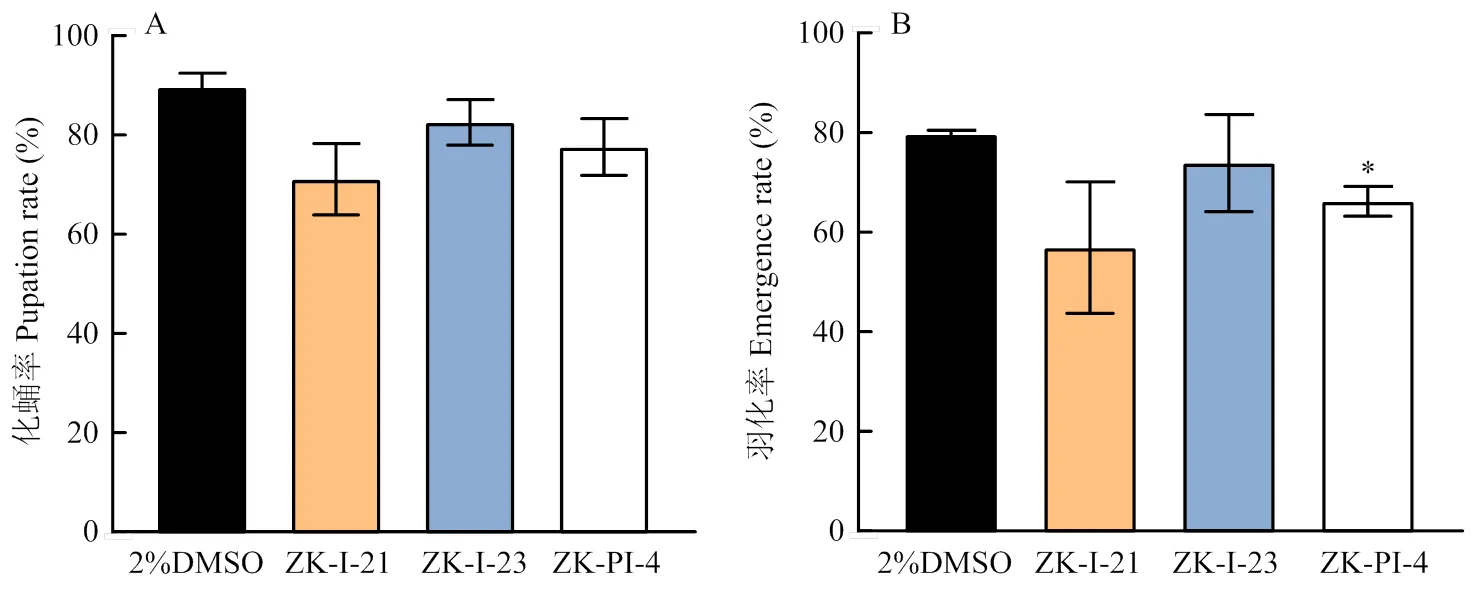
图8 不同新型化合物处理草地贪夜蛾后化蛹率和羽化率
3 讨论
3.1 抑制化合物影响草地贪夜蛾海藻糖代谢
海藻糖是昆虫的血糖[33],相关研究结果表明,海藻糖的合成和降解都能通过控制几丁质合成通路从而影响昆虫发育[34]。海藻糖酶是昆虫糖代谢与几丁质合成过程中必不可少的酶之一,其重要的代谢作用使其成为害虫防控的靶标。
杨萌萌[35]研究表明,向褐飞虱()体内注射井冈霉素后,可溶性海藻糖酶与膜结合型海藻糖酶活性均显著降低。本试验中,ZK-I-21和ZK-PI-4处理后虽然海藻糖含量与表达量均无显著变化,但可极显著或显著降低膜结合型海藻糖酶活性(图1-B),说明ZK-I-21与ZK-PI-4与膜结合型海藻糖酶的活性位点特异性结合,能够有效降低膜结合型海藻糖酶活性。井冈霉素能够诱导大豆根瘤、百脉根瘤[36]中海藻糖的累积,但其他糖类并未增加;Hirayama等将吡咯烷亚氨基糖(DAB-1)和DNJ添加到蓖麻蚕()幼虫的饲料中,观察到血淋巴海藻糖浓度显着增加[37],这些成熟的海藻糖酶抑制剂与海藻糖酶位点结合,抑制海藻糖酶活性,使海藻糖无法被分解,进而刺激海藻糖酶基因表达量升高。ZK-I-21注射后的mRNA表达量极显著高于对照组(图2-A),可溶性海藻糖酶活性虽有下降但差异不显著(图1-A),因此推测的高表达可能与可溶性海藻糖酶活性下降有关。ZK-I-23注射后的mRNA表达量极显著低于对照组(图2-A),与前人研究的结论:注射海藻糖酶抑制剂后,海藻糖酶抑制剂能够有效抑制海藻糖酶基因的表达[28-29]相符,但可溶性海藻糖酶活性并无显著变化,因此推断,ZK-I-23有望成为一种靶向抑制表达的基因抑制化合物。
3.2 抑制化合物影响草地贪夜蛾几丁质代谢
几丁质是昆虫外骨骼和围食膜的主要成分,其合成、转化和修饰与昆虫的生长发育联系紧密[6,11,38]。几丁质酶是昆虫体内几丁质代谢过程关键酶,多数几丁质酶是内切酶,可将昆虫表皮分解为壳寡糖,再由少数外切酶进行水解生成-N-乙酰葡萄糖胺,在昆虫蜕皮过程中起关键作用[16],是昆虫生长调节剂的一个重要靶标[38-41],其活性变化将直接影响几丁质的代谢过程。由于几丁质不存在于植物和脊椎动物中,因此干扰其代谢被认为是新型杀虫剂的合适目标[41]。
ZK-I-21与ZK-PI-4具有良好的抑制膜结合型海藻糖活性的能力,同时,ZK-I-21与ZK-PI-4注射组表达量均极显著下降,但表达量无明显变化(图2-C),这与前人研究:采用RNAi方法抑制褐飞虱任何一个的表达后,和在48 h的表达均显著下降[42];向褐飞虱虫体注射井冈霉素,48 h后6个几丁质酶(、、、、和)基因的表达均减少[28]相符。HUANG等研究发现,ZK-PI-4的结构类似物鬼臼毒素类化合物具有中等的杀虫活性,可能会导致几丁质酶活性异常,进而使中毒的黏虫()表现生长发育异常[43],由此证明ZK-PI-4与ZK-I-21可以通过竞争海藻糖酶结合位点,影响海藻糖酶活性,进而导致几丁质酶基因表达量下降,从而紊乱几丁质代谢通路,几丁质代谢平衡被打破,草地贪夜蛾生理活动无法正常进行进而蜕皮失败导致死亡。海藻糖代谢通路相关基因表达被抑制可导致昆虫体内几丁质代谢的紊乱[42,44-45],ZK-I-23极显著抑制的表达,导致的mRNA表达量、几丁质酶活性显著升高(图2-A、2-C、图3),表明ZK-I-23可以对草地贪夜蛾体内的几丁质代谢产生影响,但对表达量与几丁质酶活性并无抑制作用。
3.3 抑制化合物影响草地贪夜蛾生长发育
几丁质代谢的异常往往会引起昆虫几丁质含量的变化,进而影响昆虫正常的发育和形态构造,导致生长发育受阻,蜕皮、化蛹困难以致死亡。ZK-I-21组的草地贪夜蛾死亡率在3龄、4龄幼虫中较其他组高(图6),并且在死亡表型中(图7)表现出显著的致死效果,但致死效果与成熟的海藻糖酶抑制剂仍有差距,表型观察可发现未死亡的草地贪夜蛾会表现出翅短小、迁飞能力差等情况,因此推测ZK-I-21可导致草地贪夜蛾的飞行能力变差,若在野外,其取食、躲避天敌、繁殖后代等能力均会受到一定影响。此外,ZK-I-21组的蛹长显著短于对照组且蛹重显著轻于对照组(图5),说明ZK-I-21对草地贪夜蛾幼虫生长发育及蛹的形成影响较大。ZHAO等研究表明,的表达被抑制后,昆虫的几丁质合成会被严重阻碍,导致其蜕皮困难,不能完成正常的生长发育而死亡[34,46]。本试验在表型观察中发现,幼虫期草地贪夜蛾的死亡大部分是由于蜕皮困难所引起的,可能正是ZK-I-21竞争海藻糖酶活性位点进而紊乱草地贪夜蛾几丁质合成过程的结果;另外,在6龄到成蛹期间一部分草地贪夜蛾由于无法成功化蛹而死亡,蛹期无法羽化造成成虫畸形甚至死亡,可能是由于虫体内的能量代谢不足无法支持草地贪夜蛾完成化蛹,即ZK-I-21影响草地贪夜蛾化蛹及羽化过程的海藻糖与几丁质代谢。ZK-PI-4导致成虫羽化率显著下降(图8-B),研究表明,当海藻糖基因被干扰后,甜菜夜蛾()会出现化蛹畸形、展翅受阻[46];向褐飞虱注射海藻糖酶抑制剂井冈霉素后,出现了蜕皮困难、翅型异常等现象[47],这说明ZK-PI-4能够通过调控海藻糖代谢途径进而调节昆虫蜕皮过程中的几丁质代谢。ZK-I-23处理导致5龄和6龄草地贪夜蛾幼虫长度显著变短(表3),可能也是由于ZK-I-23通过影响海藻糖酶活性进而影响了几丁质代谢过程。
4 结论
ZK-I-21是膜结合型海藻糖酶的竞争抑制化合物,对草地贪夜蛾幼虫的生长发育尤其是死亡率、蛹长和蛹重有一定影响;ZK-I-23可抑制可溶性海藻糖酶基因的表达,对晚龄的幼虫体长影响较大;ZK-PI-4是膜结合型海藻糖酶的竞争抑制化合物,对成虫的羽化率有一定影响。研究结果可为新型海藻糖酶抑制剂的开发提供理论依据。
[1] Todd E L, Poole R W.Keys and illustrations for the armyworm moths of the noctuid genusGuenée from the Western hemisphere.Annals of the Entomological Society of America,1980, 73(6): 722-738.
[2] 姜玉英, 刘杰, 谢茂昌, 李亚红, 杨俊杰, 张曼丽, 邱坤.2019年我国草地贪夜蛾扩散为害规律观测.植物保护, 2019, 45(6): 10-19.
JIANG Y Y, LIU J, XIE M C, LI Y H, YANG J J, ZHANG M L, QIU K.Observation on law of diffusion damage ofin China in 2019.Plant Protection, 2019, 45(6): 10-19.(in Chinese)
[3] 孙晓飞.草地贪夜蛾的形态特征与防治方法.现代农业, 2019(12): 46-47.
SUN X F.Morphological characteristics and control methods of.Modern Agriculture, 2019(12): 46-47.(in Chinese)
[4] MONTEZANO D G, SPECHT A, SOSA-GÓMEZ D R, Roque- Specht V F, Sousa-Silva J C, Paula-Moraes S V, Peterson J A, Hunt T E.Host plants of(Lepidoptera: Noctuidae) in the Americas.African Entomology, 2018, 26(2): 286-300.
[5] 张智, 林培炯, 陈智勇, 巴吐西, 姜玉英, 穆常青, 郭书臣, 王绍林, 卢润刚, 祁俊锋, 张云慧.小麦中后期草地贪夜蛾为害特征观察.植物保护, 2021, 47(5): 297-301.
ZHANG Z, LIN P J, CHEN Z Y, BATUXI, JIANG Y Y, MU C Q, GUO S C, WANG S L, LU R G, QI J F, ZHANG Y H.Observation on the damage characteristics ofto wheat in middle and late stages.Plant Protection, 2021, 47(5): 297-301.(in Chinese)
[6] 张建珍.昆虫几丁质代谢与植物保护.中国农业科学, 2014, 47(7): 1301-1302.
ZHANG J Z.Insect chitin metabolism and plant protection.Scientia Agricultura Sinica, 2014, 47(7): 1301-1302.(in Chinese)
[7] ZHONG H Y, WEI C, ZHANG Y L.Gross morphology and ultrastructure of salivary glands of the mute cicadaDistant (Hemiptera: Cicadoidea).Micron, 2013, 45: 83-91.
[8] ZHU K Y, MERZENDORFER H, ZHANG W, ZHANG J, MUTHUKRISHNAN S.Biosynthesis, turnover, and functions of chitin in insects.Annual Review of Entomology, 2016, 61: 177-196.
[9] 唐斌, 魏苹,陈洁, 王世贵, 张文庆.昆虫海藻糖酶的基因特性及功能研究进展.昆虫学报, 2012, 55(11): 1315-1321.
TANG B, WEI P, CHEN J, WANG S G, ZHANG W Q.Progress in gene features and functions of insect trehalases.Acta Entomologica Sinica, 2012, 55(11): 1315-1321.(in Chinese)
[10] 刘晓健, 孙亚文, 崔淼, 马恩波, 张建珍.飞蝗海藻糖酶基因的分子特性及功能.中国农业科学, 2016, 49(22): 4375-4386.
LIU X J, SUN Y W, CUI M, MA E B, ZHANG J Z.Molecular characteristics and functional analysis of trehalase genes in.Scientia Agricultura Sinica, 2016, 49(22): 4375-4386.(in Chinese)
[11] 张文庆, 陈晓菲, 唐斌, 田宏刚, 陈洁, 姚琼.昆虫几丁质合成及其调控研究前沿.应用昆虫学报, 2011, 48(3): 475-479.
ZHANG W Q, CHEN X F, TANG B, TIAN H G, CHEN J, YAO Q.Insect chitin biosynthesis and its regulation.Chinese Journal of Applied Entomology, 2011, 48(3): 475-479.(in Chinese)
[12] KRAMER K J, DZIADIK-TURNER C, KOGA D.Chitin metabolism in insects//Comprehensive Insect Physiology Biochemistry Pharmacology, 1985, 3: 75-115.
[13] KRAMER K J, MUTHUKRISHNAN S.Chitin metabolism in insects//Comprehensive Molecular Insect Science, 2005, 4: 111-144.
[14] AVONCE N, MENDOZA-VARGAS A, MORETT E, ITURRIAGA G.Insights on the evolution of trehalose biosynthesis.BMC Evolutionary Biology, 2006, 6: 109.
[15] CHEN J, TANG B, CHEN H, YAO Q, HUANG X, CHEN J, ZHANG D, ZHANG W.Different functions of the insect soluble and membrane-bound trehalase genes in chitin biosynthesis revealed by RNA interference.PLoS One, 2010, 5(4): e10133.
[16] ARAKANE Y, MUTHUKRISHNAN S.Insect chitinase and chitinase-like proteins.Cellular and Molecular Life Sciences, 2010, 67(2): 201-216.
[17] 唐斌, 张露, 熊旭萍, 汪慧娟, 王世贵.海藻糖代谢及其调控昆虫几丁质合成研究进展.中国农业科学, 2018, 51(4): 697-707.
TANG B, ZHANG L, XIONG X P, WANG H J, WANG S G.Advances in trehalose metabolism and its regulation of insect chitin synthesis.Scientia Agricultura Sinica, 2018, 51(4): 697-707.(in Chinese)
[18] 范柯琴, 金利群, 郑裕国.海藻糖酶的酶学特性及其作为新农药靶标的开发应用.化学与生物工程, 2009, 26(4): 7-11.
FAN K Q, JIN L Q, ZHENG Y G.The enzymatic properties of trehalase and its exploitation as a target of new pesticides.Chemistry and Bioengineering, 2009, 26(4): 7-11.(in Chinese)
[19] WEGENER G, MACHO C, SCHLÖDER P, KAMP G, ANDO O.Long-term effects of the trehalase inhibitor trehazolin on trehalase activity in locust flight muscle.The Journal of Experimental Biology, 2010, 213(22): 3852-3857.
[20] 王军娥, 刘静.昆虫海藻糖酶的研究进展.贵州农业科学, 2009, 37(4): 88-90.
WANG J E, LIU J.Research progress of insect trehalase.Guizhou Agricultural Sciences, 2009, 37(4): 88-90.(in Chinese)
[21] IWASA T, HIGASHIDE E, YAMAMOTO H, Shibata M.Studies on validamycins, new antibiotics.II.Production and biological properties of validamycins A and B.The Journal of Antibiotics,1971, 24(2): 107-113.
[22] NIWA T, INOUYE S, TSURUOKA T, KOAZE Y, NIIDA T.“Nojirimycin” as a potent inhibitor of glucosidase.Agricultural and Biological Chemistry,1970, 34: 966-968.
[23] MATASSINI C, PARMEGGIANI C, CARDONA F.New frontiers on human safe insecticides and fungicides: An opinion on trehalase inhibitors.Molecules, 2020, 25(13): 3013.
[24] 张婧瑜, 韩清, 蒋志洋, 李慧琳, 邓鸣飞, 朱凯, 李明君, 段红霞.几丁质酶抑制剂及噻唑烷酮类化合物合成与农用活性研究进展.农药学学报, 2021, 23(3): 421-437.
ZHANG J Y, HAN Q, JIANG Z Y, LI H L, DENG M F, ZHU K, LI M J, DUAN H X.Chitinase inhibitors and synthesis and agricultural bioactivity of thiazolidinones: a review.Chinese Journal of Pesticide Science, 2021, 23(3): 421-437.(in Chinese)
[25] SAGUEZ J, VINCENT C, GIORDANENGO P.Chitinase inhibitors and chitin mimetics for crop protection.Pest Technology, 2008, 2(2): 81-86.
[26] GAYAKHE V, KAPDI A R, BOROZDINA Y, SCHULZKE C.Crystal structure of 5-(dibenzo-furan-4-yl)-2′-deoxy-uridine.Acta Crystallographica Section E.Crystallographic Communications, 2017, 73(10): 1493-1496.
[27] MIKKELSEN N E, MUNCH-PETERSEN B, EKLUND H.Structural studies of nucleoside analog and feedback inhibitor binding tomultisubstrate deoxyribonucleoside kinase.The FEBS Journal, 2008, 275(9): 2151-2160.
[28] TANG B, YANG M, SHEN Q, XU Y, WANG H, WANG S.Suppressing the activity of trehalase with validamycin disrupts the trehalose and chitin biosynthesis pathways in the rice brown planthopper,.Pesticide Biochemistry and Physiology, 2017, 137: 81-90.
[29] YANG M, ZHAO L,SHEN Q, XIE G, WANG S, TANG B.Knockdown of two trehalose-6-phosphate synthases severely affects chitin metabolism gene expression in the brown planthopper.Pest Management Science, 2017, 73(1): 206-216.
[30] Gurusamy D, Mogilicherla K, Shukla J N, Palli S R.Lipids help double-stranded RNA in endosomal escape and improve RNA interference in the fall armyworm,.Archives of Insect Biochemistry and Physiology, 2020, 104(4): e21678.
[31] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod.Methods, 2001, 25(4): 402-408.
[32] 汪慧娟.褐飞虱糖原合成酶与糖原磷酸化酶基因特性、功能鉴定与调控分析[D].杭州: 杭州师范大学, 2018.
WANG H J.Genetic characteristics, functional identification and regulation analysis of glycogen synthase andglycogen phosphorylase in[D]. Hangzhou: Hangzhou Normal University, 2018.(in Chinese)
[33] 于彩虹, 卢丹, 林荣华, 王晓军, 姜辉, 赵飞.海藻糖——昆虫的血糖.昆虫知识, 2008, 45(5): 832-837.
YU C H, LU D, LIN R H, WANG X J, JIANG H, ZHAO F.Trehalose—the blood sugar in insects.Chinese Bulletin of Entomology, 2008, 45(5): 832-837.(in Chinese)
[34] ZHAO L N, YANG M M, SHEN Q D, LIU X J, SHI Z K, WANG S G, TANG B.Functional characterization of three trehalase genes regulating the chitin metabolism pathway in rice brown planthopper using RNA interference.Scientific Reports, 2016, 6: 27841.
[35] 杨萌萌.海藻糖酶及其抑制剂(validamycin)对褐飞虱海藻糖和几丁质代谢的调控研究[D].杭州: 杭州师范大学, 2016.
YANG M M.Regulating effects of trehalase and its inhibitor (validamycin) on the trehalose and chitin metabolism in[D].Hangzhou: Hangzhou Normal University, 2016.(in Chinese)
[36] LÓPEZ M, HERRERA-CERVERA J A, IRIBARNE C, TEJERA N A, LLUC YANG H C.Growth and nitrogen fixation inandunder NaCl stress: nodule carbon metabolism.Journal of Plant Physiology, 2008, 165(6): 641-650.
[37] HIRAYAMA C, KONNO K, WASANO N, NAKAMURA M.Differential effects of sugar-mimic alkaloids in mulberry latex on sugar metabolism and disaccharidases ofand domesticated silkworms: Enzymatic adaptation ofto mulberry defense.Insect Biochemistry and Molecular Biology,2007, 37(12): 1348-1358.
[38] MERZENDORFER H, ZIMOCH L.Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases.The Journal of Experimental Biology, 2003, 206(24): 4393-4412.
[39] 李瑶, 范晓军.昆虫几丁质酶及其在害虫防治中的应用.应用昆虫学报, 2011, 48(5): 1489-1494.
LI Y, FAN X J.Insect chitinase and its application in insect pest control.Chinese Journal of Applied Entomology, 2011, 48(5): 1489-1494.(in Chinese)
[40] 马龙, 戴武, 张春妮.氟铃脲对棉铃虫的毒力及几丁质和几丁质酶的影响.西北农林科技大学学报(自然科学版), 2014, 42(7): 141-147.
MA L, DAI W, ZHANG C N.Toxicity of hexaflumuron and its effects on chitin and chitinase of cotton bollworm,.Journal of Northwest A&F University (Natural Science Edition), 2014, 42(7): 141-147.(in Chinese)
[41] SAGUEZ J, DUBOIS F, VINCENT C, LABERCHE J C, SANGWAN- NORREEL B S, GIORDANENGO P.Differential aphicidal effects of chitinase inhibitors on the polyphagous homopteran(Sulzer).Pest Management Science, 2006, 62(12): 1150-1154.
[42] 张露, 朱世城, 郑好, 沈祺达, 王世贵, 唐斌.褐飞虱海藻糖酶基因在表皮几丁质代谢中的调控作用.中国农业科学, 2017, 50(6): 1047-1056.
ZHANG L, ZHU S C, ZHENG H, SHEN Q D, WANG S G, TANG B.Regulatory function of trehalase genes on chitin metabolism in the cuticle of.Scientia Agricultura Sinica, 2017, 50(6): 1047-1056.(in Chinese)
[43] HUANG J, XU M, LI S, HE J, XU H.Synthesis of some ester derivatives of 4’-demethoxyepipodophyllotoxin/2’-chloro-4’- demethoxyepipodophyllotoxin as insecticidal agents against oriental armyworm,Walker.Bioorganic and Medicinal Chemistry Letters, 2017, 27(3): 511-517.
[44] 於卫东, 潘碧莹, 邱玲玉, 黄镇, 周泰, 叶林, 唐斌, 王世贵.两个褐飞虱海藻糖转运蛋白基因的结构及调控海藻糖代谢功能.中国农业科学, 2020, 53(23): 4802-4812.
YU W D, PAN B Y, QIU L Y, HUANG Z, ZHOU T, YE L, TANG B, WANG S G.The structure characteristics and biological functions on regulating trehalose metabolism of twoin.Scientia Agricultura Sinica, 2020, 53(23): 4802-4812.(in Chinese)
[45] 张道伟, 康奎, 余亚娅, 匡富萍, 潘碧莹, 陈静, 唐斌.白背飞虱酚氧化酶原基因特性及其免疫应答.中国农业科学, 2020, 53(15): 3108-3119.
ZHANG D W, KANG K, Yu Y Y, KUANG F P, PAN B Y, CHEN J, TANG B.Characteristics and immune response of prophenoloxidase genes in.Scientia Agricultura Sinica, 2020, 53(15): 3108-3119.(in Chinese)
[46] CHEN X F, TIAN H G, ZOU L Z, TANG B, HU J, ZHANG W Q.Disruption oflarval development by silencing chitin synthase gene A with RNA interference.Bulletin of Entomological Research, 2008, 98(6): 613-619.
[47] Chen J, Zhang D, Yao Q, Zhang J, Dong X, Tian H, Chen J, Zhang W.Feeding-based RNA interference of a trehalose phosphate synthase gene in the brown planthopper,s.Insect Molecular Biology, 2010, 19(6): 777-786.
Effect of Three Novel Compounds on trehalose and chitin metabolismand Development of
WANG SiTong1, CHEN Yan1, LUO YuJia1, YANG YuanYuan1, JIANG ZhiYang2, JIANG XinYi1, ZHONG Fan1, CHEN Hao1, XU HongXing3, WU Yan4, DUAN HongXia2*, TANG Bin1*
1College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 311121;2College of Science, China Agricultural University, Beijing 100193;3Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021;4Department of Biology and Engineering of Environment, Guiyang University, Guiyang 550005
【Objective】Chitin is the main component of insect exoskeleton and peritrophic membrane.Its synthesis begins with trehalase and ends with chitin synthase.The process of molting and epidermal remodeling needs to be completed by chitinase.In this study, three novel compounds were injected to detect the activities of trehalase and chitinase, the expression levels of related genes in, and their growth and development were also observed.This study aims to verify the inhibitory effects of novel compounds on trehalase and chitinase, screen the compounds with obvious effects, and to explore the mechanism of their regulation on the growth and development of.【Method】Microinjection method was used to inject butenolactone analogues ZK-I-21, ZK-I-23 and piperine analogue ZK-PI-4 into the 3rd instar larvae of.The changes of trehalase activity, chitinase activity and related sugar content were detected 48 h after injection, and the relative expression levels of,,andwere measured at the molecular level by quantitative real-time PCR (qRT-PCR).The phenotypic changes ofwere observed during the process from larvae to adults after injection.Besides, the mortality and deformities during developmental period were recorded.【Result】Compared with the control group, the membrane-bound trehalase activity ofdecreased significantly after ZK-I-21 (<0.01) and ZK-PI-4 (<0.05) injection.The expression level ofwas significantly increased andwas significantly decreased after ZK-I-21 injection.After ZK-I-23 injection, the expression level ofwas significantly decreased, and the expression level ofwas significantly increased.The expression level ofwas significantly decreased after ZK-PI-4 injection.The observation results of developmental duration showed that ZK-I-21 significantly prolonged the developmental period of 6th instar larvae of, and at the same time, the pupa weight became lighter and the pupa length became shorter.In addition, ZK-I-23 significantly shortened the length of 5th and 6th instar larvae, and ZK-PI-4 caused a significant reduction in adult emergence rate.All the three inhibitors could disrupt trehalose metabolism ofand then disrupt chitin metabolism, resulting in difficulties in molting and even death.【Conclusion】ZK-I-21 and ZK-PI-4 are membrane-bound trehalase inhibitor compounds, and ZK-I-23 can inhibit the expression of soluble trehalase gene.The three compounds all lead to the disturbances of chitin metabolism by affecting the process of trehalose metabolism, which results in difficulties in molting, deformities, and impaired growth and development of insects.The above results can provide a theoretical basis for the future use of novel inhibitors to regulate the growth of pests and thus control them, and support to promote the development of green and efficient pesticides.
; trehalase; chitinase; qRT-PCR; inhibitor
2021-11-14;
2021-12-30
国家重点研发计划(2017YFD0200504)、浙江省三农六方项目(2020SNLF-17)、浙江省重点研发计划(2020C02003)、国家自然科学基金(31371996)、贵阳市人才培养项目(筑科合同[2021]43-16号)
王思彤,E-mail:wst20010225@163.com。通信作者唐斌,E-mail:tbzm611@163.com。通信作者段红霞,E-mail:hxduan@cau.edu.cn
(责任编辑 岳梅)

