梨果实品质的研究进展与潜在技术应用展望
施露 高庆超 李亚辉 梁颖 张志勇
摘要:梨是温带地区生产最广泛、经济价值最高的水果之一。近年来,围绕梨果实品质的研究取得了较大进展。本文对梨果实品质的4个方面(香气、甜味、果皮色泽以及石细胞)分别进行系统梳理,然后从克隆与梨果实优质品质相关的基因,利用多组学联合分析方法解析梨品质形成的分子网络,改进遗传转化方法以及利用基因编辑技术创制梨优质果实新种质4个方面对利用现有技术在未来培育高品质梨果实上的研究提出建议,以期为优质梨品种选育和创制提供参考。
关键词:梨;香气;甜味;果皮色泽;石细胞;组学;基因编辑
中图分类号:S661.2文献标识码:A文章编号:1000-4440(2022)02-0567-10
Research progress and prospects of potential technology application in pear fruit quality
SHI Lu GAO Qing-chao LI Ya-hui LIANG Ying ZHANG Zhi-yong
Abstract:Pear is one of the most widely produced and economically valuable fruits in temperate regions. In recent years, much progress has been made in the research on the fruit quality of pears. In this paper, we reviewed four aspects of pear fruit quality (aroma, sweetness, skin color and stone cell), and discussed key research areas that would provide the scientific basis and the genetic tool for the cultivation of high-quality pears in the future. These included cloning genes involved in the formation of high-quality fruits, analyzing the network of genes involved in fruit quality using multi-omics analyses, improving genetic transformation methods, and applying gene-editing technology to create new germplasm for high-quality pears. This review will provide a reference for research on the breeding and creation of high-quality pear varieties.
Key words:pear;aroma;sweetness;skin color;stone cell;omics;gene editing
梨属于蔷薇科(Rosaceae)梨属(Pyrus L.)多年生果树,是世界上种植最广泛的果树之一。按照植物起源,梨属可分为东方梨和西方梨两大类,中国是东方梨的起源中心[1]。梨的栽培历史悠久,人类从两千多年前就开始从事梨的栽培。在中国,梨的栽培历史已有1 300年,主要的5个栽培种类包括砂梨(Pyrus pyrifolia)、新疆梨(Pyrus sinkiangensis)、白梨(Pyrus bretschneideri)、秋子梨(Pyrus ussuriensis)、西洋梨(Pyrus communis),廣泛应用于生产的栽培品种更是多达130余个,例如砀山酥梨、库尔勒香梨、鸭梨等[2]。
梨是全球主要的水果之一,在中国,梨是仅次于苹果和柑橘的第三大水果[2-3],2020年中国的梨产量达到1.78×107 t。梨因其独特的风味和较高的营养价值深受消费者喜欢[4]。然而与日本、韩国相比,中国梨果实的品质相对较差,存在风味偏淡,果肉较粗等问题,这些问题使中国梨果实在国内外市场上竞争力不足[5]。有数据显示,中国消费者对梨的选择趋于高端化,更加注重果实的品质[3]。因此,梨果实品质提升一直是梨产业发展的方向之一。
梨果实品质包括风味品质、外观品质、营养品质等,是内在遗传特性与外在环境因素共同作用的结果。本研究主要从梨果实内在的遗传特性着手,分别从香气、甜味、果皮色泽以及石细胞形成4个方面进行综述,然后结合梨产业当前遇到的发展瓶颈,从克隆与梨果实优质品质相关的基因、利用多组学联合分析方法解析梨品质形成的分子网络、改进遗传转化方法以及利用基因编辑技术创制梨优质果实新种质4个方面提出在高品质梨的研究中可借鉴的方法,为进一步改善梨果实品质提供参考。
1梨果实香气物质研究进展
梨果实生长发育经历了一系列的生理生化过程,同时伴随着其独特风味的形成。果实的香气是果实风味的重要方面,也是衡量果实品质的重要指标之一,影响消费者的选择。
1.1梨果实的香气物质
香气的形成是一个动态过程,香气是经过一系列的酶促反应产生的各种挥发性物质[6]。从1927年起,人们就开始研究梨果实的香气成分[7]。通过采用气相色谱、气相色谱-质谱联用等检测技术,科研工作者们陆续从不同梨品种中鉴定到芳香烃酯化合物和含硫化合物,达300多种[6]。这些芳香化合物香气值(香气成分的含量/香气阈值)大于1时,才会影响果实的香气。果实芳香化合物以酯类为主的属于“果香型”,以醛醇类为主的则属于“清香型”[8-9]。
不同品种梨的香气特点不同。西洋梨品种中,果实的香气成分主要有酯類、醇类和烷烃类[10],其中(2E,4Z)-癸二烯酸甲(乙)酯是西洋梨品种Bartlett的特征香气成分[11-12]。而在亚洲梨中,果实的香气物质成分主要为酯类和醛类[13]。己醛是库尔勒香梨、白梨以及砂梨中最主要的“清香型”香气物质[8,14],并且白梨品种主要的香气物质成分种类和己醛质量分数显著高于砂梨品种[14]。随着基因组学和代谢组学的发展,梨果实香气物质的生物合成以及对香气物质代谢的调控越来越受到关注。
1.2梨果实香气物质的合成
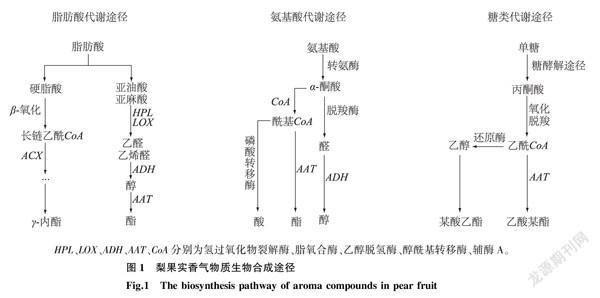
香气物质的生物合成途径根据参与生物合成反应的前体物质类型不同,主要可分为脂肪酸代谢途径、氨基酸代谢途径和糖类代谢途径[15]。
1.2.1脂肪酸代谢途径脂肪酸代谢途径是果实香气形成的重要途径,脂肪酸的减少会导致果实香气不佳[16]。如图1所示,β-氧化和脂氧合酶(LOX) 途径是脂肪酸代谢途径中最主要的2条分支。β-氧化是以饱和脂肪酸硬脂酸为底物,LOX途径以不饱和脂肪酸亚油酸和亚麻酸为底物,在一系列酶的催化作用下生成酯[17]。例如,氢过氧化物裂解酶(HPL)和LOX将不饱和脂肪酸裂解或氧化成醛类物质,醛继续在乙醇脱氢酶(ADH)作用下不断还原成醇,最后,醇通过醇酰基转移酶 (AAT)生成酯(图1)。其中脂氧合酶是LOX途径中第一步反应的关键酶,决定反应的进行[6],并且能将无挥发性的风味前体转化成具有特殊风味的物质。与绿色果实相比,成熟的果实中酶的活性更高,而亚油酸、亚麻酸的含量相对较低[16]。
1.2.2氨基酸代谢途径果实芳香化合物组成中的一些低碳数的醇、酯、醛等以氨基酸为前体物质合成。参与这个过程的氨基酸主要有亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸等,它们经过脱氨酶、脱羧酶、脱氢酶的作用生成醇或者酯(图1)。
ADH能够催化醛类及醇类之间的相互转化[18],在果实芳香物质形成中起重要作用[19]。Speirs等[20]发现ADH活性降低会导致果实的风味下降。通过将梨基因组与其他物种进行序列比对,Qin等[21]鉴定到了8个PbrADHs基因,并且进一步研究发现,在果实成熟过程中,ADH活性与ADH6基因转录呈正相关,总ADH活性与果实酯类的产生相关。Zeng等[22]从进化和ADH基因表达特性方面进一步揭示了3个ADH基因与果实中芳香物质的形成有关。
1.2.3糖类代谢途径果实中另一大类物质是糖类,包括单糖、双糖、糖醇等,也是果实香气物质合成的重要前体物质,影响着果实的风味[6]。
β-葡萄糖苷酶可以提高苹果和橙子果实中的挥发性物质含量[23-24]。Li等[19]在砀山酥梨生长的3个重要阶段进行iTRAQ蛋白表达谱分析,鉴定到3个差异表达的β-葡萄糖苷酶(Pbr042200.2、Pbr028992.1、Pbr020361.1),其中Pbr042200.2和Pbr020361.1活性在果实成熟期下降,在果实成熟阶段砀山酥梨香气的浓郁程度比欧洲梨低,表明β-葡萄糖苷酶与果实的香气形成有关。
参与梨果实香气物质形成的这些代谢途径依赖于酶的催化以及酶相关基因的表达。那么如何调控这些酶的活性在梨果实香气形成中的作用尤为重要。在果实冷藏过程中,茉莉酸甲酯预处理提高了梨果实香气物质形成代谢途径中重要酶(AAT、ADH、LOX)的活性和LOX途径中主要基因和转录因子的表达,从而增加了酯类和不饱和脂肪酸的浓度,减少梨在冷藏过程中风味物质的降低[25]。Luo等[26]发现甘氨酸甜菜碱的添加通过调控LOX途径促进酯类的合成,提高果实的抗氧化能力,从而有效增加冷藏过程中梨果实酯类香气物质含量。
2梨果实甜味物质研究进展
梨果实中的糖类,主要有蔗糖、果糖、葡萄糖、山梨醇等,它们的浓度和种类对果实成熟和商品性起到重要作用[27]。果实糖类不仅影响果实的甜度,还是有机酸、芳香化合物以及花色素等合成的基础原料,它的代谢贯穿果实生长发育到成熟的整个过程,因此了解梨果实糖的代谢过程及其运输对提高梨果实品质非常重要。
2.1梨果实中糖代谢
果实作为库器官,能够用于糖分代谢和储存。按照糖代谢产物可将糖代谢分为3类,分别为山梨醇代谢、蔗糖代谢以及己糖代谢。这些代谢途径中的关键酶,如山梨醇氧化酶(SOX)、 山梨醇脱氢酶(SDH)、山梨醇-6-磷酸脱氢酶(S6PDH)、蔗糖合成酶(SS)、转化酶(Ivr)、蔗糖磷酸合成酶(SPS)以及己糖激酶(HXK)等,在糖分积累中起到重要作用,直接影响果实糖代谢进程。
蔗糖代谢是糖代谢最主要的途径。蔗糖的积累是决定果实膨大和品质的重要因素之一,受其合成途径中酶活性和转录因子调控的影响。Moriguchi等[28]通过比较高蔗糖品种Chojuro和低蔗糖鸭梨品种果实成熟阶段酶活性的变化发现,在Chojuro果实成熟期SS和SPS活性高于低蔗糖鸭梨品种,并且SS和SPS活性与蔗糖积累量呈正相关。在对105份梨的糖图谱评估后,Lyu等[29]又进一步选择高蔗糖品种Hosui和低蔗糖品种Korla进行转录图谱分析,建立共表达网络,鉴定到7个与蔗糖生物合成相关的酶和转录因子,并且将预测的基因与梨果实蔗糖含量进行相关性分析,结果表明,这些预测的结构基因和转录因子在调控梨蔗糖积累中发挥重要作用。PuWRKY31转录因子启动子发生组蛋白甲基化,提高了蔗糖的积累[30]。
2.2梨果实光合产物的运输
梨的光合产物主要以山梨醇的形式运输[31],从韧皮部运输到细胞质中。SDH可催化山梨醇分解为果糖和葡萄糖,在维持果实高库强度、竞争碳水化合物、糖分转化等方面具有重要作用。Dai等[32]通过RNA-seq在砂梨品种中鉴定到14个PpySDH基因,并对其表达模式分析发现,PpySDH在梨小果期和接近成熟时表达量增加。
果实中的糖分由叶片光合作用产生,经长距离运输后卸载而来,并且糖分的卸载途径主要为质外体卸载途径[33]。卸载进入果实的糖一部分进入液泡,液泡是糖的主要储存场所,糖可通过转运蛋白到达液泡中。糖转运蛋白主要有3类,分别为蔗糖转运蛋白(SUT)、单糖转运蛋白以及SWEET转运蛋白[5]。
蔗糖转运蛋白主要是将蔗糖从质外体或者液泡运输到胞质。梨中的多个蔗糖转运蛋白已被发现和克隆[34]。借助砀山酥梨基因组数据库,李甲明[5]通过生物信息学手段发现18个PbSWEET糖转运蛋白,并且解析了其基因家族的结构。糖转运蛋白PuSWEET15和转录因子PuWRKY31在南果梨高糖芽变果实中表达量显著高于南果梨果实,李馨玥[35]进一步研究发现,PuWRKY31是通过结合PuSWEET15的启动子促进其表达的。
3梨果实色泽形成的调控
梨果皮按照色泽主要分为3种类型,即绿皮、褐皮和红皮[36]。在中国5大主栽梨品种中,秋子梨和白梨主要是绿皮,砂梨主要是绿皮和褐皮,西洋梨和新疆梨主要是绿皮和红皮[2]。梨果皮着色主要与植物色素[叶绿素、类胡萝卜素、酚类色素(花青素、黄酮等)]的含量和比例相关[37]。其中,果皮红色主要受花青素苷合成和降解的影响。
花青素苷是类黄酮代谢途径产生的次生代谢产物,它的合成受其结构基因、转录因子以及外界环境的调控。这三者相互影响共同调控花青素的合成。Zhai等[38]研究发现,转录因子PbMYB10b和PbMYB9分别通过激活二氢黄酮醇4-还原酶(DFR)和花青素合成酶(PbANS)的启动子的表达来调控花青素和原花青素合成途径,二氢黄酮醇4-还原酶(DFR)以及花青素合成酶(ANS)基因是花青素苷合成阶段主要的结构基因,决定花青素从无色到有色。研究发现,参与花青素苷合成调控的转录因子有MYB、bHLH、WDR、HD-zip等[39]。科研工作者以亚洲红梨为材料,克隆了PyMYB114和PyMYB10转录因子,发现它们参与花青素的合成,并且它们具有加成作用,在烟草和草莓中共表达这2个基因提高了花青素的生物合成[40-41]。转录因子MYB、bHLH和WD40可以形成MBW三元复合物,该复合物通过激活花青素生物合成途径的关键基因,从而促进花青素的合成与累积。Liu等[42]研究发现,转录因子PyPIF5在强光作用下表达量降低,减少了其与PymiR156a启动子中的G-box基序结合,使PymiR156a表达上调,降解其靶标PySPL,从而减少PySPL与PyMYB114和PyMYB10形成异二聚体,使MYB转录因子(PyMYB114、PyMYB10)更多地参与对花青苷合成途径结构基因的调控,最终促进了花青苷生物合成和积累。
红皮梨主要以西洋梨为主。张震等[43]以西洋梨品种为材料克隆了1个HD-ZipI家族基因PcHB12,研究结果表明,PcHB12作用在PyMYB10.1的启动子序列上,抑制其转录活性,从而减少了梨果实花青素苷的合成。部分西洋梨品种引种到中国栽培,出现了果皮红色在发育期消退的现象,从而降低了商品价值。Wang等[44]推测这可能与花青素苷的降解有关。而李俊才等[45]研究发现,果皮红色消退现象与花青素苷合成减少相关,他们从巴梨红色芽变品种红巴梨果皮中克隆了PcUFGT基因,该基因作为花青素苷合成过程中的结构基因,将糖基连接到不稳定的花青素上,形成稳定的花青素苷;研究还发现,PcUFGT在幼果果皮中大量表达,加速产生花青素苷,果实成熟期该基因表达下降,表明花青素苷合成减少。为进一步探明果皮褪色的原因,Wang等[46]以红星和红巴梨这2个西洋梨品种为材料,转录组测序分析它们不同发育时期基因的表达情况,筛选出61个与红巴梨果皮褪色相关的候选基因,包括花青素合成、降解、转运与调控。通常,西洋梨果实从发育阶段开始着色,褪色,直到成熟又开始着色,而亚洲红皮梨在接近果实成熟阶段才开始着色。这表明这2个品种的梨果皮着色的分子机制不同[41]。早酥红梨是从优质脆肉型梨品种早酥中鉴定到的一个红色芽变品种[38]。研究发现,PpBBX24基因编码区上的14个碱基缺失变异与早酥红梨的红色性状密切相关[47]。这些研究有助于解析梨果皮着色的调控机制,为梨果皮颜色育种和优质红梨的着色调控研究奠定基础。
褐色是砂梨品种果皮特有的颜色,主要有日本梨品种丰水、今村秋、长十郎等和中国梨品种黄花梨、三花、苍溪雪梨等[48]。部分研究者认为褐色果皮是梨果皮细胞发生木栓化,积累大量木栓质形成的[36,49]。木栓层中含有许多木质素,木质素的积累与梨果皮褐色的形成密切相关,并且已有许多文献报道木质素合成途径的相关基因参与梨褐色果皮性状的形成。果皮在转色阶段各种物质合成代谢旺盛,例如苯丙烷代谢、脂质代谢等[50]。李浩男等[51]利用GC-MS和LC-MS技术对黄花梨及其芽变品种绿黄花成熟期的果皮代谢产物分析发现,代谢物的不同导致了两者果皮颜色的差异。
梨的褐色果皮性状由多个基因控制,科研工作者都试图探寻哪些基因控制梨的褐皮性状。多个研究组已经通过数量性状基因座(Quantitative trait locus,QTL)定位将调控褐色果皮性状的主效QTL定位在梨的8号染色体上。Jiang等[52]进一步在定位区间找到PpC3H23基因,通过瞬時过表达该基因发现,PpC3H23基因提高了果皮褐化的速率,由此推测,PpC3H23基因可能在梨果皮褐化中起重要作用。并且该课题组利用转录组测序比较褐色果皮梨品种早生新水和绿色果皮梨品种秋水发现403个差异表达基因,这些基因包含转录因子基因(MYB、HD、BHLH)和功能基因,涉及脂肪酸、木栓质、角质等生物合成途径。该研究从分子层面解析了梨果皮褐化的机制,为高品质梨品种的培育提供指导。
4梨石细胞形成的调控
石细胞是梨果实组织特有的一类厚壁组织细胞,含有丰富的木质素和纤维素[53]。大量研究结果表明,石细胞的大小、数量以及密度等各种特性都与梨果实食用品质和加工品质密切相关[54]。果实中石细胞团较大,密度较高,则果肉较粗,反之果肉较细腻;石细胞还影响梨果实的糖、酸、维生素C的含量以及果实的耐贮性[53]。如何减少梨果实石细胞含量,是改善梨果实品质的重要方面。
近年来,科研工作者在石细胞的形成调控方面取得了较大进展。Xue等[55]研发出一种能简便快捷地评估石细胞的工具,该工具基于计算机图像识别技术,能快速评估石细胞的数量、大小、面积以及密度这4大性状,对395份梨种质材料的这些性状量化分析发现,不同梨品种间相差较大,并且这些性状与果实的口味相关,其中梨果实中的石细胞密度是影响梨果实口感最重要的因素。砀山酥梨在中国栽培较广,是主要的栽培品种,但其果肉较粗糙影响口感。Gong等[56]和Xu等[57]从砀山酥梨中克隆了类半胱氨酸蛋白酶基因(PbMC1a/1b)和咖啡酰莽草酸酯酶基因(PbCSE1),在拟南芥中分别过表达这2个基因发现,植株茎中木质素的积累增加,并且导管、木质纤维以及维管束间纤维细胞壁增厚,植株的生长受到抑制,同时提高了木质素生物合成相关基因的表达[56-57]。课题组进一步通过酵母双杂交(Yeast two-hybrid, Y2H)、双分子荧光互补(Bimolecular Fluorescent Complimentary, BiFC)以及GST融合蛋白沉降技术证明了PbMC1a/1b蛋白能与PbRD21互作,并且同时在梨果实和愈伤组织中瞬时表达这2个基因显著改变了木质素的含量,表明PbMC1a/1b可能与PbRD21互作提高木质素合成相关基因的表达,从而促进梨果实中石细胞的形成[56]。果实石细胞中木质素含量较高,达29.8%以上[58]。越来越多的研究发现,木质素合成相关基因与石细胞形成相关,例如PbCAD基因家族[59]。近期,Wang等[60]构建了梨果实石细胞eQTL图谱和木质素纤维素共表达网络,定位到一个重要调控因子PbrNSC,通过梨果实的瞬时转化和拟南芥的稳定转化验证,发现该调控因子通过激活PbrMYB169、Pbr4CL4和PbrLAC4基因的启动子,调控梨果实石细胞、木质素以及纤维素的形成。
5梨优质果实培育的潜在技术应用与展望
梨是典型的自交不亲和物种,同一品种相互授粉后不能正常结实,这使得梨的序列高度杂合[61],并且梨许多品质性状多由多基因控制,因此,运用传统杂交手段选育新品种周期较长、效率较低[62]。如何加快优质梨的选育来满足消费者多样化的需求是亟待解决的问题。以下就针对梨育种和基因功能研究中遇到的问题,探讨在梨优质果实培育上可应用的潜在技术,以期为梨果实品质的提高提供新的思路。
5.1克隆与梨果实优质品质相关的基因
梨的许多品质性状,如果实的含糖量、含酸量、果实大小等主要为受多基因控制的数量性状(QTL)[63]。随着分子标记技术的快速发展和梨高质量全基因图谱的构建,科研工作者发现了许多与梨果实品质相关的重要基因位点[61]。
韩明丽等[63]将果实性状差异较大的2个品种八月红梨和砀山酥梨杂交,构建他们F1杂合群体的分子遗传连锁图谱,并对后代群体的品质性状,包括单果质量、果实的纵横径、可溶性固形物等进行基因位点分析,共检测到21个基因位点,同时将控制果皮红色、果锈、萼片脱落、梨酸/低酸等性状的基因分别定位于不同的连锁群上[41,64]。通过对更多不同梨品种进行杂交,科研工作者陆续地构建出不同的分子遗传图谱,分别定位到控制梨果实蔗糖、果糖和葡萄糖等单一糖含量的基因位点[65],以及果皮红色性状[66]、单果质量、果心大小、果肉硬度、果实横纵径等性状的基因位点[67]。砂梨起源于中国西南地区,是中国目前种植面积最大的栽培种,并且砂梨的遗传多样性较为丰富。Zhang等[68]利用全基因组遗传变异解析了312份砂梨品种的重测序数据,并进一步对梨果实品质性状和物候期性状进行全基因组关联分析(GWAS),共獲得42个关联区间[68]。
梨的基因组测序已于2012年完成,第一个梨基因组测序品种为中国第一大栽培品种砀山酥梨,Zhang等[68]组装了长度达512.0 Mb的梨基因组[61]。梨基因组精细图谱的构建以及梨品种资源的遗传变异和果实相关性状的GWAS研究,都为定位和挖掘与梨果实品质相关的基因位点提供了基础。目前,控制梨果实大小的FWL5基因[69]、黄花梨及其芽变绿黄花梨HHT基因[70]、砀山酥梨褐色果皮芽变基因(PbXET)[71]、苹果梨果皮花青素苷合成基因(PyANS)[72]等与梨果实品质相关的基因被克隆。这方面的研究结果与技术手段为今后梨果实品质的遗传改良提供了基础,同时也为挖掘未知功能新基因提供了有效途径。
5.2利用多组学联合分析方法解析梨品质形成的分子网络
多种组学技术的出现可以更加全面地了解不同性状的调控网络。目前通过组学的手段挖掘重要性状的调控网络已经广泛运用于梨和其他物种中[56]。李甲明[5]通过对砀山酥梨果实发育初期、发育中期以及接近成熟期3个阶段蛋白质组学和转录组学关联分析共鉴定到35个与果实品质相关的差异表达蛋白质。利用基因组学的研究手段,张明月[73]基于已经测序的白梨基因组数据,挖掘了与果实品质和物候期相关的重要基因和调控因子。Zhu等[74]运用基因组、转录组和代谢组等组学方法对610份番茄材料进行多组学分析,构建了番茄多组学调控网络,涉及代谢物-遗传位点-基因三者之间的关系,其中包括371种代谢物质,970个遗传位点和535个基因。这些数据不仅加速了番茄风味相关候选基因的鉴定,而且有助于其代谢途径的解析。这也是首次利用多组学的手段解析作物在育种过程中代谢物的变化,为番茄品质的改良奠定了理论基础[74]。
这些多组学联合分析的方法,未来可以更多运用于梨果实品质的研究,破译与梨果实品质相关的“基因密码”,形成果实品质调控的分子网络,有助于提高我们从遗传和代谢等方面理解对梨果实品质的调控机制。
5.3改进遗传转化方法创制梨优质果实新种质
遗传转化可以通过定向引入外源基因有目的地改良作物品种,加快作物的育种进程[75]。目前,梨主要通过茎尖、叶片、子叶、花药等外植体进行组织培养,并采用农杆菌介导法将外源基因导入[76-81]。虽然梨的组织培养与遗传转化研究已有20多年,但仍然受到基因型的影响,能稳定转化和再生的基因型有限,而且利用农杆菌转化的方法需经过预培养、共培养、抗生素筛选、再生等阶段,各阶段都受到多种因素影响,再生体系转化效率较低[82],这些方面都制约了通过转基因和基因编辑手段定向改良梨品质以及相关功能基因的研究。因此,今后在梨组织培养和遗传转化方面可以从以下2个方面进行尝试:
5.3.1利用基因枪进行遗传转化基因枪可以将外源DNA分子直接导入细胞,并且与农杆菌介导法相比,可转化的品种和基因型范围更广[83]。目前基因枪转化的方法已经在多种作物(水稻、小麦、大豆等)中成功实现。Scorza等[84]将基因枪法和农杆菌介导的转化方法结合起来使用,葡萄的遗传转化率有所提升。梨的遗传转化也可以尝试将这2种方法联合起来使用,提高单独使用农杆菌介导法转化效率低的问题。
5.3.2挖掘和利用能提高梨组织培养再生能力和遗传转化效率的生长调控因子植物茎顶端分生组织形成和其再生能力保持的分子机制解析,对于改良遗传转化具有重要作用。目前研究者已经发现了一些生长调控因子与植物的遗传转化相关。Wuschel(Wus)是调控茎端分生组织的关键转录因子,能保持分生组织中心区域细胞的分裂能力[85];Baby boom(Bbm)是AP2/ERF家族的一个转录因子,与植物的分生组织发育有关[86]。Lowe等[87]发现过表达玉米的Bbm和Wus2基因可以将玉米的转化效率提高到25%~50%,并且在很难转化的玉米品种PHH5G中也能成功转化。Debernardi等[88]将生长调控转录因子GRF4与其辅助因子GIF1绑定在一起形成GRF4-GIF1复合蛋白体,研究发现,表达该复合蛋白体显著提高了小麦的再生能力,并且拓宽了可转化的基因型范围。GRF4-GIF1复合蛋白体不仅在单子叶植物遗传转化中起作用,还可以提高双子叶植物柑橘的再生效率。梨是双子叶植物,而且GRF和GIF蛋白在植物中具有高度保守性[88],因此可尝试将GRF4-GIF1复合蛋白体表达技术扩展应用于梨的遗传转化中。
5.4利用基因编辑技术创制梨优质果实新种质
基因编辑技术是生物领域的一项技术飞跃,科研工作者可以通过基因编辑技术精准定向改造作物。CRISPR/Cas9技术是基因编辑的一种,因其简单高效使得该技术快速发展[89-90],被应用于多种作物的性状改良上。与转基因相比,CRISPR/Cas9技术在对特定基因进行修饰后,可以通过杂交或者自交的方式分离掉外源基因,这为改良后的作物产业化应用提供了机遇。
CRISPR/Cas9技术在梨上已开始应用[91]。但是仅在第一代株系或者在梨的愈伤组织中Cas9的编辑效率较高。到了第二代株系,Charrier等[92]發现编辑过的梨植株大多数是以嵌合体形式存在,并且因为梨自交不亲和,不能通过自交的方式将嵌合体去除。为了克服CRISPR/Cas9技术在梨应用上的限制,Malabarba等[93]将编辑过的T0代植株再次进行不定芽的再生,可有效降低嵌合体产生。随着基因编码技术的发展,基于CRISPR/Cas9技术的单碱基编辑技术可以在基因组定点对单个碱基进行精准编辑,例如胞嘧啶碱基编辑技术(Cytosine base editor, CBE)、引导编辑技术(Prime editing, PE)[94]。2017年开始,科学家先后尝试将该技术应用在多种植物上,目前主要在大田作物上应用,例如水稻NRT1.1B和SLR1基因的编辑,分别提高了氮的利用率和降低了水稻植株高度[95]。该技术在梨上的应用才刚开始,Charrier等[92]通过单碱基编辑技术编辑ALS和PDS基因,成功获得了抗氯磺隆和白化的梨株系。未来该技术可以更多地应用于梨优异果实品质相关基因的研究上。
参考文献:
[1]曹玉芬,刘凤之,高源,等. 梨栽培品种SSR鉴定及遗传多样性[J]. 园艺学报, 2007,34(2):305-310.
[2]张绍铃,谢智华. 我国梨产业发展现状、趋势、存在问题与对策建议[J]. 果树学报, 2019, 36(8):1067-1072.
[3]王文辉,王国平,田路明,等. 新中国果树科学研究70年——梨[J]. 果树学报, 2019, 36(10):1273-1282.
[4]崔艳波. 梨(Pyrus)重要农艺性状遗传规律的研究[D]. 南京:南京农业大学, 2010.
[5]李甲明. 梨糖转运蛋白基因家族分析及PbtMT4和PbSWEET基因功能研究[D]. 南京:南京农业大学, 2017.
[6]张军,李靖靖. 梨果实香气物质的研究综述[J]. 中州大学学报,2020, 37(3):123-128.
[7]HARLEY C P,FISHER D F. The occurrence of acetaldehyde in Bartlett pears and its relation to pear scald and breakdown[J]. Journal of Agricultural Research, 1927, 35:983-993.
[8]李芳芳. 套袋对库尔勒香梨果实香气物质的影响及其生理机制[D]. 南京:南京农业大学, 2014.
[9]CHEN J Q, LYU J H, HE Z S, et al. Investigations into the production of volatile compounds in Korla fragrant pears (Pyrus sinkiangensis Yu). Food Chemistry, 2020, 302:1-6.
[10]CHEN Y Y,YIN H,WU X,et al. Comparative analysis of the volatile organic compounds in mature fruits of 12 Occidental pear (Pyrus communis L.) cultivars[J]. Scientia Horticulturae,2018, 240:239-248.
[11]JENNINGS W G, CREVELING R K. Volatile esters of Bartlett pear. II.a[J]. Journal of Food Science, 2010, 28(1):91-94.
[12]BIANCA W, MICHAEL G, PETER S. Characterization of the key aroma compounds in Bartlett pear brandies by means of the sensomics concept[J]. Journal of Agricultural and Food Chemistry, 2013, 61(40): 9583-9593.
[13]向思敏,劉园,王雪其,等. 基于HS-SPME-GC-MS方法的不同倍性库尔勒香梨果实风味相关代谢物质的变化[J].华中农业大学学报,2020, 39(1):153-160.
[14]田长平, 魏景利, 刘晓静, 等. 梨不同品种果实香气成分的GC-MS分析[J]. 果树学报, 2009, 26(3):294-299.
[15]ARAGEZ I,VALPUESTA FERNNDEZ V. Metabolic engineering of aroma components in fruits[J]. Biotechnology Journal,2013, 8(10):1144-1158.
[16]QIN G H, TAO S T, ZHANG H P, et al. Evolution of the aroma volatiles of pear fruits supplemented with fatty acid metabolic precursors[J]. Molecules, 2014, 19(12):20183-20196.
[17]王贵章,王贵禧,梁丽松,等. 桃果实芳香挥发物及其生物合成研究进展[J].食品科学,2014,35(17):278-284.
[18]DIXON J,HEWETT E W. Factors affecting apple aroma/flavour volatile concentration: a review[J]. New Zealand Journal of Crop and Horticultural Science,2000, 28(3):155-173.
[19]LI J M,HUANG X S,LI L T,et al. Proteome analysis of pear reveals key genes associated with fruit development and quality[J]. Planta, 2015, 241(6):1363-1379.
[20]SPEIRS J,CORRELL R,CAIN P. Relationship between ADH activity, ripeness and softness in six tomato cultivars[J]. Scientia Horticulturae, 2002, 93(2):137-142.
[21]QIN G H,QI X X,QI Y J,et al. Identification and expression patterns of alcohol dehydrogenase genes involving in ester volatile biosynthesis in pear fruit[J]. Journal of Integrative Agriculture, 2017, 16(8):1742-1750.
[22]ZENG W W,QIAO X,LI Q H,et al. Genome-wide identification and comparative analysis of the ADH gene family in Chinese white pear (Pyrus bretschneideri) and other rosaceae species[J]. Genomics,2020, 112(5):3484-3496.
[23]MORALES A,DUQUE C. Free and glycosidically bound volatiles in the mammee apple (Mammea americana) fruit[J]. European Food Research and Technology, 2002, 215:221-226.
[24]FAN G, XU Y X, ZHANG X M, et al. Characteristics of immobilised β-glucosidase and its effect on bound volatile compounds in orange juice[J]. International Journal of Food Science & Technology, 2011, 46(11):2312-2320.
[25]LUO M L, ZHOU X, HAO Y, et al. Methyl jasmonate pretreatment improves aroma quality of cold-stored ‘Nanguo’ pears by promoting ester biosynthesis[J]. Food Chemistry, 2020, 338:1-11.
[26]LUO M L,ZHOU X,SUN H J,et al. Glycine betaine treatment alleviates loss of aroma-related esters in cold-stored ‘Nanguo’ pears by regulating the lipoxygenase pathway[J]. Food Chemistry,2020, 316:1-10.
[27]ZHANG D Y, XU L, LIANG D, et al. Fast prediction of sugar content in Dangshan pear (Pyrus spp.) using hyperspectral imagery data[J]. Food Analytical Methods, 2018, 11(8):2336-2345.
[28]MORIGUCHI T,ABE K,SANADA T,et al. Levels and role of sucrose synthase, sucrose-phosphate synthase, and acid invertase in sucrose accumulation in fruit of asian pear[J]. Journal of the American Society for Horticultural Science,1992, 117:274-278.
[29]LYU J H,TAO X,YAO G F,et al. Transcriptome analysis of low- and high-sucrose pear cultivars identifies key regulators of sucrose biosynthesis in fruits[J]. Plant and Cell Physiology,2020, 61:1493-1506.
[30]LI X Y,GUO W,LI J C,et al. Histone acetylation at the promoter for the transcription factor PuWRKY31 affects sucrose accumulation in pear fruit[J]. Plant Physiology, 2020, 182(4):2035-2046.
[31]余彩云. 梨PbSOTs基因調控果实中糖分积累的初步研究[D]. 南京:南京农业大学, 2019.
[32]DAI N,COHEN S,PORTNOY V,et al. Metabolism of soluble sugars in developing melon fruit: a global transcriptional view of the metabolic transition to sucrose accumulation[J]. Plant Molecular Biology, 2011, 76(1/2):1-18.
[33]张虎平. 梨果实内糖的转运及积累特性研究[D]. 南京:南京农业大学, 2011.
[34]ZHANG H P,ZHANG S J,QIN G H,et al. Molecular cloning and expression analysis of a gene for sucrose transporter from pear (Pyrus bretschneideri Rehd.) fruit[J]. Plant Physiology and Biochemistry, 2013, 73:63-69.
[35]李馨玥. 南果梨及其高糖芽变果实中蔗糖积累差异的分子机制[D]. 沈阳:沈阳农业大学, 2020.
[36]王新卫. 黄花梨及其绿皮芽变果皮发育特性和差异表达基因的克隆与功能分析[D]. 南京:南京农业大学, 2012.
[37]LANCASTER J E, GRANT J E, LISTER C E, et al. Skin color in apples—influence of copigmentation and plastid pigments on shade and darkness of red color in five genotypes[J]. Journal of the American Society for Horticultural Science, 1994, 119(1):63-69.
[38]ZHAI R,WANG Z M,ZHANG S W,et al. Two MYB transcription factors regulate flavonoid biosynthesis in pear fruit (Pyrus bretschneideri Rehd.)[J]. Journal of Experimental Botany,2016,67(5):1275-1284.
[39]ALLAN A C,HELLENS R P,LAING W A. MYB transcription factors that colour our fruit[J]. Trends in Plant Science,2008,13(3):99-102.
[40]FENG S Q,WANG Y L,YANG S,et al. Anthocyanin biosynthesis in pears is regulated by a R2R3-MYB transcription factor PyMYB10[J]. Planta,2010,232(1):245-255.
[41]YAO G F,MING M L,ALLAN A C,et al. Map-based cloning of the pear gene MYB114 identifies an interaction with other transcription factors to coordinately regulate fruit anthocyanin biosynthesis[J]. The Plant Journal,2017,92(3):437-451.
[42]LIU H N, SHU Q, WANG K Y, et al. The PyPIF5-PymiR156a-PySPL9-PyMYB114/MYB10 module regulates light-induced anthocyanin biosynthesis in red pear[J]. Molecular Horticulture, 2021, 1:1-14.
[43]張震,李晨智宇,张雅,等. 西洋梨PcHB12基因抑制果实花青苷的合成[J]. 园艺学报,2021, 48(3):456-464.
[44]WANG Z G, DONG M, WANG A, et al. The methylation of the PcMYB10 promoter is associated with green-skinned sport in Max Red Bartlett pear[J]. Plant Physiology, 2013, 162(2):885-896.
[45]李俊才,李天忠,王志刚,等. 红巴梨果皮UFGT基因的克隆及表达分析[J]. 西北植物学报, 2010, 30(1):30-34.
[46]WANG Z G, DU H, ZHAI R, et al. Transcriptome analysis reveals candidate genes related to color fading of ‘Red Bartlett’ (Pyrus communis L.) [J]. Frontiers in Plant Science, 2017, 8:1-15.
[47]OU C Q,ZHANG X L,WANG F,et al. A 14 nucleotide deletion mutation in the coding region of the PpBBX24 gene is associated with the red skin of ‘Zaosu Red’ pear (Pyrus pyrifolia White Pear Group):a deletion in the PpBBX24 gene is associated with the red skin of pear[J]. Horticulture Research, 2020, 7(1):1-14.
[48]刘月,杨健,王龙,等. 木质素合成途径及其调控梨褐皮性状研究进展[J]. 果树学报, 2018, 35(S1):17-25.
[49]滕元文,沈玉英,周先章. 砂梨果皮锈斑成因及解决对策[J]. 中国南方果树, 2005 (3):52-54,56.
[50]周贺. 黄花梨转色关键期转录组研究及相关基因表达分析[D]. 南京:南京农业大学, 2016.
[51]李浩男,王宏,贾晓东,等. 黄花及其芽变绿黄花梨成熟期果皮代谢物鉴定与比较分析[J]. 果树学报, 2015, 32(6):1118-1127.
[52]JIANG S, LUO J, WANG X Q, et al. QTL mapping and transcriptome analysis to identify genes associated with green/russet peel in Pyrus pyrifolia[J]. Scientia Horticulturae, 2021, 293:1-12.
[53]陶书田. 梨(Pyrus)果实石细胞的结构成分分析及相关酶基因的克隆[D]. 南京:南京农业大学, 2009.
[54]乔勇进,张绍铃,陶书田,等. 梨果实石细胞发育机理的研究进展[J]. 果树学报, 2005, 22(4):367-371.
[55]XUE Y S,XU S Z,XUE C,et al. Pearprocess: a new phenotypic tool for stone cell trait evaluation in pear fruit[J]. Journal of Integrative Agriculture, 2020, 19(6):1625-1634.
[56]GONG X, XIE Z H, QI K J, et al. PbMC1a/1b regulates lignification during stone cell development in pear (Pyrus bretschneideri) fruit[J]. Horticulture Research, 2020, 7(1):1-13.
[57]XU J H, TAO X Y, XIE Z H, et al. PbCSE1 promotes lignification during stone cell development in pear (Pyrus bretschneideri) fruit[J]. Scientific Reports, 2021, 11:1-10.
[58]TAO S T, KHANIZADEH S, ZHANG H, et al. Anatomy, ultrastructure and lignin distribution of stone cells in two Pyrus species[J]. Plant Science, 2009, 176(3):413-419.
[59]QI K J,SONG X F,YUAN Y Z,et al. CAD genes: genome-wide identification, evolution, and their contribution to lignin biosynthesis in pear (Pyrus bretschneideri) [J]. Plants, 2021, 10(7):1-13.
[60]WANG R Z, XUE Y S, FAN J, et al. A systems genetics approach reveals PbrNSC as a regulator of lignin and cellulose biosynthesis in stone cells of pear fruit[J]. Genome Biology, 2021, 22(1):1-23.
[61]WU J, WANG Z W, SHI Z B, et al. The genome of the pear (Pyrus bretschneideri Rehd.)[J]. Genome Research, 2013, 23(2):396-408.
[62]張绍铃,钱铭,殷豪,等. 中国育成的梨品种(系)系谱分析[J]. 园艺学报, 2018, 45(12):2291-2307.
[63]韩明丽,刘永立,郑小艳,等. 梨遗传连锁图谱的构建及部分果实性状QTL的定位[J]. 果树学报,2010, 27(4):496-503.
[64]刘金义,崔海荣,王龙,等. 梨果实酸/低酸性状的SSR分析[J]. 果树学报,2011, 28(3):389-393.
[65]NISHIO S,SAITO T,TERAKAMI S,et al. Identification of QTLs associated with conversion of sucrose to hexose in mature fruit of Japanese pear[J]. Plant Molecular Biology Reporter,2018, 36(4):643-652.
[66]NTLADI S M,HUMAN J P,BESTER C,et al. Quantitative trait loci (QTL) mapping of blush skin and flowering time in a European pear (Pyrus communis) progeny of ‘Flamingo’ × ‘Abate Fetel’[J]. Tree Genetics and Genomes, 2018, 14(5):1-24.
[67]赵亚楠. 梨高密度遗传连锁图谱构建及果实品质性状的基因定位[D]. 北京:中国农业科学院, 2019.
[68]ZHANG M Y,XUE C,HU H,et al. Genome-wide association studies provide insights into the genetic determination of fruit traits of pear[J]. Nature Communications,2021,12(1):1-10.
[69]张艳. 梨FWLs基因VIGS沉默载体构建及功能验证[D]. 新疆:新疆农业大学, 2021.
[70]吕照清,任丹丹,周贺,等. 黄花梨及其芽变绿黄花梨HHT基因克隆与表达分析[J]. 西北植物学报, 2016, 36(6):1105-1109.
[71]程召阳,孙虹丽,衡伟,等. 砀山酥梨及其褐色果皮芽变PbXET基因克隆与表达分析[J]. 西北植物学报,2014, 34(12):2388-2393.
[72]王雪,曲柏宏,鹿艳新,等. 苹果梨果皮花色素苷合成相关基因PyANS的克隆与表达分析[J]. 北方园艺,2016 (5):108-112.
[73]张明月. 基于基因组学的梨群体遗传变异研究[D]. 南京:南京农业大学, 2017.
[74]ZHU G T,WANG S C,HUANG Z J,et al. Rewiring of the fruit metabolome in tomato breeding[J]. Cell, 2018,172(1/2):249-261.
[75]冉昆,王宏伟,王少敏. 梨组织培养与遗传转化研究进展[J]. 中国农学通报, 2017, 33(4):74-79.
[76]MATSUDA N,GAO M,ISUZUGAWA K,et al. Development of an agrobacterium-mediated transformation method for pear (Pyrus communis L.) with leaf-section and axillary shoot-meristem explants[J]. Plant Cell Report, 2005, 24:45-51.
[77]LANE W D. Regeneration of pear plants from shoot meristem-tips[J]. Plant Science Letters,1979, 16(2/3):337-342.
[78]FEDERICO M,BUSCONI M,FOGHER C,et al. Development of an efficient regeneration protocol for pear rootstock Pyrodwarf and assessment of SSR variability in regenerating shoots[J]. Caryologia,2009, 62(1):62-68.
[79]MOURGUES F,CHEVREAU E,LAMBERT C,et al. Efficient agrobacterium-mediated transformation and recovery of transgenic plants from pear (Pyrus communis L.)[J]. Plant Cell Reports,1996, 16(3):245-249.
[80]REED B M,DENOMA J,WADA S,et al. Micropropagation of pear (Pyrus sp.) [M]. Totowa:Humana Press, 2012.
[81]徐凌飛. 梨离体再生和遗传转化的研究[D]. 杨凌:西北农林科技大学, 2005.
[82]闫帅,徐锴,袁继存,等. 梨组织培养及遗传转化研究进展[J]. 中国果树,2017(S1):72-77.
[83]KLEIN T M,WOLF E D,WU R,et al. High-velocity microprojectiles for delivering nucleic acids into living cells[J]. Nature, 1987, 327(6117):70-73.
[84]SCORZA R,CORDTS J M,GRAY D J,et al. Producing transgenic ‘thompson seedless’ grape (Vitis vinifera L.) plants[J]. Journal of the American Society for Horticultural Science, 1996, 121(4):616-619.
[85]LAUX T,MAYER K F,BERGER J,et al. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis[J]. Development,1996, 122(1):87-96.
[86]BOUTILIER K,OFFRINGA R,SHARMA V K,et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth[J]. The Plant Cell,2002, 14(8):1737-1749.
[87]LOWE K,WU E,WANG N,et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation[J]. The Plant Cell,2016, 28(9):1998-2015.
[88]DEBERNARDI J M,TRICOLI D M,ERCOLI M F,et al. A GRF-GIF chimeric protein improves the regeneration efficiency of transgenic plants[J]. Nature Biotechnology, 2020, 38(11):1274-1279.
[89]张二豪,张杰. CRISPR/Cas9基因编辑技术应用于绿僵菌[J]. 江苏农业科学,2021,49(11):48-53.
[90]朱丽珍,王芳,王娅丽,等.基因编辑技术及CRISPR/Cas系统在草地植物开发中的应用[J]. 江苏农业科学,2021,49(20):22-30.
[91]杨锋,杨钦淞,高雨豪,等. 梨愈伤组织双靶点CRISPR/Cas9基因编辑系统的建立[J]. 园艺学报, 2021, 48(5):873-882.
[92]CHARRIER A,VERGNE E,DOUSSET N,et al. Efficient targeted mutagenesis in apple and first time edition of pear using the CRISPR-Cas9 system[J]. Frontiers in Plant Science,2019, 10:1-12.
[93]MALABARBA J,CHEVREAU E,DOUSSET N,et al. New strategies to overcome present CRISPR/Cas9 limitations in apple and pear: efficient dechimerization and base editing[J]. International Journal of Molecular Sciences, 2020, 22(1):1-19.
[94]李国斌,艾国,韦静,等. 碱基编辑技术及其在作物遗传改良中的应用综述[J]. 园艺学报,2021, 48 (4):719-732.
[95]LU Y,ZHU J K. Precise editing of a target base in the rice genome using a modified CRISPR/Cas9 system[J]. Molecular Plant,2017, 10 (3):523-525.
(责任编辑:陈海霞)
收稿日期:2021-11-10
基金项目:江苏省农业科技自主创新基金项目[CX(20)3002]
作者简介:施露(1991-),女,浙江安吉人,博士,助理研究员,研究方向为农产品品质调控。(E-mail) lus202010@163.com
通讯作者:梁颖,( E-mail)lyjaas@163.com;张志勇,(E-mail)yzuzzy@163.com

