稻虾共养病虾肠道细菌群落变化与病原细菌分离及药物敏感性
石晓媛 王麒 方明棵 王莹 杨亚珍 朱建强







摘要:病害是影响稻虾共养农民经济收入的重要因素。为明确稻虾共养发病塘口中致病菌的种类及其防治方法,以健康虾和病虾为研究材料,运用Illumina MiSeq全基因组测序技术,对健康虾和病虾肠道内细菌的群落组成进行测定和分析,预估出病原菌的种类。在此基础上,使用选择性培养基对病虾肠道内疑似病原菌进行分离。将分离所获疑似病原菌注射至健康虾体肠道内,并观察虾体死亡情况,最终确定所选病原菌菌株。通过显微观察、16S rDNA序列分析,最终确定该病原菌的分类地位。最后利用药敏性试验,筛选出对该病原菌有抑制效果的抗生素和中草药种类。试验结果表明,健康虾与病原虾肠道内的细菌群落结构具有显著性差异。在门水平上,健康虾肠道内细菌主要是柔壁菌门,其相对丰度为74.23%;而病虾肠道内细菌主要是变形菌门,其相对丰度为67.39%;在属水平上,健康虾肠道内主要是柔膜菌属,其相对丰度为48.30%;病虾肠道内主要是非保密气单胞菌属,其相对丰度为13.50%。分离结果显示,所获8株细菌均为革兰氏阴性菌,在选择性培养基上均呈黄色。病原菌回接感染结果表明,1.5×108 CFU/mL注射后1 d内,致死率高达100%。分子学鉴定结果表明,该病原菌为哈夫尼菌属蜂房哈夫尼菌。该菌对所选的卡那霉素、诺氟沙星、氧氟沙星、环丙沙星、氯霉素这5种抗生素比较敏感;对黄芩、苦参、艾叶等3种中草药水提物比较敏感。本研究可为稻虾共养流行病的诊断及防治,以及小龙虾的健康养殖提供理论依据。
关键词:克氏原螯虾;病原微生物;分离鉴定;防治;药物敏感性;蜂房哈夫尼菌
中图分类号: S182;S945.1 文献标志码: A
文章编号:1002-1302(2022)08-0169-07
克氏原螯虾(Procambarus clarkii)俗称小龙虾,原产于北美洲,1929年传入我国,目前是我国主要经济虾类之一,在淡水甲壳动物养殖中位居第一[1]。由于长期的高密度养殖,以及养殖过程中使用大量的肥料和人工饲料,导致克氏原螯虾养殖环境日渐恶化,病害频繁发生,严重影响了小龙虾产业的健康发展和农户的经济收入[2]。
克氏原螯虾常见的病害有黑鳃病、烂尾病、纤毛虫病、出血病等[3]。目前报道的病原菌主要有嗜水气单胞菌(Aeromonas hydrophila)[4]、副溶血弧菌(Vibrio parahaemolyticus)[5] 、拟态弧菌(V. mimicus)[6]、螺原体(Spiroplasma)[7]、白斑综合症病毒(white spot syndrome virus)[8]、肺炎克雷伯菌(Klebsiella pneumoniae)[2]、原螯虾摩氏摩根菌(Morganella morganii)等[9]。虽然前人对克氏原螯虾病原菌做过较多的研究,但不同养殖地区的气候条件、养殖方式存在着差异,因而病原微生物种类应有典型性。
克氏原螯虾等甲壳类动物的肠道是储存食物、消化和吸收营养的重要器官。肠道内寄生着种类复杂、数量庞大的微生物类群。这些微生物对宿主的免疫、消化、吸收等多种生理活動起到了促进作用[10-11]。在健康条件下,肠道微生物类群之间处于平衡状态,但在病害发生时,肠道内微生物类群之间的平衡会被打破。因此,研究病害发生时,小龙虾肠道微生物的群落组成变化对小龙虾疾病的诊断和预防均具有重要意义。
本研究主要针对2020年湖北省荆州地区稻虾共养塘口中存在的病害现象进行研究,以期明确病害发生的原因,找到致病根源微生物,并寻找防治该病原菌的有效措施。该研究可为稻虾共养生产中病原菌的诊断及防治提供理论依据。
1 材料与方法
1.1 试验材料
病害和健康克氏原螯虾体均采自湖北省公安县沙场村稻虾塘口。连翘、大蒜、黄柏、黄芩、陈皮、甘草、苦参、野菊花、当归、紫苏、蒲公英、丁香、秦皮、夏枯草、鱼腥草、艾叶、石榴皮、虎杖等18味中草药购自荆州市弘卫大药房。抗生素药敏纸片购自杭州微生物试剂有限公司。细菌基因组提取试剂盒、PCR Master Mix购自生工生物工程(上海)有限公司。气单胞菌培养基配方:蛋白胨5.00 g/L,酵母粉3.00 g/L,L-赖氨酸盐酸盐3.50 g/L,L-精氨酸盐酸盐2.00 g/L,山梨醇3.00 g/L,肌醇2.50 g/L,乳糖1.50 g/L,木糖3.75 g/L,胆盐3.00 g/L,硫代硫酸钠10.67 g/L,氯化钠5.00 g/L,柠檬酸铁铵0.80 g/L,溴麝香草酚蓝0.04 g/L,麝香草酚蓝 0.04 g/L,琼脂12.50 g/L,气单胞菌培养基添加剂5.00 mL/L。
1.2 试验方法
1.2.1 虾体肠道DNA的提取与16S rDNA扩增
2020年5月16日,从湖北省公安县沙场村健康稻虾塘口和发病塘口中分别采集健康和发病克氏原螯虾(以下简称为健康虾、病虾)各30尾,用75%乙醇擦拭虾体表面,再用无菌生理盐水冲洗2~3次,取其肠道物。使用十六烷基三甲基溴化铵(CTAB)方法提取克氏原螯虾后肠总DNA,通过Nanodrop 2000和琼脂糖凝胶电泳检测其浓度和纯度。用无菌水将DNA稀释至1 ng/μL用于 16S rDNA的扩增。使用16S V3~V4区引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)进行扩增。PCR反应程序:94 ℃ 预变性5 min;94 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环。
1.2.2 高通量测序与数据分析
PCR产物经纯化后制备文库,测序使用IonS5TMXL测序平台,利用单端测序(single-end)的方法,构建小片段文库进行单端测序。通过对reads剪切过滤,将一致性(identity)大于97%的测序序列归为1个操作分类单元(operational taxonomic unit,OTU)进行聚类和物种分析。利用丰富度指数(Chao1指数、ACE指数)以及多样性指数(Simpson指数、Shannon指数)分析病虾和健康虾肠道内微生物群落的丰度和多样性。同时在门、纲、目、科、属5个分类水平上统计每个样品的物种群落结构和丰度,根据分析结果,预判疑似病原菌的种类。
1.2.3 疑似病原菌的分离与纯化
用无菌接种环挑取病虾肠道物1环,接种到疑似病原菌(气单胞菌)的选择性培养基上,于培养箱中36 ℃培养24 h后,从培养基上挑取单菌落,纯化2~3次后放入 4 ℃ 冰箱内保存备用。
1.2.4 回接感染試验确定病原菌株
将所有分离菌株分别接种1环至150 mL气单胞菌液体培养基中,培养3 d后,用无菌水将每1菌体的菌体浓度分别调至1.5×108、1.5×107、1.5×106、1.5×105、1.5×104 CFU/mL等5个浓度梯度。选取室内养殖活力较好、无明显外伤的健康克氏原螯虾150尾(每尾质量大约为12 g),随机平均分为5组,在每尾克氏原螯虾第2腹节处注射各浓度菌悬液100 μL,并以注射无菌生理盐水100 μL作为对照组,对照同样重复30尾。感染病原菌后的虾体继续饲养,记录感染之后 7 d 内各处理组虾体的临床症状和死亡率。
克氏原螯虾室内养殖条件:试验于2020年6—9月在长江大学生命科学学院实验楼内进行。小龙虾采用白色塑料盆养殖,盆内径长 125 cm、宽 75 cm、高37 cm。试验用水为当地稻虾共养塘口水,每箱水深10 cm。每天投喂饲料2次(08:00、19:00),投饵量为虾体质量的3.5%。5 d为1个周期进行换水,溶解氧控制在5.5~5.7 mg/mL范围内,室温保持在23~25 ℃,箱内放置水草及覆盖物。
1.2.5 病原菌菌株的革兰氏染色及分子鉴定
将致死率高的浓度梯度菌种接种于气单胞菌培养基上,于培养箱中36 ℃培养24 h,挑取单菌落的一小部分进行革兰氏染色。
按照细菌基因组DNA提取试剂盒说明方法提取革兰氏染色菌株的总DNA,以27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物进行PCR扩增,采用DNA纯化回收试剂盒纯化回收16S rDNA产物,然后交由生工生物工程(上海)股份有限公司进行测序,将所得16S rDNA序列在NCBI的GenBank和Blast中进行同源性比对分析,通过MEGA 7等软件,采用邻接法(neighbor-joining method)构建系统发育树[2]。
1.2.6 病原菌对抗生素药物的敏感性试验
采用纸片扩散法进行药物敏感性试验。每种药敏片直径为6 mm,将1环病原菌接种至100 mL液体培养基中,于培养箱中36 ℃培养24 h后,用移液枪吸取 100 μL 菌悬液至固体培养基上,并用无菌玻璃棒涂布均匀,然后将药敏纸片均匀放置于平板上,每个处理放置3个重复,于培养箱中36 ℃培养18 h后,用游标卡尺测定抑菌圈直径,参照杭州微生物试剂有限公司提供的判定标准判定该菌对不同种类抗生素药物的敏感性。
1.2.7 病原菌对中草药水提物的敏感性试验
分别称取每种中草药50 g,放入烧杯中,加入蒸馏水 1 000 mL,浸泡30 min,加热至沸腾以后保持微沸状态20 min,然后将其过滤至容器内,滤液浓度调至 1 g/mL。 药敏试验采用琼脂扩散法,将培养至对数生长期的菌悬液稀释至浓度为1×107 CFU/mL,用移液枪吸取100 μL菌悬液至固体培养基上,再用无菌刮铲将菌液涂抹均匀,然后用打孔器(直径为6 mm)在平板上均匀打3个孔,挑出孔内琼脂并用空白琼脂封底,做好标记。在每孔内加入100 μL药液,放入36 ℃培养箱中培养24 h,然后用游标卡尺测定抑菌圈直径。依据《中药药理学》中敏感性的判断标准,抑菌圈直径≥20 mm属于极敏,抑菌圈直径在15~19 mm之间为高敏,抑菌圈直径在10~14 mm 之间为中敏,抑菌圈直径<10 mm为低敏,没有抑菌圈为不敏,判定病原菌对各种中草药水提物的敏感性[12]。
2 结果与分析
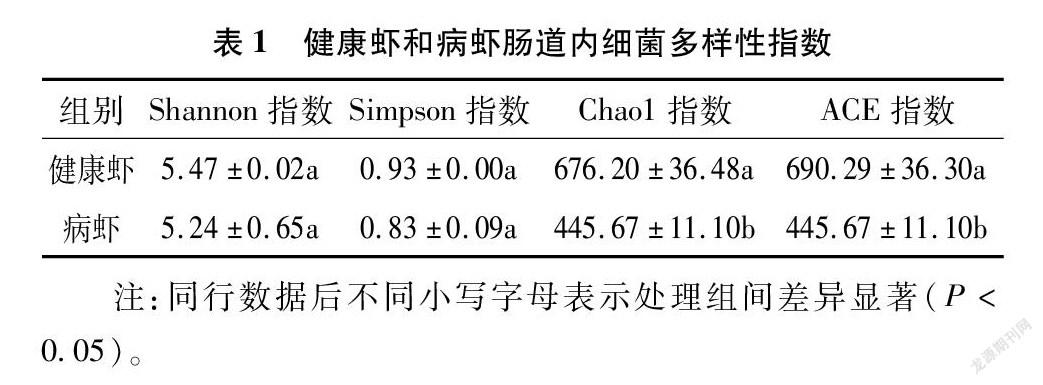
2.1 健康虾与病虾肠道内细菌多样性差异
Shannon指数和Simpson指数反映了微生物的多样性,而Chaol指数和ACE指数反映了微生物的丰富度。从表1可知,健康虾与病虾相比,Simpson和Shannon指数差异并不显著,但健康虾的Chaol和ACE指数显著高于病虾。
2.2 健康虾与病虾肠道内细菌群落结构差异
在门水平上,健康虾主要以柔壁菌门(Tenericutes)为主,相对丰度为74.23%;而病虾主要以变形菌门(Proteobacteria)为主,相对丰度为67.39%(图1)。在属水平上,如图2所示,柔膜菌纲的柔膜细菌(Unclassified Mollicutes)(48.3%)和RsaHF231(18.5%)为健康虾肠道内的优势菌群,二者相对丰度共占细菌类群的66.8%;而病虾肠道内这2种菌体含量仅占细菌总量的12.7%。但病虾中气单胞菌目的气单胞菌(Unclassified Aeromonadaceae)相对丰度较高,为13.5%,而在健康虾中,这种菌几乎没有,因此初步推断该菌为主要致病菌,并做进一步的分离。
2.3 疑似病原菌的分离
将病虾肠道物接种于气单胞菌选择培养基上,于培养箱中36 ℃培养24 h后,共获得8株菌体(编号为N1~N8)。如表2所示,这8株菌体菌落均呈现黄色、圆形、表面光滑、边缘平整、菌落突起的特征,革兰氏染色为阴性,因此推断这8株菌可能为同一菌种。
2.4 疑似病原菌的回接感染验证
由于所分离的8株疑似病原菌,菌落形态和革兰氏染色结果相同,因此选择N1菌株作为回接感染的出发菌株,以注射方式感染健康虾,注射后虾体出现不同程度的死亡,死亡率随菌液浓度的增大而增加。高浓度试验组(1.5×108 CFU/mL)在注射后1 d内,小龙虾发生急性死亡现象,死亡率高达100%。1.5×107 CFU/mL注射组在3 d内死亡率达到90%,随后的4 d未见虾体死亡。1.5×106 CFU/mL 注射组感染5 d后,死亡率达56.67%,而1.5×105 CFU/mL和1.5×104 CFU/mL注射组死亡率较低。各处理组的小龙虾发病症状均类似于分离前病虾症状,表现为虾体活力下降、摄食量降低、尾弹反应减弱、应激能力变差等。感染试验中注射生理盐水的对照组未出现发病和死亡情况(表3),表明分离的菌株N1为导致本次虾体发病和死亡的致病菌之一。
2.5 病原菌N1菌株的分类地位确定
利用Blast工具将N1菌株所得16S rDNA序列与 GenBank 数据库中已知微生物的 16S rDNA 序列进行同源性比对后发现,该菌株16S rDNA序列与Gen Bank中的部分序列有较高的相似性(100%)。系统发育分析结果显示菌株N1(以S00664X1表示)的16S rDNA基因与JX267126.1聚为同一分支,同源性为100%,根据江枫的研究可知,细菌的16S rDNA序列相似度大于98%,可将它们菌体认定为是相同的种[13],因此该菌株被认定为蜂房哈夫尼菌(图3)。
2.6 病原菌N1菌株对抗生素药物的敏感性试验结果
病原菌对所选11种抗菌药物敏感性试验结果表明,菌株N1对卡那霉素、诺氟沙星、氧氟沙星、环丙沙星等4种抗生素较为敏感,对氯霉素中介,对庆大霉素、新霉素、青霉素、四环素、多西环素、红霉素等6种药物耐药(表4)。
2.7 病原菌N1菌株对中药水提物的敏感性试验结果
琼脂扩散法试验结果表明,病原菌N1菌株对黄芩极度敏感,对苦参、艾叶高度敏感,对甘草中度敏感,对当归低敏,对其他13种中药水提液不敏感(表5)。
3 讨论与结论
克氏原螯虾因其营养丰富,商业价值高被广泛养殖。随着养殖面积和密度的增加导致克氏原螯虾疾病感染日益严重[14-15]。有关小龙虾致病菌的报道也越來越多,如副溶血弧菌、嗜水气单胞菌、拟态弧菌、弗氏柠檬酸杆菌、维氏气单胞菌[16]。本试验从病虾肠道中分离出的主要病原菌为蜂房哈夫尼菌。蜂房哈夫尼菌是一种常见的革兰氏阴性菌,该菌存在于蔬菜、植物以及哺乳动物的胃肠道环境中,可以直接引发感染或者在一些慢性病症的条件下引起疾病发生[17]。王霞研究发现,蜂房哈夫尼菌可以引起人的化脓性脑膜炎[18]。赵淑芳等报道,蜂房哈夫尼菌能感染棘胸蛙致其产生严重的腹泻和腹胀等肠道类疾病[19]。闫艳新等报道,蜂房哈夫尼菌能够引起人类泌尿系统和呼吸道的感染,甚至会引起败血症的发生[20]。蜂房哈夫尼菌还能引起锦鲫体表出现血点、肠道肿胀溃烂的症状,也会引起小白鼠身体抽搐、眼睛分泌黄色黏稠物,以及胃部胀气、肠部肿胀等一系列的症状[21]。本研究发现蜂房哈夫尼菌能够感染克氏原螯虾,引起其活力下降、摄食量降低、尾弹反应减弱、应激能力变差,进而发生死亡。
测序结果表明,健康虾与病虾相比 Simpson指数和Shannon指数差异并不显著;但健康虾的Chaol指数和ACE指数显著高于病虾。表明病虾和健康虾肠道内微生物类群相似度不高,差异明显。健康虾肠道细菌的优势类群是柔壁菌门,相对丰度为74.23%;病虾肠道细菌类群主要为变形菌门,相对丰度为67.39%,其中γ-变形菌纲气单胞菌和β-变形菌纲伯克霍尔德氏菌科非保密伯克霍尔德氏菌属为优势菌群,该研究结果与郁维娜等的研究结果[22]不尽相同。本研究发现,病虾和健康虾肠道内微生物多样性差异不明显,这与郁维娜等的研究结果[22]一致。但本研究发现病虾肠道内细菌类群主要为γ-变形菌纲和β-变形菌纲,而郁维娜等的研究认为,病虾中主要是γ-变形菌纲。分析原因认为,本研究材料为淡水小龙虾,而郁维娜等的研究对象为淡水凡纳滨对虾,凡纳滨对虾样品采自宁波市瞻岐椿霖对虾养殖场(29.53°N,121.5°E),另外养殖地区和养殖习惯与本研究中的也不尽相同。
施用抗菌药物是水产养殖中治疗细菌性疾病使用最多亦是最有效的方法,由于养殖户缺乏流行病的诊断和防治技术,导致抗菌药物种类使用不当,抗菌物质滥用等现象较为普遍,造成了水产养殖环境中病原菌产生多重耐药性,无法做到有针对性的科学用药。另外,药物会在水产动物体内发生残留影响人类的健康,破坏生态的平衡以及影响小龙虾的健康养殖[23]。而许多中草药中含有丰富的生物碱、皂荚、多糖、蒽醌类等免疫调节物质,可以强化机体能力抵御病原体[24]。它们不仅具有天然、无毒副、无残留等特点,还能补充机体营养,提高机体免疫力[25-26],起到抗菌、抗病的作用,达到药物性和营养性的兼并效果[27],因此用中草药来治疗细菌性疾病逐渐受到人们的重视,同时也鼓励采用抗生素中草药联合来抑制病原细菌的发生[28-29]。本试验结果表明,该菌对黄芩、苦参、艾叶等中草药比较敏感。另外,该菌对不同种类的抗菌药物耐受性不同,该菌对喹诺酮类抗生素中的诺氟沙星、氧氟沙星、环丙沙星高度敏感,对氨基糖苷类抗生素的卡那霉素比较敏感,对氯霉素类抗生素中的氯霉素有一定程度的抑制作用。
本试验虽找到了病害发生的主要微生物根源,筛选出了几种能有效防治该病原菌的抗生素和中草药种类,可为病原菌的诊断及其防治提供一定帮助。但针对所选抗生素和中草药联合防治还未开展研究。另外,关于蜂房哈夫尼菌对克氏原螯虾致病性相关的报道甚少,因此对于该病原菌的致病机制以及有效防治手段还需进一步研究阐明。
参考文献:
[1]江红霞,刘慧芬,马 晓,等. 转录组测序筛选克氏原螯虾卵巢发育、免疫和生长相关基因[J]. 水产学报,2021,45(3):396-414.
[2]董 靖,张露珊,刘绍春,等. 1株克氏原螯虾肺炎克雷伯菌的分离鉴定及药物敏感性分析[J]. 华中农业大学学报,2021,40(1):93-98.
[3]吴红英. 稻虾综合种养技术要点及病害防治[J]. 水产养殖,2020,41(11):64-65.
[4]周冬仁,章文敏,李建应,等. 克氏原螯虾细菌性病原的分离与鉴定[J]. 中国农学通报,2011,27(26):102-105.
[5]Dong X,Li Z,Wang X,et al. Characteristics of Vibrio parahaemolyticus isolates obtained from crayfish (Procambarus clarkii) in freshwater[J]. International Journal of Food Microbiology,2016,238:132-138.
[6]马小荣,薛 晖,唐建清,等. 克氏原螯虾致病性嗜水气单胞菌的分离鉴定及药敏试验[J]. 水产养殖,2012,33(8):45-47.
[7]王 文. 虾蟹新型病原螺原体的发现和研究[J]. 南京师大学报(自然科学版),2016,39(1):1-13.
[8]Du H H,Fu L L,Xu Y X,et al. Improvement in a simple method for isolating white spot syndrome virus (WSSV) from the crayfish Procambarus clarkii[J]. Aquaculture,2007,262(2/3/4):532-534.
[9]董 靖,刘永涛,胥 宁,等. 1株克氏原螯虾摩氏摩根菌的分离鉴定及联合药敏试验[J]. 华中农业大学学报,2021,40(1):99-104.
[10]叶建勇,唐金玉,丁辰龙,等. 基于高通量测序的克氏原螯虾肠道及其养殖环境菌群结构分析[J]. 青岛农业大学学报(自然科学版),2020,37(2):129-134.
[11]张立强,李 媛,邓 平,等. 健康和患病克氏原螯虾肠道微生物群落结构和多样性分析[J]. 水产科技情报,2020,47(1):37-40.
[12]胡 骞. 克氏原螯虾源维氏气单胞菌的鉴定、致病性研究及抗菌中草药筛选[D]. 武汉:华中农业大学,2020:42-43.
[13]江 枫. 群体感应抑制剂对蜂房哈夫尼菌生物膜形成的影响[D]. 大连:大连工业大学,2017:26-27.
[14]Liu F,Qu Y K,Geng C,et al. Effects of hesperidin on the growth performance,antioxidant capacity,immune responses and disease resistance of red swamp crayfish (Procambarus clarkii)[J]. Fish & Shellfish Immunology,2020,99:154-166.
[15]Wu Z B,Zhang Q Q,Zhang T L,et al. Association of the microbiota dysbiosis in the hepatopancreas of farmed crayfish (Procambarus clarkii) with disease outbreaks[J]. Aquaculture,2021,536:736492.
[16]Yuan G L,Zhu L,Jiang X Y,et al. Diagnosis of co-infection with white spot syndrome virus and Aeromonas veronii in red swamp crayfish Procambarus clarkii[J]. Aquaculture,2021,532:736010.
[17]邱吉宇. 中蜂蜂房哈夫尼菌病的诊断与中西药防治[D]. 贵阳:贵州大学,2018:12-13.
[18]王 霞. 蜂房哈夫尼菌引起化脓性脑膜炎病例报告[J]. 实用医技杂志,2002(12):920.
[19]赵淑芳,曹卢园,唐子晴,等. 棘胸蛙新型病菌蜂房哈夫尼菌的分离、鉴定与药敏试验[J]. 丽水学院学报,2019,41(5):29-33.
[20]闫艳新,邹 玲,刘文华,等. 一例水貂感染蜂房哈夫尼菌的分离鉴定及药敏试验[J]. 经济动物学报,2015,19(2):74-76,79.
[21]袁 瑞. 中国大鲵主要病原菌的鉴定及皮肤分泌液抗菌活性成份的分离[D]. 杨凌:西北农林科技大学,2014:28-29.
[22]郁维娜,戴文芳,陶 震,等. 健康与患病凡纳滨对虾肠道菌群结构及功能差异研究[J]. 水产学报,2018,42(3):399-409.
[23]吴亚锋,王楠楠,王晶晶,等. 2017年和2018年江苏省水生动物气单胞菌分离鉴定及耐药分析[J]. 江苏农业科学,2020,48(24):156-162.
[24]孟 愔,胡 骞,金玉立,等. 复方中草药制剂对克氏原螯虾生长、免疫功能及肝胰腺组织的影响[J]. 中国饲料,2019(21):60-65.
[25]刘云宁,李小凤,班旭霞,等. 中药抗菌成分及其抗菌机制的研究进展[J]. 环球中医药,2015,8(8):1012-1017.
[26]朱 淼,夏艳洁,李虹晔,等. 鱼用中草药饲料添加剂主要有效成分及其作用机制的研究进展[J]. 中国畜牧杂志,2020,56(2):39-43.
[27]王洪彬,李永慧,朱利霞,等. 24味中草药对舌鳎源嗜水气单胞菌的体外抑菌效果[J]. 水产学杂志,2018,31(1):21-24.
[28]郝晨光,冼健安,李军涛,等. 中草药饲料添加剂在克氏原螯虾养殖中的应用[J]. 饲料研究,2021,44(2):122-124.
[29]巫愛军,赵 楠,李 浩,等. 一种中草药配合饲料对小龙虾的防病效果[J]. 水产养殖,2020,41(12):66-69.

