施氮对大豆结瘤、固氮及产量影响的研究进展
侯慧云 高峰 高同国 朱宝成
摘要:氮是大豆[Glycine max (L.) Merrill]生长的必需元素,大豆生长所需氮量的50%~60%来自于共生固氮,少量施氮对大豆结瘤、固氮效率及产量有促进作用,施氮量过高则表现为抑制作用。本文着重从施氮的氮素形态、氮素施用量和施氮时期3个方面阐述了氮素对大豆根瘤数量、固氮酶活性和产量的影响。探讨了高氮抑制结瘤和固氮效率的作用机理即AON(autoregulation of nodulation)系统负反馈调节机理、激素调节作用、碳饥饿假说、硝酸盐毒性假说,并据此为大豆种植提供合理的施氮方案,为提高大豆固氮能力和产量提供科学依据。
关键词:氮素;大豆;结瘤;固氮效率
中图分类号:S565.106 文献标志码: A
文章编号:1002-1302(2022)08-0042-07
氮素是构成植物体内蛋白质、核酸、叶绿素及激素等重要组分的必需元素,可直接或间接参与植物体内不同时期各种生理过程,是限制植物生长发育和判断农产品蛋白质含量的关键要素之一。施用适量氮肥可改善植物体内营养状况,满足植物生长发育对氮的需要,促进光合作用的进行和产物的积累。大豆中蛋白质含量高达40%,因此对氮需求量更高,氮素不仅调控大豆生长发育,还会调控其根瘤形成及固氮效率,在根瘤形成关键时期,科学施用氮肥能促进植株生长,利于氮素及光合产物向根瘤转运,促进有效根瘤形成,保障生长后期氮素供应,使大豆达到高产[1]。
大豆利用氮素的主要来源为土壤氮、施肥氮以及根瘤固氮。根瘤固氮是大豆氮素的主要来源,大豆一生所需氮量的50%~60%来源于共生固氮体系固定的氮素,剩余部分则来源于土壤氮和施肥氮[2]。土壤氮是大豆生长发育初期所需的基础来源,而我国大部分地方的土壤都存在含氮量偏低的问题,因此通过施肥保持土壤氮水平对大豆生长发育至关重要[3]。3种氮素之间既相互利用又相互制约。大豆生长初期,少量的土壤氮和施肥氮可促进植株生长、干物质积累和根瘤形成;氮素缺乏时植物需要消耗大量能量来适应环境,用于生长的能量被消耗,生长受到抑制,根瘤不能形成[4];施氮过量则会抑制根瘤形成及固氮作用。大豆生育中后期,尤其是生殖器官生长阶段,根瘤固定的氮大部分会转向生殖器官,而施肥氮和土壤氮能保持植株生長需要。大豆在不同发育时期对氮素需求存在差异,协调好土壤氮、施肥氮和根瘤固氮三者之间的互利关系,制定科学的施氮方案,才能减少化学肥料施用,使大豆生长、根瘤形成及固氮作用达到最佳,从而提高大豆产量[3]。因此本文从氮素形态、氮素施用量及施氮时期3个方面总结了氮素对大豆结瘤和固氮能力的影响,提出科学有效的施氮方案,为高效合理利用氮肥,减少化肥使用量,提高大豆产量等方面提供理论依据。
1 氮素形态对大豆结瘤和固氮作用的影响
土壤中主要存在有机态氮和无机态氮2种氮素形态。有机态氮在土壤中占95%以上,一般来源于土壤腐殖质、动植物残体及有机肥料,不能直接被植物吸收利用。无机态氮在土壤中占1%左右,其分子量小、易溶于水,可以直接被植物吸收利用。土壤中无机氮主要是硝态氮和铵态氮2种形态,2种形态的氮对大豆生长均表现出低氮促进大豆生长和结瘤,高氮则表现为抑制作用,但2种氮素在大豆中吸收、同化和代谢途径不同,对植株生长发育及根瘤和固氮效率产生不同的影响[5]。
1.1 铵态氮
对于铵态氮,植物根系每吸收1个NH+4的同时就会释放1个H+,而NH3进入植物体内后同化成氨基酸和酰胺被植物利用,释放的H+使根际pH值下降,土壤变酸。与硝态氮相比,施用适量的铵态氮更利于植物生长及根瘤固氮作用,而施用量过高则对根瘤固氮作用有抑制作用,甚至会导致植物中毒。Gan等施用低浓度的铵态氮(1.00、3.75 mmol/L)提高了大豆生物积累量、根瘤数量和干质量,10 mmol/L的铵态氮则表现为抑制作用[6]。严君等发现同一氮素水平不同氮素形态中铵态氮更有利于根瘤生长[7]。李凯等研究发现,全铵氮处理后1周内营养液的pH值从5.8下降到3.2,过低的pH值环境会对植物本身根系产生毒害作用,且营养液铵态氮的浓度高于1.2 mmol/L会显著抑制大豆根瘤的发生和生长,并降低大豆根瘤固氮活性[8]。植物吸收铵态氮后将其同化成有机氮的过程需要消耗大量体内积累的碳水化合物,铵态氮施用过高不仅会抑制植物生长还会影响植株对其他阳离子如钾、钙和镁等营养元素的吸收。Bown等利用全铵态氮处理的植株在移苗1周后就出现根系短小且无结瘤、植株矮小、叶片发黄等症状[9]。
1.2 硝态氮
植物吸收硝态氮后先在根系将其转化为铵态氮,而后进入植物的不同部位被转化为氨后再被利用。硝态氮不仅可以促进植物根系对阳离子的吸收,还可以促进根系的伸长[10],发达的根系有利于作物吸取更多的养分,促进植株生长和根瘤形成。当土壤中硝态氮的浓度低于7.5 mmol/L时,可明显促进大豆的结瘤和固氮,当浓度超过15 mmol/L时,硝态氮对结瘤固氮起到抑制作用[11]。即土壤中适量的硝态氮有利于根瘤的形成和发育,而施用量过高则对根瘤菌侵染、固氮酶活性、根瘤生物量产生抑制作用,甚至会加速根瘤的衰老与解体[12]。硝态氮对大豆结瘤的抑制作用是多方面的,包括根瘤菌侵染、根瘤生长及固氮酶活性,但这种抑制作用是局部的,分根试验表明,只有经过硝酸盐处理的根瘤生长和固氮酶活性才会受到抑制,这可能与处理后根和根瘤中硝酸盐的大量积累有关[13]。土壤中较高的硝态氮会对类黄酮等大豆信号物质的合成与累积产生抑制,进而影响豆科作物与根瘤菌之间的识别和侵染[14],同时阻碍根瘤皮层内O2的扩散,根瘤侵染区细胞O2含量降低[15],类菌体呼吸和固氮所需氧供应不足,导致根瘤呼吸速率及固氮酶活性下降,从而表现出硝态氮对根瘤固氮的抑制作用。Carroll等研究发现在高氮胁迫下,将供O2浓度由21%提高到60%时,根瘤固氮酶活性也随之提高,表明硝酸盐通过阻碍根瘤中O2供给而抑制根瘤活性[16]。此外,结瘤自动调节(AON)的丧失会导致硝酸盐耐受以及高结瘤和超结瘤,Reid等揭示了硝酸盐诱导的LjCLE-RS2和GmNIC1通过HAR1/GmNARK抑制大豆结瘤,另外CLE-RS2糖肽通过直接与HAR1结合也可以抑制结瘤[17-18]。
1.3 铵态氮和硝态氮协同作用
铵态氮和硝态氮之间存在协同效应:供给合适配比的铵态氮和硝态氮比仅供给单一氮源的植物往往能获得更高的生物量和产量。董守坤等的研究表明硝态氮的存在能够解除铵盐毒害并促进大豆对氮素的吸收[19]。宋海星等发现硝态氮 ∶铵态氮的比例为1 ∶5时,根瘤固氮酶活性相对最高[20]。合适的硝铵配比对根瘤固氮及产量的影响效果比施用单一的氮素形态更明显[13],并且在硝铵配比中适当增加铵态氮的比例可促进植株地上部分的生长,增强光合作用,生物量也会增加[21]。
2 氮素施用量对大豆根瘤固氮作用的影响
土壤中氮素含量对大豆根瘤形成及固氮的影响一直是研究的热点问题,施用一定的氮肥不仅可以满足植株生长发育的需要,更能为根瘤的形成和固氮作用的发挥提供物质基础[22]。对154篇文献的研究发现施用少量氮肥可以使大豆平均增产0.52 t/hm2,施用量在50 kg/hm2时产量增加最多,达到0.64 t/hm2[3],并且施用适宜氮肥可以提高大豆对氮的吸收效率。王树起等对大豆施以0.0、12.5、20.0、50.0、100.0 mg/kg梯度浓度的氮素发现,随着施氮量的增加根瘤干质量和数量均呈现先增后降的趋势,固氮酶类活性则表现出持续下降趋势,在50 mg/kg氮素處理下根瘤数达到最大,表明适量施氮有利于根瘤的生长,施用量过高或不足则均对根瘤的形成有抑制作用,且施用氮素的浓度越高抑制程度越明显[23-24]。施用一定量氮肥一定程度上可促进大豆根瘤的形成和固氮作用,过量施氮或在不适宜的阶段施氮均会抑制根瘤固氮系统,甚至还会导致植株疯长、不结籽粒的情况[25]。
2.1 低施氮量对大豆结瘤和固氮的促进作用
植物需要吸收大量的氮素以满足高产的需要,大豆中含大量蛋白质,对氮素的需求量更大。大豆与根瘤菌互作形成的共生固氮体系-根瘤为大豆提供了50%~60%的氮,其他部分需要从外界补充。根瘤的生长及固氮作用受外源氮素的影响很大,但结瘤固氮并不是伴随大豆整个生育期,在生长初期需施用少量氮肥以发挥启动效应。这种启动效应是在大豆生长初期根瘤尚未形成和根瘤固氮尚不能满足植株生长需要时,施用适量氮肥促进大豆的生长,进而促进根系吸收土壤氮素的一种反馈作用[26-27]。甘银波等的研究表明,施氮量为 25 kg/hm2 时,大豆的根瘤干质量和固氮率最高[28]。严君等研究表明,施用低氮量可提高大豆植株光合生产能力,促进地上和地下部分物质积累,进而促进根瘤生长和提高结瘤固氮能力,最后使作物达到高产;随施氮量增加,根瘤干质量先逐渐增加而后显著降低,低氮处理的根瘤干质量最大,氮素施用量过高则会打破大豆植株体内各物质在不同部位的分配比例平衡,能量向根瘤转运减少,根瘤生长发育受到抑制[29-30]。当营养液氮素浓度为 50 mg/L 时,有利于根瘤的生长,当氮素浓度大于50 mg/L时,根瘤干质量显著降低,根瘤的生长也显著受到抑制作用[19]。Gulden等研究表明,0.5、1 mmol/L NH+4-N处理的根瘤干质量和数量均高于无氮处理和2 mmol/L NH+4-N处理的。施用少量氮不仅能促进植物生长,还能提高植物结瘤数量和根瘤干质量,因此,豆科植物需在适宜生长阶段施以小剂量的氮素才能提高根瘤固氮能力[31]。
2.2 高施氮量对大豆结瘤和固氮的抑制作用
高氮对大豆结瘤的抑制作用已有大量文献报道,过量施氮会降低根瘤的固氮效应,且这种抑制作用会随施氮量的增加而呈逐渐增强的趋势。Saito等认为氮素浓度大于5 mmol/L为高浓度氮,当施以高浓度氮时显著抑制了大豆根瘤数量、根瘤质量及每株大豆总固氮量[32]。邸伟等认为大豆植株氮素积累量随着施氮量的增加呈现先增后减的变化趋势,高施氮量降低了氮素积累量和根瘤固定的氮素在籽粒中所占的比例[33]。Gibson等提出,当施用NO-3浓度为1 mmol/L时,延缓和阻碍了大豆根瘤的形成,并且固氮酶活性明显降低[34]。施氮量过高不仅抑制根瘤形成、数量及积累生物量,还会通过豆血红蛋白来抑制固氮酶活性。固氮酶需要在低氧的环境才能维持活性,而豆血红蛋白可以与氧气结合,为固氮酶提供低氧的环境[35]。Fujikake等证实5 mmol/L硝态氮能快速抑制根瘤的生长及固氮酶活性,但无氮培养液能解除这种抑制作用[36]。王树起等发现,施氮量超过50 mg/kg时对大豆根瘤形成及固氮作用有明显的抑制作用,可显著降低根瘤数量和根瘤干质量,根瘤固氮酶和豆血红蛋白的活性随着施氮量的增加呈持续下降趋势,且抑制程度和时间及施氮量呈正相关关系,施氮量越大,抑制程度越高,抑制时间越长[23]。此外,施氮量过多也会使得大豆在生育前期植株疯长,当进入生殖关键期时植株营养器官又需要吸收大量养分来维持生理代谢,而根瘤共生固氮又不足以满足其需求,导致生育后期植株养分供给不足,而向籽粒中转运的营养物质减少,会降低产量和品质。
在高氮抑制大豆结瘤固氮试验中,多集中于硝酸盐,但其抑制机理尚不清楚。本文对已报道的机理和假设进行总结来解释硝酸盐对根瘤菌侵染、根瘤形成和发展及根瘤固氮酶活性等各阶段的抑制作用。
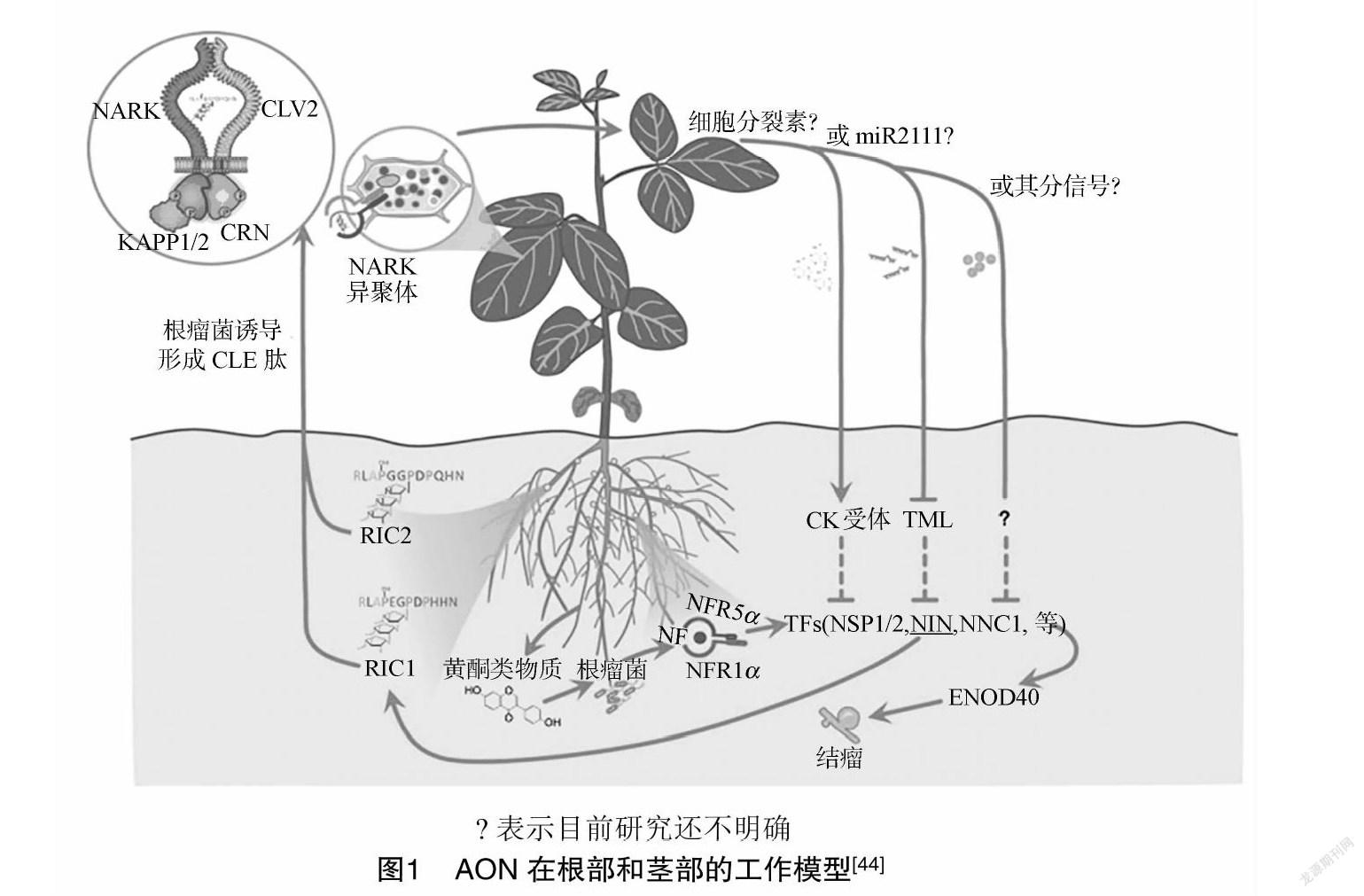
2.2.1 AON(autoregulation of nodulation)负反馈调节系统 根瘤固氮系统是一个非常复杂且精细调控的过程,豆科植物在长期进化过程中发展出了一套负反馈调节机制,使已经形成的根瘤能够抑制新的根瘤形成,被称为结瘤自主调控机制AON[37]。豆科植物根系分泌黄酮类化合物,吸引相容的根瘤菌并刺激其产生Nod因子(NF)。NF被受体(大豆中的NFR1α/NFR5α)感知,诱导下游信号产生,如转录因子[TF,如结瘤信号通路(NSP1/NSP2)、结瘤起始(NIN)、转录抑制α(NNC1)等]和早期结瘤蛋白(如ENOD40),以启动结瘤的发育(图1)。结瘤抑制的CLE肽也会产生(大豆中称为RIC1和RIC2),它们被运输到地上部,被结瘤自动调节受体激酶(大豆中的NARK,CRN和CLV2为NARK的组分)识别,并形成同二聚体或异二聚体复合物。激酶相关蛋白磷酸酶(KAPP1、KAPP2)磷酸化和去磷酸化NARK的激酶结构域,以传递对CLE肽的感知。调节茎部因子(可能是细胞分裂素、miRNA2111或其他因子)的产生,这些因子运输到根部,并与其他因子相互作用,如too much love(TML)和细胞分裂素受体(CK受体)等,控制CLE的表达,控制进一步的结瘤过程。
硝酸盐可作为外部刺激信号激发AON的活性,高氮环境会使AON系统活跃,负向调控结瘤数目。Wang等则用不同浓度硝酸盐处理拟南芥,分析后认为积累硝态氮可能作为某种分子信号在植株生长发育过程中产生调节[38]。Nishida等发现CLE信号肽基因不仅参与AON系统调控根瘤的形成,而且对硝酸盐也能做出响应[39-40]。若AON途径相关基因发生突变,植物根瘤数目会失去控制,表现出超结瘤的表型。但是,在高氮条件下,突变体虽然结瘤数量增加,但形成的都是小且没有固氮能力的白色根瘤,根瘤固氮仍受到显著抑制[41-42],这说明仅AON途径不足以完全解释高氮抑制结瘤的机制。
当环境中存在充足硝酸盐时,结瘤调控因子(NIN)的表达也会受到抑制,同时NIN同源蛋白NLP(NIN-like protein)NLP1通过核-质穿梭响应并传递硝酸盐信号,并进入细胞核与NIN形成复合体,和NIN竞争结合位点,抑制NIN对下游CRE1和NF-YA1等基因的激活,最终无法形成根瘤[43]。
2.2.2 碳饥饿假说 碳饥饿假说认为,根瘤生长发育及固氮作用等活动都需要碳水化合物的支持,施用氮量过高会导致光合产物向根瘤分配减少,碳供应不足使根瘤中一切生理活动减弱,故表現为高氮抑制结瘤固氮[45]。Seneviratne等认为,环境中氮素含量过高会使大豆根系积累大量无机氮于体内,而将这些无机氮在大豆体内转化合成NH3被利用需要相当一部分碳水化合物,而植物供给根部及根瘤的碳水化合物自然也就相对减少,从而影响根瘤的发育和功能[46]。Bacanamwo等发现,高氮抑制大豆固氮酶活性不仅与植株中的碳氮比有关,还与根瘤中碳氮比及根瘤中可利用碳水化合物呈正相关关系[47]。利用转录组和代谢组研究分析得出,硝酸盐可促进大豆根系对碳的利用,从而减少碳向根瘤的运输,抑制根瘤中的碳氮代谢。根瘤中碳供应的减少主要影响固氮所需的碳骨架、能量和一些还原剂[48]。
2.2.3 硝酸盐毒性假说 硝酸盐代谢在高氮条件下对抑制根瘤的形成及固氮酶活性有重要作用。首先,硝酸盐可抑制根毛形成。Abdel等分别对几种不同豆科植物施加硝态氮后发现,硝态氮抑制植物根毛形成,进而影响根瘤菌侵染[49]。其次,硝酸盐可被硝酸还原酶还原为亚硝酸盐,而亚硝酸盐可能对细胞产生毒性。Becana等通过研究不同氮素浓度对根瘤硝酸还原酶的影响认为NO-2积累会产生毒害作用,抑制根瘤固氮酶活性[50]。另外,亚硝酸盐也能进一步转化为一氧化氮(NO),豆血红蛋白(Lb)对NO的亲和力高于对O2的亲和力,因此,根瘤中NO的存在使局部O2浓度升高,会抑制固氮酶的活性[51]。Meakin等在用硝酸盐处理的大豆根瘤中发现了Lb-NO的存在[52]。但随着研究的深入也存在许多与硝酸盐毒性假说相矛盾的证据,如在接种硝酸还原酶缺乏的根瘤菌突变体的根瘤中检测不到亚硝酸盐,而固氮酶活性却仍显著降低。
2.2.4 激素调节作用 激素是植物体内重要的调节因子,目前发现多种植物激素参与豆科植物结瘤过程的正向调控,如细胞分裂素、生长素和赤霉素等,而乙烯、水杨酸、茉莉酸、脱落酸等激素能负向调控根瘤形成。高氮环境下多种激素参与结瘤固氮过程的调控,乙烯会抑制根瘤菌的侵染和结瘤[53]。Caba等用硝酸盐处理紫花苜蓿的根部发现,乙烯含量会增加,使用乙烯抑制剂(AVG)可以减弱或解除高氮抑制,说明硝态氮的抑制作用可通过植物激素乙烯来介导,而乙烯信号转导蛋白突变体表现出超结瘤表型更加证明了这一点[54]。Reid等利用百脉根研究发现,细胞分裂素与高氮抑制结瘤固氮过程有关,降解细胞分裂素的酶突变会增强硝酸盐对结瘤和固氮的抑制作用[55]。Walch-Liu等发现铵态氮易导致激素水平失衡,易使细胞分裂素含量急剧下降,从而延迟或阻遏作物生长和根瘤形成[56]。各植物激素对氮素的响应并不相同,高氮会减少生长素(IAA)的浓度来抑制结瘤,赤霉素和脱落酸对不同的氮素浓度回应较少。高氮也会降低植株根系分泌黄酮类物质而抑制根瘤菌与根系的识别与侵染过程,进而影响根瘤形成[57]。
3 施氮时期对大豆结瘤固氮的影响
豆科植物在不同发育阶段对氮素需求量的多少和形态是不同的。在大豆的发育前期,施用适宜的氮肥可促进植株光合作用产物的积累,促进根系生长和营养物质向根瘤转运,为根瘤的构建创造良好的条件;在发育中后期,根瘤逐渐发育成熟,固氮作用也随之增强,提供给大豆生殖生长所需的氮营养也增多,在大豆鼓粒期再追施少量氮肥可维持大豆植株正常生理代谢和延长根瘤菌固氮作用的时间,促使根瘤固氮量增多及向籽粒中转运[23],提高大豆产量和品质。方海燕等通过研究大豆整个生长发育期与根瘤形成关系得出,提高大豆根瘤固氮的关键时期是大豆发育前期,而非发育中后期[58]。丁洪等的研究结果表明高氮对根瘤固氮的抑制作用主要表现在盛花期前,鼓粒期后抑制作用较小。不同氮素形态配比在豆科植物的不同发育时期对其影响效果也不相同[59]。刘晓静等对紫花苜蓿研究发现,在生长发育前期铵态氮比例大的处理根长、根体积和根干质量均明显优于硝态氮比例大的处理,而中后期硝态氮比例大的处理根系生物量、根瘤数及固氮能力均较好[60]。
4 合理施肥
大豆结瘤与固氮作用的充分发挥不仅与施氮形态、施氮量和施氮时间有关,还与作物品种及土壤条件有关。首先,不同的大豆品种有自己偏好的氮素形态且对氮素的耐受程度也不同。其次,大豆生育初期氮素主要来自土壤,此时施入适量的氮肥对作物生长发育及根瘤形成非常重要。而在大豆营养生长与生殖生长并进时期施入适量的氮可在维持植株生长的同时提高根瘤固氮能力,使根瘤共生固定的氮较多地向籽粒中分配,从而达到高产。且大豆不同生长时期对氮素形态的需求也是不同的,生长初期大豆对铵态氮较为敏感,生育后期又对硝态氮吸收得较多。施入氮肥的硝铵配比还需要考虑当地土壤条件,因地适宜。我国南北方土壤条件差异明显,北方干燥,土壤pH值偏高,硝化作用强烈,易积累硝态氮。而南方湿润,土壤pH值偏低,反硝化作用相对较强,易积累铵态氮[61-62]。科学合理的施氮措施需综合考虑以上各个因素,平衡施氮和大豆根瘤固氮之间的关系,充分调动大豆生物固氮潜力,实现最优的经济和生态效益。
总结上述结论可知:(1)大豆生长前期和后期均有2个施肥关键期,分别为第1张复叶充分生长期(V2期)、始花期(R1期)和始荚期(R3期)、始粒期(R5期),各时期需要的土壤无机氮素浓度分别为V2期为135 mg/kg左右,R1期为55~90 mg/kg,R3期为25~65 mg/kg,R5期为100 mg/kg左右[63]。(2)在大豆生长前期(V2期和R1期)土壤氮素的硝铵比约为1 ∶7对形成的根瘤数目、质量和固氮酶活性更好,在生长中后期(R3期和R5期)土壤氮素的硝铵比为5 ∶3至3 ∶1对根瘤固氮作用的发挥和提高产量更有利[8]。(3)在制定具体施氮方案时可先测定土壤无机氮构成比例及含量,依据本文给出的各时期土壤氮素浓度和硝铵比例计算需要施加的氮素量和硝铵比例,再综合大豆品种对氮素的偏好和当地气候降雨等特点对施氮方案进行调整,最后在大豆需要的生长阶段按照施氮方案补施氮肥即可。
5 结论
氮素水平对豆科植物根瘤固氮能力的调节作用是一个非常复杂的问题。本文从氮素的不同形态及施氮的硝铵配比、施氮量、施氮时间3个方面阐明其对根瘤生长发育、根瘤数量及固氮酶活性的影响。同时也阐述了4个高氮抑制结瘤固氮作用的机理,但其中碳饥饿假说和硝酸毒性假说仍存在争议,须要更多数据支持或者该机理还存在其他可能性,亦或是高氮对根瘤固氮的抑制作用是多种机制共同作用的结果,机理之间存在复杂的网络联系等,这都需要进一步证实。另外,低氮如何促进豆科植物结瘤固氮的机理目前报道比较少,有待进一步研究。总之,对农业发展来说,了解当地土壤条件及降水情况,因地制宜、制定出合理科学的施氮措施,使豆科植物经济收益最大化的同时改善土壤结构与环境十分重要。
参考文献:
[1]Kobayashi R,Yamaguchi S,Iwasa Y. Optimal control of root nodulation-prediction of life history theory of a mutualistic system[J]. Journal of Theoretical Biology,2021,510:110544.
[2]Salvagiotti F,Cassman K G,Specht J E,et al. Nitrogen uptake,fixation and response to fertilizer N in soybeans:a review[J]. Field Crops Research,2008,108(1):1-13.
[3]Ribeiro V H V,Maia L G S,Arneson N J,et al. Influence of PRE-emergence herbicides on soybean development,root nodulation and symbiotic nitrogen fixation[J]. Crop Protection,2021,144:105576.
[4]王 鹤,吕艳秋,丁亦男,等. 低氮胁迫对不同品种野大豆幼苗生长特性的影响[J]. 长春师范大学学报,2019,38(10):99-103.
[5]Meharg A. Marschners mineral nutrition of higher plants[J]. Experimental Agriculture,2012,48(2):305.
[6]Gan Y B,Stulen I,van Keulen H,et al. Low concentrations of nitrate and ammonium stimulate nodulation and N2 fixation while inhibiting specific nodulation (nodule DW g-1 root dry weight) and specific N2 fixation (N2 fixed g-1 root dry weight) in soybean[J]. Plant and Soil,2004,258(1):281-292.
[7]嚴 君,韩晓增,王守宇,等. 不同形态氮对大豆根瘤生长及固氮的影响[J]. 大豆科学,2009,28(4):674-677.
[8]李 凯,郭宇琦,刘楚楠,等. 铵硝配比对大豆生长及结瘤固氮的影响[J]. 中国油料作物学报,2014,36(3):349-356.
[9]Bown H E,Watt M S,Clinton P W,et al. Influence of ammonium and nitrate supply on growth,dry matter partitioning,N uptake and photosynthetic capacity of Pinus radiata seedlings[J]. Trees,2010,24(6):1097-1107.
[10]Zhang H,Jennings A,Barlow P W,et al. Dual pathways for regulation of root branching by nitrate[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(11):6529-6534.
[11]Lü X C,Xia X A,Wang C,et al. Effects of changes in applied nitrogen concentrations on nodulation,nitrogen fixation and nitrogen accumulation during the soybean growth period[J]. Soil Science and Plant Nutrition,2019,65(5):479-489.
[12]Nishida H,Tanaka S,Handa Y,et al. A NIN-like protein mediates nitrate-induced control of root nodule symbiosis in Lotus japonicus[J]. Nature Communications,2018,9:499.
[13]Lim C W,Lee Y W,Lee S C,et al. Nitrate inhibits soybean nodulation by regulating expression of CLE genes[J]. Plant Science,2014,229:1-9.
[14]Dakora F D. A functional relationship between leghaemoglobin and nitrogenase based on novel measurements of the two proteins in legume root nodules[J]. Annals of Botany,1995,75(1):49-54.
[15]苗淑杰,乔云发,韩晓增. 2种形态氮源条件下磷对大豆结瘤固氮的影响[J]. 大豆科学,2006,25(3):250-253,258.
[16]Carroll B J,Hansen A P,McNeil D L,et al. Effect of oxygen supply on nitrogenase activity of nitrate-and dark-stressed soybean [Glycine max (L.) Merr.]plants[J]. Functional Plant Biology,1987,14(6):679.
[17]Reid D E,Ferguson B J,Gresshoff P M. Inoculation-and nitrate-induced CLE peptides of soybean control NARK-dependent nodule formation[J]. Molecular Plant-Microbe Interactions,2011,24(5):606-618.
[18]Okamoto S,Shinohara H,Mori T,et al. Root-derived CLE glycopeptides control nodulation by direct binding to HAR1 receptor kinase[J]. Nature Communications,2013,4:2191.
[19]董守坤,刘丽君,马春梅,等. 利用 15N标记研究铵态氮与硝态氮对大豆的营养作用[J]. 大豆科学,2012,31(6):911-914.
[20]宋海星,申斯乐,马淑英,等. 硝态氮和氨态氮对大豆根瘤固氮的影响[J]. 大豆科学,1997,16(4):283-287.
[21]陈 磊,朱月林,杨立飞,等. 氮素形态配比对菜用大豆生长及籽粒膨大中矿质营养含量的影响[J]. 西北农业学报,2010,19(10):189-193.
[22]la Menza N C,Monzon J P,Specht J E,et al. Is soybean yield limited by nitrogen supply?[J]. Field Crops Research,2017,213:204-212.
[23]王树起,韩晓增,乔云发,等. 施氮对大豆根瘤生长和结瘤固氮的影响[J]. 华北农学报,2009,24(2):176-179.
[24]王树起,韩晓增,乔云发,等. 施氮对大豆根系形态和氮素吸收积累的影响[J]. 中国生态农业学报,2009,17(6):1069-1073.
[25]Petricka J J,Winter C M,Benfey P N. Control of Arabidopsis root development[J]. Annual Review of Plant Biology,2012,63:563-590.
[26]Sincik M,Gksoy A T,Turan Z M. Soybean seed yield performances under different cultural practices[J]. Turkish Journal of Agriculture and Forestry,2009,33(2):111-118.
[27]陳 慧,邸 伟,姚玉波,等. 不同大豆品种根瘤固氮酶活性与固氮量差异研究[J]. 核农学报,2013,27(3):379-383.
[28]甘银波,陈 静. 大豆不同生长阶段施用氮肥对生长、结瘤及产量的影响[J]. 大豆科学,1997,16(2):125-130.
[29]严 君,韩晓增,王守宇,等. 不同施氮量及供氮方式对大豆根瘤生长及固氮的影响[J]. 江苏农业学报,2010,26(1):75-79.
[30]雍太文,董 茜,刘文钰,等. 施氮方式对玉米-大豆套作体系下大豆根瘤固氮、光合特性及产量的影响[J]. 大豆科学,2013,32(6):791-796.
[31]Gulden R H,Vessey J K. Low concentrations of ammonium inhibit specific nodulation (nodule number g-1 root DW) in soybean [Glycine max (L.) Merr.][J]. Plant & Soil,1998,198(2):127-136.
[32]Saito A,Tanabata S,Tanabata T,et al. Effect of nitrate on nodule and root growth of soybean (Glycine max L. Merr.)[J]. International Journal of Molecular Sciences,2014,15(3):4464-4480.
[33]邸 偉,金喜军,马春梅,等. 施氮水平对大豆氮素积累与产量影响的研究[J]. 核农学报,2010,24(3):612-617.
[34]Gibson A H,Harper J E. Nitrate effect on nodulation of soybean by Bradyrhizobium japonicum[J]. Crop Science,1985,25(3):497-501.
[35]Larrainzar E,Villar I,Rubio M C,et al. Hemoglobins in the legume-Rhizobium symbiosis[J]. New Phytologist,2020,228(2):472-484.
[36]Fujikake H,Yashima H,Sato T,et al. Rapid and reversible nitrate inhibition of nodule growth and N2 fixation activity in soybean [Glycine max (L.) Merr.][J]. Soil Science and Plant Nutrition,2002,48(2):211-217.
[37]Zhang M B,Su H N,Gresshoff P M,et al. Shoot-derived miR2111 controls legume root and nodule development[J]. Plant,Cell & Environment,2021,44(5):1627-1641.
[38]Wang R C,Xing X J,Crawford N. Nitrite acts as a transcriptome signal at micromolar concentrations in Arabidopsis roots[J]. Plant Physiology,2007,145(4):1735-1745.
[39]Nishida H,Handa Y,Tanaka S,et al. Expression of the CLE-RS3 gene suppresses root nodulation in Lotus japonicus[J]. Journal of Plant Research,2016,129(5):909-919.
[40]Hastwell A H,Bang T C D,Gresshoff P M,et al. CLE peptide-encoding gene families in Medicago truncatula and Lotus japonicus,compared with those of soybean,common bean and Arabidopsis[J]. Scientific Reports,2017,7:9384.
[41]Okamoto S,Kawaguchi M. Shoot HAR1 mediates nitrate inhibition of nodulation in Lotus japonicus[J]. Plant Signaling & Behavior,2015,10(5):e1000138.
[42]Jeudy C,Ruffel S,Freixes S,et al. Adaptation of Medicago truncatula to nitrogen limitation is modulated via local and systemic nodule developmental responses[J]. New Phytologist,2010,185(3):817-828.
[43]Lin J S,Li X L,Luo Z P,et al. NIN interacts with NLPs to mediate nitrate inhibition of nodulation in Medicago truncatula[J]. Nature Plants,2018,4(11):942-952.
[44]Ferguson B,Mens C,Hastwell A,et al. Legume nodulation:the host controls the party[J]. Plant,Cell & Environment,2019,42(1):41-51.
[45]Fujikake H,Yashima H,Sato T,et al. Rapid and reversible nitrate inhibition of nodule growth and N2 fixation activity in soybean [Glycine max (L.) Merr.][J]. Soil Science and Plant Nutrition,2002,48(2):211-217.
[46]Seneviratne G,van Holm L H J,Ekanayake E M H G S. Agronomic benefits of rhizobial inoculant use over nitrogen fertilizer application in tropical soybean[J]. Field Crops Research,2000,68(3):199-203.
[47]Bacanamwo M,Harper J E. Regulation of nitrogenase activity in Bradyrhizobium japonicum/soybean symbiosis by plant N status as determined by shoot C ∶N ratio[J]. Physiologia Plantarum,1996,98(3):529-538.
[48]柯丹霞,徐勤朕,杨 娜,等. 高氮抑制豆科植物结瘤固氮机制研究进展[J]. 生物技术通报,2019,35(10):40-45.
[49]Abdel W A M,Zahran H H,Abd-Alla M H. Root-hair infection and nodulation of four grain legumes as affected by the form and the application time of nitrogen fertilizer[J]. Folia Microbiologica,1996,41(4):303-308.
[50]Becana M,Aparicio-Tejo P M,Sánchez-Díaz M. Nitrate and nitrite reduction by alfalfa root nodules:accumulation of nitrite in Rhizobium melioti bacteroids and senescence of nodules[J]. Physiologia Plantarum,1985,64(3):353-358.
[51]Vessey J K,Waterer J. In search of the mechanism of nitrate inhibition of nitrogenase activity in legume nodules:recent developments[J]. Physiologia Plantarum,1992,84(1):171-176.
[52]Meakin G E,Bueno E,Jepson B,et al. The contribution of bacteroidal nitrate and nitrite reduction to the formation of nitrosylleghaemoglobin complexes in soybean root nodules[J]. Microbiology,2007,153(2):411-419.
[53]Oldroyd G E D,Engstrom E M,Long S R. Ethylene inhibits the nod factor signal transduction pathway of Medicago truncatula[J]. The Plant Cell,2001,13(8):1835-1849.
[54]Caba J M,Recalde L,Ligero F. Nitrate-induced ethylene biosynthesis and the control of nodulation in alfalfa[J]. Plant,Cell & Environment,1998,21(1):87-93.
[55]Reid D E,Heckmann A B,Novák O,et al. CYTOKININ OXIDASE/DEHYDROGENASE3 maintains cytokinin homeostasis during root and nodule development in Lotus japonicus[J]. Plant Physiology,2015,170(2):1060-1074.
[56]Walch-Liu P,Neumann G,Bangerth F,et al. Rapid effects of nitrogen form on leaf morphogenesis in tobacco[J]. Journal of Experimental Botany,2000,51(343):227-237.
[57]夏 玄,龚振平. 氮素与豆科作物固氮关系研究进展[J]. 东北农业大学学报,2017,48(1):79-88.
[58]方海燕,寸植贤,陈建斌,等. 大豆生长发育与根瘤形成的关系[J]. 农学学报,2014,4(6):1-4,23.
[59]丁 洪,郭慶元,张学江. 氮肥对大豆不同类型品种结瘤固氮影响的差异性研究[J]. 大豆科学,1994,13(3):274-278.
[60]刘晓静,蒯佳林,李文卿,等. 硝态氮与铵态氮对紫花苜蓿根系生长及结瘤固氮的影响[J]. 甘肃农业大学学报,2011,46(5):106-110.
[61]Ju X T,Lu X,Gao Z L,et al. Processes and factors controlling N2O production in an intensively managed low carbon calcareous soil under sub-humid monsoon conditions[J]. Environmental Pollution,2011,159(4):1007-1016.
[62]杜臻杰,陈效民,张佳宝,等. 长期施肥对典型旱地红壤中硝态氮和铵态氮时空变异的影响[J]. 土壤通报,2010,41(3):611-616.
[63]严 君,韩晓增. 盆栽条件下土壤无机氮浓度对大豆结瘤、固氮和产量的影响[J]. 中国农业科学,2014,47(10):1929-1938.

